Iodin
53I Iodin | |||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 Kristal iodin | |||||||||||||||||||||||||||||||||||||||||
Garis spektrum iodin | |||||||||||||||||||||||||||||||||||||||||
| Sifat umum | |||||||||||||||||||||||||||||||||||||||||
| Pengucapan | /iodin/[1] | ||||||||||||||||||||||||||||||||||||||||
| Penampilan | padatan abu-abu metalik berkilau, cairan hitam/ungu, gas berwarna ungu | ||||||||||||||||||||||||||||||||||||||||
| Iodin dalam tabel periodik | |||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||
| Nomor atom (Z) | 53 | ||||||||||||||||||||||||||||||||||||||||
| Golongan | golongan 17 (halogen) | ||||||||||||||||||||||||||||||||||||||||
| Periode | periode 5 | ||||||||||||||||||||||||||||||||||||||||
| Blok | blok-p | ||||||||||||||||||||||||||||||||||||||||
| Kategori unsur | nonlogam diatomik | ||||||||||||||||||||||||||||||||||||||||
| Berat atom standar (Ar) |
| ||||||||||||||||||||||||||||||||||||||||
| Konfigurasi elektron | [Kr] 4d10 5s2 5p5 | ||||||||||||||||||||||||||||||||||||||||
| Elektron per kelopak | 2, 8, 18, 18, 7 | ||||||||||||||||||||||||||||||||||||||||
| Sifat fisik | |||||||||||||||||||||||||||||||||||||||||
| Fase pada STS (0 °C dan 101,325 kPa) | padat | ||||||||||||||||||||||||||||||||||||||||
| Titik lebur | (I2) 386,85 K (113,7 °C, 236,66 °F) | ||||||||||||||||||||||||||||||||||||||||
| Titik didih | (I2) 457,4 K (184,3 °C, 363,7 °F) | ||||||||||||||||||||||||||||||||||||||||
| Kepadatan mendekati s.k. | 4,933 g/cm3 | ||||||||||||||||||||||||||||||||||||||||
| Titik tripel | 386,65 K, 12,1 kPa | ||||||||||||||||||||||||||||||||||||||||
| Titik kritis | 819 K, 11,7 MPa | ||||||||||||||||||||||||||||||||||||||||
| Kalor peleburan | (I2) 15,52 kJ/mol | ||||||||||||||||||||||||||||||||||||||||
| Kalor penguapan | (I2) 41,57 kJ/mol | ||||||||||||||||||||||||||||||||||||||||
| Kapasitas kalor molar | (I2) 54,44 J/(mol·K) | ||||||||||||||||||||||||||||||||||||||||
Tekanan uap (rombus)
| |||||||||||||||||||||||||||||||||||||||||
| Sifat atom | |||||||||||||||||||||||||||||||||||||||||
| Bilangan oksidasi | −1, +1, +3, +4, +5, +6, +7 (oksida asam kuat) | ||||||||||||||||||||||||||||||||||||||||
| Elektronegativitas | Skala Pauling: 2,66 | ||||||||||||||||||||||||||||||||||||||||
| Energi ionisasi | ke-1: 1008,4 kJ/mol ke-2: 1845,9 kJ/mol ke-3: 3180 kJ/mol | ||||||||||||||||||||||||||||||||||||||||
| Jari-jari atom | empiris: 140 pm | ||||||||||||||||||||||||||||||||||||||||
| Jari-jari kovalen | 139±3 pm | ||||||||||||||||||||||||||||||||||||||||
| Jari-jari van der Waals | 198 pm | ||||||||||||||||||||||||||||||||||||||||
| Lain-lain | |||||||||||||||||||||||||||||||||||||||||
| Kelimpahan alami | primordial | ||||||||||||||||||||||||||||||||||||||||
| Struktur kristal | ortorombus berpusat muka | ||||||||||||||||||||||||||||||||||||||||
| Konduktivitas termal | 0,449 W/(m·K) | ||||||||||||||||||||||||||||||||||||||||
| Resistivitas listrik | 1,3×107 Ω·m (suhu 0 °C) | ||||||||||||||||||||||||||||||||||||||||
| Arah magnet | diamagnetik[2] | ||||||||||||||||||||||||||||||||||||||||
| Suseptibilitas magnetik molar | −88,7×10−6 cm3/mol (298 K)[3] | ||||||||||||||||||||||||||||||||||||||||
| Modulus curah | 7,7 GPa | ||||||||||||||||||||||||||||||||||||||||
| Nomor CAS | 7553-56-2 | ||||||||||||||||||||||||||||||||||||||||
| Sejarah | |||||||||||||||||||||||||||||||||||||||||
| Penemuan dan isolasi pertama | B. Courtois (1811) | ||||||||||||||||||||||||||||||||||||||||
| Isotop iodin yang utama | |||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||
Iodin atau yodium adalah sebuah unsur kimia dengan lambang I dan nomor atom 53. Menjadi unsur halogen stabil terberat, ia merupakan padatan nonlogam semi-berkilau pada kondisi standar yang melebur membentuk cairan berwarna lembayung tua pada suhu 114 °C (237 °F), dan mendidih menjadi gas berwarna lembayung pada 184 °C (363 °F). Unsur ini ditemukan oleh kimiawan Prancis Bernard Courtois pada tahun 1811 dan diberi nama dua tahun kemudian oleh Joseph L. Gay-Lussac, dari bahasa Yunani Kuno Ιώδης 'berwarna lembayung'.
Iodin terjadi dalam banyak keadaan oksidasi, meliputi iodida (I−), iodat (IO−3), dan berbagai anion periodat. Ia adalah halogen stabil yang paling tidak melimpah, menjadi unsur paling melimpah ke-61. Sebagai nutrisi mineral esensial terberat, iodin diperlukan untuk sintesis hormon tiroid.[4] Kekurangan iodin mempengaruhi sekitar dua miliar orang dan merupakan penyebab utama kecacatan intelektual yang dapat dicegah.[5]
Produsen iodin yang dominan saat ini adalah Chili dan Jepang. Karena nomor atomnya yang tinggi dan kemudahannya menempel pada senyawa organik, ia juga disukai sebagai bahan radiokontras yang tidak beracun. Karena kekhususan serapannya oleh tubuh manusia, isotop radioaktif iodin juga dapat digunakan untuk mengobati kanker tiroid. Iodin juga digunakan sebagai katalis dalam produksi industri dari asam asetat dan beberapa polimer.
Unsur ini terdapat dalam Daftar Obat Esensial Organisasi Kesehatan Dunia.[6]
Sejarah[sunting | sunting sumber]
Pada tahun 1811, iodin ditemukan oleh kimiawan Prancis Bernard Courtois,[7][8] yang berasal dari produsen kalium nitrat (sebuah komponen bubuk mesiu yang penting). Pada saat Perang Napoleon, kalium nitrat sangat diminati di Prancis. Kalium nitrat yang diproduksi dari lapisan nitrat membutuhkan natrium karbonat, yang dapat diisolasi dari rumput laut yang dikumpulkan di pantai Normandy dan Brittany. Untuk mengisolasi natrium karbonat, rumput laut dibakar dan abunya dicuci dengan air. Limbah yang tersisa dihancurkan dengan menambahkan asam sulfat. Courtois pernah menambahkan asam sulfat secara berlebihan dan awan uap berwarna ungu mulai muncul. Dia mencatat bahwa uap tersebut mengkristal pada permukaan yang dingin, membuat kristal gelap.[9] Courtois menduga bahwa materi ini merupakan unsur baru namun dia kekurangan dana untuk melakukan penelitian lebih jauh.[10]
Courtois memberikan sampel kepada temannya, Charles B. Desormes (1777–1838) dan Nicolas Clément (1779–1841), untuk melanjutkan penelitian. Dia juga memberikan sebagian zat tersebut kepada kimiawan Joseph L. Gay-Lussac (1778–1850), dan kepada fisikawan André-Marie Ampère (1775–1836). Pada 29 November 1813, Desormes dan Clément mengumumkan penemuan Courtois. Mereka menjelaskan zat tersebut pada pertemuan Imperial Institute of France.[11] Pada 6 Desember, Gay-Lussac mengumumkan bahwa zat baru itu bisa berupa sebuah unsur atau sebuah senyawa oksigen.[12][13][14] Gay-Lussac menyarankan nama "iode", dari bahasa Yunani Kuno ἰοειδής (ioeidēs, "lembayung"), karena warna uap iodin.[7][12] Ampère telah memberikan beberapa sampelnya kepada kimiawan Inggris Humphry Davy (1778–1829), yang bereksperimen pada zat tersebut dan mencatat kemiripannya dengan klorin.[15] Davy mengirim sebuah surat tertanggal 10 Desember kepada Royal Society of London yang menyatakan bahwa dia telah mengidentifikasi sebuah unsur baru.[16] Beberapa argumen meletus antara Davy dan Gay-Lussac mengenai siapa yang pertama kali mengidentifikasi iodin, tetapi kedua ilmuwan tersebut mengakui Courtois sebagai orang pertama yang mengisolasi unsur tersebut.[10]
Pada tahun 1873 peneliti medis Prancis Casimir J. Davaine (1812–1882) menemukan tindakan antiseptik iodin.[17] Antonio Grossich (1849–1926), seorang ahli bedah kelahiran Istria, termasuk orang pertama yang menggunakan sterilisasi bidang operasi. Pada tahun 1908, dia memperkenalkan tingtur iodin sebagai cara untuk mensterilkan kulit manusia dengan cepat di bidang bedah.[18]
Pada tabel periodik awal, iodin sering diberi lambang J, dari Jod, nama unsur ini dalam bahasa Jerman.[19]
Sifat[sunting | sunting sumber]

Iodin adalah halogen keempat, menjadi anggota golongan 17 dalam tabel periodik, di bawah fluorin, klorin, dan bromin; ia adalah anggota stabil yang paling berat di golongannya. (Halogen kelima dan keenam, astatin dan tenesin yang radioaktif, tidak dipelajari dengan baik karena biaya mereka yang tinggi dan tidak dapat diakses dalam jumlah besar, tetapi tampaknya menunjukkan berbagai sifat yang tidak biasa untuk golongan mereka karena adanya efek relativistik.) Iodin memiliki konfigurasi elektron [Kr]4d105s25p5, dengan tujuh elektron di kulit kelima dan terluar sebagai elektron valensinya. Seperti halogen lainnya, ia kekurangan satu elektron pendek dari oktet penuh sehingga ia merupakan agen pengoksidasi, bereaksi dengan banyak unsur untuk melengkapi kulit terluarnya, meskipun sesuai dengan tren periodik, ia adalah agen pengoksidasi terlemah di antara halogen stabil: ia memiliki keelektronegatifan terendah di antara mereka, hanya 2,66 pada skala Pauling (bandingkan dengan fluorin, klorin, dan bromin masing-masing pada 3,98, 3,16, dan 2,96; astatin melanjutkan tren ini dengan keelektronegatifan 2,2). Oleh karena itu, iodin elemental membentuk molekul diatomik dengan rumus kimia I2, di mana dua atom iodin berbagi sepasang elektron untuk mencapai oktet yang stabil untuk diri mereka sendiri; pada suhu tinggi, molekul diatomik ini secara reversibel memisahkan sepasang atom iodin. Demikian pula, anion iodida, I−, adalah zat pereduksi terkuat di antara halogen stabil, yang paling mudah dioksidasi kembali menjadi I2 diatomik.[20] (Astatin melangkah lebih jauh, menjadi tidak stabil sebagai At− dan mudah teroksidasi menjadi At0 atau At+.)[21]
Semakin ke bawah golongan, warna halogen akan menjadi semakin gelap: fluorin berwarna kuning sangat pucat, klorin berwarna kuning kehijauan, bromin berwarna cokelat kemerahan, dan iodin berwarna lembayung.
Iodin elemental sedikit larut dalam air, dengan satu gram akan larut dalam 3450 ml pada suhu 20 °C dan 1280 ml pada suhu 50 °C; kalium iodida dapat ditambahkan untuk meningkatkan kelarutan melalui pembentukan ion triiodida, di antara poliiodida lainnya.[22] Pelarut nonpolar seperti heksana dan karbon tetraklorida memberikan kelarutan yang lebih tinggi.[23] Larutan polar, seperti larutan berair, berwarna cokelat, mencerminkan peran pelarut ini sebagai basa Lewis; di sisi lain, larutan nonpolar berwarna ungu, warna uap iodin.[22] Kompleks transfer muatan (kompleks CT) akan terbentuk ketika iodin dilarutkan dalam pelarut polar, sehingga mengubah warnanya. Iodin akan berwarna lembayung ketika dilarutkan dalam karbon tetraklorida dan hidrokarbon jenuh tetapi akan berwarna cokelat tua dalam alkohol dan amina, pelarut yang membentuk aduk transfer muatan.[24]

Titik lebur dan titik didih iodin adalah yang tertinggi di antara semua halogen, sesuai dengan tren yang meningkat ke bawah golongan, karena iodin memiliki awan elektron terbesar yang paling mudah terpolarisasi di antara mereka, sehingga molekulnya memiliki interaksi van der Waals yang paling kuat di antara semua halogen. Demikian pula, iodin adalah halogen yang paling tidak volatil, meskipun padatannya masih dapat diamati mengeluarkan uap lembayung.[20] Karena sifat ini, iodin biasanya digunakan untuk mendemonstrasikan sublimasi langsung dari padat menjadi gas, yang menimbulkan kesalahpahaman bahwa iodin tidak melebur dalam tekanan atmosfer.[26] Karena ia memiliki jari-jari atom terbesar di antara semua halogen, iodin memiliki energi ionisasi pertama terendah, afinitas elektron terendah, elektronegativitas terendah, dan reaktivitas terendah di antara mereka.[20]
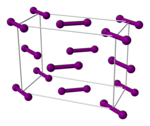
Ikatan antarhalogen pada diiodin adalah yang terlemah dari semua halogen. Dengan demikian, 1% sampel gas iodin pada tekanan atmosfer akan terdisosiasi menjadi atom iodin pada suhu 575 °C. Suhu yang lebih besar dari 750 °C diperlukan agar fluorin, klorin, dan bromin terdisosiasi pada tingkat yang sama. Sebagian besar ikatan dengan iodin lebih lemah daripada ikatan analog dengan halogen yang lebih ringan.[20] Iodin gas terdiri dari molekul I2 dengan panjang ikatan I–I sebesar 266,6 pm. Ikatan I–I adalah salah satu ikatan tunggal terpanjang yang diketahui. Ikatan ini bahkan akan lebih panjang (271,5 pm) dalam iodin kristalin ortorombus padat, yang memiliki struktur kristal yang sama dengan klorin dan bromin. (Rekor ini dipegang oleh tetangga iodin, xenon: panjang ikatan Xe–Xe adalah 308,71 pm.)[27] Dengan demikian, dalam molekul iodin, interaksi elektronik yang signifikan terjadi dengan dua tetangga terdekat berikutnya dari setiap atom, dan interaksi ini menimbulkan, dalam iodin curah, penampilan mengilap dan sifat semikonduktor.[20] Iodin adalah semikonduktor dua dimensi dengan celah pita sebesar 1,3 eV (125 kJ/mol): ia adalah semikonduktor dalam bidang lapisan kristalnya dan insulator dalam arah tegak lurus.[20]
Isotop[sunting | sunting sumber]
Dari tiga puluh tujuh isotop iodin yang diketahui, hanya satu yang terdapat di alam, iodin-127. Isotop lainnya bersifat radioaktif dan memiliki waktu paruh yang terlalu pendek untuk menjadi primordial. Dengan demikian, iodin adalah unsur monoisotop dan mononuklida serta berat atomnya diketahui dengan sangat presisi, karena merupakan konstanta alam.[20]
Isotop radioaktif iodin yang berumur paling panjang adalah iodin-129, yang memiliki waktu paruh 15,7 juta tahun, meluruh melalui peluruhan beta menjadi xenon-129 yang stabil.[28] Beberapa iodin-129 terbentuk bersama dengan iodin-127 sebelum pembentukan Tata Surya, tetapi sekarang telah benar-benar meluruh, menjadikannya radionuklida yang telah punah yang masih berguna dalam menentukan usia sejarah Tata Surya awal atau air tanah yang sangat tua, karena mobilitasnya di lingkungan. Keberadaannya sebelumnya dapat ditentukan dari kelebihan anaknya, xenon-129.[29][30][31][32][33] Sejumlah kecil iodin-129 masih ada hingga sekarang, karena ia juga merupakan nuklida kosmogenik, terbentuk dari spalasi sinar kosmik xenon atmosfer: ia membentuk sekitar 10−14 hingga 10−10 dari semua iodin terestrial. Ia juga terjadi dari uji coba nuklir di udara terbuka, tetapi tidak berbahaya karena waktu paruhnya yang sangat panjang, yang terpanjang dari semua produk fisi. Pada puncak pengujian termonuklir pada tahun 1960-an dan 1970-an, iodin-129 hanya membentuk sekitar 10−7 dari semua iodin terestrial.[34] Keadaan tereksitasi dari iodin-127 dan iodin-129 sering digunakan dalam spektroskopi Mössbauer.[20]
Radioisotop iodin lainnya memiliki waktu paruh yang jauh lebih pendek, tidak lebih dari beberapa hari.[28] Beberapa di antaranya memiliki aplikasi medis yang melibatkan kelenjar tiroid, tempat iodin yang masuk ke dalam tubuh disimpan dan dipekatkan. Iodin-123 memiliki waktu paruh 13 jam dan meluruh melalui penangkapan elektron menjadi telurium-123, memancarkan radiasi gama; ia digunakan dalam pencitraan kedokteran nuklir, meliputi pemindaian tomografi terkomputasi emisi foton tunggal (SPECT) dan tomografi terkomputasi sinar-X (X-Ray CT).[35] Iodin-125 memiliki waktu paruh 59 hari, meluruh melalui penangkapan elektron menjadi telurium-125 dan memancarkan radiasi gama berenergi rendah; ia merupakan radioisotop iodin dengan umur terpanjang kedua, dan telah digunakan dalam pengujian biologis, pencitraan kedokteran nuklir, dan dalam terapi radiasi sebagai brakiterapi untuk mengobati sejumlah kondisi, meliputi kanker prostat, melanoma uvea, dan tumor otak.[36] Yang terakhir, iodin-131, dengan waktu paruh 8 hari, meluruh melalui peluruhan beta menjadi keadaan tereksitasi dari xenon-131 yang kemudian berubah menjadi keadaan dasarnya dengan memancarkan radiasi gama. Ia adalah produk fisi yang umum sehingga hadir dalam tingkat yang tinggi dalam luruhan nuklir. Ia kemudian dapat diserap melalui makanan yang terkontaminasi, dan juga akan menumpuk pada kelenjar tiroid. Karena ia meluruh, ia dapat menyebabkan kerusakan pada kelenjar tiroid. Risiko utama dari paparan iodin-131 tingkat tinggi adalah kemungkinan terjadinya kanker tiroid radiogenik di kemudian hari. Risiko lain meliputi kemungkinan pertumbuhan nonkanker dan tiroiditis.[37]
Cara perlindungan yang biasa terhadap efek negatif iodin-131 adalah dengan menjenuhkan kelenjar tiroid dengan iodin-127 yang stabil dalam bentuk tablet kalium iodida, diminum setiap hari untuk profilaksis yang optimal.[38] Namun, iodin-131 juga dapat digunakan untuk tujuan pengobatan dalam terapi radiasi karena alasan ini, ketika penghancuran jaringan diinginkan setelah penyerapan iodin oleh jaringan itu.[39] Iodin-131 juga digunakan sebagai pelacak radioaktif.[40][41][42][43]
Kimia dan senyawa[sunting | sunting sumber]
| X | XX | HX | BX3 | AlX3 | CX4 |
|---|---|---|---|---|---|
| F | 159 | 574 | 645 | 582 | 456 |
| Cl | 243 | 428 | 444 | 427 | 327 |
| Br | 193 | 363 | 368 | 360 | 272 |
| I | 151 | 294 | 272 | 285 | 239 |
Iodin cukup bersifat reaktif, tetapi kurang reaktif dibandingkan halogen lainnya. Misalnya, gas klorin dapat menghalogenasi karbon monoksida, nitrogen monoksida, dan belerang dioksida (masing-masing menjadi fosgen, nitrosil klorida, dan sulfuril klorida), sementara iodin tidak akan melakukannya. Selain itu, iodinasi logam cenderung menghasilkan keadaan oksidasi yang lebih rendah daripada klorinasi atau brominasi; misalnya, logam renium dapat bereaksi dengan klorin membentuk renium heksaklorida, tetapi dengan bromin hanya membentuk renium pentabromida dan iodin hanya dapat menghasilkan renium tetraiodida.[20] Namun, dengan cara yang sama, karena iodin memiliki energi ionisasi terendah di antara para halogen dan merupakan yang paling mudah teroksidasi, ia memiliki sifat kimia kationik yang lebih signifikan dan keadaan oksidasinya yang lebih tinggi agak lebih stabil daripada bromin dan klorin, misalnya dalam iodin heptafluorida.[22]
Kompleks transfer muatan[sunting | sunting sumber]
Molekul iodin, I2, dapat larut dalam CCl4 dan hidrokarbon alifatik menghasilkan larutan berwarna lembayung terang. Dalam pelarut ini, pita serapan maksimum terjadi pada daerah 520 – 540 nm dan ditetapkan untuk transisi π* menjadi σ*. Ketika I2 bereaksi dengan basa Lewis dalam pelarut ini, pergeseran biru pada puncak I2 akan terlihat dan puncak baru (230 – 330 nm) akan muncul yang disebabkan oleh pembentukan aduk, yang disebut sebagai kompleks transfer muatan.[44]
Hidrogen iodida[sunting | sunting sumber]
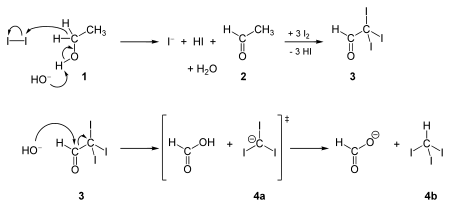
Senyawa iodin yang paling sederhana adalah hidrogen iodida, HI. Ia adalah gas nirwarna yang bereaksi dengan oksigen menghasilkan air dan iodin. Meskipun berguna dalam reaksi iodinasi di laboratorium, ia tidak memiliki kegunaan industri skala besar, tidak seperti hidrogen halida lainnya. Secara komersial, ia biasanya dibuat dengan mereaksikan iodin dengan hidrogen sulfida atau hidrazina:[45]
- 2 I2 + N2H4 4 HI + N2
Pada suhu kamar, hidrogen iodida adalah gas nirwarna, seperti semua hidrogen halida selain hidrogen fluorida, karena hidrogen tidak dapat membentuk ikatan hidrogen yang kuat dengan atom iodin yang besar dan hanya sedikit elektronegatif. Ia melebur pada suhu −51,0 °C dan mendidih pada suhu −35,1 °C. Ia adalah sebuah senyawa endotermik yang dapat terdisosiasi secara eksotermik pada suhu kamar, meskipun prosesnya sangat lambat kecuali jika terdapat katalis: reaksi antara hidrogen dan iodin pada suhu kamar untuk menghasilkan hidrogen iodida tidak akan berlanjut hingga selesai. Energi disosiasi ikatan H–I juga merupakan yang terkecil dari semua hidrogen halida, pada 295 kJ/mol.[46]
Hidrogen iodida berair dikenal sebagai asam iodida, yang merupakan asam kuat. Hidrogen iodida sangat larut dalam air: satu liter air akan melarutkan 425 liter hidrogen iodida, dan larutan jenuh hanya memiliki empat molekul air per molekul hidrogen iodida.[47] Apa yang disebut dengan asam iodida "pekat" komersial biasanya mengandung sekitar 48–57% massa HI; larutan ini akan membentuk azeotrop dengan titik didih 126,7 °C pada 56,7 g HI per 100 g larutan. Dengan demikian, asam iodida tidak dapat dipekatkan melewati titik ini melalui penguapan air.[46]
Tidak seperti hidrogen fluorida, hidrogen iodida cair anhidrat sulit untuk digunakan sebagai pelarut, karena titik didihnya rendah, kisaran cairannya kecil, permitivitasnya rendah, serta tidak terdisosiasi menjadi ion H2I+ dan HI−2 – namun, ion HI−2 jauh lebih tidak stabil daripada ion bifluorida (HF−2) karena ikatan hidrogen yang sangat lemah antara hidrogen dan iodin, meskipun garamnya dengan kation yang sangat besar dan terpolarisasi lemah seperti Cs+ dan NR+4 (R = Me, Et, Bun) mungkin masih dapat diisolasi. Hidrogen iodida anhidrat adalah pelarut yang buruk, hanya mampu melarutkan senyawa molekul kecil seperti nitrosil klorida dan fenol, atau garam dengan energi kisi yang sangat rendah seperti tetraalkilamonium halida.[46]
Senyawa iodin biner lainnya[sunting | sunting sumber]
Kecuali gas mulia, hampir semua unsur pada tabel periodik hingga einsteinium (EsI3 telah diketahui) diketahui membentuk senyawa biner dengan iodin. Hingga tahun 1990, nitrogen triiodida[48] hanya dikenal sebagai sebuah aduk amonia. NI3 bebas amonia ditemukan dapat diisolasi pada suhu –196 °C tetapi akan terdekomposisi secara spontan pada suhu 0 °C.[49] Untuk alasan termodinamika terkait elektronegativitas unsur, belerang dan selenium iodida netral yang stabil pada suhu kamar juga tidak ada, meskipun S2I2 dan SI2 masing-masing stabil hingga suhu 183 dan 9 K. Hingga tahun 2022, tidak ada selenium iodida biner netral yang telah diidentifikasi secara jelas (pada suhu berapa pun).[50] Kation poliatomik belerang- dan selenium-iodin (misalnya [S2I42+][AsF6–]2 dan [Se2I42+][Sb2F11–]2) telah dibuat dan dikarakterisasi secara kristalografi.[51]
Mengingat ukuran anion iodida yang besar dan daya oksidasi iodin yang lemah, keadaan oksidasi yang tinggi sulit dicapai dalam iodida biner, dengan maksimum yang diketahui berada pada pentaiodida niobium, tantalum, dan protaktinium. Iodida dapat dibuat dengan mereaksikan suatu unsur atau oksida, hidroksida, atau karbonatnya dengan asam iodida, dan kemudian didehidrasi dengan suhu agak tinggi serta dikombinasikan dengan tekanan rendah atau gas hidrogen iodida anhidrat. Metode ini bekerja paling baik bila produk iodida stabil terhadap hidrolisis; jika tidak, kemungkinannya meliputi iodinasi oksidatif suhu tinggi dari unsur tersebut dengan iodin atau hidrogen iodida, iodinasi suhu tinggi dari oksida atau halida logam lainnya oleh iodida, halida logam yang volatil, karbon tetraiodida, atau sebuah iodida organik. Sebagai contoh, molibdenum(IV) oksida bereaksi dengan aluminium(III) iodida pada suhu 230 °C menghasilkan molibdenum(II) iodida. Contoh yang melibatkan pertukaran halogen diberikan di bawah ini, melibatkan reaksi tantalum(V) klorida dengan aluminium(III) iodida berlebih pada suhu 400 °C menghasilkan tantalum(V) iodida:[52]
Iodida yang lebih rendah dapat diproduksi baik melalui dekomposisi atau disproporsionasi termal, atau dengan mereduksi iodida yang lebih tinggi dengan hidrogen atau logam, misalnya:[52]
Sebagian besar iodida logam dengan logam dalam keadaan oksidasi rendah (+1 hingga +3) bersifat ionik. Nonlogam cenderung membentuk molekul iodida kovalen, seperti halnya logam dalam keadaan oksidasi tinggi, mulai dari +3 ke atas. Iodida ionik dan kovalen dikenal untuk logam dalam keadaan oksidasi +3 (misalnya, skandium iodida hampir bersifat ionik, tetapi aluminium iodida tidak). Iodida ionik MIn cenderung memiliki titik lebur dan titik didih terendah di antara halida MXn dari unsur yang sama, karena gaya tarik-menarik elektrostatik antara kation dan anion dalam anion iodida besar merupakan yang paling lemah. Sebaliknya, iodida kovalen cenderung memiliki titik lebur dan titik didih tertinggi di antara halida dari unsur yang sama, karena iodin adalah halogen yang paling dapat dipolarisasi dan, memiliki elektron paling banyak di antara mereka, sehingga dapat berkontribusi paling besar pada gaya van der Waals. Secara alami, pengecualiannya ialah pada iodida perantara di mana satu tren memberi jalan ke yang lain. Demikian pula, kelarutan iodida yang didominasi ionik (misalnya kalium dan kalsium) dalam air adalah yang terbesar di antara halida ionik dari unsur tersebut, sedangkan kelarutan iodida kovalen (misalnya perak) adalah yang terendah dari unsur tersebut. Secara khusus, perak iodida sangat tidak larut dalam air dan pembentukannya sering digunakan sebagai uji kualitatif untuk iodin.[52]
Iodin halida[sunting | sunting sumber]
Halogen membentuk banyak senyawa antarhalogen diamagnetik biner dengan stoikiometri XY, XY3, XY5, dan XY7 (di mana X lebih berat dari Y), dan tak terkecuali iodin. Iodin membentuk seluruh tiga kemungkinan antarhalogen diatomik, sebuah trifluorida dan triklorida, sebuah pentafluorida dan, yang tidak biasa di antara para halogen, sebuah heptafluorida. Sejumlah turunan kationik dan anionik juga dikarakterisasi, seperti senyawa ICl+2 berwarna merah anggur atau jingga cerah dan senyawa I2Cl+ berwarna cokelat tua atau hitam keunguan. Selain itu, beberapa pseudohalida juga dikenal, seperti sianogen iodida (ICN), iodin tiosianat (ISCN), dan iodin azida (IN3).[53]

Iodin monofluorida (IF) bersifat tidak stabil pada suhu kamar dan akan terdisproporsionasi secara sangat cepat dan ireversibel menjadi iodin dan iodin pentafluorida, sehingga ia tidak dapat diperoleh dalam bentuk murni. Ia dapat disintesis dari reaksi iodin dengan gas fluorin dalam triklorofluorometana pada suhu −45 °C, dengan iodin trifluorida dalam triklorofluorometana pada suhu −78 °C, atau dengan perak(I) fluorida pada suhu 0 °C.[53] Sebaliknya, iodin monoklorida (ICl) dan iodin monobromida (IBr) cukup stabil. ICl, senyawa berwarna merah-cokelat yang volatil, ditemukan secara terpisah oleh Joseph L. Gay-Lussac dan Humphry Davy pada tahun 1813–1814 tidak lama setelah penemuan klorin dan iodin, dan ia meniru perilaku halogen bromin dengan sangat baik sehingga membuat Justus von Liebig mengira bahwa bromin (yang dia temukan) adalah iodin monoklorida. Iodin monoklorida dan iodin monobromida dapat dibuat secara sederhana dengan mereaksikan iodin dengan klorin atau bromin pada suhu kamar dan dimurnikan dengan kristalisasi fraksional. Keduanya cukup reaktif dan bahkan dapat menyerang platina dan emas, meski bukan boron, karbon, kadmium, timbal, zirkonium, niobium, molibdenum, dan wolfram. Reaksi mereka dengan senyawa organik bergantung pada kondisi. Uap iodin klorida cenderung mengklorinasi fenol dan asam salisilat, karena ketika iodin klorida mengalami disosiasi homolitik, klorin dan iodin akan diproduksi dan klorin menjadi yang lebih reaktif. Namun, iodin klorida dalam larutan tetraklorometana menghasilkan iodinasi sebagai reaksi utama, karena sekarang terjadi fisi heterolitik ikatan I–Cl dan I+ menyerang fenol sebagai elektrofil. Namun, iodin monobromida cenderung membrominasi fenol bahkan dalam larutan tetraklorometana karena ia cenderung berdisosiasi menjadi unsur-unsurnya dalam larutan, dan bromin lebih reaktif daripada iodin.[53] Ketika cair, iodin monoklorida dan iodin monobromida akan berdisosiasi menjadi anion I2X+ dan IX−2 (X = Cl, Br); dengan demikian, mereka adalah konduktor listrik yang signifikan dan dapat digunakan sebagai pelarut pengion.[53]
Iodin trifluorida (IF3) adalah padatan berwarna kuning tidak stabil yang terurai di atas suhu −28 °C, sehingga hanya sedikit yang diketahui darinya. Ia sulit untuk diproduksi karena gas fluorin cenderung mengoksidasi iodin hingga ke pentafluorida; diperlukan reaksi pada suhu rendah dengan xenon difluorida. Iodin triklorida, yang eksis dalam keadaan padat sebagai dimer planar I2Cl6, adalah padatan berwarna kuning cerah, disintesis dengan mereaksikan iodin dengan klorin cair pada suhu −80 °C; kehati-hatian diperlukan selama pemurniannya karena ia mudah berdisosiasi menjadi iodin monoklorida dan klorin, sehingga ia dapat bertindak sebagai zat klorinasi yang kuat. Iodin triklorida cair dapat menghantarkan listrik, kemungkinan menunjukkan disosiasi menjadi ion ICl+2 dan ICl−4.[54]
Iodin pentafluorida (IF5), cairan tidak berwarna dan volatil, adalah iodin fluorida yang paling stabil secara termodinamika, dan dapat dibuat dengan mereaksikan iodin dengan gas fluorin pada suhu kamar. Ia adalah sebuah agen fluorinasi, tetapi cukup ringan untuk disimpan dalam peralatan kaca. Sekali lagi, sedikit konduktivitas listrik hadir dalam keadaan cairnya karena ia berdisosiasi menjadi IF+4 dan IF−6. Iodin heptafluorida (IF7) berstruktur bipiramida pentagon adalah sebuah agen fluorinasi yang sangat kuat, hanya di bawah klorin trifluorida, klorin pentafluorida, dan bromin pentafluorida di antara semua antarhalogen: ia bereaksi dengan hampir semua unsur bahkan pada suhu rendah, memfluorinasi kaca Pyrex untuk membentuk iodin(VII) oksifluorida (IOF5), dan dapat membakar karbon monoksida.[55]
Iodin oksida dan asam okso[sunting | sunting sumber]

Iodin oksida adalah halogen oksida yang paling stabil, karena ikatan I–O yang kuat dihasilkan dari perbedaan elektronegativitas yang besar antara iodin dan oksigen, dan mereka telah dikenal sejak lama.[24] Iodin pentoksida (I2O5) berwarna putih yang stabil dan bersifat higroskopis telah dikenal sejak pembentukannya pada tahun 1813 oleh Gay-Lussac dan Davy. Ia dibuat paling mudah dengan dehidrasi asam iodat (HIO3), yang merupakan anhidrida. Ia dengan cepat akan mengoksidasi karbon monoksida sepenuhnya menjadi karbon dioksida pada suhu kamar, sehingga ia merupakan reagen yang berguna dalam menentukan konsentrasi karbon monoksida. Ia juga dapat mengoksidasi nitrogen oksida, etilena, dan hidrogen sulfida. Ia bereaksi dengan belerang trioksida dan peroksodisulfuril difluorida (S2O6F2) untuk membentuk garam kation iodil, [IO2]+, dan direduksi oleh asam sulfat pekat menjadi garam iodosil yang melibatkan [IO]+. Ia dapat difluorinasi oleh fluorin, bromin trifluorida, belerang tetrafluorida, atau kloril fluorida, menghasilkan iodin pentafluorida, yang juga bereaksi dengan iodin pentoksida, menghasilkan iodin(V) oksifluorida, IOF3. Beberapa oksida lain yang kurang stabil telah diketahui, khususnya I4O9 dan I2O4; struktur mereka belum ditentukan, tetapi tebakan yang masuk akal adalah IIII(IVO3)3 dan [IO]+[IO3]−, masing-masing.[56]
| E°(pasangan) | a(H+) = 1 (asam) |
E°(pasangan) | a(OH−) = 1 (basa) |
|---|---|---|---|
| I2/I− | +0,535 | I2/I− | +0,535 |
| HOI/I− | +0,987 | IO−/I− | +0,48 |
| IO−3/I− | +0,26 | ||
| HOI/I2 | +1,439 | IO−/I2 | +0,42 |
| IO−3/I2 | +1,195 | ||
| IO−3/HOI | +1,134 | IO−3/IO− | +0,15 |
| IO−4/IO−3 | +1,653 | ||
| H5IO6/IO−3 | +1,601 | H3IO2−6/IO−3 | +0,65 |
Yang lebih penting adalah empat asam okso: asam hipoiodit (HIO), asam iodit (HIO2), asam iodat (HIO3), dan asam periodat (HIO4 atau H5IO6). Ketika iodin larut dalam larutan berair, reaksi berikut akan terjadi:[57]
I2 + H2O  HIO + H+ + I−
HIO + H+ + I−Kac = 2,0 × 10−13 mol2 l−2 I2 + 2 OH−  IO− + H2O + I−
IO− + H2O + I−Kalk = 30 mol2 l−2
Asam hipoiodit tidak stabil terhadap disproporsionasi. Dengan demikian, ion hipoiodit akan segera membentuk disproporsi untuk menghasilkan iodida dan iodat:[57]
3 IO−  2 I− + IO−3
2 I− + IO−3K = 1020
Asam iodit dan iodit bahkan kurang stabil dan hanya eksis sebagai zat antara dalam oksidasi iodida menjadi iodat, jika ada.[57] Sejauh ini, iodat merupakan senyawa yang paling penting, yang dapat dibuat dengan mengoksidasi iodida logam alkali dengan oksigen pada suhu 600 °C dan tekanan tinggi, atau dengan mengoksidasi iodin dengan klorat. Tidak seperti klorat, yang terdisproporsi secara sangat lambat untuk membentuk klorida dan perklorat, iodat bersifat stabil terhadap disproporsionasi baik dalam larutan asam maupun basa. Dari sini, garam dari sebagian besar logam dapat diperoleh. Asam iodat paling mudah dibuat melalui oksidasi suspensi iodin berair dengan elektrolisis atau mengasapi asam nitrat. Iodat memiliki kekuatan pengoksidasi terlemah dari semua halat, tetapi bereaksi paling cepat.[58]
Banyak periodat yang telah diketahui, tidak hanya IO−4 tetrahedron yang diperkirakan, tetapi juga IO3−5 piramida persegi, ortoperiodat oktahedron IO5−6, [IO3(OH)3]2−, [I2O8(OH2)]4−, dan I2O4−9. Mereka biasanya dibuat melalui oksidasi natrium iodat secara elektrokimia (dengan timbal(IV) oksida sebagai anoda) atau dengan gas klorin:[59]
- IO−3 + 6 OH− → IO5−6 + 3 H2O + 2 e−
- IO−3 + 6 OH− + Cl2 → IO5−6 + 2 Cl− + 3 H2O
Mereka adalah agen pengoksidasi yang kuat secara termodinamika dan kinetik, dengan cepat mengoksidasi Mn2+ menjadi MnO−4, dan membelah glikol, α-diketon, α-ketol, α-aminoalkohol, dan α-diamina.[59] Ortoperiodat dapat menstabilkan keadaan oksidasi tinggi di antara semua logam karena muatan negatifnya yang sangat tinggi, yaitu −5. Asam ortoperiodat, H5IO6, bersifat stabil, dan akan mengalami dehidrasi pada suhu 100 °C dalam ruang hampa menjadi asam metaperiodat, HIO4. Langkah lebih jauh tidak akan menghasilkan iodin heptoksida (I2O7) yang bahkan tidak eksis, melainkan iodin pentoksida dan oksigen. Asam periodat dapat diprotonasi oleh asam sulfat untuk menghasilkan kation I(OH)+6, isoelektronik menjadi Te(OH)6 dan Sb(OH)−6, serta menghasilkan garam dengan bisulfat dan sulfat.[24]
Senyawa poliiodin[sunting | sunting sumber]
Ketika iodin dilarutkan dalam asam kuat, seperti asam sulfat berasap, larutan paramagnetik berwarna biru cerah termasuk kation I+2 akan terbentuk. Garam padat dari kation diiodin dapat diperoleh dengan mengoksidasi iodin dengan antimon pentafluorida:[24]
- 2 I2 + 5 SbF5 2 I2Sb2F11 + SbF3
Garam I2Sb2F11 berwarna biru tua, dan analog tantalum berwarna biru I2Ta2F11 juga dikenal. Panjang ikatan I–I pada I2 adalah 267 pm, sedangkan pada I+2 hanya 256 pm karena elektron yang hilang pada I+2 telah dipindahkan dari orbital antiikatan, membuat ikatan menjadi lebih kuat tetapi lebih pendek. Dalam larutan asam fluorosulfat, I+2 berwarna biru tua secara reversibel berdimerisasi di bawah suhu −60 °C, membentuk persegi panjang berwarna merah yang diamagnetik I2+4. Kation poliiodin lainnya tidak dikarakterisasi dengan baik, termasuk I+3 berwarna cokelat tua atau hitam yang bengkok dan C2h berwarna hijau yang sentrosimetris atau I+5 berwarna hitam, yang dikenal dalam garam AsF−6 dan AlCl−4, dan garam lainnya.[24][60]
Satu-satunya anion poliiodida yang penting dalam larutan berair adalah triiodida linear, I−3. Pembentukannya menjelaskan mengapa kelarutan iodin dalam air dapat ditingkatkan dengan penambahan larutan kalium iodida:[24]
- I2 + I−
 I−3 (Keq = ~700 pada suhu 20 °C)
I−3 (Keq = ~700 pada suhu 20 °C)
Banyak poliiodida lain dapat ditemukan ketika larutan yang mengandung iodin dan iodida mengkristal, seperti I−5, I−9, I2−4, dan I2−8, di mana garamnya dengan kation besar dan terpolarisasi lemah seperti Cs+ dapat diisolasi.[24][61]
Senyawa organoiodin[sunting | sunting sumber]

Senyawa organiodin telah mendasar dalam pengembangan sintesis organik, seperti dalam eliminasi amina Hofmann,[62] sintesis eter Williamson,[63] reaksi penggandengan Wurtz,[64] dan dalam reagen Grignard.[65]
Ikatan karbon–iodin adalah gugus fungsi umum yang membentuk bagian dari kimia organik inti; secara formal, senyawa ini dapat dianggap sebagai turunan organik dari anion iodida. Senyawa organoiodin yang paling sederhana, alkil iodida, dapat disintesis melalui reaksi alkohol dengan fosforus triiodida; ini kemudian dapat digunakan dalam reaksi substitusi nukleofilik, atau untuk membuat reagen Grignard. Ikatan C–I merupakan yang terlemah dari semua ikatan karbon–halogen karena perbedaan keelektronegatifan yang sangat kecil antara karbon (2,55) dan iodin (2,66). Dengan demikian, iodida adalah gugus pergi terbaik di antara para halogen, sedemikian rupa sehingga banyak senyawa organoiodin berubah menjadi kuning ketika disimpan dari waktu ke waktu karena dekomposisi menjadi iodin elemental; mereka umumnya digunakan dalam sintesis organik, karena pembentukan dan pembelahan ikatan C–I yang mudah.[66] Mereka juga secara signifikan lebih padat daripada senyawa organohalogen lainnya berkat berat atom iodin yang tinggi.[67] Beberapa zat pengoksidasi organik seperti iodana mengandung iodin dalam keadaan oksidasi lebih tinggi dari −1, seperti asam 2-iodoksibenzoat, sebuah reagen umum untuk oksidasi alkohol menjadi aldehida,[68] dan iodobenzena diklorida (PhICl2), digunakan untuk klorinasi alkena dan alkuna selektif.[69] Salah satu penggunaan senyawa organoiodin yang lebih terkenal adalah apa yang disebut dengan uji iodoform, di mana iodoform (CHI3) dihasilkan oleh iodinasi menyeluruh dari metil keton (atau senyawa lain yang dapat dioksidasi menjadi metil keton), sebagai berikut:[70]
Beberapa kelemahan penggunaan senyawa organoiodin dibandingkan dengan senyawa organoklorin atau organobromin adalah biaya dan toksisitas yang lebih besar dari turunan iodin, karena iodin memiliki harga tinggi dan senyawa organoiodin merupakan zat alkilasi yang lebih kuat.[71] Sebagai contoh, iodoasetamida dan asam iodoasetat dapat mendenaturasi protein dengan mengalkilasi residu sisteina secara ireversibel dan mencegah pembentukan kembali ikatan disulfida.[72]
Pertukaran halogen untuk menghasilkan iodoalkana melalui reaksi Finkelstein sedikit diperumit oleh fakta bahwa iodida merupakan gugus pergi yang lebih baik daripada klorida atau bromida. Perbedaannya cukup kecil sehingga reaksi ini dapat didorong hingga selesai dengan mengeksploitasi perbedaan kelarutan garam halida, atau dengan menggunakan kelebihan garam halida.[70] Dalam reaksi Finkelstein klasik, sebuah alkil klorida atau alkil bromida diubah menjadi sebuah alkil iodida melalui perlakuan dengan larutan natrium iodida dalam aseton. Natrium iodida dapat larut dalam aseton, sedangkan natrium klorida dan natrium bromida tidak.[73] Reaksi ini didorong menuju produk dengan aksi massa karena adanya pengendapan garam yang tidak larut.[74][75]
Keterjadian dan produksi[sunting | sunting sumber]
Iodin adalah halogen stabil yang paling tidak melimpah, membentuk hanya 0,46 bagian per juta batuan kerak Bumi (bandingkan: fluorin 544 ppm, klorin 126 ppm, bromin 2,5 ppm).[76] Di antara 84 unsur yang terdapat dalam jumlah yang signifikan (unsur 1–42, 44–60, 62–83, 90 dan 92), ia menempati urutan ke-61 dalam kelimpahan. Mineral iodida langka, dan sebagian besar endapan yang cukup terkonsentrasi untuk ekstraksi ekonomis adalah mineral iodat. Contohnya ialah lautarit, Ca(IO3)2, dan dietzeit, 7Ca(IO3)2·8CaCrO4.[76] Mereka adalah mineral yang muncul sebagai pengotor kecil pada kalise, ditemukan di Chili, yang produk utamanya adalah natrium nitrat. Secara total, mereka dapat mengandung setidaknya 0,02% dan paling banyak 1% iodin berdasarkan massa.[77] Natrium iodat diekstraksi dari kalise dan direduksi menjadi iodida oleh natrium bisulfit. Larutan ini kemudian direaksikan dengan iodat yang baru diekstraksi, menyebabkan komproporsionasi menjadi iodin, yang dapat disaring.[20]
Kalise adalah sumber iodin utama pada abad ke-19 dan terus menjadi penting hingga saat ini, menggantikan kelp (yang tidak lagi menjadi sumber yang layak secara ekonomi),[78] tetapi pada akhir abad ke-20 air garam mulai muncul sebagai sumber yang sebanding. Ladang gas Minami Kanto Jepang di sebelah timur Tokyo dan ladang gas Cekungan Anadarko Amerika di barat laut Oklahoma adalah dua sumber terbesar. Air garam lebih panas dari 60 °C dari kedalaman sumbernya. Air garam pertama-tama dimurnikan dan diasamkan menggunakan asam sulfat, kemudian iodida yang ada dioksidasi menjadi iodin dengan klorin. Larutan iodin akan dihasilkan, tetapi encer dan harus dipekatkan. Udara dihembuskan ke dalam larutan untuk menguapkan iodin, yang dialirkan ke menara pengabsorb, tempat di mana belerang dioksida mereduksi iodin. Hidrogen iodida (HI) direaksikan dengan klorin untuk mengendapkan iodin. Setelah penyaringan dan pemurnian, iodin siap dikemas.[77][79]
- 2 HI + Cl2 → I2↑ + 2 HCl
- I2 + 2 H2O + SO2 → 2 HI + H2SO4
- 2 HI + Cl2 → I2↓ + 2 HCl
Sumber-sumber ini memastikan bahwa Chili dan Jepang adalah produsen iodin terbesar saat ini.[76] Secara alternatif, air garam dapat direaksikan dengan perak nitrat untuk mengendapkan iodin sebagai perak iodida, yang kemudian didekomposisi melalui reaksi dengan besi untuk membentuk logam perak dan larutan besi(II) iodida. Iodin kemudian dapat dibebaskan melalui penggantian dengan klorin.[80]
Aplikasi[sunting | sunting sumber]
Sekitar setengah dari semua iodin yang dihasilkan masuk ke dalam berbagai senyawa organoiodin, 15% lainnya tetap sebagai unsur murni, 15% lainnya digunakan untuk membentuk kalium iodida, dan 15% lainnya untuk senyawa iodin anorganik lainnya.[20] Penggunaan utama senyawa iodin adalah katalis, suplemen pakan ternak, stabilisator, pewarna dan pigmen, farmasi, sanitasi (dari tingtur iodin), dan fotografi; kegunaan kecil meliputi penghambatan asbut, penyemaian awan, dan berbagai kegunaan dalam kimia analitis.[20]
Analisis kimia[sunting | sunting sumber]

Anion iodida dan iodat sering digunakan untuk analisis volumetrik kuantitatif, misalnya dalam iodometri. Iodin dan pati membentuk kompleks biru, dan reaksi ini sering digunakan untuk menguji pati atau iodin dan sebagai indikator dalam iodometri. Uji iodin untuk pati masih digunakan untuk mendeteksi uang kertas palsu yang dicetak di atas kertas yang mengandung pati.[81]
Bilangan iodin adalah massa iodin dalam gram yang dikonsumsi oleh 100 gram dari suatu zat kimia, biasanya lemak atau minyak. Bilangan iodin sering digunakan untuk menentukan jumlah ketidakjenuhan dalam asam lemak. Ketidakjenuhan ini berupa ikatan ganda yang bereaksi dengan senyawa iodin.
Kalium tetraiodomerkurat(II), K2HgI4, juga dikenal sebagai reagen Nessler. Ia sering digunakan sebagai uji titik sensitif untuk amonia. Demikian pula, reagen Mayer (larutan kalium tetraiodomerkurat(II)) digunakan sebagai reagen pengendap untuk menguji alkaloid.[82] Larutan iodin alkali encer digunakan dalam uji iodoform untuk metil keton.[70]
Spektroskopi[sunting | sunting sumber]
Spektrum molekul iodin, I2, (tidak hanya) terdiri dari puluhan ribu garis spektrum tajam dalam rentang panjang gelombang 500–700 nm. Oleh karena itu, ia menjadi referensi panjang gelombang yang umum digunakan (standar sekunder). Melalui pengukuran dengan teknik spektroskopi bebas Doppler sambil memfokuskan pada salah satu garis ini, struktur hiperhalus dari molekul iodin akan menampakkan diri. Sebuah garis akan diselesaikan sedemikian rupa sehingga 15 komponen (dari bilangan kuantum rotasi genap, Jgenap), atau 21 komponen (dari bilangan kuantum rotasi ganjil, Jganjil) dapat diukur.[83]
Sesium iodida dan natrium iodida yang didoping talium digunakan dalam sintilator kristal untuk mendeteksi sinar gama. Ia memiliki efisiensi dan spektroskopi dispersif energi dimungkinkan, tetapi resolusinya agak buruk.
Propulsi wahana antariksa[sunting | sunting sumber]
Sistem propulsi yang menggunakan iodin sebagai propelan dapat dibangun lebih padu, dengan massa (dan biaya) yang lebih sedikit, dan beroperasi lebih efisien daripada pendorong ion terkisi yang digunakan untuk menggerakkan wahana antariksa sebelumnya, seperti prob Hayabusa Jepang, satelit GOCE ESA, atau misi DART NASA, yang semuanya menggunakan xenon sebagai massa reaksi. Berat atom iodin hanya 3,3% lebih kecil dari xenon, sedangkan dua energi ionisasi pertamanya rata-rata 12% lebih sedikit; bersama-sama, dua alasan ini menjadikan ion iodin sebagai pengganti yang menjanjikan.[84][85]
Penggunaan iodin harus memungkinkan penerapan teknologi dorong ion yang lebih luas, terutama dengan kendaraan antariksa berskala lebih kecil.[85] Menurut Badan Antariksa Eropa, "Inovasi kecil namun berpotensi mengganggu ini dapat membantu membersihkan langit dari sampah antariksa, dengan memungkinkan satelit kecil untuk menghancurkan diri mereka sendiri dengan murah dan mudah di akhir misi mereka, dengan mengarahkan diri mereka ke atmosfer tempat mereka akan terbakar."[86]
Pada awal 2021, kelompok ThrustMe Prancis melakukan demonstrasi dalam-orbit dari pendorong ion bertenaga listrik untuk wahana antariksa, di mana iodin digunakan sebagai pengganti xenon sebagai sumber plasma, untuk menghasilkan daya dorong dengan mempercepat ion dengan medan elektrostatis.[84]
Obat-obatan[sunting | sunting sumber]
Iodin elemental[sunting | sunting sumber]
Iodin elemental digunakan sebagai antiseptik baik sebagai unsur, atau sebagai anion triiodida I3− yang larut dalam air yang dihasilkan in situ dengan menambahkan iodida ke iodin elemental yang kurang larut dalam air (reaksi kimia balik membuat beberapa iodin elemental bebas dapat tersedia untuk antisepsis). Iodin elemental juga dapat digunakan untuk mengobati kekurangan iodin.[87]
Sebagai alternatif, iodin dapat dihasilkan dari iodofor, yang mengandung kompleks iodin dengan zat pelarut (ion iodida dapat dianggap sebagai iodofor dalam larutan air triiodida). Contoh pembuatan tersebut meliputi:[88]
- Tingtur iodin: iodin dalam etanol, atau iodin dan natrium iodida dalam campuran etanol dan air.
- Iodin Lugol: iodin dan iodida dalam air saja, sebagian besar membentuk triiodida. Tidak seperti tingtur iodin, iodin Lugol memiliki jumlah komponen iodin bebas (I2) yang diminimalkan.
- Iodin povidon (sebuah iodofor).
- Iodin-V: iodin (I2) dan asam fulvat membentuk senyawa klatrat (molekul iodin akan "dikurung" oleh asam fulvat di dalam kompleks inang-tamu ini). Sebuah kompleks kristalin yang larut dalam air, berbentuk padat dan bersifat stabil. Tidak seperti iodofor lainnya, Iodin-V hanya mengandung iodin dalam bentuk molekul (I2).[89]
Tindakan antimikroba iodin bekerja dengan cepat dan dapat bekerja pada konsentrasi rendah, sehingga ia digunakan di ruang operasi.[90] Cara kerjanya yang spesifik tidak diketahui. Ia akan menembus ke dalam mikroorganisme dan menyerang asam amino tertentu (seperti sisteina dan metionina), nukleotida, dan asam lemak, yang pada akhirnya mengakibatkan kematian sel. Ia juga memiliki tindakan antivirus, tetapi virus dan parvovirus kurang sensitif dibandingkan virus yang diselimuti lipid. Iodin mungkin dapat menyerang protein permukaan virus yang diselimuti, dan mungkin juga dapat mengacaukan asam lemak membran dengan bereaksi dengan ikatan karbon tak jenuh.[91]
Formulasi lainnya[sunting | sunting sumber]
Sebelum munculnya agen pengelat organik, garam iodida diberikan secara oral dalam pengobatan keracunan timbal atau raksa, seperti yang dipopulerkan oleh Louis Melsens dan banyak dokter pada abad ke-19 dan awal abad ke-20.[92][93]
Dalam pengobatan, larutan jenuh kalium iodida digunakan untuk mengobati tirotoksikosis akut. Ia juga digunakan untuk memblokir penyerapan iodin-131 di kelenjar tiroid (lihat bagian isotop di atas), ketika isotop ini digunakan sebagai bagian dari radiofarmasi (seperti iobenguan) yang tidak ditargetkan ke jaringan tiroid atau bertipe tiroid.[94][95]
Iodin-131 (biasanya sebagai iodida) adalah komponen dari luruhan nuklir, dan sangat berbahaya karena kecenderungan kelenjar tiroid untuk mengonsentrasikan iodin yang tertelan dan menahannya untuk waktu yang lebih lama dari waktu paruh radiologis isotop ini selama delapan hari. Untuk alasan ini, orang yang berisiko terpapar iodin radioaktif lingkungan (iodin-131) dalam luruhan dapat diinstruksikan untuk mengonsumsi tablet kalium iodida nonradioaktif. Dosis umum orang dewasa adalah satu tablet 130 mg per 24 jam, memasok 100 mg (100.000 mikrogram) iodin ionik. (Dosis iodin harian umum untuk kesehatan normal adalah 100 mikrogram; lihat "Asupan Diet" di bawah.) Menelan iodin nonradioaktif dalam dosis besar ini akan meminimalkan penyerapan iodin radioaktif oleh kelenjar tiroid.[96]

Sebagai unsur dengan kerapatan elektron dan nomor atom tinggi, iodin mengabsorb sinar-X lebih lemah dari 33,3 keV karena efek fotolistrik dari elektron terdalam.[97] Senyawa organoiodin digunakan melalui injeksi intravena sebagai agen radiokontras sinar-X. Aplikasi ini sering digabungkan dengan teknik sinar-X tingkat lanjut seperti angiografi dan pemindaian CT. Saat ini, semua agen radiokontras yang larut dalam air bergantung pada senyawa yang mengandung iodin.
Lainnya[sunting | sunting sumber]
Produksi etilenadiamina dihidroiodida, yang disediakan sebagai suplemen nutrisi untuk ternak, mengonsumsi sebagian besar iodin yang tersedia. Penggunaan signifikan lainnya adalah sebagai katalis untuk produksi asam asetat melalui proses Monsanto dan Cativa. Dalam teknologi ini, yang mendukung permintaan dunia akan asam asetat, asam iodida mengubah bahan baku metanol menjadi metil iodida, yang mengalami karbonilasi. Hidrolisis asetil iodida yang dihasilkan akan meregenerasi asam iodida dan menghasilkan asam asetat.[98]
Iodida anorganik memiliki kegunaan khusus. Titanium, zirkonium, hafnium, dan torium dimurnikan melalui proses van Arkel–de Boer, yang melibatkan pembentukan tetraiodida reversibel dari unsur-unsur ini. Perak iodida adalah bahan utama dari film gulung tradisional. Ribuan kilogram perak iodida digunakan setiap tahunnya untuk penyemaian awan untuk menginduksi hujan.[98]
Senyawa organoiodin eritrosin adalah zat pewarna makanan yang penting. Perfluoroalkil iodida adalah prekursor dari beberapa surfaktan penting, seperti asam perfluorooktanasulfonat.[98]
Reaksi jam iodin (di mana iodin juga berfungsi sebagai uji pati, membentuk kompleks berwarna biru tua),[20] adalah percobaan demonstrasi pendidikan populer dan contoh dari sebuah reaksi yang tampaknya berosilasi (hanya konsentrasi dari produk antara yang berosilasi).
Meskipun iodin memiliki peran luas pada banyak spesies, agen yang mengandungnya dapat memberikan efek yang berbeda berbeda pada spesies yang berbeda dalam sistem pertanian. Pertumbuhan semua galur Fusarium verticillioides secara signifikan dihambat oleh fungistatik yang mengandung iodin (AJ1629-34EC) pada konsentrasi yang tidak membahayakan tanaman. Ini mungkin merupakan perawatan pertanian antijamur yang kurang beracun karena bahan kimianya yang relatif alami.[99]
125I digunakan sebagai radiolabel dalam menyelidiki ligan mana yang menuju ke reseptor pengenalan pola tumbuhan (PRR) mana.[100]
Peran biologis[sunting | sunting sumber]


Iodin adalah sebuah unsur esensial bagi kehidupan dan, dengan nomor atom Z = 53, merupakan unsur terberat yang umumnya dibutuhkan oleh organisme hidup. (Lantanum dan lantanida lainnya, serta wolfram dengan Z = 74 dan uranium dengan Z = 92, digunakan oleh beberapa mikroorganisme.[102][103][104]) Ia diperlukan untuk sintesis hormon tiroid pengatur pertumbuhan tiroksina dan triiodotironina (masing-masing T4 dan T3, dinamai menurut jumlah atom iodinnya). Kekurangan iodin akan menyebabkan penurunan produksi T3 dan T4 seiring dengan pembesaran jaringan tiroid dalam upaya untuk mendapatkan lebih banyak iodin, menyebabkan penyakit yang dikenal sebagai gondok sederhana. Bentuk utama hormon tiroid dalam darah adalah tiroksina (T4), yang memiliki waktu paruh lebih lama daripada T3. Pada manusia, rasio T4 terhadap T3 yang dilepaskan ke dalam darah adalah antara 14:1 dan 20:1. T4 diubah menjadi T3 aktif (tiga sampai empat kali lebih kuat dari T4) di dalam sel melalui deiodinase (5'-iodinase). Mereka akan diproses lebih lanjut melalui dekarboksilasi dan deiodinasi untuk menghasilkan iodotironamina (T1a) dan tironamina (T0a'). Ketiga isoform deiodinase adalah enzim yang mengandung selenium; dengan demikian, selenium diet sangatlah penting untuk produksi T3.[105]
Iodin menyumbang 65% dari berat molekul T4 dan 59% dari T3. 15 hingga 20 mg iodin terkonsentrasi di jaringan tiroid dan hormon, tetapi 70% dari semua yodium dalam tubuh ditemukan di jaringan lain, termasuk kelenjar susu, mata, mukosa lambung, timus janin, cairan serebro-spinal dan pleksus koroid, dinding arteri, leher rahim, dan kelenjar ludah. Selama kehamilan, plasenta mampu menyimpan dan menumpuk iodin.[106][107] Di dalam sel-sel jaringan tersebut, iodida masuk langsung melalui simporter natrium-iodida (NIS). Aksi iodin dalam jaringan susu berhubungan dengan perkembangan janin dan neonatus, tetapi di jaringan lain, (setidaknya) sebagian tidak diketahui.[108]
Asupan diet[sunting | sunting sumber]
Tingkat asupan harian yang direkomendasikan oleh Akademi Kedokteran Nasional Amerika Serikat adalah antara 110 dan 130 µg untuk bayi hingga 12 bulan, 90 µg untuk anak hingga 8 tahun, 130 µg untuk anak hingga 13 tahun, 150 µg untuk orang dewasa, 220 µg untuk ibu hamil, dan 290 µg untuk ibu menyusui.[4][109] Batas Atas Asupan (UL) untuk orang dewasa adalah 1.100 μg/hari.[110] Batas atas ini dinilai dengan menganalisis efek suplementasi pada hormon perangsang tiroid.[108]
Kelenjar tiroid membutuhkan tidak lebih dari 70 μg/hari untuk menyintesis jumlah T4 dan T3 harian yang diperlukan.[4] Tingkat kecukupan harian yang direkomendasikan lebih tinggi dari iodin tampaknya diperlukan untuk fungsi optimal dari sejumlah sistem tubuh, meliputi laktasi, mukosa lambung, kelenjar liur, sel otak, pleksus koroid, timus, dan dinding arteri.[4][111][112][113]
Sumber iodin makanan alami meliputi makanan laut, seperti ikan, rumput laut (seperti kelp) dan kerang-kerangan, produk susu dan telur selama hewan menerima cukup iodin, dan tumbuhan yang tumbuh di tanah yang kaya iodin.[114][115] Garam beriodin diperkaya dengan iodin dalam bentuk natrium iodida atau kalium iodat.[115][116][117]
Pada tahun 2000, rata-rata asupan iodin dari makanan di Amerika Serikat adalah 240 hingga 300 μg/hari untuk pria dan 190 hingga 210 μg/hari untuk wanita.[110] Populasi umum A.S. memiliki nutrisi iodin yang memadai,[118][119] dengan wanita usia subur dan wanita hamil memiliki kemungkinan risiko kekurangan yang ringan.[119] Di Jepang, konsumsi dianggap jauh lebih tinggi, berkisar antara 5.280 μg/hari hingga 13.800 μg/hari dari makanan rumput laut atau kelp kombu,[108] seringkali dalam bentuk ekstrak kombu umami untuk kaldu sup dan keripik kentang. Namun, studi baru menunjukkan bahwa konsumsi iodin di Jepang mendekati 1.000–3.000 μg/hari.[120] UL dewasa di Jepang terakhir direvisi menjadi 3.000 µg/hari pada tahun 2015.[121]
Setelah program fortifikasi iodin seperti iodisasi garam telah dilaksanakan, beberapa kasus hipertiroidisme yang diinduksi iodin telah teramati (disebut fenomena Jod-Basedow). Kondisi ini tampaknya terjadi terutama pada orang di atas 40 tahun, dan risikonya tampak lebih tinggi ketika kekurangan iodin dirasa parah dan peningkatan awal asupan iodin dirasa tinggi.[122]
Kekurangan iodin[sunting | sunting sumber]
Di daerah di mana terdapat sedikit iodin dalam makanan,[123] biasanya daerah pedalaman terpencil dan iklim khatulistiwa semi-arid di mana tidak ada makanan laut yang dimakan, kekurangan iodin akan menimbulkan hipotiroidisme, gejalanya adalah kelelahan ekstrem, gondok, penurunan mental, depresi, berat badan naik, dan suhu tubuh basal yang rendah.[124] Kekurangan iodin adalah penyebab utama kecacatan intelektual yang dapat dicegah, hasil yang terjadi terutama ketika bayi atau anak kecil mengalami hipotiroid karena kekurangan unsur tersebut. Penambahan iodin ke dalam garam dapur sebagian besar telah menghilangkan masalah ini di negara-negara kaya, tetapi kekurangan iodin tetap menjadi masalah kesehatan masyarakat yang serius di negara berkembang saat ini.[125] Kekurangan iodin juga menjadi masalah di daerah tertentu di Eropa. Pemrosesan informasi, keterampilan motorik halus, dan pemecahan masalah visual dapat ditingkatkan dengan pemenuhan iodin pada anak-anak dengan kekurangan iodin sedang.[126]
Pencegahan[sunting | sunting sumber]
Toksisitas[sunting | sunting sumber]
| Bahaya | |
|---|---|
| Piktogram GHS |  
|
| Keterangan bahaya GHS | {{{value}}} |
| H312, H332, H315, H319, H335, H372, H400 | |
| P261, P273, P280, P305, P351, P338, P314[127] | |
Iodin elemental (I2) bersifat racun jika dikonsumsi secara oral tanpa diencerkan. Dosis yang mematikan untuk manusia dewasa adalah 30 mg/kg, yaitu sekitar 2,1–2,4 gram untuk manusia dengan berat 70 hingga 80 kg (bahkan jika percobaan pada tikus menunjukkan bahwa hewan ini dapat bertahan hidup setelah memakan dosis 14000 mg/kg). Kelebihan iodin dapat lebih sitotoksik dengan adanya kekurangan selenium.[129] Suplementasi iodin pada populasi yang kekurangan selenium, secara teori, bermasalah, sebagian karena alasan ini.[108] Toksisitasnya berasal dari sifat pengoksidasinya, yang melaluinya ia dapat mendenaturasi protein (termasuk enzim).[130]
Iodin elemental juga merupakan iritan kulit. Kontak langsung dengan kulit dapat menyebabkan kerusakan, dan kristal iodin padat harus ditangani dengan hati-hati. Larutan dengan konsentrasi iodin elemental yang tinggi, seperti tingtur iodin dan larutan Lugol, dapat menyebabkan kerusakan jaringan jika digunakan dalam pembersihan atau antisepsis yang berkepanjangan; demikian pula, iodin povidon (Betadine) cair yang terperangkap di kulit dapat mengakibatkan luka bakar kimia dalam beberapa kasus yang dilaporkan.[131]
Paparan saat bekerja[sunting | sunting sumber]
Orang dapat terpapar iodin di tempat kerja melalui inhalasi, konsumsi, kontak kulit, dan kontak mata. Administrasi Keselamatan dan Kesehatan Kerja (OSHA) telah menetapkan batas legal (batas paparan yang diizinkan) untuk paparan iodin di tempat kerja sebesar 0,1 ppm (1 mg/m3) selama 8 jam hari kerja. Institut Nasional untuk Keselamatan dan Kesehatan Kerja (NIOSH) telah menetapkan batas paparan yang direkomendasikan (REL) sebesar 0,1 ppm (1 mg/m3) selama 8 jam hari kerja. Pada kadar 2 ppm, iodin langsung berbahaya bagi kehidupan dan kesehatan.[132]
Reaksi alergi[sunting | sunting sumber]
Beberapa orang mengembangkan hipersensitivitas terhadap produk dan makanan yang mengandung iodin. Aplikasi tingtur iodin atau Betadine dapat menyebabkan ruam, terkadang parah.[133] Penggunaan agen kontras berbasis iodin secara parenteral (lihat di atas) dapat menyebabkan reaksi mulai dari ruam ringan hingga anafilaksis yang fatal. Reaksi semacam itu telah menyebabkan kesalahpahaman (diakui secara luas, bahkan di kalangan dokter) bahwa beberapa orang alergi terhadap iodin itu sendiri; bahkan alergi terhadap makanan laut yang kaya iodin telah ditafsirkan demikian.[134] Faktanya, belum pernah ada laporan yang dikonfirmasi mengenai alergi iodin yang sebenarnya, dan alergi terhadap iodin elemental atau garam iodida sederhana secara teori tidak mungkin terjadi. Reaksi hipersensitivitas terhadap produk dan makanan yang mengandung iodin tampaknya terkait dengan komponen molekuler lainnya;[135] dengan demikian, seseorang yang menunjukkan alergi terhadap satu makanan atau produk yang mengandung iodin mungkin tidak memiliki reaksi alergi terhadap yang lain. Pasien dengan berbagai alergi makanan (kerang, telur, susu, dll.) tidak memiliki peningkatan risiko hipersensitivitas media kontras.[135][136] Seperti halnya semua obat, riwayat alergi pasien harus ditanyakan dan dikonsultasikan sebelum obat yang mengandung iodin diberikan.[137]
Status Daftar I DEA A.S.[sunting | sunting sumber]
Fosforus dapat mereduksi iodin elemental menjadi asam iodida, yang merupakan reagen yang efektif untuk mereduksi efedrina atau pseudoefedrina menjadi metamfetamina.[138] Untuk alasan ini, iodin ditetapkan oleh Badan Narkotika Amerika Serikat (DEA) sebagai bahan kimia prekursor Daftar I di bawah 21 CFR 1310.02.[139]
Referensi[sunting | sunting sumber]
- ^ (Indonesia) "Iodin". KBBI Daring. Diakses tanggal 17 Juli 2022.
- ^ Magnetic susceptibility of the elements and inorganic compounds, in Handbook of Chemistry and Physics 81st edition, CRC Press.
- ^ Weast, Robert (1984). CRC, Handbook of Chemistry and Physics. Boca Raton, Florida: Chemical Rubber Company Publishing. hlm. E110. ISBN 0-8493-0464-4.
- ^ a b c d "Iodine". Micronutrient Information Center, Linus Pauling Institute, Oregon State University, Corvallis. 2015. Diakses tanggal 22 Juni 2023.
- ^ McNeil Jr DG (16 Desember 2006). "In Raising the World's I.Q., the Secret's in the Salt". The New York Times. Diarsipkan dari versi asli tanggal 12 Juli 2010. Diakses tanggal 22 Juni 2023.
- ^ World Health Organization (2021). World Health Organization model list of essential medicines: 22nd list (2021). Jenewa: World Health Organization. hdl:10665/345533
 . WHO/MHP/HPS/EML/2021.02.
. WHO/MHP/HPS/EML/2021.02.
- ^ a b Courtois B (1813). "Découverte d'une substance nouvelle dans le Vareck" [Penemuan zat baru dalam rumput laut]. Annales de chimie (dalam bahasa Prancis). 88: 304–310. Dalam bahasa Prancis, rumput laut yang telah tersapu ke pantai disebut "varec", "varech", atau "vareck", yang menjadi asal kata bahasa Inggris "wrack". Kemudian, "varec" juga merujuk pada abu rumput laut tersebut: abunya digunakan sebagai sumber iodin serta garam natrium dan kalium.
- ^ Swain PA (2005). "Bernard Courtois (1777–1838) famed for discovering iodine (1811), and his life in Paris from 1798" (PDF). Bulletin for the History of Chemistry. 30 (2): 103. Diarsipkan dari versi asli (PDF) tanggal 14 Juli 2010. Diakses tanggal 22 Juni 2023.
- ^ Greenwood dan Earnshaw, hlm. 794
- ^ a b "53 Iodine". Elements.vanderkrogt.net. Diakses tanggal 22 Juni 2023.
- ^ Desormes dan Clément membuat pengumuman mereka di Institut impérial de France pada 29 November 1813; ringkasan pengumuman mereka dimuat dalam Gazette nationale ou Le Moniteur Universel tertanggal 2 Desember 1813. Lihat:
- (Staff) (2 Desember 1813). "Institut Imperial de France". Le Moniteur Universel (dalam bahasa Prancis) (336): 1344.
- Chattaway FD (23 April 1909). "The discovery of iodine". Chemical News and Journal of Industrial Science. 99 (2578): 193–195.
- ^ a b Gay-Lussac J (1813). "Sur un nouvel acide formé avec la substance décourverte par M. Courtois" [Pada asam baru yang dibentuk oleh zat yang ditemukan oleh Tn. Courtois]. Annales de Chimie (dalam bahasa Prancis). 88: 311–318.
- ^ Gay-Lussac J (1813). "Sur la combination de l'iode avec d'oxigène" [Pada kombinasi iodin dengan oksigen]. Annales de Chimie (dalam bahasa Prancis). 88: 319–321.
- ^ Gay-Lussac J (1814). "Mémoire sur l'iode" [Memoar tentang iodin]. Annales de Chimie (dalam bahasa Prancis). 91: 5–160.
- ^ Davy H (1813). "Sur la nouvelle substance découverte par M. Courtois, dans le sel de Vareck" [Tentang zat baru yang ditemukan oleh Tn. Courtois dalam garam rumput laut]. Annales de Chimie (dalam bahasa Prancis). 88: 322–329.
- ^ Davy H (1 Januari 1814). "Some experiments and observations on a new substance which becomes a violet coloured gas by heat". Philosophical Transactions of the Royal Society of London. 104: 74–93. doi:10.1098/rstl.1814.0007
 .
.
- ^ Davaine C (1873). "Recherches relatives à l'action des substances dites antiseptiques sur le virus charbonneux" [Investigasi mengenai aksi yang disebut zat antiseptik pada bakteri antraks]. Comptes rendus hebdomadaires des séances de l'Académie des Sciences (dalam bahasa Prancis). 77: 821–825.
- ^ Grossich A (31 Oktober 1908). "Eine neue Sterilisierungsmethode der Haut bei Operationen" [Metode sterilisasi kulit baru untuk operasi]. Zentralblatt für Chirurgie (dalam bahasa Jerman). 35 (44): 1289–1292.
- ^ "Mendeleev's First Periodic Table". web.lemoyne.edu.
- ^ a b c d e f g h i j k l m Greenwood dan Earnshaw, hlm. 800–4
- ^ Kugler HK, Keller C (1985). 'At, Astatine', System No. 8a. Gmelin Handbook of Inorganic and Organometallic Chemistry. 8 (edisi ke-8). Springer-Verlag. ISBN 978-3-540-93516-2.
- ^ a b c d Greenwood dan Earnshaw, hlm. 804–9
- ^ Windholz, Martha; Budavari, Susan; Stroumtsos, Lorraine Y.; Fertig, Margaret Noether, ed. (1976). Merck Index of Chemicals and Drugs (edisi ke-9). J A Majors Company. ISBN 978-0-911910-26-1.
- ^ a b c d e f g King RB (1995). Inorganic Chemistry of Main Group Elements. Wiley-VCH. hlm. 173–98. ISBN 978-0-471-18602-1.
- ^ Housecroft, C. E.; Sharpe, A. G. (2008). Inorganic Chemistry (edisi ke-3rd). Prentice Hall. hlm. 541. ISBN 978-0131755536.
- ^ Stojanovska M, Petruševski VM, Šoptrajanov B (1 Maret 2012). "The concept of sublimation – iodine as an example". Educación Química (dalam bahasa Inggris). 23: 171–175. doi:10.1016/S0187-893X(17)30149-0
 . ISSN 0187-893X.
. ISSN 0187-893X.
- ^ Li WK, Zhou GD, Mak TC (2008). Advanced Structural Inorganic Chemistry
 . Oxford University Press. hlm. 674. ISBN 978-0-19-921694-9.
. Oxford University Press. hlm. 674. ISBN 978-0-19-921694-9.
- ^ a b Audi, Georges; Bersillon, Olivier; Blachot, Jean; Wapstra, Aaldert Hendrik (2003), "The NUBASE evaluation of nuclear and decay properties", Nuclear Physics A, 729: 3–128, Bibcode:2003NuPhA.729....3A, doi:10.1016/j.nuclphysa.2003.11.001
- ^ Watson JT, Roe DK, Selenkow HA (September 1965). "Iodine-129 as a "nonradioactive" tracer". Radiation Research. 26 (1): 159–163. Bibcode:1965RadR...26..159W. doi:10.2307/3571805. JSTOR 3571805. PMID 4157487.
- ^ Santschi PH, Moran JE, Oktay S, Hoehn E, Sharma P (1998). "129Iodine: A new tracer for surface water/groundwater interaction" (PDF). Livermore, AS: Lawrence Livermore National Laboratory preprint UCRL-JC-132516. Diarsipkan dari versi asli (PDF) tanggal 21 Desember 2016.
- ^ Snyder G, Fabryka-Martin J (2007). "I-129 and Cl-36 in dilute hydrocarbon waters: Marine-cosmogenic, in situ, and anthropogenic sources". Applied Geochemistry. 22 (3): 692–714. Bibcode:2007ApGC...22..692S. doi:10.1016/j.apgeochem.2006.12.011.
- ^ Clayton DD (1983). Principles of Stellar Evolution and Nucleosynthesis
 (edisi ke-2). University of Chicago Press. hlm. 75. ISBN 978-0-226-10953-4.
(edisi ke-2). University of Chicago Press. hlm. 75. ISBN 978-0-226-10953-4.
- ^ Bolt BA, Packard RE, Price PB (2007). "John H. Reynolds, Physics: Berkeley". The University of California, Berkeley. Diakses tanggal 23 Juni 2023.
- ^ SCOPE 50 - Radioecology after Chernobyl Diarsipkan 13 Mei 2014 di Wayback Machine., Scientific Committee on Problems of the Environment (SCOPE), 1993. Lihat tabel 1.9 di Bagian 1.4.5.2.
- ^ Hupf HB, Eldridge JS, Beaver JE (April 1968). "Production of iodine-123 for medical applications". The International Journal of Applied Radiation and Isotopes. 19 (4): 345–351. doi:10.1016/0020-708X(68)90178-6. PMID 5650883.
- ^ Harper, P.V.; Siemens, W.D.; Lathrop, K.A.; Brizel, H.E.; Harrison, R.W. Iodine-125. Proc. Japan Conf. Radioisotopes; Vol: ke-4 01 Jan 1961
- ^ Rivkees SA, Sklar C, Freemark M (November 1998). "Clinical review 99: The management of Graves' disease in children, with special emphasis on radioiodine treatment". The Journal of Clinical Endocrinology and Metabolism. 83 (11): 3767–3776. doi:10.1210/jcem.83.11.5239
 . PMID 9814445.
. PMID 9814445.
- ^ Zanzonico PB, Becker DV (Juni 2000). "Effects of time of administration and dietary iodine levels on potassium iodide (KI) blockade of thyroid irradiation by 131I from radioactive fallout". Health Physics. 78 (6): 660–667. doi:10.1097/00004032-200006000-00008. PMID 10832925.
- ^ "Medical isotopes the likely cause of radiation in Ottawa waste". CBC News. 4 Februari 2009. Diakses tanggal 23 Juni 2023.
- ^ Moser H, Rauert W (2007). "Isotopic Tracers for Obtaining Hydrologic Parameters". Dalam Aggarwal PK, Gat JR, Froehlich KF. Isotopes in the water cycle : past, present and future of a developing science. Dordrecht: Springer. hlm. 11. ISBN 978-1-4020-6671-9. Diakses tanggal 23 Juni 2023.
- ^ Rao SM (2006). "Radioisotopes of hydrological interest". Practical isotope hydrology. New Delhi: New India Publishing Agency. hlm. 12–13. ISBN 978-81-89422-33-2. Diakses tanggal 23 Juni 2023.
- ^ "Investigating leaks in Dams & Reservoirs" (PDF). IAEA.org. Diarsipkan dari versi asli (PDF) tanggal 30 Juli 2013. Diakses tanggal 23 Juni 2023.
- ^ Araguás LA, Bedmar AP (2002). "Artificial radioactive tracers". Detection and prevention of leaks from dams. Taylor & Francis. hlm. 179–181. ISBN 978-90-5809-355-4. Diakses tanggal 23 Juni 2023.
- ^ Greenwood dan Earnshaw, hlm. 806-7
- ^ Greenwood dan Earnshaw, hlm. 809–12
- ^ a b c Greenwood dan Earnshaw, hlm. 812–9
- ^ Holleman, A. F.; Wiberg, E. "Inorganic Chemistry" Academic Press: San Diego, 2001. ISBN 0-12-352651-5.
- ^ Aduk amonia NI3•NH3 lebih stabil dan dapat diisolasi pada suhu kamar sebagai padatan hitam yang terkenal peka terhadap kejutan.
- ^ Tornieporth-Oetting, Inis; Klapötke, Thomas (Juni 1990). "Nitrogen Triiodide". Angewandte Chemie International Edition in English (dalam bahasa Inggris). 29 (6): 677–679. doi:10.1002/anie.199006771. ISSN 0570-0833.
- ^ Vilarrubias, Pere (17 November 2022). "The elusive diiodosulphanes and diiodoselenanes". Molecular Physics. 120 (22): e2129106. Bibcode:2022MolPh.12029106V. doi:10.1080/00268976.2022.2129106. ISSN 0026-8976.
- ^ Klapoetke, T.; Passmore, J. (1 Juli 1989). "Sulfur and selenium iodine compounds: from non-existence to significance". Accounts of Chemical Research (dalam bahasa Inggris). 22 (7): 234–240. doi:10.1021/ar00163a002. ISSN 0001-4842.
- ^ a b c Greenwood dan Earnshaw, hlm. 821–4
- ^ a b c d Greenwood dan Earnshaw, hlm. 824–8
- ^ Greenwood dan Earnshaw, hlm. 828–831
- ^ Greenwood dan Earnshaw, hlm. 832–835
- ^ Greenwood dan Earnshaw, hlm. 851–3
- ^ a b c d Greenwood dan Earnshaw, hlm. 853–9
- ^ Greenwood dan Earnshaw, hlm. 863–4
- ^ a b Greenwood dan Earnshaw, hlm. 872–5
- ^ Greenwood dan Earnshaw, hlm. 842–4
- ^ Greenwood dan Earnshaw, hlm. 835–9
- ^ Hofmann AW (1851). "Beiträge zur Kenntniss der flüchtigen organischen Basen". Annalen der Chemie und Pharmacie. 78 (3): 253–286. doi:10.1002/jlac.18510780302.
- ^ Williamson A (1850). "Theory of Aetherification". Philosophical Magazine. 37 (251): 350–356. doi:10.1080/14786445008646627. (Link to excerpt.)
- ^ Wurtz A (1855). "Ueber eine neue Klasse organischer Radicale". Annalen der Chemie und Pharmacie. 96 (3): 364–375. doi:10.1002/jlac.18550960310.
- ^ Grignard V (1900). "Sur quelques nouvelles combinaisons organométaliques du magnésium et leur application à des synthèses d'alcools et d'hydrocabures". Compt. Rend. 130: 1322–25.
- ^ "Iodine and Iodine Compounds", Ullmann's Encyclopedia of Industrial Chemistry, Weinheim: Wiley-VCH, 2005, doi:10.1002/14356007.a14_381
- ^ Blanksby SJ, Ellison GB (April 2003). "Bond dissociation energies of organic molecules" (PDF). Accounts of Chemical Research. 36 (4): 255–263. CiteSeerX 10.1.1.616.3043
 . doi:10.1021/ar020230d. PMID 12693923. Diarsipkan dari versi asli (PDF) tanggal 6 Februari 2009. Diakses tanggal 23 Juni 2023.
. doi:10.1021/ar020230d. PMID 12693923. Diarsipkan dari versi asli (PDF) tanggal 6 Februari 2009. Diakses tanggal 23 Juni 2023.
- ^ (2000) "Dess–Martin periodinane: 1,1,1-Triacetoxy-1,1-dihydro-1,2-benziodoxol-3(1H)-one". Org. Synth. 77: 141; Coll. Vol. 10: 696.
- ^ Jung ME, Parker MH (Oktober 1997). "Synthesis of Several Naturally Occurring Polyhalogenated Monoterpenes of the Halomon Class(1)". The Journal of Organic Chemistry. 62 (21): 7094–7095. doi:10.1021/jo971371. PMID 11671809.
- ^ a b c Smith, Michael B.; March, Jerry (2007), Advanced Organic Chemistry: Reactions, Mechanisms, and Structure (edisi ke-6), New York: Wiley-Interscience, ISBN 0-471-72091-7
- ^ "Safety data for iodomethane". Oxford University.
- ^ Polgár L (Agustus 1979). "Deuterium isotope effects on papain acylation. Evidence for lack of general base catalysis and for enzyme--leaving-group interaction". European Journal of Biochemistry. 98 (2): 369–374. doi:10.1111/j.1432-1033.1979.tb13196.x. PMID 488108.
- ^ Ervithayasuporn V, Ervithayasuporn V, Pornsamutsin N, Pornsamutsin N, Prangyoo P, Prangyoo P, et al. (Oktober 2013). "One-pot synthesis of halogen exchanged silsesquioxanes: octakis(3-bromopropyl)octasilsesquioxane and octakis(3-iodopropyl)octasilsesquioxane". Dalton Transactions. 42 (37): 13747–13753. doi:10.1039/C3DT51373D. PMID 23907310.
- ^ Streitwieser A (1956). "Solvolytic Displacement Reactions at Saturated Carbon Atoms". Chem. Rev. 56 (4): 571–752. doi:10.1021/cr50010a001.
- ^ Bordwell FG, Brannen WT (1964). "The Effect of the Carbonyl and Related Groups on the Reactivity of Halides in SN2 Reactions". J. Am. Chem. Soc. 86 (21): 4645–4650. doi:10.1021/ja01075a025.
- ^ a b c Greenwood dan Earnshaw, hlm. 795–796.
- ^ a b Kogel JE, Trivedi NC, Barker JM, Krukowski ST, ed. (2006). Industrial Minerals & Rocks: Commodities, Markets, and Uses. SME. hlm. 541–552. ISBN 978-0-87335-233-8.
- ^ Stanford EC (1862). "On the Economic Applications of Seaweed". Journal of the Society of Arts: 185–189.
- ^ Maekawa T, Igari SI, Kaneko N (2006). "Chemical and isotopic compositions of brines from dissolved-in-water type natural gas fields in Chiba, Japan". Geochemical Journal. 40 (5): 475. Bibcode:2006GeocJ..40..475M. doi:10.2343/geochemj.40.475
 .
.
- ^ Greenwood dan Earnshaw, hlm. 799.
- ^ Emsley J (2001). Nature's Building Blocks (edisi ke-Hardcover, First). Oxford University Press. hlm. 244–250. ISBN 978-0-19-850340-8.
- ^ Szász, György; Buda, László (1971). "Contribution to the reaction of alkaloids with potassium tetraiodomercurate". Fresenius' Zeitschrift für Analytische Chemie. Springer Science and Business Media LLC. 253 (5): 361–363. doi:10.1007/bf00426350. ISSN 0016-1152.
- ^ Sansonetti CJ (Agustus 1997). "Precise measurements of hyperfine components in the spectrum of molecular iodine". Journal of the Optical Society of America B (dalam bahasa Inggris). 14 (8): 1913–1920. doi:10.2172/464573. OSTI 464573.
- ^ a b Rafalskyi D, Martínez JM, Habl L, Zorzoli Rossi E, Proynov P, Boré A, et al. (November 2021). "In-orbit demonstration of an iodine electric propulsion system". Nature. 599 (7885): 411–415. Bibcode:2021Natur.599..411R. doi:10.1038/s41586-021-04015-y. PMC 8599014
 Periksa nilai
Periksa nilai |pmc=(bantuan). PMID 34789903 Periksa nilai|pmid=(bantuan).Ion iodin atomik dan molekuler dipercepat oleh jaringan tegangan tinggi untuk menghasilkan daya dorong, dan sinar yang sangat terkolimasi dapat dihasilkan dengan disosiasi iodin yang substansial.
- ^ a b Ravisetti M (18 November 2021). "In a space first, scientists test ion thrusters powered by iodine". CNET. Red Ventures. Diakses tanggal 23 Juni 2023.
- ^ "Iodine thruster used to change the orbit of a small satellite for the first time ever". www.esa.int. The European Space Agency. 22 Januari 2021. Diakses tanggal 23 Juni 2023.
- ^ World Health Organization (2009). Stuart MC, Kouimtzi M, Hill SR, ed. WHO Model Formulary 2008. Organisasi Kesehatan Dunia. hlm. 499. hdl:10665/44053
 . ISBN 9789241547659.
. ISBN 9789241547659.
- ^ Block SS (2001). Disinfection, sterilization, and preservation. Hagerstwon, MD: Lippincott Williams & Wilkins. hlm. 159. ISBN 978-0-683-30740-5.
- ^ Köntös Z (9 Juli 2021). "Efficacy of "Essential Iodine Drops" against Severe Acute Respiratory Syndrome-Coronavirus 2 (SARS-CoV-2)". PLOS ONE. 16 (7): e0254341. Bibcode:2021PLoSO..1654341K. doi:10.1371/journal.pone.0254341
 . PMC 8270147
. PMC 8270147  Periksa nilai
Periksa nilai |pmc=(bantuan). PMID 34242340 Periksa nilai|pmid=(bantuan). - ^ Patwardhan N, Kelkar U (2011). "Disinfection, sterilization and operation theater guidelines for dermatosurgical practitioners in India". Indian Journal of Dermatology, Venereology and Leprology. 77 (1): 83–93. doi:10.4103/0378-6323.74965
 . PMID 21220895.
. PMID 21220895.
- ^ McDonnell G, Russell AD (Januari 1999). "Antiseptics and disinfectants: activity, action, and resistance". Clinical Microbiology Reviews. 12 (1): 147–179. doi:10.1128/CMR.12.1.147. PMC 88911
 . PMID 9880479.
. PMID 9880479.
- ^ "Sur l'emploi de l'iodure de potassium pour combattre les affections saturnines et mercurielles", dalam Annales de chimie et de physique, t. 26, 3e série, 1849.
- ^ "On the Employment of Iodide of Potassium as a Remedy for the Affections Caused by Lead and Mercury", dalam Br Foreign Med Chir Rev. 1853 Jan; 11(21): 201–224.
- ^ "Solubility of KI in water". Hazard.com. 21 April 1998. Diakses tanggal 23 Juni 2023.
- ^ "EANM procedure guidelines for 131I-meta-iodobenzylguanidine (131I-mIBG) therapy" (PDF). 23 Juni 2023. Diarsipkan dari versi asli (PDF) tanggal 17 Juni 2009.
- ^ "CDC Radiation Emergencies", U.S. Centers for Disease Control, 11 Oktober 2006, diakses tanggal 23 Juni 2023.
- ^ Lancaster JL. "Chapter 4: Physical Determinants of Contrast" (PDF). Physics of Medical X-Ray Imaging. The University of Texas Health Science Center. Diarsipkan dari versi asli (PDF) tanggal 10 Oktober 2015.
- ^ a b c Lyday PA, Kaiho T (2015). "Iodine and Iodine Compounds". Ullmann's Encyclopedia of Industrial Chemistry. A14. Weinheim: Wiley-VCH. hlm. 382–390. doi:10.1002/14356007.a14_381.pub2. ISBN 9783527306732.
- ^ Yates IE, Arnold JW, Bacon CW, Hinton DM (2004). "In vitro assessments of diverse plant pathogenic fungi treated with a novel growth control agent". Crop Protection. Elsevier BV. 23 (12): 1169–1176. doi:10.1016/j.cropro.2004.03.019. ISSN 0261-2194.
- ^ Boutrot F, Zipfel C (Agustus 2017). "Function, Discovery, and Exploitation of Plant Pattern Recognition Receptors for Broad-Spectrum Disease Resistance". Annual Review of Phytopathology. Annual Reviews. 55 (1): 257–286. doi:10.1146/annurev-phyto-080614-120106. PMID 28617654.
- ^ Mornex, 1987 dan Le Guen dkk., 2000, dikutip oleh Le Guen B, Hemidy PY, Gonin M, Bailloeuil C, Van Boxsom D, Renier S, Garcier Y (2001). "Arguments et retour d'expérience sur la distribution d'iode stable autour des centrales nucléaires françaises". Radioprotection. 36 (4): 417–430. doi:10.1051/radiopro:2001101
 .
.
- ^ Pol A, Barends TR, Dietl A, Khadem AF, Eygensteyn J, Jetten MS, Op den Camp HJ (Januari 2014). "Rare earth metals are essential for methanotrophic life in volcanic mudpots". Environmental Microbiology. 16 (1): 255–264. doi:10.1111/1462-2920.12249. PMID 24034209.
- ^ Johnson JL, Rajagopalan KV, Mukund S, Adams MW. (5 Maret 1993). "Identification of molybdopterin as the organic component of the tungsten cofactor in four enzymes from hyperthermophilic Archaea". Journal of Biological Chemistry. 268 (7): 4848–52. doi:10.1016/S0021-9258(18)53474-8
 . PMID 8444863.
. PMID 8444863.
- ^ Koribanics NM, Tuorto SJ, Lopez-Chiaffarelli N, McGuinness LR, Häggblom MM, Williams KH, et al. (2015). "Spatial distribution of an uranium-respiring betaproteobacterium at the Rifle, CO field research site". PLOS ONE. 10 (4): e0123378. Bibcode:2015PLoSO..1023378K. doi:10.1371/journal.pone.0123378
 . PMC 4395306
. PMC 4395306  . PMID 25874721.
. PMID 25874721.
- ^ Irizarry L (23 April 2014). "Thyroid Hormone Toxicity". Medscape. WedMD LLC. Diakses tanggal 23 Juni 2023.
- ^ Burns, R; O'Herlihy, C; Smyth, PP (Mei 2011). "The placenta as a compensatory iodine storage organ". Thyroid. 21 (5): 541–6. doi:10.1089/thy.2010.0203. PMID 21417918.
- ^ Neven, KY; Marien, CBD; Janssen, BG; Roels, HA; Waegeneers, N; Nawrot, TS; Ruttens, A (13 Januari 2020). "Variability of iodine concentrations in the human placenta". Scientific Reports. 10 (1): 161. Bibcode:2020NatSR..10..161N. doi:10.1038/s41598-019-56775-3. PMC 6957482
 . PMID 31932629.
. PMID 31932629.
- ^ a b c d Patrick L (Juni 2008). "Iodine: deficiency and therapeutic considerations" (PDF). Alternative Medicine Review. 13 (2): 116–127. PMID 18590348. Diarsipkan dari versi asli (PDF) tanggal 31 Mei 2013.
- ^ "Dietary Reference Intakes (DRIs): Recommended Intakes for Individuals, Vitamins". Institute of Medicine. 2004. Diarsipkan dari versi asli tanggal 30 Oktober 2009. Diakses tanggal 24 Juni 2023.
- ^ a b United States National Research Council (2000). Dietary Reference Intakes for Vitamin A, Vitamin K, Arsenic, Boron, Chromium, Copper, Iodine, Iron, Manganese, Molybdenum, Nickel, Silicon, Vanadium, and Zinc. National Academies Press. hlm. 258–259. doi:10.17226/10026. ISBN 978-0-309-07279-3. PMID 25057538.
- ^ Venturi S, Venturi M (September 2009). "Iodine, thymus, and immunity". Nutrition. 25 (9): 977–979. doi:10.1016/j.nut.2009.06.002. PMID 19647627.
- ^ Ullberg S, Ewaldsson B (February 1964). "Distribution of radio-iodine studied by whole-body autoradiography". Acta Radiologica. 2: 24–32. doi:10.3109/02841866409134127. PMID 14153759.
- ^ Venturi S (2014). "Iodine, PUFAs and Iodolipids in Health and Disease: An Evolutionary Perspective". Human Evolution. 29 (1–3): 185–205. ISSN 0393-9375.
- ^ "Where do we get iodine from?". Iodine Global Network. Diarsipkan dari versi asli tanggal 13 Agustus 2015.
- ^ a b "Iodine in diet". MedlinePlus Medical Encyclopedia.
- ^ "American Thyroid Association". thyroid.org. American Thyroid Association. Diakses tanggal 24 Juni 2023.
- ^ "Cerebos iodised table salt". Waitrose. 2023. Diarsipkan dari versi asli tanggal 28 Maret 2023. Diakses tanggal 24 Juni 2023.
- ^ Caldwell KL, Makhmudov A, Ely E, Jones RL, Wang RY (April 2011). "Iodine status of the U.S. population, National Health and Nutrition Examination Survey, 2005–2006 and 2007–2008". Thyroid. 21 (4): 419–427. doi:10.1089/thy.2010.0077. PMID 21323596.
- ^ a b Leung AM, Braverman LE, Pearce EN (November 2012). "History of U.S. iodine fortification and supplementation". Nutrients. 4 (11): 1740–1746. doi:10.3390/nu4111740
 . PMC 3509517
. PMC 3509517  . PMID 23201844.
. PMID 23201844.
- ^ Zava TT, Zava DT (Oktober 2011). "Assessment of Japanese iodine intake based on seaweed consumption in Japan: A literature-based analysis". Thyroid Research. 4: 14. doi:10.1186/1756-6614-4-14. PMC 3204293
 . PMID 21975053.
. PMID 21975053.
- ^ "Overview of Dietary Reference Intakes for Japanese (2015)" (PDF). Minister of Health, Labour and Welfare, Japan. Diakses tanggal 24 Juni 2023.
- ^ Wu T, Liu GJ, Li P, Clar C (2002). Wu T, ed. "Iodised salt for preventing iodine deficiency disorders". The Cochrane Database of Systematic Reviews. 2010 (3): CD003204. doi:10.1002/14651858.CD003204. PMC 9006116
 Periksa nilai
Periksa nilai |pmc=(bantuan). PMID 12137681. - ^ Dissanayake CB, Chandrajith R, Tobschall HJ (1999). "The iodine cycle in the tropical environment – implications on iodine deficiency disorders". International Journal of Environmental Studies. 56 (3): 357. doi:10.1080/00207239908711210.
- ^ Felig P, Frohman LA (2001). "Endemic Goiter". Endocrinology & metabolism. McGraw-Hill Professional. ISBN 978-0-07-022001-0.
- ^ "Micronutrient deficiency: iodine deficiency disorders". WHO. Diarsipkan dari versi asli tanggal 30 September 2006.
- ^ Zimmermann MB, Connolly K, Bozo M, Bridson J, Rohner F, Grimci L (January 2006). "Iodine supplementation improves cognition in iodine-deficient schoolchildren in Albania: a randomized, controlled, double-blind study". The American Journal of Clinical Nutrition. 83 (1): 108–114. doi:10.1093/ajcn/83.1.108
 . PMID 16400058.
. PMID 16400058.
- ^ "Iodine 207772". I2.
- ^ Technical data for Iodine. periodictable.com
- ^ Smyth PP (2003). "Role of iodine in antioxidant defence in thyroid and breast disease". BioFactors. 19 (3–4): 121–130. doi:10.1002/biof.5520190304. PMID 14757962.
- ^ Yerkes C (2007). "Lecture 29: Protein Structure and Denaturation". chem.uiuc.edu. University of Illinois. Diakses tanggal 24 Juni 2023.
- ^ Lowe DO, Knowles SR, Weber EA, Railton CJ, Shear NH (November 2006). "Povidone-iodine-induced burn: case report and review of the literature". Pharmacotherapy. 26 (11): 1641–1645. doi:10.1592/phco.26.11.1641. PMID 17064209.
- ^ "CDC - NIOSH Pocket Guide to Chemical Hazards - Iodine". cdc.gov. Diakses tanggal 24 Juni 2023.
- ^ DermNet New Zealand Trust, Iodine
- ^ Boehm I (Agustus 2008). "Seafood allergy and radiocontrast media: are physicians propagating a myth?". The American Journal of Medicine. 121 (8): e19. doi:10.1016/j.amjmed.2008.03.035. PMID 18691465.
- ^ a b UCSF Department of Radiology & Biomedical Imaging, Iodine Allergy and Contrast Administration
- ^ Lombardo P, Nairz K, Boehm I (Juli 2019). "Patients' safety and the "iodine allergy" - How should we manage patients with iodine allergy before they receive an iodinated contrast medium?". European Journal of Radiology. 116 (7): 150–151. doi:10.1016/j.ejrad.2019.05.002. PMID 31153557.
- ^ Katelaris C (2009). "'Iodine Allergy' label is misleading". Australian Prescriber. 32 (5): 125–128. doi:10.18773/austprescr.2009.061
 .
.
- ^ Skinner HF (1990). "Methamphetamine synthesis via hydriodic acid/red phosphorus reduction of ephedrine". Forensic Science International. 48 (2): 123–134. doi:10.1016/0379-0738(90)90104-7.
- ^ "PART 1310 - Section 1310.02 Substances covered". Diarsipkan dari versi asli tanggal 17 Oktober 2017. Diakses tanggal 24 Juni 2023.
Bibliografi[sunting | sunting sumber]
- Greenwood, Norman N.; Earnshaw, A. (1997), Chemistry of the Elements (edisi ke-2), Oxford: Butterworth-Heinemann, ISBN 0-7506-3365-4
| (besar) | |||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | ||||||||||||||||
| 1 | H | He | |||||||||||||||||||||||||||||||
| 2 | Li | Be | B | C | N | O | F | Ne | |||||||||||||||||||||||||
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar | |||||||||||||||||||||||||
| 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | |||||||||||||||
| 5 | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | |||||||||||||||
| 6 | Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | |
| 7 | Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | |
|
| |||||||||||||||||||||||||||||||||




![{\displaystyle {\ce {TaI5{}+Ta->[{\text{gradien termal}}][{\ce {630^{\circ }C\ ->\ 575^{\circ }C}}]Ta6I14}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/c7efd628ecf597d23edfcea5633b9dd299629a83)