Isotop
Isotop adalah dua atau lebih jenis atom yang memiliki nomor atom (jumlah proton dalam inti mereka) yang sama dan posisi dalam tabel periodik (dan karenanya termasuk dalam unsur kimia yang sama), dan yang berbeda dalam nomor nukleon (nomor massa) karena untuk jumlah neutron yang berbeda dalam inti mereka. Walaupun semua isotop dari unsur tertentu memiliki sifat kimia yang hampir sama, mereka memiliki massa atom dan sifat fisik yang berbeda.[1]
Istilah isotop dibentuk dari akar kata Yunani isos (ἴσος "sama") dan topos (τόπος "tempat"), yang berarti "tempat yang sama"; dengan demikian, makna di balik nama tersebut adalah bahwa isotop yang berbeda dari suatu unsur menempati posisi yang sama pada tabel periodik.[2] Istilah ini diciptakan oleh dokter dan penulis Skotlandia Margaret Todd pada tahun 1913 dalam sebuah usul kepada ahli kimia Inggris Frederick Soddy.[3]
Jumlah proton dalam inti atom disebut nomor atom dan sama dengan jumlah elektron dalam atom netral (tidak terionisasi). Setiap nomor atom mengidentifikasi unsur tertentu, tetapi bukan isotopnya; sebuah atom dari unsur tertentu mungkin memiliki kisaran jumlah neutron yang luas. Jumlah nukleon (proton dan neutron) dalam inti adalah nomor massa atom, dan setiap isotop unsur tertentu memiliki nomor massa yang berbeda.
Misalnya, karbon-12, karbon-13, dan karbon-14 adalah tiga isotop dari unsur karbon dengan nomor massa masing-masing 12, 13, dan 14. Nomor atom karbon adalah 6, yang artinya setiap atom karbon memiliki 6 proton, sehingga jumlah neutron dari isotop-isotop tersebut adalah 6, 7, dan 8, berturut-turut.
Isotop vs. nuklida
[sunting | sunting sumber]Nuklida adalah spesies atom dengan jumlah proton dan neutron tertentu dalam inti mereka, misalnya, karbon-13 dengan 6 proton dan 7 neutron. Konsep nuklida (mengacu pada spesies inti individu) menekankan sifat inti di atas sifat kimia, sedangkan konsep isotop (mengelompokkan semua atom dari setiap unsur) menekankan sifat kimia di atas sifat inti. Jumlah neutron memiliki efek besar pada sifat inti, tetapi pengaruhnya terhadap sifat kimia dapat diabaikan untuk sebagian besar unsur. Bahkan untuk unsur yang paling ringan, yang rasio nomor neutron terhadap nomor atomnya paling bervariasi antar isotop, biasanya hanya memiliki efek kecil meskipun dalam beberapa keadaan (untuk hidrogen, unsur paling ringan, efek isotopnya cukup besar untuk mempengaruhi biologinya dengan kuat). Istilah isotop (awalnya juga unsur isotop,[4] sekarang kadang-kadang nuklida isotop[5]) dimaksudkan untuk menyiratkan perbandingan (seperti sinonim atau isomer). Misalnya, nuklida 12
6C, 13
6C, 14
6C merupakan isotop (nuklida dengan nomor atom yang sama tetapi nomor massa yang berbeda[6]), tetapi 40
18Ar, 40
19K, 40
20Ca merupakan isobar (nuklida dengan nomor massa yang sama[7]). Namun, isotop merupakan istilah yang lebih tua dan lebih dikenal daripada nuklida dan kadang-kadang masih digunakan dalam konteks di mana nuklida mungkin lebih tepat, seperti teknologi nuklir dan kedokteran nuklir.
Notasi
[sunting | sunting sumber]Sebuah isotop dan/atau nuklida ditentukan dengan nama unsur tertentu (ini menunjukkan nomor atom) diikuti dengan tanda hubung dan nomor massa (misalnya helium-3, helium-4, karbon-12, karbon-14, uranium-235 dan uranium-239).[8] Ketika lambang kimia digunakan, misalnya "C" untuk karbon, notasi standar (sekarang dikenal sebagai "notasi AZE" karena A adalah nomor massa, Z adalah nomor atom, dan E adalah unsur) digunakan untuk menunjukkan nomor massa (jumlah nukleon) dengan superskrip di bagian atas kiri unsur kimia dan untuk menunjukkan nomor atom dengan subskrip di kiri bawah (misalnya 3
2He, 4
2He, 12
6C, 14
6C, 235
92U, dan 239
92U).[9] Karena nomor atom diberikan oleh lambang unsur, maka biasanya hanya nomor massa saja yang dinyatakan dalam superskrip dan mengabaikan subskrip nomor atomnya (misalnya 3He, 4He, 12C, 14C, 235U, dan 239U). Huruf m kadang-kadang ditambahkan setelah nomor massa untuk menunjukkan isomer nuklir, sebuah keadaan nuklir metastabil atau tereksitasi secara energetik (berlawanan dengan keadaan dasar, yang memiliki energi terendah), misalnya 180m
73Ta (tantalum-180m).
Pengucapan umum untuk notasi AZE berbeda dari cara penulisannya: 4
2He biasanya diucapkan sebagai helium-empat, bukan empat-dua-helium, dan 235
92U sebagai uranium-dua-tiga-lima atau uranium dua-tiga-puluh-lima dan bukannya 235-92-uranium.
Isotop radioaktif, primordial, dan stabil
[sunting | sunting sumber]Beberapa isotop/nuklida bersifat radioaktif, dan oleh karena itu mereka disebut sebagai radioisotop atau radionuklida, sedangkan yang tidak pernah teramati meluruh secara radioaktif disebut sebagai isotop stabil atau nuklida stabil. Misalnya, 14C adalah bentuk radioaktif dari karbon, sedangkan 12C dan 13C adalah isotop stabil. Ada sekitar 339 nuklida yang terjadi secara alami di Bumi,[10] dan 286 di antaranya adalah nuklida primordial, artinya mereka telah ada sejak pembentukan Tata Surya.
Nuklida primordial mencakup 34 nuklida dengan waktu paruh yang sangat panjang (lebih dari 100 juta tahun) dan 252 yang secara formal dianggap sebagai "nuklida stabil",[10] karena mereka belum teramati meluruh. Dalam kebanyakan kasus, untuk alasan yang jelas, jika suatu unsur memiliki isotop stabil, isotop tersebut mendominasi kelimpahan unsur yang ditemukan di Bumi dan di Tata Surya. Namun, dalam kasus tiga unsur (telurium, indium, dan renium) isotop paling melimpah yang ditemukan di alam sebenarnya adalah satu (atau dua) radioisotop yang berumur sangat panjang dari unsur tersebut, meskipun unsur-unsur ini memiliki satu atau lebih isotop yang stabil.
Teori memprediksi bahwa banyak isotop/nuklida yang tampaknya "stabil" bersifat radioaktif, dengan waktu paruh yang sangat panjang (tidak termasuk kemungkinan peluruhan proton, yang akan membuat semua nuklida pada akhirnya tidak stabil). Beberapa nuklida stabil secara teori rentan terhadap bentuk peluruhan lain yang diketahui, seperti peluruhan alfa atau peluruhan beta ganda, tetapi belum ada produk peluruhan yang teramati, sehingga isotop-isotop ini dikatakan "stabil secara pengamatan". Waktu paruh yang diprediksi untuk nuklida ini seringkali jauh melebihi perkiraan usia alam semesta, dan faktanya, ada juga 31 radionuklida yang diketahui (lihat nuklida primordial) dengan waktu paruh yang lebih lama daripada usia alam semesta.
Dengan menambahkan nuklida radioaktif yang telah dibuat secara artifisial, ada 3.339 nuklida yang diketahui saat ini.[11] Ini termasuk 905 nuklida yang stabil atau memiliki waktu paruh lebih dari 60 menit. Lihat daftar nuklida untuk detailnya.
Sejarah
[sunting | sunting sumber]Isotop radioaktif
[sunting | sunting sumber]Keberadaan mengenai isotop pertama kali diusulkan pada tahun 1913 oleh ahli radiokimia Frederick Soddy, berdasarkan studi rantai peluruhan radioaktif yang menunjukkan sekitar 40 spesies berbeda yang disebut sebagai unsur radio (yaitu unsur radioaktif) antara uranium dan timbal, meskipun tabel periodik hanya diperbolehkan untuk 11 unsur antara timbal dan uranium inklusif.[12][13][14]
Beberapa upaya untuk memisahkan unsur-unsur radio baru ini secara kimiawi telah gagal.[15] Sebagai contoh, Soddy telah menunjukkan pada tahun 1910 bahwa mesotorium (kemudian terbukti menjadi 228Ra), radium (226Ra, isotop berumur paling panjang), dan torium X (224Ra) tidak mungkin untuk dipisahkan.[16] Upaya untuk menempatkan unsur radio dalam tabel periodik membuat Soddy dan Kazimierz Fajans secara independen mengusulkan hukum perpindahan radioaktif mereka pada tahun 1913, yang menyatakan bahwa peluruhan alfa menghasilkan sebuah unsur dua tempat ke kiri dalam tabel periodik, sedangkan emisi peluruhan beta menghasilkan sebuah unsur satu tempat ke kanan.[17][18][19][20] Soddy menyadari bahwa emisi partikel alfa diikuti oleh dua partikel beta menyebabkan pembentukan unsur kimia identik dengan unsur awal tetapi dengan massa empat unit lebih ringan dan dengan sifat radioaktif yang berbeda.
Soddy mengusulkan bahwa beberapa jenis atom (berbeda dalam sifat radioaktif) dapat menempati tempat yang sama dalam tabel periodik.[14] Misalnya, peluruhan alfa dari uranium-235 akan membentuk torium-231, sedangkan peluruhan beta dari aktinium-230 akan membentuk torium-230.[15] Istilah "isotop", bahasa Yunani untuk "di tempat yang sama",[14] disarankan kepada Soddy oleh Margaret Todd, seorang dokter Skotlandia dan teman keluarga, selama percakapan di mana ia menjelaskan ide-idenya kepadanya.[16][21][22][23][24][25] Dia memenangkan Penghargaan Nobel 1921 di bidang Kimia karena karyanya mengenai isotop.[26]
Pada tahun 1914 T. W. Richards menemukan variasi antara berat atom timbal dari sumber mineral yang berbeda, yang disebabkan oleh variasi komposisi isotop karena asal radioaktif yang berbeda.[15][26]
Isotop stabil
[sunting | sunting sumber]Bukti pertama untuk beberapa isotop dari unsur stabil (nonradioaktif) ditemukan oleh J. J. Thomson pada tahun 1912 sebagai bagian dari eksplorasinya ke dalam komposisi sinar kanal (ion positif).[27][28] Thomson menyalurkan aliran ion neon melalui medan magnet dan listrik paralel, mengukur defleksinya dengan menempatkan pelat fotografi di jalurnya, dan menghitung rasio massa terhadap muatan menggunakan metode yang kemudian dikenal sebagai metode parabola Thomson. Setiap aliran akan menciptakan tambalan bercahaya di pelat pada titik yang dipukulnya. Thomson mengamati dua tambalan cahaya parabola yang terpisah pada pelat fotografi (lihat gambar), yang menunjukkan dua spesies inti dengan rasio massa terhadap muatan yang berbeda.
F. W. Aston kemudian menemukan beberapa isotop stabil untuk banyak unsur menggunakan spektrograf massa. Pada tahun 1919, Aston mempelajari neon dengan resolusi yang cukup untuk menunjukkan bahwa dua massa isotop sangat dekat dengan bilangan bulat 20 dan 22 dan keduanya tidak sama dengan massa molar yang diketahui (20,2) dari gas neon. Ini adalah contoh dari kaidah bilangan bulat Aston untuk massa isotop, yang menyatakan bahwa penyimpangan besar massa molar unsur dari bilangan bulat terutama disebabkan oleh fakta bahwa unsur tersebut adalah campuran dari beberapa isotop. Aston juga menunjukkan[per kapan?] bahwa massa molar klorin (35,45) adalah rata-rata tertimbang dari massa hampir integral untuk dua isotop 35Cl dan 37Cl.[29]
Variasi sifat antar isotop
[sunting | sunting sumber]Sifat kimia dan molekul
[sunting | sunting sumber]Sebuah atom netral memiliki jumlah elektron yang sama dengan proton. Jadi, isotop-isotop yang berbeda dari suatu unsur tertentu semuanya memiliki jumlah elektron yang sama dan memiliki struktur elektronik yang serupa. Karena perilaku kimia atom sangat ditentukan oleh struktur elektroniknya, isotop yang berbeda menunjukkan perilaku kimia yang hampir identik.
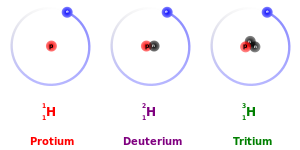
Pengecualian utama untuk ini adalah efek isotop kinetik: karena massanya yang lebih besar, isotop yang lebih berat cenderung bereaksi agak lebih lambat daripada isotop yang lebih ringan dari unsur yang sama. Ini paling jelas untuk protium (1H), deuterium (2H), dan tritium (3H), memiliki dua kali massa protium dan tritium memiliki tiga kali massa protium.[30] Perbedaan massa ini juga mempengaruhi perilaku ikatan kimianya masing-masing, dengan mengubah pusat gravitasi (massa tereduksi) dari sistem atom. Namun, untuk unsur yang lebih berat, perbedaan massa relatif antara isotop jauh lebih kecil sehingga efek perbedaan massa pada kimia biasanya dapat diabaikan. (Unsur berat juga memiliki neutron yang relatif lebih banyak daripada unsur yang lebih ringan, sehingga rasio massa nuklir terhadap massa elektronik kolektif sedikit lebih besar.) Ada juga efek kesetimbangan isotop.

Demikian pula, dua molekul yang berbeda hanya dalam isotop atom mereka (isotopolog) memiliki struktur elektronik yang identik, dan karena itu sifat fisik dan kimia yang hampir tidak dapat dibedakan (sekali lagi dengan deuterium dan tritium sebagai pengecualian utama). Mode vibrasi molekul ditentukan oleh bentuk dan massa atom penyusunnya; jadi isotopolog yang berbeda memiliki set mode vibrasi yang berbeda. Karena mode vibrasi memungkinkan molekul untuk menyerap foton dari energi yang sesuai, isotopolog memiliki sifat optik yang berbeda dalam rentang inframerah.
Sifat dan stabilitas nuklir
[sunting | sunting sumber]Inti atom terdiri dari proton dan neutron yang terikat bersama oleh sisa gaya kuat. Karena proton bermuatan positif, mereka saling tolak. Neutron, yang secara elektrik netral, menstabilkan nukleus dengan dua cara. Keberadaan mereka mendorong proton sedikit terpisah, mengurangi tolakan elektrostatik antara proton, dan mereka mengerahkan gaya nuklir yang menarik satu sama lain dan pada proton. Untuk alasan ini, satu atau lebih neutron diperlukan untuk mengikat dua atau lebih proton menjadi sebuah inti. Dengan bertambahnya jumlah proton, demikian juga rasio neutron terhadap proton yang diperlukan untuk memastikan inti yang stabil (lihat grafik di sebelah kanan). Misalnya, meskipun rasio neutron:proton 3
2He adalah 1:2, rasio neutron:proton 238
92U lebih besar dari 3:2. Sejumlah unsur yang lebih ringan memiliki nuklida yang stabil dengan perbandingan 1:1 (Z = N). Nuklida 40
20Ca (kalsium-40) secara observasional adalah nuklida stabil terberat dengan jumlah neutron dan proton yang sama. Semua nuklida stabil yang lebih berat dari kalsium-40 mengandung lebih banyak neutron daripada proton.
Jumlah isotop per unsur
[sunting | sunting sumber]Dari 80 unsur dengan isotop stabil, jumlah isotop stabil terbesar yang diamati untuk setiap unsur adalah sepuluh (untuk unsur timah). Tidak ada unsur yang memiliki sembilan atau delapan isotop stabil. Lima unsur memiliki tujuh isotop stabil, delapan memiliki enam isotop stabil, sepuluh memiliki lima isotop stabil, sembilan memiliki empat isotop stabil, lima memiliki tiga isotop stabil, 16 memiliki dua isotop stabil (memasukkan 180m
73Ta sebagai stabil), dan 26 unsur hanya memiliki satu isotop stabil (dari jumlah tersebut, 19 diantaranya disebut sebagai unsur mononuklida, memiliki satu isotop stabil primordial tunggal yang mendominasi dan menetapkan berat atom unsur alami hingga presisi tinggi; 3 unsur mononuklida radioaktif juga terjadi).[31] Secara total, ada 252 nuklida yang belum teramati meluruh. Untuk 80 unsur yang memiliki satu atau lebih isotop stabil, jumlah rata-rata isotop stabil adalah 252/80 = 3,15 isotop per unsur.
Bilangan nukleon genap dan ganjil
[sunting | sunting sumber]| p, n | GnGn | GjGj | GnGj | GjGn | Total |
|---|---|---|---|---|---|
| Stabil | 146 | 5 | 53 | 48 | 252 |
| Berumur panjang | 22 | 4 | 3 | 5 | 34 |
| Semuanya primordial | 168 | 9 | 56 | 53 | 286 |
Rasio proton:neutron bukan satu-satunya faktor yang mempengaruhi stabilitas nuklir. Ia juga tergantung pada kegenapan atau keganjilan dari nomor atom Z-nya, nomor neutron N-nya, dan, akibatnya, jumlah mereka, nomor massa A. Keganjilan dari Z dan N cenderung menurunkan energi pengikatan inti, membuat inti ganjil, umumnya, kurang stabil. Perbedaan energi pengikatan inti yang luar biasa antara inti tetangga, terutama isobar ganjil-A, memiliki konsekuensi penting: isotop tidak stabil dengan jumlah neutron atau proton yang tidak optimal meluruh melalui peluruhan beta (termasuk emisi positron), penangkapan elektron, atau mode peluruhan lain yang kurang umum seperti fisi spontan dan peluruhan gugus.
Mayoritas nuklida stabil adalah proton-genap-neutron-genap, di mana semua bilangan Z, N, dan A adalah genap. Nuklida stabil ganjil-A dibagi (kurang lebih merata) menjadi nuklida proton-genap-neutron-ganjil, dan nuklida proton-genap-neutron-ganjil. Inti proton-ganjil-neutron-ganjil yang stabil adalah yang paling tidak umum.
Nomor atom genap
[sunting | sunting sumber]146 nuklida proton-genap, neutron-genap (GnGn) terdiri dari ~58% dari semua nuklida stabil dan semuanya memiliki spin 0 karena berpasangan. Ada juga 24 nuklida genap-genap primordial yang berumur panjang. Akibatnya, masing-masing dari 41 unsur genap dari 2 hingga 82 memiliki setidaknya satu isotop stabil, dan sebagian besar unsur ini memiliki beberapa isotop primordial. Setengah dari unsur bernomor genap ini memiliki enam atau lebih isotop stabil. Stabilitas ekstrim dari helium-4 adalah karena pasangan ganda dari 2 proton dan 2 neutron mencegah semua nuklida yang mengandung lima (5
2He, 5
3Li) atau delapan (8
4Be) nukleon dari muncul untuk waktu yang cukup lama untuk berfungsi sebagai platform untuk penumpukan unsur yang lebih berat melalui fusi nuklir di bintang (lihat proses tripel alfa).
| Peluruhan | Waktu paruh | |
|---|---|---|
| 113 48Cd |
beta | 7,7×1015 a |
| 147 62Sm |
alfa | 1,06×1011 a |
| 235 92U |
alfa | 7,04×108 a |
53 nuklida stabil memiliki jumlah proton genap dan jumlah neutron ganjil. Mereka adalah minoritas dibandingkan dengan isotop genap-genap, yang jumlahnya sekitar 3 kali lipat. Di antara 41 unsur Z-genap yang memiliki nuklida stabil, hanya dua unsur (argon dan serium) yang tidak memiliki nuklida stabil genap-ganjil. Satu unsur (timah) memiliki tiga. Ada 24 unsur yang memiliki satu nuklida genap-ganjil dan 13 unsur yang memiliki dua nuklida genap-ganjil. Dari 35 radionuklida primordial, terdapat empat nuklida genap ganjil (lihat tabel di sebelah kanan), termasuk 235
92U yang fisil. Karena jumlah neutron ganjilnya, nuklida genap-ganjil cenderung memiliki penampang penangkapan neutron yang besar, karena energi yang dihasilkan dari efek pasangan neutron. Nuklida-nuklida proton-genap neutron-ganjil yang stabil ini cenderung jarang ditemukan di alam, umumnya karena, untuk membentuk dan masuk ke dalam kelimpahan primordial, mereka harus lolos dari penangkapan neutron untuk membentuk isotop genap stabil lainnya, selama proses s dan proses r dari penangkapan neutron, selama nukleosintesis di bintang. Karena alasan ini, hanya 195
78Pt dan 9
4Be yang merupakan isotop paling melimpah secara alami dari masing-masing unsur mereka.
Nomor atom ganjil
[sunting | sunting sumber]Empat puluh delapan nuklida proton-ganjil-neutron-genap yang stabil, distabilkan oleh pasangan neutronnya, membentuk sebagian besar isotop stabil dari unsur-unsur bernomor ganjil; sangat sedikit nuklida proton-ganjil-neutron-ganjil terdiri dari yang lain. Ada 41 unsur bernomor ganjil dengan Z = 1 hingga 81, dimana 39 di antaranya memiliki isotop stabil (unsur teknesium (43Tc) dan prometium (61Pm) tidak memiliki isotop stabil). Dari 39 unsur Z ganjil ini, 30 unsur (termasuk hidrogen-1 di mana 0 neutron adalah genap) memiliki satu isotop genap-ganjil yang stabil, dan sembilan unsur: klorin (17Cl), kalium (19K), tembaga (29Cu), galium (31Ga), bromin (35Br), perak (47Ag), antimon (51Sb), iridium (77Ir), dan talium (81Tl), masing-masing memiliki dua isotop ganjil-genap yang stabil. Ini membuat total 30 + 2(9) = 48 isotop ganjil-genap yang stabil.
Ada juga lima isotop ganjil-genap radioaktif primordial yang berumur panjang, 87
37Rb, 115
49In, 187
75Re, 151
63Eu, dan 209
83Bi. Dua yang terakhir baru-baru ini ditemukan meluruh, dengan waktu paruh lebih dari 1018 tahun.
Hanya ada lima nuklida stabil yang mengandung jumlah proton ganjil dan jumlah neutron ganjil. Empat nuklida "ganjil-ganjil" pertama terjadi pada nuklida bermassa rendah, di mana mengubah proton menjadi neutron atau sebaliknya akan menghasilkan rasio proton-neutron yang sangat miring (2
1H, 6
3Li, 10
5B, dan 14
7N; spin 1, 1, 3, 1). Satu-satunya nuklida ganjil-ganjil "stabil" lainnya, 180m
73Ta (spin 9), dianggap sebagai isotop stabil paling langka dari semua 252 isotop stabil, dan merupakan satu-satunya isomer nuklir yang primordial, yang belum teramati meluruh meskipun ada upaya eksperimental.[32]
Banyak radionuklida ganjil-ganjil (seperti tantalum-180) dengan waktu paruh yang relatif pendek telah diketahui. Biasanya, mereka mengalami peluruhan beta menjadi isobar genap-genap terdekat yang membuat pasangan proton dan pasangan neutron. Dari sembilan nuklida ganjil-ganjil primordial (lima stabil dan empat radioaktif dengan waktu paruh yang panjang), hanya 14
7N yang merupakan isotop yang paling umum dari sebuah unsur umum. Ini terjadi karena ia merupakan salah satu bagian dari siklus CNO. Nuklida 6
3Li dan 10
5B merupakan isotop minoritas dari unsur-unsur yang jarang dibandingkan dengan unsur-unsur ringan lainnya, sedangkan enam isotop lainnya hanya merupakan persentase kecil dari kelimpahan alami unsur-unsurnya.
Nomor neutron ganjil
[sunting | sunting sumber]| N | Genap | Ganjil |
|---|---|---|
| Stabil | 194 | 58 |
| Berumur panjang | 27 | 7 |
| Semuanya primordial | 221 | 65 |
Aktinida dengan jumlah neutron ganjil umumnya fisil (dengan neutron termal), sedangkan aktinida dengan jumlah neutron genap umumnya tidak, meskipun mereka dapat dibelah dengan neutron cepat. Semua nuklida ganjil-ganjil yang stabil secara pengamatan memiliki spin bilangan bulat bukan nol. Ini karena neutron tunggal yang tidak berpasangan dan proton yang tidak berpasangan memiliki daya tarik gaya nuklir yang lebih besar satu sama lain jika spinnya sejajar (menghasilkan spin total minimal 1 unit), bukan antiselaras. Lihat deuterium untuk kasus paling sederhana dari perilaku nuklir ini.
Hanya 195
78Pt, 9
4Be, dan 14
7N memiliki jumlah neutron ganjil dan merupakan isotop yang paling melimpah secara alami dari masing-masing unsurnya.
Keterjadian di alam
[sunting | sunting sumber]Sebuah unsur dapat terdiri dari satu nuklida (unsur mononuklida), atau lebih dari satu isotop alami. Isotop yang tidak stabil (radioaktif) dapat sebagai isotop primordial atau pascaprimordial. Isotop primordial adalah produk nukleosintesis bintang atau jenis nukleosintesis lain seperti spalasi sinar kosmik, dan telah bertahan hingga saat ini karena laju peluruhannya sangat lambat (misalnya uranium-238 dan kalium-40). Isotop pascaprimordial diciptakan oleh pemborbardiran sinar kosmik sebagai nuklida kosmogenik (misalnya, tritium, karbon-14), atau dengan peluruhan isotop primordial radioaktif menjadi anaknya yang merupakan nuklida radiogenik radioaktif (misalnya uranium menjadi radium). Beberapa isotop secara alami disintesis sebagai nuklida nukleogenik, oleh beberapa reaksi nuklir alami lainnya, seperti ketika neutron dari fisi nuklir alami diserap oleh atom lain.
Seperti yang telah dibahas di atas, hanya 80 unsur yang memiliki isotop stabil, dan 26 di antaranya hanya memiliki satu isotop stabil. Jadi, sekitar dua pertiga unsur stabil terjadi secara alami di Bumi dalam beberapa isotop stabil, dengan jumlah isotop stabil terbesar untuk suatu unsur adalah sepuluh, untuk timah (50Sn). Ada sekitar 94 unsur yang ditemukan secara alami di Bumi (hingga termasuk plutonium), meskipun beberapa hanya terdeteksi dalam jumlah yang sangat kecil, seperti plutonium-244. Para ilmuwan memperkirakan bahwa unsur-unsur yang terjadi secara alami di Bumi (beberapa hanya sebagai radioisotop) terjadi sebagai 339 isotop (nuklida) secara total.[33] Hanya 252 dari nuklida yang terjadi secara alami ini yang stabil dalam artian belum pernah teramati meluruh sampai saat ini. Tambahan 34 nuklida primordial (total 286 nuklida primordial), bersifat radioaktif dengan waktu paruh yang diketahui, tetapi memiliki waktu paruh lebih dari 100 juta tahun, memungkinkan mereka ada sejak awal Tata Surya. Lihat daftar nuklida untuk detailnya.
Semua nuklida stabil yang diketahui terjadi secara alami di Bumi; nuklida yang terjadi secara alami lainnya bersifat radioaktif tetapi terjadi di Bumi karena waktu paruhnya yang relatif lama, atau karena cara lain dari produksi alami yang sedang berlangsung. Ini termasuk nuklida kosmogenik yang disebutkan di atas, nuklida nukleogenik, dan setiap nuklida radiogenik yang dibentuk oleh peluruhan berkelanjutan dari nuklida radioaktif primordial, seperti radon dan radium dari uranium.
Tambahan ~3000 nuklida radioaktif yang tidak ditemukan di alam telah dibuat dalam reaktor nuklir dan pemercepat partikel. Banyak nuklida berumur pendek yang tidak ditemukan secara alami di Bumi juga telah diamati dengan analisis spektroskopi, yang secara alami tercipta dalam bintang atau supernova. Contohnya adalah aluminium-26, yang tidak ditemukan secara alami di Bumi tetapi ditemukan berlimpah dalam skala astronomi.
Massa atom unsur yang ditabulasi adalah rata-rata yang menjelaskan keberadaan beberapa isotop dengan massa yang berbeda. Sebelum penemuan isotop, nilai-nilai noninteger yang ditentukan secara empiris dari massa atom membingungkan para ilmuwan. Misalnya, sampel klorin mengandung 75,8% klorin-35 dan 24,2% klorin-37, memberikan massa atom rata-rata 35,5 satuan massa atom.
Menurut teori kosmologi yang diterima secara umum, hanya isotop hidrogen dan helium, jejak beberapa isotop litium dan berilium, dan mungkin beberapa boron, yang diciptakan saat Ledakan Dahsyat, sementara semua nuklida lain disintesis kemudian, di bintang dan supernova, dan di interaksi antara partikel energik seperti sinar kosmik, dan nuklida yang dihasilkan sebelumnya. (Lihat nukleosintesis untuk perincian berbagai proses yang dianggap bertanggung jawab atas produksi isotop.) Kelimpahan masing-masing isotop di Bumi dihasilkan dari jumlah yang dibentuk oleh proses-proses ini, penyebarannya melalui galaksi, dan laju peluruhan isotop yang tidak stabil. Setelah penggabungan awal Tata Surya, isotop-isotop didistribusikan kembali menurut massanya, dan komposisi unsur isotop sedikit berbeda dari planet ke planet. Hal ini terkadang memungkinkan untuk melacak asal usul meteorit.
Massa atom isotop
[sunting | sunting sumber]Massa atom (mr) dari suatu isotop (nuklida) ditentukan terutama oleh nomor massanya (yaitu jumlah nukleon dalam intinya). Koreksi kecil disebabkan oleh energi pengikatan inti (lihat cacat massa), sedikit perbedaan massa antara proton dan neutron, dan massa elektron yang terkait dengan atom, yang terakhir karena rasio elektron:nukleon berbeda di antara isotop.
Nomor massa adalah besaran nirdimensi. Massa atom, di sisi lain, diukur menggunakan satuan massa atom berdasarkan massa atom karbon-12. Ia dilambangkan dengan simbol "u" (untuk unified atomic mass unit (satuan massa atom terpadu)) atau "Da" (untuk dalton).
Massa atom isotop yang terjadi secara alami dari suatu unsur menentukan massa atom unsur tersebut. Ketika unsur tersebut mengandung N isotop, ekspresi di bawah ini diterapkan untuk massa atom rata-rata :
di mana m1, m2, ..., mN adalah massa atom dari masing-masing isotop, dan x1, ..., xN adalah kelimpahan relatif dari isotop-isotop ini.
Aplikasi isotop
[sunting | sunting sumber]Pemurnian isotop
[sunting | sunting sumber]Ada beberapa aplikasi yang memanfaatkan sifat-sifat dari berbagai isotop unsur tertentu. Pemisahan isotop merupakan tantangan teknologi yang signifikan, terutama dengan unsur-unsur berat seperti uranium atau plutonium. Unsur yang lebih ringan seperti litium, karbon, nitrogen, dan oksigen biasanya dipisahkan oleh difusi gas dari senyawanya seperti CO dan NO. Pemisahan hidrogen dan deuterium tidak biasa karena ia didasarkan pada sifat kimianya daripada sifat fisiknya, misalnya dalam proses sulfida Girdler. Isotop uranium telah dipisahkan secara massal dengan difusi gas, sentrifugasi gas, pemisahan ionisasi laser, dan (dalam Proyek Manhattan) dengan jenis spektrometri massa produksi.
Penggunaan sifat kimia dan biologi
[sunting | sunting sumber]- Analisis isotop adalah penentuan jejak isotop, yaitu kelimpahan relatif isotop dari unsur tertentu dalam sampel tertentu. Analisis isotop sering dilakukan dengan spektrometri massa rasio isotop. Untuk zat biogenik khususnya, variasi yang signifikan dari isotop C, N, dan O dapat terjadi. Analisis variasi tersebut memiliki berbagai aplikasi, seperti deteksi pemalsuan dalam produk makanan[34] atau asal geografis dari suatu produk menggunakan isoskap. Pengidentifikasian beberapa meteorit tertentu sebagian didasarkan pada jejak isotop dari gas renik yang terkandung di dalamnya.[35]
- Substitusi isotop dapat digunakan untuk menentukan mekanisme reaksi kimia melalui efek isotop kinetik.
- Aplikasi umum lainnya adalah pelabelan isotop, penggunaan isotop yang tidak biasa sebagai pelacak atau penanda dalam reaksi kimia.[36] Biasanya, atom dari unsur tertentu tidak dapat dibedakan satu sama lain. Namun, dengan menggunakan isotop dengan massa yang berbeda, bahkan isotop stabil nonradioaktif yang berbeda dapat dibedakan dengan spektrometri massa atau spektroskopi inframerah. Misalnya, dalam 'pelabelan isotop stabil dengan asam amino dalam kultur sel (Stable Isotope Labeling by/with Amino acids in Cell culture, SILAC)' isotop stabil digunakan untuk mengukur protein. Jika isotop radioaktif digunakan, mereka dapat dideteksi oleh radiasi yang dipancarkannya (ini disebut dengan pelabelan radioisotop).
- Isotop biasanya digunakan untuk menentukan konsentrasi berbagai unsur atau zat menggunakan metode pengenceran isotop, di mana sejumlah senyawa yang tersubstitusi secara isotop dicampur dengan sampel, dan jejak isotop dari campuran yang dihasilkan ditentukan dengan menggunakan spektrometri massa.
Penggunaan sifat nuklir
[sunting | sunting sumber]- Sebuah teknik yang mirip dengan pelabelan radioisotopik adalah penanggalan radiometrik: dengan menggunakan waktu paruh yang diketahui dari suatu unsur yang tidak stabil, seseorang dapat menghitung jumlah waktu yang telah berlalu sejak konsentrasi isotop yang diketahui ada. Contoh yang paling banyak dikenal adalah penanggalan radiokarbon yang digunakan untuk menentukan umur bahan berkarbon.
- Beberapa bentuk spektroskopi bergantung pada sifat nuklir unik dari isotop tertentu, baik radioaktif maupun stabil. Misalnya, spektroskopi resonansi magnet inti (nuclear magnetic resonance, NMR) hanya dapat digunakan untuk isotop dengan spin nuklir bukan nol. Nuklida yang paling umum digunakan dengan spektroskopi NMR adalah 1H, 2D (deuterium), 15N, 13C, dan 31P.
- Spektroskopi Mössbauer juga bergantung pada transisi nuklir dari isotop tertentu, seperti 57Fe.
- Radionuklida juga memiliki yang kegunaan penting. Tenaga nuklir dan pengembangan senjata nuklir membutuhkan jumlah isotop spesifik yang relatif besar. Kedokteran nuklir dan onkologi radiasi masing-masing menggunakan radioisotop untuk diagnosis dan pengobatan medis.
Lihat pula
[sunting | sunting sumber]- Bahan referensi untuk analisis isotop stabil
- Daftar nuklida
- Daftar partikel
- Daftar unsur berserta isotopnya
- GEOTRACES
- Isotopomer
- Kelimpahan unsur kimia
- Spektrometer massa Bainbridge
- Spektrometri massa
- Tabel nuklida
Referensi
[sunting | sunting sumber]- ^ Herzog, Gregory F. (2 Juni 2020). "Isotope". Encyclopædia Britannica.
- ^ Soddy, Frederick (12 Desember 1922). "The origins of the conceptions of isotopes" (PDF). Nobelprize.org. hlm. 393. Diakses tanggal 20 Juli 2022.
Jadi unsur-unsur yang identik secara kimia - atau isotop, sebagaimana saya menyebutnya untuk pertama kalinya dalam surat ini kepada Nature, karena mereka menempati tempat yang sama dalam Tabel Periodik ...
- ^ "isotope—Origin and meaning". www.etymonline.com (dalam bahasa Inggris). Diakses tanggal 20 Juli 2022.
- ^ Soddy, Frederick (1913). "Intra-atomic charge". Nature. 92 (2301): 399–400. Bibcode:1913Natur..92..399S. doi:10.1038/092399c0.
- ^ "IUPAP Red Book" (PDF). Diarsipkan dari versi asli (PDF) tanggal 18 Maret 2015. Diakses tanggal 20 Juli 2022.
- ^ IUPAC Gold Book
- ^ IUPAC Gold Book
- ^ IUPAC (Connelly, N. G.; Damhus, T.; Hartshorn, R. M.; and Hutton, A. T.), Nomenclature of Inorganic Chemistry – IUPAC Recommendations 2005, The Royal Society of Chemistry, 2005; IUPAC (McCleverty, J. A.; and Connelly, N. G.), Nomenclature of Inorganic Chemistry II. Recommendations 2000, The Royal Society of Chemistry, 2001; IUPAC (Leigh, G. J.), Nomenclature of Inorganic Chemistry (recommendations 1990), Blackwell Science, 1990; IUPAC, Nomenclature of Inorganic Chemistry, Second Edition Diarsipkan 2016-03-03 di Wayback Machine., 1970; mungkin di edisi pertama tahun 1958 juga
- ^ Notasi ini tampaknya telah diperkenalkan pada paruh kedua tahun 1930-an. Sebelumnya, berbagai macam notasi digunakan, seperti Ne(22) untuk neon-22 (1934), Ne22 untuk neon-22 (1935), atau bahkan Pb210 untuk timbal-210 (1933).
- ^ a b "Radioactives Missing From The Earth".
- ^ "NuDat 2 Description". Diakses tanggal 20 Juli 2022.
- ^ Choppin, G.; Liljenzin, J. O. dan Rydberg, J. (1995) Radiochemistry and Nuclear Chemistry (ed. ke-2) Butterworth-Heinemann, hlm. 3–5
- ^ Yang lain juga memperkirakan kemungkinan adanya isotop; misalnya:
- Strömholm, Daniel dan Svedberg, Theodor (1909) "Untersuchungen über die Chemie der radioactiven Grundstoffe II." (Investigasi mengenai kimia dari unsur radioaktif, bagian 2), Zeitschrift für anorganischen Chemie, 63: 197–206; lihat khususnya di halaman 206.
- Alexander Thomas Cameron, Radiochemistry (London, Inggris: J. M. Dent & Sons, 1910), hlm. 141. (Cameron juga mengantisipasi hukum perpindahan.)
- ^ a b c Ley, Willy (Oktober 1966). "The Delayed Discovery". For Your Information. Galaxy Science Fiction. hlm. 116–127.
- ^ a b c Scerri, Eric R. (2007) The Periodic Table Oxford University Press, hlm. 176–179 ISBN 0-19-530573-6
- ^ a b Nagel, Miriam C. (1982). "Frederick Soddy: From Alchemy to Isotopes". Journal of Chemical Education. 59 (9): 739–740. Bibcode:1982JChEd..59..739N. doi:10.1021/ed059p739.
- ^ Kasimir Fajans (1913) "Über eine Beziehung zwischen der Art einer radioaktiven Umwandlung und dem elektrochemischen Verhalten der betreffenden Radioelemente" (Pada hubungan antara jenis transformasi radioaktif dan perilaku elektrokimia dari unsur-unsur radioaktif yang relevan), Physikalische Zeitschrift, 14: 131–136.
- ^ Soddy mengumumkan hukum perpindahannya di: Soddy, Frederick (1913). "The Radio-Elements and the Periodic Law". Nature. 91 (2264): 57–58. Bibcode:1913Natur..91...57S. doi:10.1038/091057a0. .
- ^ Soddy menguraikan hukum perpindahannya dalam: Soddy, Frederick (1913) "Radioactivity," Chemical Society Annual Report, 10: 262–288.
- ^ Alexander Smith Russell (1888–1972) juga menerbitkan hukum perpindahan: Russell, Alexander S. (1913) "The periodic system and the radio-elements," Chemical News and Journal of Industrial Science, 107: 49–52.
- ^ Soddy pertama kali menggunakan kata "isotop" dalam: Soddy, Frederick (1913). "Intra-atomic charge". Nature. 92 (2301): 399–400. Bibcode:1913Natur..92..399S. doi:10.1038/092399c0.
- ^ Fleck, Alexander (1957). "Frederick Soddy". Biographical Memoirs of Fellows of the Royal Society. 3: 203–216. doi:10.1098/rsbm.1957.0014
 .
. hlm. 208: Hingga tahun 1913 kami menggunakan istilah 'unsur radio yang tidak dapat dipisahkan secara kimia' dan pada saat itu kata isotop diusulkan dalam diskusi di ruang tamu dengan Dr. Margaret Todd di rumah ayah mertua Soddy, Sir George Beilby.
- ^ Budzikiewicz H, Grigsby RD (2006). "Mass spectrometry and isotopes: a century of research and discussion". Mass Spectrometry Reviews. 25 (1): 146–57. Bibcode:2006MSRv...25..146B. doi:10.1002/mas.20061. PMID 16134128.
- ^ Scerri, Eric R. (2007) The Periodic Table, Oxford University Press, ISBN 0-19-530573-6, bab 6, catatan 44 (hlm. 312) mengutip Alexander Fleck, digambarkan sebagai mantan murid Soddy.
- ^ Dalam bukunya tahun 1893, William T. Preyer juga menggunakan kata "isotop" untuk menunjukkan kesamaan di antara unsur-unsur. Dalam hlm. 9 dari William T. Preyer, Das genetische System der chemischen Elemente [Sistem genetik unsur kimia] (Berlin, Jerman: R. Friedländer & Sohn, 1893): "Die ersteren habe ich der Kürze wegen isotope Elemente genannt, weil sie in jedem der sieben Stämmme der gleichen Ort, nämlich dieselbe Stuffe, einnehmen." (Untuk singkatnya, saya menamakan unsur-unsur "isotop" sebelumnya, karena mereka menempati tempat yang sama di masing-masing dari tujuh keluarga [yaitu, kolom tabel periodik], yaitu langkah yang sama [yaitu, baris tabel periodik].)
- ^ a b Asal usul mengenai konsepsi isotop Frederick Soddy, kuliah penghargaan Nobel
- ^ Thomson, J. J. (1912). "XIX. Further experiments on positive rays". Philosophical Magazine. Seri 6. 24 (140): 209–253. doi:10.1080/14786440808637325.
- ^ Thomson, J. J. (1910). "LXXXIII. Rays of positive electricity". Philosophical Magazine. Seri 6. 20 (118): 752–767. doi:10.1080/14786441008636962.
- ^ Mass spectra and isotopes Francis W. Aston, kuliah penghargaan Nobel 1922
- ^ Laidler, Keith (1987). Chemical Kinetics (dalam bahasa English) (edisi ke-3). India: Pearson Education. hlm. 427. ISBN 978-81-317-0972-6.
- ^ Sonzogni, Alejandro (2008). "Interactive Chart of Nuclides". National Nuclear Data Center: Brookhaven National Laboratory. Diarsipkan dari versi asli tanggal 10 Oktober 2018. Diakses tanggal 20 Juli 2022.
- ^ Hult, Mikael; Wieslander, J. S.; Marissens, Gerd; Gasparro, Joël; Wätjen, Uwe; Misiaszek, Marcin (2009). "Search for the radioactivity of 180mTa using an underground HPGe sandwich spectrometer". Applied Radiation and Isotopes. 67 (5): 918–21. doi:10.1016/j.apradiso.2009.01.057. PMID 19246206.
- ^ "Radioactives Missing From The Earth". Diakses tanggal 21 Juli 2022.
- ^ Jamin, Eric; Guérin, Régis; Rétif, Mélinda; Lees, Michèle; Martin, Gérard J. (2003). "Improved Detection of Added Water in Orange Juice by Simultaneous Determination of the Oxygen-18/Oxygen-16 Isotope Ratios of Water and Ethanol Derived from Sugars". Journal of Agricultural and Food Chemistry. 51 (18): 5202–6. doi:10.1021/jf030167m. PMID 12926859.
- ^ Treiman, A. H.; Gleason, J. D.; Bogard, D. D. (2000). "The SNC meteorites are from Mars". Planetary and Space Science. 48 (12–14): 1213. Bibcode:2000P&SS...48.1213T. doi:10.1016/S0032-0633(00)00105-7.
- ^ Deegan, Frances M.; Troll, Valentin R.; Whitehouse, Martin J.; Jolis, Ester M.; Freda, Carmela (4 Agustus 2016). "Boron isotope fractionation in magma via crustal carbonate dissolution". Scientific Reports (dalam bahasa Inggris). 6 (1): 30774. Bibcode:2016NatSR...630774D. doi:10.1038/srep30774. ISSN 2045-2322. PMC 4973271
 . PMID 27488228.
. PMID 27488228.
Pranala luar
[sunting | sunting sumber]- Portal web Ilmu Nuklir Nucleonica
- Bagan Nuklida Karlsruhe
- Portal Pusat Data Nuklir Nasional ke gudang besar program data dan analisis gratis dari NNDC
- Pusat Pengembangan Isotop Nasional Koordinasi dan pengelolaan produksi, ketersediaan, dan distribusi isotop, serta informasi referensi bagi komunitas isotop
- Pengembangan & Produksi Isotop untuk Penelitian dan Aplikasi (IDPRA) Program Departemen Energi AS untuk produksi isotop dan penelitian dan pengembangan produksi
- Badan Tenaga Atom Internasional beranda Badan Tenaga Atom Internasional (IAEA), sebuah Badan Perserikatan Bangsa-Bangsa (PBB)
- Berat Atom dan Komposisi Isotopik untuk Semua Unsur Tabel statis, dari NIST (Institut Standar dan Teknologi Nasional)
- Atomgewichte, Zerfallsenergien und Halbwertszeiten aller Isotope
- Jelajahi Tabel Isotop di LBNL
- Penelitian dan informasi isotop saat ini isotope.info
- Kesiapsiagaan dan Tanggapan Darurat: Isotop Radioaktif oleh CDC
- Bagan Nuklida Diarsipkan 10 Oktober 2018 di Wayback Machine. Bagan Nuklida Interaktif (Pusat Data Nuklir Nasional)
- Bagan Interaktif Nuklida, Isotop dan Tabel Periodik Diarsipkan 2008-09-30 di Wayback Machine.
- LIVEChart Nuklida – IAEA dengan data isotop.
- Bibliografi beranotasi untuk isotop dari Perpustakaan Digital Alsos untuk Masalah Nuklir
- Lembah Stabilitas (video) – sebuah "penerbangan" virtual melalui representasi 3D dari grafik nuklida, oleh CEA (Prancis)


