Reseptor (biokimia)
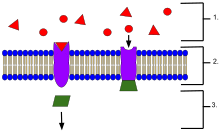
- Ligand, berlokasi di luar sel
- Ligan terhubung ke protein reseptor spesifik berdasarkan bentuk situs aktif protein.
- Reseptor melepaskan pembawa pesan kedua (second messenger) setelah ligan menempel ke reseptor.
Dalam biokimia dan farmakologi, reseptor adalah molekul protein yang menerima sinyal kimia dari luar sel.[1] Ketika sinyal kimia tersebut berikatan dengan reseptor, terjadi beberapa bentuk respons seluler, misalnya perubahan aktivitas listrik sel. Reseptor berlokasi di membran sel, sitoplasma, dan nukleus. Molekul pemberi sinyal yang melekat pada suatu reseptor disebut ligan, yang dapat berupa suatu peptida atau molekul kecil lain seperti neurotransmiter, hormon, obat, atau toksin.
Reseptor dapat diklasifikasikan berdasarkan lokasinya. Reseptor transmembran meliputi reseptor terhubung dengan kanal ion (reseptor ionotropik), reseptor terhubung protein G (metabotropik), dan reseptor tirosin kinase.[1] Reseptor intraseluler ditemukan di dalam sel (di sitosol atau di inti sel).[1] Molekul yang berikatan secara alami untuk reseptor tertentu disebut sebagai ligan endogen. Misalnya ligan endogen untuk reseptor asetilkolin yaitu asetilkolin.
Setiap reseptor dihubungkan dengan jalur biokimia seluler spesifik. Banyak reseptor ditemukan di sebagian besar sel, dan masing-masing reseptor hanya mengikat dengan ligan struktur tertentu, seperti halnya gembok yang menerima kunci berbentuk khusus. Ketika ligan berikatan dengan reseptornya, ligan mengaktifkan jalur biokimia yang terkait reseptor.
Jenis[sunting | sunting sumber]
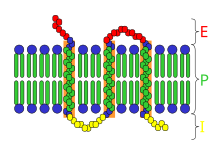
Reseptor ionotropik[sunting | sunting sumber]
Reseptor terkait kanal ion teraktivasi ligan (reseptor ionotropik) biasanya menjadi target neurotransmiter cepat seperti reseptor asetilkolin nikotinik dan reseptor GABA. Aktivasi reseptor ini menghasilkan perubahan gerakan ion melintasi membran. Reseptor ionotropik memiliki struktur heteromer dengan setiap subunit terdiri dari domain pengikat ligan ekstraseluler dan domain transmembran. Domain transmembran pada gilirannya mencakup empat heliks alfa transmembran. Rongga pengikat ligan terletak di antarmuka antara subunit.
Reseptor terhubung protein G[sunting | sunting sumber]
Reseptor terhubung protein G (reseptor metabotropik) (GPCR) adalah keluarga reseptor terbesar dan termasuk reseptor untuk beberapa hormon dan neurotransmiter misalnya reseptor dopamin dan reseptor glutamat. GPCR terdiri dari tujuh heliks alfa transmembran. Lengkung yang menghubungkan heliks alfa membentuk domain ekstraseluler dan intraseluler. Situs pengikatan untuk ligan peptida yang lebih besar biasanya terletak di domain ekstraseluler, sedangkan situs pengikatan untuk ligan non-peptida yang lebih kecil sering terletak di antara tujuh heliks alfa dan satu lengkungan ekstraseluler.[2] Reseptor yang disebutkan di atas digabungkan ke sistem efektor intraseluler yang berbeda melalui protein G.[3]
Reseptor tirosin kinase[sunting | sunting sumber]
Reseptor yang terkait dengan kinase terdiri dari domain ekstraseluler yang mengandung situs pengikatan ligan dan domain intraseluler, sering kali dengan fungsi enzimatik, dihubungkan oleh heliks alfa transmembran tunggal. Contoh reseptor terkait kinase yaitu reseptor insulin.
Reseptor inti[sunting | sunting sumber]
Meskipun reseptor ini disebut reseptor inti, sebenarnya mereka terletak di sitoplasma dan bermigrasi ke inti setelah mengikat dengan ligan. Reseptor terdiri dari daerah pengikat ligan ujung C, domain pengikat DNA inti (DBD) dan domain ujung N yang berisi wilayah AF1 (fungsi aktivasi 1). Wilayah inti memiliki dua zinc finger yang bertanggung jawab untuk mengenali sekuens DNA khusus untuk reseptor ini. Ujung N berinteraksi dengan faktor-faktor transkripsi seluler lainnya dengan cara yang tidak bergantung ligan; dan tergantung pada interaksi ini, reseptor dapat memodifikasi pengikatan/aktivitas reseptor. Reseptor steroid dan hormon tiroid merupakan contoh dari reseptor tersebut.[4]
Reseptor membran dapat diisolasi dari membran sel dengan prosedur ekstraksi kompleks menggunakan pelarut, deterjen, dan/atau pemurnian afinitas.
Struktur dan aksi reseptor dapat dipelajari dengan menggunakan metode biofisik seperti kristalografi sinar-X, NMR, dichroism lingkaran, dan interferometri polarisasi ganda. Simulasi komputer tentang perilaku dinamis dari reseptor telah digunakan untuk mendapatkan pemahaman tentang mekanisme aksi dari reseptor-reseptor inti.
Pengikatan dan aktivasi[sunting | sunting sumber]
Pengikatan ligan adalah proses kesetimbangan. Ligan mengikat reseptor dan memisahkan diri dari kompleks menurut hukum aksi massa.
Salah satu ukuran seberapa baik suatu molekul cocok dengan suatu reseptor yaitu afinitas pengikatannya, yang berbanding terbalik dengan konstanta disosiasi Kd. Kecocokan baik sesuai dengan afinitas tinggi dan rendah Kd. Respons biologis akhir (misal kaskade pembawa pesan kedua, kontraksi otot), hanya tercapai setelah sejumlah besar reseptor diaktifkan.
Agonis versus antagonis[sunting | sunting sumber]
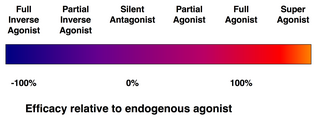
Tidak semua ligan yang berikatan dengan reseptor akan mengaktifkan reseptor tersebut. Kelas ligan bisa dibagi menjadi:
- Agonis (penuh), dapat mengaktifkan reseptor dan menghasilkan respons biologis yang kuat. Ligan endogen alami dengan efikasi terbesar untuk reseptor yang diberikan menurut definisi merupakan agonis penuh (efikasi/kemanjuran 100%).
- Agonis parsial, tidak mengaktifkan reseptor dengan efikasi maksimal, bahkan dengan pengikatan maksimal, menyebabkan respons parsial dibandingkan dengan agonis penuh (khasiat antara 0 dan 100%).
- Antagonis, mengikat reseptor tetapi tidak mengaktifkannya. Antagonis menghasilkan blokade reseptor, menghambat pengikatan agonis dan agonis terbalik (inverse agonist). Antagonis reseptor dapat bersifat terbalikkan, dan bersaing dengan agonis untuk reseptor (kompetitif), atau dapat bersifat antagonis ireversibel yang membentuk ikatan kovalen (atau ikatan nonkovalen afinitas sangat tinggi) dengan reseptor dan mengebloknya secara total. Omeprazol merupakan inhibitor pompa proton merupakan contoh dari antagonis ireversibel. Efek dari antagonisme ireversibel hanya dapat dibalikkan dengan sintesis reseptor baru.
- Agonis terbalik (inverse agonist), mengurangi aktivitas reseptor dengan menghambat aktivitas konstitutifnya (efikasi negatif).
- Modulator alosterik: Agonis tidak mengikat ke situs pengikatan pada reseptor melainkan pada situs pengikatan alosterik tertentu, tempa memodifikasi efek agonis. Misalnya, benzodiazepin (BZD) mengikat ke situs BZD pada reseptor GABA-A dan mempotensiasi efek GABA endogen.
Perhatikan bahwa gagasan agonisme dan antagonisme reseptor hanya mengacu pada interaksi antara reseptor dan ligan dan bukan pada efek biologisnya.
Aktivitas konstitutif[sunting | sunting sumber]
Reseptor yang mampu menghasilkan respons biologis tanpa adanya ligan terikat dikatakan menunjukkan "aktivitas konstitutif".[5] Aktivitas konstitutif dari reseptor dapat diblok oleh agonis terbalik. Obat anti-obesitas rimonabant dan taranabant merupakan agonis terbalik pada reseptor kanabinoid CB1 dan meskipun kedua obat menghasilkan penurunan berat badan yang signifikan, keduanya ditarik dari pasaran karena tingginya insiden depresi dan kecemasan, yang diyakini berkaitan dengan penghambatan aktivitas konstitutif reseptor kanabinoid.
Mutasi pada reseptor yang mengakibatkan peningkatan aktivitas konstitutif yang mendasari beberapa penyakit bawaan seperti pubertas dini (karena mutasi pada reseptor LH) dan hipertiroidisme (karena mutasi pada reseptor hormon TSH).
Teori interaksi reseptor obat[sunting | sunting sumber]
Teori pendudukan[sunting | sunting sumber]
Dogma utama farmakologi reseptor adalah bahwa efek obat berbanding lurus dengan jumlah reseptor yang ditempati. Selain itu, efek obat berhenti ketika obat terdisosiasi atau lepas ikatannya dari reseptor.
Ariëns dan Stephenson memperkenalkan istilah "afinitas" dan "efikasi" untuk menggambarkan aksi ligan yang terikat pada reseptor.[6][7]
- Afinitas: Kemampuan suatu obat untuk bergabung dengan reseptor untuk menciptakan kompleks reseptor-obat.
- Efikasi: Kemampuan kompleks reseptor obat untuk memulai respons.
Teori laju[sunting | sunting sumber]
Berbeda dengan Teori Pendudukan yang diterima secara luas, Teori Laju mengusulkan bahwa aktivasi reseptor berbanding lurus dengan jumlah total pertemuan obat dengan reseptornya per unit waktu. Aktivitas farmakologis berbanding lurus dengan tingkat disosiasi dan hubungan, bukan jumlah reseptor yang ditempati:[8]
- Agonis: Obat dengan asosiasi cepat dan disosiasi cepat.
- Agonis parsial: Obat dengan hubungan sedang dan disosiasi menengah.
- Antagonis: Obat dengan asosiasi cepat dan disosiasi lambat
Teori induksi fit[sunting | sunting sumber]
Ketika obat mendekati reseptor, reseptor mengubah konformasi tempat pengikatannya untuk menghasilkan kompleks reseptor obat.
Reseptor cadangan[sunting | sunting sumber]
Dalam beberapa sistem reseptor (misalnya asetilkolin pada sambungan neuromuskuler pada otot polos), agonis mampu memperoleh respons maksimal pada tingkat hunian reseptor yang sangat rendah (<1%). Dengan demikian, sistem itu memiliki reseptor cadangan. Pengaturan ini menghasilkan ekonomi produksi dan pelepasan neurotransmitter.[4]
Pengaturan reseptor[sunting | sunting sumber]
Sel dapat meningkatkan atau mengurangi jumlah reseptor terhadap hormon atau neurotransmitter yang diberikan untuk mengubah sensitivitasnya terhadap molekul yang berbeda. Cara ini merupakan mekanisme umpan balik yang bertindak secara lokal.
- Perubahan konformasi reseptor sedemikian rupa sehingga pengikatan agonis tidak mengaktifkan reseptor. Hal ini terlihat pada reseptor kanal ion.
- Pelepasan molekul efektor terlihat pada reseptor terhubung protein G.
- Pengasingan reseptor (internalisasi)[9] misalnya dalam kasus reseptor hormon.
Ligan[sunting | sunting sumber]
Ligan untuk reseptor sangat beragam. Contohnya termasuk:[10]
Ekstraseluler[sunting | sunting sumber]
| Reseptor | Ligan | Arus ion |
|---|---|---|
| Reseptor asetilkolin nikotinik | Asetilkolin, nikotin | Na +, K +, Ca 2+[10] |
| Reseptor glisn (GlyR) | Glisin, strychnine | Cl - > HCO - 3[10] |
| Reseptor GABA: GABA-A, GABA-C | GABA | Cl - > HCO - 3[10] |
| Reseptor glutamat: reseptor NMDA, reseptor AMPA, dan reseptor Kainate | Glutamat | Na +, K +, Ca 2+[10] |
| Reseptor 5-HT3 | Serotonin | Na +, K +[10] |
| Reseptor P2X | ATP | Ca 2+, Na +, Mg 2+[10] |
Intraseluler[sunting | sunting sumber]
| Reseptor | Ligan | Arus ion |
|---|---|---|
| Kanal ion nukleotida siklik | cGMP (penglihatan), cAMP dan cGTP (penciuman) | Na +, K +[10] |
| Reseptor IP3 | IP<sub id="mwAQU">3</sub> | Ca 2+[10] |
| Reseptor ATP intraseluler | ATP (menutup saluran) [10] | K +[10] |
| Reseptor ryanodine | Ca 2+ | Ca 2+[10] |
Peran dalam kesehatan dan penyakit[sunting | sunting sumber]
Dalam kelainan genetik[sunting | sunting sumber]
Banyak kelainan genetik melibatkan cacat bawaan pada gen reseptor. Seringkali, sulit untuk menentukan apakah reseptor tidak berfungsi atau hormon diproduksi pada tingkat yang menurun; ini menimbulkan kelompok kelainan endokrin "pseudo-hypo-", di mana tampaknya ada penurunan tingkat hormonal sementara pada kenyataannya reseptor yang tidak merespon cukup terhadap hormon.
Dalam sistem imun[sunting | sunting sumber]
Reseptor utama dalam sistem imun yaitu reseptor pengenalan pola (PRR), reseptor Toll-like (TLR), reseptor pembunuh diaktifkan dan reseptor pembunuh inhibitor (KAR dan KIR), reseptor komlemen, reseptor Fc, reseptor sel B dan reseptor sel T.[11]
Referensi[sunting | sunting sumber]
- ^ a b c Hall, JE (2016). Guyton and Hall Textbook of Medical Physiology. Philadelphia, PA: Elsevier Saunders. hlm. 930–937. ISBN 978-1-4557-7005-2.
- ^ "The impact of GPCR structures on pharmacology and structure-based drug design". British Journal of Pharmacology. 159 (5): 986–96. March 2010. doi:10.1111/j.1476-5381.2009.00476.x. PMC 2839258
 . PMID 19912230.
. PMID 19912230.
- ^ "Inactive-state preassembly of G(q)-coupled receptors and G(q) heterotrimers". Nature Chemical Biology. 7 (10): 740–7. August 2011. doi:10.1038/nchembio.642. PMC 3177959
 . PMID 21873996.
. PMID 21873996.
- ^ a b Rang & Dale's Pharmacology (edisi ke-7th). Elsevier Churchill Livingstone. 2012. ISBN 978-0-7020-3471-8.
- ^ "Constitutive activity and inverse agonists of G protein-coupled receptors: a current perspective". Molecular Pharmacology. 64 (6): 1271–6. December 2003. doi:10.1124/mol.64.6.1271. PMID 14645655.
- ^ "Affinity and intrinsic activity in the theory of competitive inhibition. I. Problems and theory". Archives Internationales De Pharmacodynamie Et De Therapie. 99 (1): 32–49. September 1954. PMID 13229418.
- ^ "A modification of receptor theory". British Journal of Pharmacology and Chemotherapy. 11 (4): 379–93. December 1956. doi:10.1111/j.1476-5381.1956.tb00006.x. PMC 1510558
 . PMID 13383117.
. PMID 13383117.
- ^ Silverman RB (2004). "3.2.C Theories for Drug—Receptor Interactions". The Organic Chemistry of Drug Design and Drug Action (edisi ke-2nd). Amsterdam: Elsevier Academic Press. ISBN 0-12-643732-7.
- ^ "Short-term desensitization of the angiotensin II receptor of bovinde adrenal glomerulosa cells corresponds to a shift from a high to low affinity state". Endocrinology. 135 (5): 2130–6. November 1994. doi:10.1210/en.135.5.2130.
- ^ a b c d e f g h i j k l Medical physiology: a cellular and molecular approach. St. Louis, Mo: Elsevier Saunders. 2005. hlm. 90. ISBN 1-4160-2328-3.
- ^ Immunology. Philadelphia: Wolters Kluwer Health/Lippincott Williams & Wilkins. 2008. hlm. 20. ISBN 0-7817-9543-5.

![{\displaystyle {\overset {}{\underset {\text{(the brackets stand for concentrations)}}{[{\ce {Ligand}}]\cdot [{\ce {Receptor}}]{\ce {<=>[{K_{d}}]}}[{\text{Ligand-receptor complex}}]}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/59c3c80451a744bac62346222691014b5360d93e)