Oksigen
8O Oksigen | |||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 Oksigen cair mendidih | |||||||||||||||||||||
Garis spektrum oksigen | |||||||||||||||||||||
| Sifat umum | |||||||||||||||||||||
| Pengucapan | /oksigèn/[1] | ||||||||||||||||||||
| Alotrop | O2, O3 (ozon) dan lainnya (lihat alotrop oksigen) | ||||||||||||||||||||
| Penampilan | gas: tak berwarna cairan dan padatan: biru pucat | ||||||||||||||||||||
| Kelimpahan | |||||||||||||||||||||
| di kerak Bumi | 461.000 ppm | ||||||||||||||||||||
| Oksigen dalam tabel periodik | |||||||||||||||||||||
| |||||||||||||||||||||
| Nomor atom (Z) | 8 | ||||||||||||||||||||
| Golongan | golongan 16 (kalkogen) | ||||||||||||||||||||
| Periode | periode 2 | ||||||||||||||||||||
| Blok | blok-p | ||||||||||||||||||||
| Kategori unsur | nonlogam diatomik | ||||||||||||||||||||
| Berat atom standar (Ar) |
| ||||||||||||||||||||
| Konfigurasi elektron | 1s2 2s2 2p4 | ||||||||||||||||||||
| Elektron per kelopak | 2, 6 | ||||||||||||||||||||
| Sifat fisik | |||||||||||||||||||||
| Fase pada STS (0 °C dan 101,325 kPa) | gas | ||||||||||||||||||||
| Titik lebur | (O2) 54,36 K (−218,79 °C, −361,82 °F) | ||||||||||||||||||||
| Titik didih | (O2) 90,20 K (−182,95 °C, −297,31 °F) | ||||||||||||||||||||
| Kerapatan (pada STS) | 1,429 g/L | ||||||||||||||||||||
| saat cair, pada t.d. | 1.141 g/cm3 | ||||||||||||||||||||
| Titik tripel | 54,361 K, 0,1463 kPa | ||||||||||||||||||||
| Titik kritis | 154,581 K, 5,043 MPa | ||||||||||||||||||||
| Kalor peleburan | (O2) 0,444 kJ/mol | ||||||||||||||||||||
| Kalor penguapan | (O2) 6,82 kJ/mol | ||||||||||||||||||||
| Kapasitas kalor molar | (O2) 29,378 J/(mol·K) | ||||||||||||||||||||
Tekanan uap
| |||||||||||||||||||||
| Sifat atom | |||||||||||||||||||||
| Bilangan oksidasi | −2, −1, 0, +1, +2 | ||||||||||||||||||||
| Elektronegativitas | Skala Pauling: 3,44 | ||||||||||||||||||||
| Energi ionisasi | ke-1: 1313,9 kJ/mol ke-2: 3388,3 kJ/mol ke-3: 5300,5 kJ/mol (artikel) | ||||||||||||||||||||
| Jari-jari kovalen | 66±2 pm | ||||||||||||||||||||
| Jari-jari van der Waals | 152 pm | ||||||||||||||||||||
| Lain-lain | |||||||||||||||||||||
| Kelimpahan alami | primordial | ||||||||||||||||||||
| Struktur kristal | kubus | ||||||||||||||||||||
| Kecepatan suara | 330 m/s (gas, suhu 27 °C) | ||||||||||||||||||||
| Konduktivitas termal | 26,58×10−3 W/(m·K) | ||||||||||||||||||||
| Arah magnet | paramagnetik | ||||||||||||||||||||
| Suseptibilitas magnetik molar | +3.449,0×10−6 cm3/mol (293 K)[2] | ||||||||||||||||||||
| Nomor CAS | 7782-44-7 | ||||||||||||||||||||
| Sejarah | |||||||||||||||||||||
| Penemuan | C. Scheele (1771) | ||||||||||||||||||||
| Asal nama | A. Lavoisier (1777) | ||||||||||||||||||||
| Isotop oksigen yang utama | |||||||||||||||||||||
| |||||||||||||||||||||
Oksigen (bahasa Latin: oxygenium; bahasa Inggris: oxygen), yang juga disebut zat asam atau zat pembakar, adalah unsur kimia dengan lambang O dan nomor atom 8. Dalam tabel periodik, oksigen merupakan unsur nonlogam golongan VIA (kalkogen) dan dapat dengan mudah bereaksi dengan hampir semua unsur lainnya (utamanya menjadi oksida). Pada temperatur dan tekanan standar, dua atom oksigen berikatan menjadi O (dioksigen), gas yang tidak berwarna, tidak berasa, dan tidak berbau. Oksigen merupakan unsur paling melimpah ketiga di alam semesta berdasarkan massa (setelah hidren dan helium)[3] dan unsur paling melimpah di kerak Bumi.[4] Berdasarkan volume, 20,9% atmosfer bumi adalah oksigen.[5]
Semua kelompok molekul organik pada makhluk hidup, seperti protein, karbohidrat, dan lemak, mengandung unsur oksigen. Demikian pula senyawa anorganik yang terdapat pada cangkang, gigi, dan tulang hewan. Sebagian besar oksigen dalam tubuh makhluk hidup dalam bentuk air (H2O), senyawa penting pada makhluk hidup. Oksigen dalam bentuk O dihasilkan dari air oleh sianobakteri, ganggang, dan tumbuhan selama fotosintesis, dan digunakan pada respirasi sel oleh hampir semua makhluk hidup. Oksigen beracun bagi organisme anaerob, yang merupakan bentuk kehidupan paling dominan pada masa-masa awal evolusi kehidupan. O kemudian mulai berakumulasi di atmosfer sekitar 2,5 miliar tahun yang lalu.[6] Terdapat pula alotrop oksigen lainnya, yaitu ozon (O). Lapisan ozon pada atmosfer membantu melindungi biosfer dari radiasi ultraviolet, tetapi pada permukaan bumi ia adalah polutan yang merupakan produk samping dari asbut.
Oksigen secara terpisah ditemukan oleh Carl Wilhelm Scheele di Uppsala pada tahun 1773 dan Joseph Priestley di Wiltshire pada tahun 1774. Temuan Priestley lebih terkenal oleh karena publikasinya merupakan yang pertama kali dicetak. Namun, Priestley memanggil oksigen "dephlogisticated air" dan tidak mengetahuinya sebagai elemen kimia. Istilah oxygen diciptakan oleh Antoine Lavoisier pada tahun 1777,[7] yang eksperimennya dengan oksigen berhasil meruntuhkan teori flogiston pembakaran dan korosi yang terkenal. Ia juga berhasil menjelaskan peran oksigen dalam pembakaran.
Oksigen secara industri dihasilkan dengan distilasi bertingkat udara cair, dengan menggunakan zeolit untuk memisahkan karbon dioksida dan nitrogen dari udara, ataupun elektrolisis air, dll. Oksigen digunakan dalam produksi baja, plastik, dan tekstil, ia juga digunakan sebagai propelan roket, untuk terapi oksigen, dan sebagai penyokong kehidupan pada pesawat terbang, kapal selam, penerbangan luar angkasa, dan penyelaman,
Sejarah
[sunting | sunting sumber]Percobaan awal
[sunting | sunting sumber]Salah satu eksperimen pertama yang diketahui tentang hubungan antara pembakaran dan udara dilakukan oleh Philo dari Byzantium, seorang penulis Yunani abad ke-2 SM tentang mekanika. Dalam karyanya, Pneumatica, Philo mengamati bahwa membalikkan wadah di atas lilin yang menyala dan memasukkan air di bawah leher kapal mengakibatkan air naik ke leher.[8] Philo salah menduga bahwa bagian udara di bejana diubah menjadi api elemen klasik dan dengan demikian keluar melalui pori-pori di kaca.
Awalnya, para ilmuwan banyak menganggap bahwa udara adalah satu dari empat unsur dan bukan merupakan campuran berbagai gas, seperti yang diketahui ilmuwan sekarang. Karena itu, awalnya para ilmuwan tidak mengetahui adanya oksigen sebagai salah satu komponen udara. Leonardo da Vinci yang hidup pada 1452–1519 mengamati bahwa sebagian udara digunakan dalam proses pembakaran dan pernapasan, dan tanpa udara api maupun makhluk hidup akan mati.[9][10]
Pada akhir abad ke-17, Robert Boyle membuktikan bahwa udara diperlukan dalam proses pembakaran. Kimiawan Inggris, John Mayow, melengkapi hasil kerja Boyle dengan menunjukkan bahwa hanya sebagian komponen udara yang ia sebut sebagai spiritus nitroaereus atau nitroaereus yang diperlukan dalam pembakaran.[11] Pada satu eksperimen, ia menemukan bahwa dengan memasukkan seekor tikus ataupun sebatang lilin ke dalam wadah penampung yang tertutup oleh permukaan air akan mengakibatkan permukaan air tersebut naik dan menggantikan seperempatbelas volume udara yang hilang.[12] Dari percobaan ini, ia menyimpulkan bahwa nitroaereus digunakan dalam proses respirasi dan pembakaran.
Mayow mengamati bahwa berat antimon akan meningkat ketika dipanaskan. Ia menyimpulkan bahwa nitroaereus haruslah telah bergabung dengan antimon.[11] Ia juga mengira bahwa paru-paru memisahkan nitroaereus dari udara dan menghantarkannya ke dalam darah, dan panas tubuh hewan serta pergerakan otot akan mengakibatkan reaksi nitroaereus dengan zat-zat tertentu dalam tubuh.[11] Laporan seperti ini dan pemikiran-pemikiran serta percobaan-percobaan lainnya dipublikasikan pada tahun 1668 dalam karyanya Tractatus duo pada bagian "De respiratione".[12]
Teori flogiston
[sunting | sunting sumber]
Dalam percobaan Robert Hooke, Ole Borch, Mikhail Lomonosov, dan Pierre Bayen, percobaan mereka semuanya menghasilkan oksigen, tetapi tiada satupun dari mereka yang mengenalinya sebagai unsur.[13] Hal ini kemungkinan besar disebabkan oleh prevalensi filosofi pembakaran dan korosi yang dikenal sebagai teori flogiston.
Teori flogiston dikemukakan oleh alkimiawan Jerman, J. J. Becher pada tahun 1667, dan dimodifikasi oleh kimiawan Georg Ernst Stahl pada tahun 1731.[14] Teori flogiston menyatakan bahwa semua bahan yang dapat terbakar terbuat dari dua bagian komponen. Salah satunya adalah flogiston, yang dilepaskan ketika bahan tersebut dibakar, sedangkan bagian yang tersisa setelah terbakar merupakan bentuk asli materi tersebut.[15]
Bahan-bahan yang terbakar dengan hebat dan meninggalkan sedikit residu (misalnya kayu dan batu bara), dianggap memiliki kadar flogiston yang sangat tinggi, sedangkan bahan-bahan yang tidak mudah terbakar dan berkorosi (misalnya besi), mengandung sangat sedikit flogiston. Udara tidak memiliki peranan dalam teori flogiston. Tiada eksperimen kuantitatif yang pernah dilakukan untuk menguji keabsahan teori flogiston ini, melainkan teori ini hanya didasarkan pada pengamatan bahwa ketika sesuatu terbakar, kebanyakan objek tampaknya menjadi lebih ringan dan sepertinya kehilangan sesuatu selama proses pembakaran tersebut.[15] Fakta bahwa materi seperti kayu sebenarnya bertambah berat dalam proses pembakaran tertutup oleh gaya apung yang dimiliki oleh produk pembakaran yang berupa gas tersebut. Sebenarnya pun, fakta bahwa logam akan bertambah berat ketika berkarat menjadi petunjuk awal bahwa teori flogiston tidaklah benar (yang mana menurut teori flogiston, logam tersebut akan menjadi lebih ringan).

Penemuan
[sunting | sunting sumber]Michael Sendivogius (Michał Sędziwój), seorang ahli alkimia, filsuf, dan dokter dari Polandia, dalam karyanya De Lapide Philosophorum Tractatus duodecim e naturae fonte et manuali experientia depromti (tahun 1604) menggambarkan zat yang terkandung di udara, yang dia sebut sebagai 'cibus vitae' (makanan kehidupan[16]), dan identik dengan oksigen.[17] Sendivogius, selama eksperimennya yang dilakukan antara tahun 1598 dan 1604, mengenali dengan tepat bahwa zat tersebut setara dengan produk sampingan gas yang dilepaskan oleh dekomposisi termal kalium nitrat. Dalam pandangan Bugaj, isolasi oksigen dan asosiasi yang tepat dari zat tersebut ke dalam bagian udara yang diperlukan untuk kehidupan, adalah bukti yang cukup untuk penemuan oksigen oleh Sendivogius.[17] Namun, penemuan Sendivogius ini sering dibantah oleh generasi ilmuwan dan ahli kimia berikutnya.[15]
Oksigen pertama kali ditemukan oleh seorang ahli obat Carl Wilhelm Scheele. Ia menghasilkan gas oksigen dengan memanaskan raksa oksida dan berbagai nitrat sekitar tahun 1772.[5][15] Scheele menyebut gas ini 'udara api' karena ia merupakan satu-satunya gas yang diketahui mendukung pembakaran. Ia menuliskan pengamatannya ke dalam sebuah manuskrip yang berjudul Treatise on Air and Fire, yang kemudian ia kirimkan ke penerbitnya pada tahun 1775. Namun, dokumen ini tidak dipublikasikan sampai dengan tahun 1777.[18]

Pada saat yang sama, seorang pastor Britania, Joseph Priestley, melakukan percobaan yang memfokuskan cahaya matahari ke raksa oksida (HgO) dalam tabung gelas pada tanggal 1 Agustus 1774. Percobaan ini menghasilkan gas yang ia namakan "dephlogisticated air'".[5] Ia mencatat bahwa lilin akan menyala lebih terang di dalam gas tersebut dan seekor tikus akan menjadi lebih aktif dan hidup lebih lama ketika menghirup udara tersebut. Setelah mencoba menghirup gas itu sendiri, ia menulis: "The feeling of it to my lungs was not sensibly different from that of common air, but I fancied that my breast felt peculiarly light and easy for some time afterwards."[13] Priestley mempublikasikan penemuannya pada tahun 1775 dalam sebuah laporan yang berjudul "An Account of Further Discoveries in Air". Laporan ini pula dimasukkan ke dalam jilid kedua bukunya yang berjudul Experiments and Observations on Different Kinds of Air.[15][19] Oleh karena ia mempublikasikan penemuannya terlebih dahulu, Priestley biasanya diberikan prioritas terlebih dahulu dalam penemuan oksigen.
Seorang kimiawan Prancis, Antoine Laurent Lavoisier kemudian mengklaim bahwa ia telah menemukan zat baru secara independen. Namun, Priestley mengunjungi Lavoisier pada Oktober 1774 dan memberitahukan Lavoisier mengenai eksperimennya serta bagaimana ia menghasilkan gas baru tersebut. Scheele juga mengirimkan sebuah surat kepada Lavoisier pada 30 September 1774 yang menjelaskan penemuannya mengenai zat yang tak diketahui, tetapi Lavoisier tidak pernah mengakui menerima surat tersebut (sebuah kopian surat ini ditemukan dalam barang-barang pribadi Scheele setelah kematiannya).[18]
Kontribusi Lavoisier
[sunting | sunting sumber]Apa yang Lavoisier pernah lakukan tidak terbantahkan (walaupun pada saat itu dipertentangkan) adalah percobaan kuantitatif pertama mengenai oksidasi yang mengantarkannya kepada penjelasan bagaimana proses pembakaran bekerja.[5] Ia menggunakan percobaan ini beserta percobaan yang mirip lainnya untuk meruntuhkan teori flogiston dan membuktikan bahwa zat yang ditemukan oleh Priestley dan Scheele adalah unsur kimia.

Pada satu eksperimen, Lavoisier mengamati bahwa tidak terdapat keseluruhan peningkatan berat ketika timah dan udara dipanaskan di dalam wadah tertutup.[5] Ia mencatat bahwa udara segera masuk ke dalam wadah seketika ia membuka wadah tersebut. Hal ini mengindikasikan bahwa sebagian udara yang berada dalam wadah tersebut telah dikonsumsi. Ia juga mencatat bahwa berat timah tersebut juga telah meningkat dan jumlah peningkatan ini adalah sama beratnya dengan udara yang masuk ke dalam wadah tersebut. Percobaan ini beserta percobaan mengenai pembakaran lainnya didokumentasikan ke dalam bukunya Sur la combustion en général yang dipublikasikan pada tahun 1777.[5] Hasil kerjanya membuktikan bahwa udara merupakan campuran dua gas, 'udara vital', yang diperlukan dalam pembakaran dan respirasi, serta azote (Bahasa Yunani ἄζωτον "tak bernyawa"), yang tidak mendukung pembakaran maupun respirasi. Azote kemudian menjadi apa yang dinamakan sebagai nitrogen, walaupun dalam Bahasa Prancis dan beberapa bahasa Eropa lainnya masih menggunakan nama Azote.[5]
Lavoisier menamai ulang 'udara vital' tersebut menjadi oxygène pada tahun 1777. Nama tersebut berasal dari akar kata Yunani ὀξύς (oxys) (asam, secara harfiah "tajam") dan -γενής (-genēs) (penghasil, secara harfiah penghasil keturunan). Ia menamainya demikian karena ia percaya bahwa oksigen merupakan komponen dari semua asam.[7] Ini tidaklah benar, tetapi pada saat para kimiawan menemukan kesalahan ini, nama oxygène telah digunakan secara luas dan sudah terlambat untuk menggantinya. Sebenarnya gas yang lebih tepat untuk disebut sebagai "penghasil asam" adalah hidrogen.
Oxygène kemudian diserap menjadi oxygen dalam bahasa Inggris walaupun terdapat penentangan dari ilmuwan-ilmuwan Inggris dikarenakan bahwa adalah seorang Inggris, Priestley, yang pertama kali mengisolasi serta menuliskan keterangan mengenai gas ini. Penyerapan ini secara sebagian didorong oleh sebuah puisi berjudul "Oxygen" yang memuji gas ini dalam sebuah buku populer The Botanic Garden (1791) oleh Erasmus Darwin, kakek Charles Darwin.[18]
Sejarah selanjutnya
[sunting | sunting sumber]
Hipotesis atom awal John Dalton berasumsi bahwa semua unsur berupa monoatomik dan atom-atom dalam suatu senyawa akan memiliki rasio atom paling sederhana terhadap satu sama lainnya. Sebagai contoh, Dalton berasumsi bahwa rumus air adalah HO, sehingga massa atom oksigen adalah 8 kali massa hidrogen (nilai yang sebenarnya adalah 16).[20] Pada tahun 1805, Joseph Louis Gay-Lussac dan Alexander von Humboldt menunjukkan bahwa air terbentuk dari dua volume hidrogen dengan satu volume oksigen; dan pada tahun 1811, berdasarkan apa yang sekarang disebut hukum Avogadro dan asumsi molekul unsur diatomik, Amedeo Avogadro memperkirakan komposisi air dengan benar.[21][a]
Pada akhir abad ke-19, para ilmuwan menyadari bahwa udara dapat dicairkan dan komponen-komponennya dapat dipisahkan dengan mengkompres dan mendinginkannya. Kimiawan dan fisikawan Swiss, Raoul Pierre Pictet, menguapkan cairan sulfur dioksida untuk mencairkan karbon dioksida, yang mana pada akhirnya diuapkan untuk mendinginkan gas oksigen menjadi cairan. Ia mengirim sebuah telegram pada 22 Desember 1877 kepada Akademi Sains Prancis di Paris dan mengumumkan penemuan oksigen cairnya.[22] Dua hari kemudian, fisikawan Perancis Louis Paul Cailletet mengumumkan metodenya untuk mencairkan oksigen molekuler.[22] Hanya beberapa tetes cairan yang dihasilkan sehingga tidak ada analisis berarti yang dapat dilaksanakan. Oksigen berhasil dicairkan ke dalam keadaan stabil untuk pertama kalinya pada 29 Maret 1877 oleh ilmuwan Polandia dari Universitas Jagiellonian, Zygmunt Wróblewski dan Karol Olszewski.[23]

Pada tahun 1891, kimiawan Skotlandia James Dewar berhasil memproduksi oksigen cair dalam jumlah yang cukup banyak untuk dipelajari.[24] Proses produksi oksigen cair secara komersial dikembangkan secara terpisah pada tahun 1895 oleh insinyur Jerman Carl von Linde dan insinyur Britania William Hampson. Kedua insinyur tersebut menurunkan suhu udara sampai ia mencair dan kemudian mendistilasi udara cair tersebut.[25] Pada tahun 1901, pengelasan oksiasetilena didemonstrasikan untuk pertama kalinya dengan membakar campuran asetilena dan O yang dimampatkan. Metode pengelasan dan pemotongan logam ini pada akhirnya digunakan secara meluas.[25]
Pada tahun 1923, ilmuwan Amerika Robert H. Goddard menjadi orang pertama yang mengembangkan mesin roket; mesin ini menggunakan bensin sebagai bahan bakar dan oksigen cair sebagai oksidator. Goddard berhasil menerbangkan roket kecil sejauh 56 m dengan kecepatan 97 km/jam pada 16 Maret 1926 di Auburn, Massachusetts, Amerika Serikat.[25][26]
Dalam laboratorium akademik, oksigen bisa disiapkan dengan membakar kalium klorat yang dicampur dengan sedikit mangan dioksida.[27]
Baru-baru ini, konsentrasi oksigen dalam atmosfer bumi sedikit menurun, mungkin karena pembakaran bahan bakar fosil.[28]
Karakteristik
[sunting | sunting sumber]Struktur
[sunting | sunting sumber]
Pada temperatur dan tekanan standar, oksigen adalah gas yang tidak berwarna, tidak berbau, dan tidak berasa dengan rumus molekul O, yang disebut sebagai dioksigen,[30] di mana dua atom oksigen secara kimiawi berikatan dengan konfigurasi elektron triplet spin. Ikatan ini memiliki orde ikatan dua dan sering dijelaskan secara sederhana sebagai ikatan ganda[31] ataupun sebagai kombinasi satu ikatan dua elektron dengan dua ikatan tiga elektron.[32]
Sebagai dioksigen, dua atom oksigen terikat satu sama lain. Ikatan dapat dideskripsikan berdasarkan tingkat teori, tetapi secara umum dijelaskan sebagai ikatan ganda kovalen yang dihasilkan dari pengisian orbital molekul yang terbentuk dari orbital atom oksigen, yang pengisiannya menghasilkan angka orde ikatan dua. Untuk yang lebih spesifik, ikatan ganda adalah hasil pengisian orbital berurutan, berenergi rendah ke tinggi, atau Aufbau, dan pembatalan kontribusi elektron 2s, setelah pengisian orbital σ dan σ* rendah secara berurutan; σ tumpang tindih dengan dua orbital 2p atom yang terletak di sepanjang sumbu molekul O-O dan π tumpang tindih dengan dua pasang orbital atom 2p yang tegak lurus dengan sumbu molekul O-O, dan kemudian pembatalan kontribusi dari sisa dua dari enam elektron 2p setelah mengisi sebagian orbital π dan π* terendah.[29]
Kombinasi pembatalan dan tumpang tindih σ dan π ini menghasilkan karakter ikatan rangkap dan reaktivitas dioksigen, dan keadaan dasar elektronik triplet. Konfigurasi elektron dengan dua elektron yang tidak berpasangan, seperti yang ditemukan dalam orbital dioksigen (lihat orbital π* yang terisi dalam diagram) yang energinya sama — yaitu berdegenerasi — adalah konfigurasi yang disebut keadaan spin triplet. Oleh karena itu, keadaan dasar molekul O disebut sebagai oksigen triplet.[33][b] Orbital dengan energi tertinggi dan sebagian terisi bersifat anti-ikat, dan pengisiannya melemahkan orde ikatan dari tiga menjadi dua. Hal ini membuat ikatan oksigen diatomik lebih lemah daripada ikatan rangkap tiga nitrogen.[33] Karena elektronnya yang tidak berpasangan, oksigen triplet lambat bereaksi dengan sebagian besar molekul organik, yang memiliki spin elektron berpasangan; ini mencegah pembakaran spontan.[34]
Dalam bentuk triplet yang normal, molekul O bersifat paramagnetik oleh karena spin momen magnetik elektron tak berpasangan molekul tersebut dan energi pertukaran negatif antara molekul O yang bersebelahan. Oksigen cair akan tertarik kepada magnet, sedemikiannya pada percobaan laboratorium, jembatan oksigen cair akan terbentuk di antara dua kutub magnet kuat.[35][c]

Oksigen singlet, adalah nama molekul oksigen O yang kesemuaan spin elektronnya berpasangan. Ia lebih reaktif terhadap molekul organik pada umumnya. Secara alami, oksigen singlet umumnya dihasilkan dari air selama fotosintesis.[36] Ia juga dihasilkan di troposfer melalui fotolisis ozon oleh sinar berpanjang gelombang pendek,[37] dan oleh sistem kekebalan tubuh sebagai sumber oksigen aktif.[38] Karotenoid pada organisme yang berfotosintesis (kemungkinan juga ada pada hewan) memainkan peran yang penting dalam menyerap oksigen singlet dan mengubahnya menjadi berkeadaan dasar tak tereksitasi sebelum ia menyebabkan kerusakan pada jaringan.[39]
Alotrop
[sunting | sunting sumber]
Alotrop oksigen elementer yang umumnya ditemukan di bumi adalah dioksigen O. Ia memiliki panjang ikat 121 pm dan energi ikat 498 kJ·mol-1.[40] Alotrop oksigen ini digunakan oleh makhluk hidup dalam respirasi sel dan merupakan komponen utama atmosfer bumi.
Trioksigen (O), dikenal sebagai ozon, merupakan alotrop oksigen yang sangat reaktif dan dapat merusak jaringan paru-paru.[41] Ozon diproduksi di atmosfer bumi ketika O bergabung dengan oksigen atomik yang dihasilkan dari pemisahan O oleh radiasi ultraviolet (UV).[7] Oleh karena ozon menyerap gelombang UV dengan sangat kuat, lapisan ozon yang berada di atmosfer berfungsi sebagai perisai radiasi yang melindungi planet.[7] Namun, dekat permukaan bumi, ozon merupakan polutan udara yang dibentuk dari produk sampingan pembakaran otomobil.[42]
Molekul metastabil tetraoksigen (O) ditemukan pada tahun 2001,[43][44] dan dianggap terdapat pada salah satu enam fase oksigen padat. Hal ini dibuktikan pada tahun 2006, dengan menekan O sampai dengan 20 GPa, dan ditemukan struktur gerombol rombohedral O.[45] Gerombol ini berpotensi sebagai oksidator yang lebih kuat daripada O maupun O, dan dapat digunakan dalam bahan bakar roket.[43][44] Fase logam oksigen ditemukan pada tahun 1990 ketika oksigen padat ditekan sampai di atas 96 GPa.[46] Ditemukan pula pada tahun 1998 bahwa pada suhu yang sangat rendah, fase ini menjadi superkonduktor.[47]
Sifat fisik
[sunting | sunting sumber]
Oksigen lebih larut dalam air daripada nitrogen. Air mengandung sekitar satu molekul O untuk setiap dua molekul N, bandingkan dengan rasio atmosferik yang sekitar 1:4. Kelarutan oksigen dalam air bergantung pada suhu. Pada suhu 0 °C, konsentrasi oksigen dalam air adalah 14,6 mg·L−1, manakala pada suhu 20 °C oksigen yang larut adalah sekitar 7,6 mg·L−1.[13][48] Pada suhu 25 °C dan 1 atm udara, air tawar mengandung 6,04 mililiter (mL) oksigen per liter, manakala dalam air laut mengandung sekitar 4,95 mL per liter.[49] Pada suhu 5 °C, kelarutannya bertambah menjadi 9,0 mL (50% lebih banyak daripada 25 °C) per liter untuk air murni dan 7,2 mL (45% lebih) per liter untuk air laut.
| 5 °C | 25 °C | |
|---|---|---|
| Air tawar | 9,00 | 6,04 |
| Air laut | 7,20 | 4,95 |
Oksigen mengembun pada 90,20 K (−182,95 °C, −297,31 °F), dan membeku pada 54.36 K (−218,79 °C, −361,82 °F).[50] Baik oksigen cair dan oksigen padat berwarna biru langit. Hal ini dikarenakan oleh penyerapan warna merah. Oksigen cair dengan kadar kemurnian yang tinggi biasanya didapatkan dengan distilasi bertingkat udara cair;[51] Oksigen cair juga dapat dihasilkan dari pengembunan udara, menggunakan nitrogen cair dengan pendingin.
Oksigen merupakan zat yang sangat reaktif dan harus dipisahkan dari bahan-bahan yang mudah terbakar.[52]
Spektroskopi molekul oksigen dikaitkan dengan proses atmosfer aurora dan pijaran udara.[53] Penyerapan dalam rangkaian Herzberg dan ultraviolet dalam pita Schumann-Runge menghasilkan atom oksigen yang penting dalam kimia atmosfer tengah.[54] Molekul oksigen singlet dalam keadaan tereksitasi adalah penyebab dari kemiluminesens merah dalam larutan.[55]
Isotop
[sunting | sunting sumber]
Oksigen yang dapat ditemukan secara alami adalah 16O, 17O, dan 18O, dengan 16O merupakan yang paling melimpah (99,762%).[56] Isotop oksigen dapat berkisar dari yang bernomor massa 12 sampai dengan 28.[56]
Kebanyakan 16O di disintesis pada akhir proses fusi helium pada bintang, tetapi ada juga beberapa yang dihasilkan pada proses pembakaran neon.[57] 17O utamanya dihasilkan dari pembakaran hidrogen menjadi helium semasa siklus CNO, membuatnya menjadi isotop yang paling umum pada zona pembakaran hidrogen bintang.[57] Kebanyakan 18O diproduksi ketika 14N (berasal dari pembakaran CNO) menangkap inti 4He, menjadikannya bentuk isotop yang paling umum di zona kaya helium bintang.[57]
Empat belas radioisotop telah berhasil dikarakterisasi, yang paling stabil adalah 15O dengan umur paruh 122,24 detik dan 14O dengan umur paruh 70,606 detik.[56] Isotop radioaktif sisanya memiliki umur paruh yang lebih pendek daripada 27 detik, dan mayoritas memiliki umur paruh kurang dari 83 milidetik.[56] Modus peluruhan yang paling umum untuk isotop yang lebih ringan dari 16O adalah penangkapan elektron, menghasilkan nitrogen, sedangkan modus peluruhan yang paling umum untuk isotop yang lebih berat daripada 18O adalah peluruhan beta, menghasilkan fluorin.[56]
Keberadaan
[sunting | sunting sumber]| Z | Unsur | Fraksi massa dalam bagian per sejuta | |
|---|---|---|---|
| 1 | Hidrogen | 739.000 | 71 × massa oksigen (batang merah) |
| 2 | Helium | 240.000 | 23 × massa oksigen (batang merah) |
| 8 | Oksigen | 10.400 | |
| 6 | Karbon | 4.600 | |
| 10 | Neon | 1.340 | |
| 26 | Besi | 1.090 | |
| 7 | Nitrogen | 960 | |
| 14 | Silikon | 650 | |
| 12 | Magnesium | 580 | |
| 16 | Belerang | 440 | |
Menurut massanya, oksigen merupakan unsur kimia paling melimpah di biosfer, udara, laut, dan tanah bumi. Oksigen merupakan unsur kimia paling melimpah ketiga di alam semesta, setelah hidrogen dan helium.[3] Sekitar 0,9% massa Matahari adalah oksigen.[5] Oksigen mengisi sekitar 49,2% massa kerak bumi[4] dan merupakan komponen utama dalam samudera (88,8% berdasarkan massa).[5] Gas oksigen merupakan komponen paling umum kedua dalam atmosfer bumi, menduduki 21,0% volume dan 23,1% massa (sekitar 1015 ton) atmosfer.[5][59][d] Bumi memiliki ketidaklaziman pada atmosfernya dibandingkan planet-planet lainnya dalam sistem tata surya karena ia memiliki konsentrasi gas oksigen yang tinggi di atmosfernya. Bandingkan dengan Mars yang hanya memiliki 0,1% O berdasarkan volume dan Venus yang bahkan memiliki kadar konsentrasi yang lebih rendah. Namun, O yang berada di planet-planet selain bumi hanya dihasilkan dari radiasi ultraviolet yang menimpa molekul-molekul beratom oksigen, misalnya karbon dioksida.

Konsentrasi gas oksigen di Bumi yang tidak lazim ini merupakan akibat dari siklus oksigen. Siklus biogeokimia ini menjelaskan pergerakan oksigen di dalam dan di antara tiga reservoir utama bumi: atmosfer, biosfer, dan litosfer. Faktor utama yang mendorong siklus oksigen ini adalah fotosintesis. Fotosintesis melepaskan oksigen ke atmosfer, manakala respirasi dan proses pembusukan menghilangkannya dari atmosfer. Dalam keadaan kesetimbangan, laju produksi dan konsumsi oksigen adalah sekitar 1/2000 keseluruhan oksigen yang ada di atmosfer setiap tahunnya.
Oksigen bebas juga terdapat dalam air sebagai larutan. Peningkatan kelarutan O pada temperatur yang rendah memiliki implikasi yang besar pada kehidupan laut. Lautan di sekitar kutub bumi dapat menyokong kehidupan laut yang lebih banyak oleh karena kandungan oksigen yang lebih tinggi.[60] Air yang terkena polusi dapat mengurangi jumlah O dalam air tersebut. Para ilmuwan menaksir kualitas air dengan mengukur kebutuhan oksigen biologis atau jumlah O yang diperlukan untuk mengembalikan konsentrasi oksigen dalam air itu seperti semula.[61]
Analisis
[sunting | sunting sumber]
Ahli paleoklimatologi mengukur rasio oksigen-18 dan oksigen-16 dalam cangkang dan kerangka organisme laut untuk menentukan iklim jutaan tahun yang lalu (lihat siklus rasio isotop oksigen). Molekul air laut yang mengandung isotop yang lebih ringan, oksigen-16, menguap sedikit lebih cepat daripada molekul air yang mengandung oksigen-18, yang lebih berat 12% daripada oksigen-16, dan perbedaan ini meningkat pada suhu yang lebih rendah.[62] Selama periode suhu global yang lebih rendah, salju dan hujan dari air menguap cenderung lebih tinggi dalam oksigen-16, dan air laut yang ditinggalkan cenderung lebih tinggi dalam oksigen-18. Organisme laut kemudian memasukkan lebih banyak oksigen-18 ke dalam kerangka dan cangkangnya daripada di iklim yang lebih hangat.[62] Ahli paleoklimatologi juga secara langsung mengukur rasio ini dalam molekul air sampel inti es yang berusia sampai ratusan ribu tahun.
Ahli geologi planet telah mengukur jumlah relatif isotop oksigen dalam sampel dari Bumi, Bulan, Mars, dan meteorit, tetapi lama tidak dapat memperoleh nilai referensi untuk rasio isotop di Matahari, yang diyakini sama dengan yang ada di purba nebula matahari. Analisis wafer silikon yang terpapar angin surya di luar angkasa dan dikembalikan oleh wahana antariksa Genesis yang jatuh menunjukkan bahwa Matahari memiliki proporsi oksigen-16 yang lebih tinggi daripada Bumi. Pengukuran tersebut menyiratkan bahwa proses yang tidak diketahui menghabiskan oksigen-16 dari piringan materi protoplanet Matahari sebelum penggabungan butiran debu yang membentuk Bumi.[63]
Oksigen membuat dua pita serapan spektrofotometri yang memuncak pada panjang gelombang 687 dan 760 nm. Beberapa ilmuwan penginderaan jauh mengusulkan menggunakan pengukuran pancaran yang berasal dari tajuk vegetasi di pita tersebut untuk menentukan kesehatan tanaman dari platform satelit.[64] Pendekatan ini memanfaatkan sebuah fakta bahwa pada pita-pita tersebut bisa membedakan reflektansi vegetasi dari fluoresensinya, yang jauh lebih lemah. Pengukuran secara teknis sulit karena rasio signal-to-noise yang rendah dan struktur fisik vegetasi; tetapi diusulkan sebagai metode yang memungkinkan untuk memantau siklus karbon dari satelit dalam skala global.
Peranan biologis
[sunting | sunting sumber]Fotosintesis dan respirasi
[sunting | sunting sumber]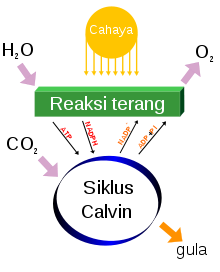
Di alam, oksigen bebas dihasilkan dari fotolisis air selama fotosintesis oksigenik. Ganggang hijau dan sianobakteri di lingkungan lautan menghasilkan sekitar 70% oksigen bebas yang dihasilkan di bumi, sedangkan sisanya dihasilkan oleh tumbuhan daratan.[65]
Persamaan kimia yang sederhana untuk fotosintesis adalah:[66]
- 6CO + 6H + foton → C + 6O
Atau lebih sederhananya:
- karbon dioksida + air + sinar matahari → glukosa + dioksigen
Evolusi oksigen fotolitik terjadi di membran tilakoid organisme dan memerlukan energi empat foton.[e] Terdapat banyak langkah proses yang terlibat, tetapi hasilnya merupakan pembentukan gradien proton di seluruh permukaan tilakod. Ini digunakan untuk mensintesis ATP via fotofosforilasi.[67] O yang dihasilkan sebagai produk sampingan kemudian dilepaskan ke atmosfer.[f]
Dioksigen molekuler, O, sangatlah penting untuk respirasi sel organisme aerob. Oksigen digunakan di mitokondria untuk membantu menghasilkan adenosina trifosfat (ATP) selama fosforilasi oksidatif. Reaksi respirasi aerob ini secara garis besar merupakan kebalikan dari fotosintesis, secara sederhana:
- C + 6O → 6CO + 6H + 2880 kJ·mol-1
Pada vertebrata, O berdifusi melalui membran paru-paru dan dibawa oleh sel darah merah. Hemoglobin mengikat O, mengubah warnanya dari merah kebiruan menjadi merah cerah.[68][41] Terdapat pula hewan lainnya yang menggunakan hemosianin (hewan moluska dan beberapa artropoda) ataupun hemeritrin (laba-laba dan lobster).[59] Satu liter darah dapat melarutkan 200 mL O.[59]
Spesi oksigen yang reaktif, misalnya ion superoksida (O) dan hidrogen peroksida (H), adalah produk sampingan penggunaan oksigen dalam tubuh organisme.[59] Namun, bagian sistem kekebalan organisme tingkat tinggi pula menghasilkan peroksida, superoksida, dan oksigen singlet untuk menghancurkan mikroba. Spesi oksigen reaktif juga memainkan peran yang penting pada respon hipersensitif tumbuhan melawan serangan patogen.[67]
Dalam keadaan istirahat, manusia dewasa menghirup 1,8 sampai 2,4 gram oksigen per menit.[69] Jumlah ini setara dengan 6 miliar ton oksigen yang dihirup oleh seluruh manusia per tahun.[g]
Makhluk hidup
[sunting | sunting sumber]
| Unit | Tekanan gas di alveolus | Oksigen darah pada arteri | Gas darah pada pembuluh balik |
|---|---|---|---|
| kPa | 14,2 | 11[70]-13[70] | 4,0[70]-5,3[70] |
| mmHg | 107 | 75[71]-100[71] | 30[72]-40[72] |
Tekanan parsial oksigen bebas dalam tubuh organisme vertebrata yang hidup paling tinggi dalam sistem pernapasan, dan menurun sepanjang pembuluh nadi, jaringan periferal, dan pembuluh nadi. Tekanan parsial adalah tekanan yang akan dimiliki oksigen jika hanya oksigen menempati volume.[73]
Penumpukan oksigen di atmosfer
[sunting | sunting sumber]
Gas oksigen bebas hampir tidak terdapat pada atmosfer bumi sebelum munculnya arkaea dan bakteri fotosintetik. Oksigen bebas pertama kali muncul dalam kadar yang signifikan semasa masa Paleoproterozoikum (antara 2,5 sampai dengan 1,6 miliar tahun yang lalu). Pertama-tama, oksigen bersamaan dengan besi yang larut dalam samudera, membentuk formasi pita besi (Banded iron formation). Oksigen mulai melepaskan diri dari samudera 2,7 miliar tahun lalu, dan mencapai 10% kadar sekarang sekitar 1,7 miliar tahun lalu.[74]
Keberadaan oksigen dalam jumlah besar di atmosfer dan samudera kemungkinan membuat kebanyakan organisme anaerob hampir punah semasa bencana oksigen sekitar 2,4 miliar tahun yang lalu. Namun, respirasi sel yang menggunakan O2 mengizinkan organisme aerob untuk memproduksi lebih banyak ATP daripada organisme anaerob, sehingga organisme aerob mendominasi biosfer bumi.[75] Fotosintesis dan respirasi seluler O mengizinkan berevolusinya sel eukariota dan akhirnya berevolusi menjadi organisme multisel seperti tumbuhan dan hewan.
Sejak permulaan era Kambrium 540 juta tahun yang lalu, kadar O berfluktuasi antara 15% sampai 30% berdasarkan volume.[76] Pada akhir masa Karbon, kadar O atmosfer mencapai maksimum dengan 35% berdasarkan volume,[76] mengizinkan serangga dan amfibi tumbuh lebih besar daripada ukuran sekarang.
Fluktuasi konsentrasi oksigen atmosfer telah memengaruhi iklim masa lalu. Ketika oksigen menurun, kepadatan atmosfer turun, yang mengakibatkan peningkatan penguapan, yang menyebabkan curah hujan meningkat dan suhu menjadi lebih hangat.[77]
Aktivitas manusia, meliputi pembakaran 7 miliar ton bahan bakar fosil per tahun hanya memiliki pengaruh yang sangat kecil terhadap penurunan kadar oksigen di atmosfer. Dengan laju fotosintesis sekarang ini, diperlukan sekitar 2.000 tahun untuk memproduksi ulang seluruh O yang ada di atmosfer sekarang.[78]
Produksi industri
[sunting | sunting sumber]
Seratus juta ton O2 diekstraksi dari udara untuk keperluan industri setiap tahun melalui dua metode utama.[79] Metode yang paling banyak digunakan adalah distilasi fraksional dari udara yang sudah dicairkan. Saat proses berlangsung, N2 menguap sedangkan O2 tersisa sebagai cairan.[79]
Metode kedua untuk menghasilkan O2 melewatkan aliran udara bersih dan kering melalui sebuah unggun dari sepasang saringan molekuler zeolit yang seperti satu sama lain, yang menyerap nitrogen dan mengalirkan aliran gas dengan kemurnian O2 90% sampai 93% .[79] Pada waktu bersamaan, gas nitrogen dilepaskan dari unggun zeolit yang jenuh dengan nitrogen yang lain, dengan mengurangi tekanan operasi ruang dan mengalihkan sebagian gas oksigen dari unggun produsen melaluinya, dengan arah aliran yang berlawanan. Setelah waktu siklus yang ditetapkan, fungsi kedua unggun dipertukarkan, memungkinkan pasokan gas oksigen yang terus menerus untuk dipompa melalui pipa. Ini dikenal sebagai adsorpsi ayunan tekanan. Gas oksigen semakin sering diperoleh dengan teknologi non-kriogenik (lihat juga teknologi yang terkait adsorpsi ayunan vakum).[80]
Gas oksigen juga dapat diproduksi melalui elektrolisis air menjadi molekul oksigen dan hidrogen. Listrik DC harus digunakan: jika llstrik AC digunakan, gasnya terdiri dari hidrogen dan oksigen dengan rasio 2:1 yang bisa meledak. Metode serupa adalah evolusi elektrokatalitik O2 dari oksida dan asam okso. Katalis kimia juga dapat digunakan, seperti pada generator oksigen kimia atau lilin oksigen yang digunakan sebagai bagian dari peralatan pendukung kehidupan di kapal selam, dan masih menjadi bagian dari perlengkapan standar dalam pesawat komersial jika terjadi keadaan darurat kekurangan tekanan. Metode pemisahan udara lainnya memaksa udara untuk larut melalui membran keramik dengan dasar zirkonium dioksida, baik dengan tekanan tinggi atau arus listrik, untuk menghasilkan gas O2 yang hampir murni.[81]
Penyimpanan
[sunting | sunting sumber]
Penyimpanan oksigen dapat berupa tangki oksigen tekanan tinggi, kriogenik, dan senyawa kimia. Untuk alasan ekonomi, oksigen sering diangkut dalam jumlah besar sebagai cairan di truk tangki yang diisolasi, karena satu liter oksigen cair setara dengan 840 liter gas oksigen pada tekanan atmosfer dan temperatur 20 °C (68 °F).[79] Truk tangki semacam itu digunakan untuk mengisi ulang wadah penyimpanan oksigen cair curah, yang berada di luar rumah sakit dan institusi lain yang membutuhkan gas oksigen murni dalam jumlah besar. Oksigen cair melewati penukar panas, yang mengubah cairan kriogenik menjadi gas oksigen sebelum memasuki gedung. Oksigen juga disimpan dan dikirim dalam kemasan silinder yang lebih kecil yang berisi gas terkompresi, berguna untuk aplikasi medis portabel tertentu serta las karbit.[79]
Penggunaan
[sunting | sunting sumber]Medis
[sunting | sunting sumber]
Pengambilan O2 dari udara adalah tujuan penting dari respirasi, jadi suplementasi oksigen digunakan dalam pengobatan. Perawatan tidak hanya meningkatkan kadar oksigen dalam darah pasien, tetapi juga memiliki efek sekunder menurunkan resistensi aliran darah di berbagai jenis paru-paru yang sakit, mengurangi beban kerja pada jantung. Terapi oksigen digunakan untuk mengobati emfisema, radang paru-paru, beberapa gangguan jantung (gagal jantung kongestif), beberapa gangguan yang menyebabkan peningkatan tekanan arteri pulmonalis, dan penyakit apa pun yang memengaruhi kemampuan tubuh untuk mengambil dan menggunakan gas oksigen.[82]
Perawatannya cukup fleksibel untuk digunakan di rumah sakit, rumah pasien, atau dengan perangkat portabel. Tenda oksigen dulu digunakan dalam suplementasi oksigen, tetapi sudah diganti dengan penggunaan masker oksigen atau kanula hidung.[83]
Obat hiperbarik (tekanan tinggi) menggunakan ruang oksigen khusus untuk meningkatkan tekanan parsial O2 di sekitar pasien dan, bila diperlukan, staf medis.[84] Keracunan karbon monoksida, gas gangrene, dan penyakit dekompresi ('tikungan' atau the bends) terkadang disembuhkan dengan terapi ini.[85] Meningkatkan konsentrasi O2 di paru-paru membantu mengeluarkan karbon monoksida dari kelompok heme hemoglobin.[86][87] Gas oksigen beracun bagi bakteri anaerob yang menyebabkan gas gangrene. Oleh karena itu, meningkatkan tekanan parsial akan membantu membunuh bakteri anaerob.[86][87] Penyakit dekompresi terjadi pada penyelam yang naik ke atas terlalu cepat setelah menyelam, mengakibatkan gelembung gas lengai, sebagian besar terdiri dari nitrogen dan helium, terbentuk di dalam darah. Meningkatkan tekanan O2 secepatnya membantu melarutkan kembali gelembung ke dalam darah sehingga kelebihan gas ini dapat dikeluarkan melalui paru-paru.[82][88][89] Pemberian oksigen normobarik pada konsentrasi tertinggi yang tersedia sering digunakan sebagai pertolongan pertama untuk cedera penyelaman apapun yang mungkin melibatkan pembentukan gelembung gas lengai di jaringan. Ada dukungan epidemiologis untuk penggunaannya dari studi statistik kasus-kasus yang dicatat dalam pangkalan data jangka panjang.[90][91][92]
Dukungan hidup dan penggunaan rekreasi
[sunting | sunting sumber]
O2 digunakan sebagai gas pernapasan bertekanan rendah dalam pakaian luar angkasa modern, yang mengelilingi tubuh pemakainya dengan gas pernapasan. Air dalam pakaian luar angkasa berupa oksigen yang hampir murni pada sekitar sepertiga tekanan normal, dengan hasil tekanan parsial darah normal O2. Tarik-ulur konsentrasi oksigen yang lebih tinggi untuk tekanan yang lebih rendah diperlukan untuk mempertahankan fleksibilitas.[93][94]
Penyelam bawah laut dan orang dalam kapal selam juga memerlukan O2 yang dikirim secara artifisial. Kapal selam dan pakaian selam atmosferik biasanya menggunakan udara bertekanan normal. Udara dibersihkan dari karbon dioksida menggunakan ekstraksi kimiawi dan oksigen diganti untuk mempertahankan tekanan parsial yang konstan. Penyelam tekanan ambien menghirup campuran udara atau gas dengan fraksi oksigen yang disesuaikan dengan kedalaman penyelam. Penggunaan O2 murni atau hampir murni untuk penyelaman pada tekanan yang lebih tinggi dari atmosfer Bumi biasanya terbatas untuk rebreather, atau dekompresi pada kedalaman yang relatif dangkal (kurang dari ~6 meter),[95][96] atau perawatan medis di ruang kompresi ulang dengan tekanan hingga 2,8 bar, dimana toksisitas oksigen dapat dikelola tanpa risiko tenggelam. Penyelaman yang lebih dalam membutuhkan penambahan gas lain, seperti nitrogen atau helium, untuk mencegah keracunan oksigen.[95]
Orang yang mendaki gunung atau terbang dengan pesawat bersayap tetap tidal bertekanan kadang memiliki suplai O2 tambahan.[h] Pesawat komersial bertekanan memiliki pasokan darurat O2 yang secara otomatis disalurkan ke penumpang jika terjadi penurunan tekanan kabin. Kehilangan tekanan kabin yang tiba-tiba mengaktifkan generator oksigen kimia di atas kursi masing-masing, yang kemudian menyebabkan masker oksigen jatuh. Menarik masker "untuk memulai aliran oksigen" seperti yang diperintahkan oleh instruksi keselamatan kabin, memaksa besi masuk ke dalam natrium klorat di dalam tabung.[81] Gas oksigen kemudian diproduksi oleh reaksi eksotermik yang kemudian mengalir dengan stabil.
Oksigen, sebagai euforik ringan, memiliki sejarah penggunaan rekreasi dalam bar oksigen dan olahraga. Bar oksigen adalah bar yang ditemukan di Amerika Serikat sejak akhir 1990-an yang menawarkan gas O2 dengan biaya sedikit.[97] Atlet profesional, terutama dalam sepak bola Amerika, kadang-kadang pergi ke luar lapangan di antara permainan untuk mengenakan masker oksigen untuk meningkatkan kinerja. Efek farmakologisnya diragukan; efek plasebo adalah penjelasan yang lebih mungkin.[97] Studi yang tersedia mendukung peningkatan kinerja dari gas kaya oksigen hanya jika dihirup selama latihan aerobik.[98]
Penggunaan rekreasi lainnya yang tidak melibatkan pernapasan adalah aplikasi piroteknik, seperti penyalaan pemanggang barbeku selama lima detik oleh George Goble.[99]
Industri
[sunting | sunting sumber]
Peleburan bijih besi menjadi baja mengkonsumsi 55% oksigen yang diproduksi secara komersial[81] Dalam proses ini, O2 disuntikkan melalui tombak bertekanan tinggi ke dalam besi cair, yang menghilangkan kotoran belerang dan karbon berlebih sebagai oksida masing-masing, SO2 dan CO2. Reaksinya eksotermik, sehingga suhunya meningkat sampai 1.700 °C pada saat reaksi terjadi.[100]
25% oksigen yang diproduksi secara komersial digunakan oleh industri kimia.[100] Etilen bereaksi dengan O2 untuk membuat etilena oksida, yang kemudian diubah menjadi etilena glikol; sebuah bahan utama dengan kegunaan yang banyak, termasuk antibeku dan polimer poliester (bahan dari berbagai plastik dan kain).[100] Banyak oksigen atau udara digunakan untuk proses pemecahan oksi[101] dan produksi asam akrilat,[102] diformil-furan,[103] dan asam benzilat.[104] Sintesis elektrokimia hidrogen peroksida dari oksigen adalah teknologi memungkinkan untuk menggantikan proses hidrokuinon yang saat ini digunakan[105]. Oksidasi katalitik digunakan dalam pembakar lanjut untuk menghilangkan gas berbahaya.[106][107]
Sebagian besar sisa 20% oksigen yang diproduksi secara komersial digunakan dalam aplikasi medis, pemotongan dan pengelasan logam, sebagai oksidator bahan bakar roket, dan dalam penjernihan air.[100] Oksigen digunakan dalam pengelasan oksiasetilen, yang membakar asetilena dengan O2 untuk menghasilkan nyala api yang sangat panas. Dalam proses ini, logam dengan ketebalan hingga 60 cm (24 in) dipanaskan terlebih dahulu dengan nyala oksi-asetilen kecil, kemudian dipotong dengan cepat menggunakan aliran O2 yang besar.[108]
Senyawa oksigen
[sunting | sunting sumber]
Keadaan oksidasi oksigen adalah -2 untuk hampir semua senyawa oksigen yang diketahui. Keadaan oksidasi -1 ditemukan pada beberapa senyawa seperti peroksida.[109] Senyawa oksigen dengan keadaan oksidasi lainnya sangat jarang ditemukan, yakni -1/2 (superoksida), -1/3 (ozonida), 0 (asam hipofluorit), +1/2 (dioksigenil), +1 (dioksigen difluorida), dan +2 (oksigen difluorida).[110]
Senyawa oksida dan senyawa anorganik lainnya
[sunting | sunting sumber]Air (H) adalah oksida hidrogen dan merupakan senyawa oksigen yang paling dikenal. Atom hidrogen secara kovalen berikatan dengan oksigen. Selain itu, atom hidrogen juga berinteraksi dengan atom oksigen dari molekul air lainnya (sekitar 23,3 kJ·mol−1 per atom hidrogen).[111] Ikatan hidrogen antar molekul air ini menjaga kedua molekul 15% lebih dekat daripada yang diperkirakan apabila hanya memperhitungkan gaya Van der Waals.[112][i]

Oleh karena elektronegativitasnya, oksigen akan membentuk ikatan kimia dengan hampir semua unsur lainnya pada suhu tinggi dan menghasilkan senyawa oksida. Namun, terdapat pula beberapa unsur yang secara spontan akan membentuk oksida pada suhu dan tekanan standar. Perkaratan besi merupakan salah satu contohnya. Permukaan logam seperti aluminium dan titanium teroksidasi dengan keberadaan udara dan membuat permukaan logam tersebut tertutupi oleh lapisan tipis oksida. Lapisan oksida ini akan mencegah korosi lebih lanjut. Beberapa senyawa oksida logam transisi ditemukan secara alami sebagai senyawa non-stoikiometris. Sebagai contohnya, FeO (wustit) sebenarnya berumus , dengan x biasanya sekitar 0,05.[113]
Di atmosfer, kita dapat menemukan sejumlah kecil oksida karbon, yaitu karbon dioksida (CO). Pada kerak bumi pula dapat ditemukan berbagai senyawa oksida, yakni oksida silikon (Silika SO) yang ditemukan pada granit dan pasir, oksida aluminium (aluminium oksida Al yang ditemukan pada bauksit dan korundum), dan oksida besi (besi(III) oksida Fe) yang ditemukan pada hematit dan karat logam.
Silikat yang larut dalam air dalam bentuk Na4SiO4, Na2SiO3, dan Na2Si2O5 digunakan sebagai deterjen dan perekat.[114]
Oksigen juga berperan sebagai ligan untuk logam transisi, membentuk kompleks dioksigen logam transisi, yang mengandung logam-O2. Kelas senyawa ini termasuk protein heme hemoglobin dan mioglobin.[115] Reaksi eksotis dan tidak biasa terjadi dengan PtF6, yang mengoksidasi oksigen menjadi O2+PtF6−, yaitu dioksigenil hexafluoroplatinat.[116]
Senyawa organik
[sunting | sunting sumber]
Golongan paling penting dari senyawa organik yang mengandung oksigen adalah (dimana "R" adalah grup organik): alkohol (R-OH); eter (R-O-R); keton (R-CO-R); aldehida (R-CO-H); asam karboksilat (R-COOH); ester (R-COO-R); anhidrida asam (R-CO-O-CO-R); dan amida (R-C(O)-NR2). Ada banyak pelarut organik penting yang mengandung oksigen, antara lain: aseton, metanol, etanol, isopropanol, furan, THF, dietil eter, dioksan, etil asetat, DMF, DMSO, asam asetat, dan asam format. Aseton ((CH3)2CO) dan fenol (C6H5OH) digunakan sebagai bahan pengumpan dalam sintesis berbagai zat. Senyawa organik penting lainnya yang mengandung oksigen adalah: gliserol, formaldehida, glutaraldehida, asam sitrat, asetat anhidrida, dan asetamida. Epoksida adalah eter dimana atom oksigen merupakan bagian dari cincin yang terdiri dari tiga atom. Unsur ini juga ditemukan di hampir semua biomolekul yang penting untuk (atau dihasilkan oleh) kehidupan.
Oksigen bereaksi secara spontan dengan banyak senyawa organik pada atau di bawah suhu ruangan dalam proses yang disebut autoksidasi.[117] Sebagian besar senyawa organik yang mengandung oksigen tidak dibuat oleh aksi langsung O2. Senyawa organik yang penting dalam industri dan perdagangan yang dibuat dengan oksidasi langsung prekursor termasuk etilena oksida dan asam perasetat.[114]
Toksisitas dan pencegahan
[sunting | sunting sumber]Standar NFPA 704 menilai gas oksigen terkompresi tidak berbahaya bagi kesehatan, tidak mudah terbakar dan tidak reaktif, tetapi merupakan oksidator. Oksigen cair yang didinginkan (LOX) diberi angka peringkat bahaya kesehatan 3 (untuk peningkatan risiko hiperoksia dari uap terkondensasi, dan untuk bahaya yang umum terjadi pada cairan kriogenik seperti radang dingin), dan semua peringkat lainnya sama dengan bentuk gas terkompresi.[118]
Toksisitas
[sunting | sunting sumber]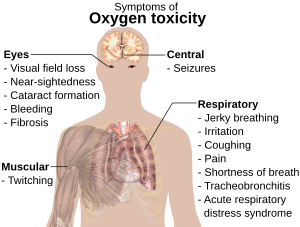
Gas oksigen (O2) dapat menjadi racun pada tekanan parsial yang tinggi, yang bisa menyebabkan kejang dan masalah kesehatan lainnya.[95]{[j][120] Toksisitas oksigen biasanya mulai terjadi pada tekanan parsial diatas 50 kilopascal (kPa), yang sama dengan sekitar 50% komposisi oksigen pada tekanan standar atau 2,5 kali tekanan parsial normal O2 di permukaan laut, yaitu sekitar 21 kPa. Ini tidak menjadi masalah kecuali untuk pasien yang menggunakan ventilator mekanis, karena gas yang disuplai melalui masker oksigen dalam aplikasi medis biasanya hanya terdiri dari 30%–50% volume O2 (sekitar 30 kPa pada tekanan standar).[121]
Bayi prematur pernah ditempatkan di inkubator berisi udara yang kaya O2, tetapi praktik ini dihentikan setelah beberapa bayi dibutakan karena kandungan oksigen yang terlalu tinggi.[121]
Menghirup udara yang berisi O2 murni dalam aplikasi luar angkasa, seperti dalam beberapa pakaian luar angkasa modern, atau dalam wahana antariksa awal seperti Apollo, tidak menyebabkan masalah kesehatan karena tekanan totalnya rendah.[93][122] Untuk pakaian antariksa, tekanan parsial O2 pada gas pernafasan secara umum sekitar 30 kPa (1,4 kali normal), dan dampak tekanan parsial O2 dalam darah arteri astronaut hanya sedikit diatas tekanan parsial normal O2 di permukaan laut.[123]
Keracunan paru-paru dan sistem saraf pusat karena oksigen juga dapat terjadi pada penyelaman scuba dalam dan penyelaman yang disuplai dari permukaan.[121][124] Pernapasan campuran udara dengan O2 tekanan parsial lebih dari 60 kPa terus-menerus pada akhirnya dapat menyebabkan fibrosis paru permanen.[125] Paparan udara dengan tekanan parsial O2 yang lebih besar dari 160 kPa (sekitar 1,6 atm) dapat menyebabkan konvulsi (biasanya fatal untuk penyelam). Toksisitas oksigen akut (menyebabkan kejang, efek yang paling ditakuti penyelam) dapat terjadi dengan menghirup campuran udara dengan 21% O2 pada kedalaman 66 m (217 ft) atau lebih; hal yang sama dapat terjadi dengan menghirup udara dengan 100% O2 pada kedalaman 6 m (20 ft).[125][126][127][128]
Kebakaran dan bahaya lain
[sunting | sunting sumber]
Sumber oksigen yang terkonsentrasi mendorong pembakaran yang cepat. Bahaya kebakaran dan ledakan muncul ketika oksidan terkonsentrasi dan bahan bakar didekatkan; peristiwa penyalaan, seperti panas atau percikan, diperlukan untuk memicu pembakaran.[129][130] Oksigen adalah oksidator, bukan bahan bakar, tetapi tetap menjadi sumber sebagian besar energi kimia yang dilepaskan dalam pembakaran.[34][131]
O2 terkonsentrasi memungkinkan pembakaran berlangsung dengan cepat dan penuh energi.[130] Pipa baja dan bejana penyimpan yang digunakan untuk menyimpan dan menyalurkan oksigen berbentuk gas dan cair bertindak seperti bahan bakar; dan karena itu, desain dan pembuatan O2 sistem memerlukan pelatihan khusus untuk memastikan bahwa sumber penyalaan diminimalkan.[130] Api yang menewaskan awak Apollo 1 dalam uji landasan peluncuran menyebar dengan cepat karena udara kapsul hanya mengandung O2 murni dengan tekanan sedikit lebih dari tekanan atmosfer, bukan ⅓ tekanan normal yang akan digunakan dalam sebuah misi.[k][133]
Tumpahan oksigen cair, jika dibiarkan meresap ke dalam bahan organik, seperti kayu, petrokimia, dan aspal dapat menyebabkan bahannya meledak secara tak terduga pada dampak mekanis selanjutnya.[130]
Lihat juga
[sunting | sunting sumber]- Sejarah oksigen secara geologi
- Hipoksia (lingkungan) untuk kekurangan O2 dalam ekologi akuatik
- Pengurangan oksigen di dalam laut
- Hipoksia (medis), kekurangan oksigen
- Batas konsentrasi oksigen
- Senyawa oksigen
- Pabrik oksigen
- Sensor oksigen
Catatan
[sunting | sunting sumber]- ^ Namun, hasil kerjanya kebanyakan diabaikan sampai dengan tahun 1860. Hal ini sebagian dikarenakan oleh kepercayaan bahwa atom yang seunsur tidak akan memiliki afinitas kimia terhadap satu sama lainnya. Selain itu, juga disebabkan oleh kekecualian hukum Avogadro yang belum berhasil dijelaskan pada saat itu.
- ^ Orbital adalah konsep dari mekanika kuantum yang memodelkan elektron sebagai partikel yang mirip dengan gelombang yang memiliki distribusi spasial tentang sebuah atom atau molekul.
- ^ Paramagnetisme oksigen dapat digunakan secara analitis dalam penganalisis gas oksigen paramagnetik yang menentukan kemurnian gas oksigen. ("Company literature of Oxygen analyzers (triplet)". Servomex. Diarsipkan dari versi asli tanggal 2008-03-08. Diakses tanggal 2007-12-15.)
- ^ Angka yang diberikan adalah untuk ketinggian hingga 80 km (50 mil) di atas permukaan
- ^ Membran tilakoid merupakan bagian kloroplas ganggang dan tumbuhan, sedangkan pada sianobakteri, ia adalah struktur membran sel sianobakteri. Kloroplas diperkirakan berevolusi dari sianobakteri yang bersimbiosis dengan tumbuhan.
- ^ Oksidasi air dikatalisis oleh kompleks enzim yang mengandung mangan yang dikenal sebagai oxygen evolving complex (OEC) atau kompleks pemecah air yang ditemukan terkait dengan sisi lumenal membran tilakoid. Mangan adalah kofaktor penting, dan kalsium dan klorida juga diperlukan untuk terjadinya reaksi. (Raven 2005)
- ^ (1,8 gram)*(60 menit)*(24 jam)*(365 hari)*(6,6 miliar orang)/1.000.000=6,24 miliar ton
- ^ Alasannya menambah proporsi oksigen dalam tekanan rendah menambah tekanan parsial O2 menjadi lebih dekat dengan yang ditemukan di permukaan laut
- ^ Selain itu, oleh karena oksigen memiliki elektronegativitas yang lebih tinggi daripada hidrogen, molekul air bersifat polar. Interaksi antara dipol yang berbeda dari setiap molekul menyebabkan gaya tarik.
- ^ Karena tekanan parsial O2 adalah fraksi O2 kali tekanan total, tekanan parsial yang tinggi dapat terjadi karena fraksi O2 yang tinggi dalam gas pernapasan atau tekanan gas pernapasan tinggi, atau kombinasi keduanya.
- ^ Tidak ada sumber penyalaan tunggal api yang dapat diidentifikasi dengan yakin, meskipun beberapa bukti menunjukkan adanya busur api dari percikan listrik.[132]
Referensi
[sunting | sunting sumber]Catatan kaki
[sunting | sunting sumber]- ^ (Indonesia) "Oksigen". KBBI Daring. Diakses tanggal 17 Juli 2022.
- ^ Weast, Robert (1984). CRC, Handbook of Chemistry and Physics. Boca Raton, Florida: Chemical Rubber Company Publishing. hlm. E110. ISBN 0-8493-0464-4.
- ^ a b Emsley 2001, p.297
- ^ a b "Oxygen". Los Alamos National Laboratory. Diarsipkan dari versi asli tanggal 2007-10-26. Diakses tanggal 2007-12-16.
- ^ a b c d e f g h i j Cook & Lauer 1968, p.500
- ^ "NASA Research Indicates Oxygen on Earth 2.5 Billion Years Ago" (Siaran pers). NASA. 2007-09-27. Diakses tanggal 2008-03-13.[pranala nonaktif permanen]
- ^ a b c d Mellor 1939
- ^ Jastrow, Joseph (1936). Story of Human Error. Ayer Publishing. hlm. 171. ISBN 978-0-8369-0568-7.
- ^ Emsley 2001, hlm. 299.
- ^ Cook & Lauer, hlm. 499.
- ^ a b c Britannica contributors 1911, "John Mayow"
- ^ a b World of Chemistry contributors 2005, "John Mayow"
- ^ a b c Emsley 2001, p.299
- ^ Morris 2003
- ^ a b c d e Cook & Lauer 1968, p.499.
- ^ Marples, Frater James A. "Michael Sendivogius, Rosicrucian, and Father Of Studies of Oxygen" (PDF). Societas Rosicruciana in Civitatibus Foederatis, Nebraska College. hlm. 3–4. Diarsipkan (PDF) dari versi asli tanggal 2020-05-08. Diakses tanggal 2018-05-25.
- ^ a b Bugaj, Roman (1971). "Michał Sędziwój – Traktat o Kamieniu Filozoficznym". Biblioteka Problemów (dalam bahasa Polski). 164: 83–84. ISSN 0137-5032.
- ^ a b c Emsley 2001, p.300
- ^ Priestley 1775, 384–94
- ^ DeTurck, Dennis (1997). "The Interactive Textbook of PFP96". University of Pennsylvania. hlm. Do We Take Atoms for Granted?. Diarsipkan dari versi asli tanggal 2008-01-17. Diakses tanggal 2008-01-28.
- ^ Roscoe 1883, 38
- ^ a b Daintith 1994, p.707
- ^ Poland - Culture, Science and Media. Condensation of oxygen and nitrogen. Retrieved on 2008-10-04.
- ^ Emsley 2001, p.303
- ^ a b c How Products are Made contributors, "Oxygen"
- ^ "Goddard-1926". NASA. Diarsipkan dari versi asli tanggal 2015-11-06. Diakses tanggal 2007-11-18.
- ^ Flecker, Oriel Joyce (1924). A school chemistry. MIT Libraries. Oxford, Clarendon press. hlm. 30.
- ^ Scripps Institute. "Atmospheric Oxygen Research". Diarsipkan dari versi asli tanggal 2017-07-25. Diakses tanggal 2020-09-10.
- ^ a b Jack Barrett, 2002, "Atomic Structure and Periodicity, (Basic concepts in chemistry, Vol. 9 of Tutorial chemistry texts), Cambridge, U.K.:Royal Society of Chemistry, p. 153, ISBN 0854046577, see [1] accessed January 31, 2015.
- ^ "Oxygen Facts". Science Kids. February 6, 2015. Diarsipkan dari versi asli tanggal 2020-05-07. Diakses tanggal November 14, 2015.
- ^ "Molecular Orbital Theory". Purdue University. Diarsipkan dari versi asli tanggal 2008-05-10. Diakses tanggal 2008-01-28.
- ^ Pauling, L. The Nature of the Chemical Bond. Cornell University Press, 1960.
- ^ a b Jakubowski, Henry. "Chapter 8: Oxidation-Phosphorylation, the Chemistry of Di-Oxygen". Biochemistry Online. Saint John's University. Diarsipkan dari versi asli tanggal 2018-10-05. Diakses tanggal January 28, 2008.
- ^ a b Weiss, H. M. (2008). "Appreciating Oxygen". J. Chem. Educ. 85 (9): 1218–1219. Bibcode:2008JChEd..85.1218W. doi:10.1021/ed085p1218. Diarsipkan dari versi asli tanggal 2020-10-18. Diakses tanggal 2020-09-11.
- ^ "Demonstration of a bridge of liquid oxygen supported against its own weight between the poles of a powerful magnet". University of Wisconsin-Madison Chemistry Department Demonstration lab. Diarsipkan dari versi asli tanggal 2007-12-17. Diakses tanggal 2007-12-15.
- ^ Krieger-Liszkay 2005, 337-46
- ^ Harrison 1990
- ^ Wentworth 2002
- ^ Hirayama 1994, 149-150
- ^ Chieh, Chung. "Bond Lengths and Energies". University of Waterloo. Diarsipkan dari versi asli tanggal 2007-12-14. Diakses tanggal 2007-12-16.
- ^ a b Stwertka 1998, p.48
- ^ Stwertka 1998, p.49
- ^ a b Cacace 2001, 4062
- ^ a b Ball, Phillip (2001-09-16). "New form of oxygen found". Nature News. Diarsipkan dari versi asli tanggal 2013-10-21. Diakses tanggal 2008-01-09.
- ^ Lundegaard 2006, 201–04
- ^ Desgreniers 1990, 1117–22
- ^ Shimizu 1998, 767–69
- ^ "Air solubility in water". The Engineering Toolbox. Diarsipkan dari versi asli tanggal 2019-04-04. Diakses tanggal 2007-12-21.
- ^ Evans & Claiborne 2006, 88
- ^ Lide 2003, Section 4
- ^ "Overview of Cryogenic Air Separation and Liquefier Systems". Universal Industrial Gases, Inc. Diarsipkan dari versi asli tanggal 2018-10-21. Diakses tanggal 2007-12-15.
- ^ "Liquid Oxygen Material Safety Data Sheet" (PDF). Matheson Tri Gas. Diarsipkan dari versi asli (PDF) tanggal 2008-02-27. Diakses tanggal 2007-12-15.
- ^ Krupenie, Paul H. (1972). "The Spectrum of Molecular Oxygen". Journal of Physical and Chemical Reference Data. 1 (2): 423–534. Bibcode:1972JPCRD...1..423K. doi:10.1063/1.3253101. Diarsipkan dari versi asli tanggal 2021-10-01. Diakses tanggal 2020-09-12.
- ^ Guy P. Brasseur; Susan Solomon (January 15, 2006). Aeronomy of the Middle Atmosphere: Chemistry and Physics of the Stratosphere and Mesosphere. Springer Science & Business Media. hlm. 220–. ISBN 978-1-4020-3824-2. Diarsipkan dari versi asli tanggal 2023-01-16. Diakses tanggal 2020-09-12.
- ^ Kearns, David R. (1971). "Physical and chemical properties of singlet molecular oxygen". Chemical Reviews. 71 (4): 395–427. doi:10.1021/cr60272a004.
- ^ a b c d e "Oxygen Nuclides / Isotopes". EnvironmentalChemistry.com. Diarsipkan dari versi asli tanggal 2020-08-18. Diakses tanggal 2007-12-17.
- ^ a b c Meyer 2005, 9022
- ^ Croswell, Ken (February 1996). Alchemy of the Heavens. Anchor. ISBN 978-0-385-47214-2. Diarsipkan dari versi asli tanggal 2019-06-08. Diakses tanggal 2020-09-21.
- ^ a b c d Emsley 2001, p.298
- ^ From The Chemistry and Fertility of Sea Waters by H.W. Harvey, 1955, citing C.J.J. Fox, "On the coefficients of absorption of atmospheric gases in sea water", Publ. Circ. Cons. Explor. Mer, no. 41, 1907. Harvey however notes that according to later articles in Nature the values appear to be about 3% too high.
- ^ Emsley 2001, p.301
- ^ a b Emsley 2001, p.304
- ^ Hand, Eric (March 13, 2008). "The Solar System's first breath". Nature. 452 (7185): 259. Bibcode:2008Natur.452..259H. doi:10.1038/452259a. PMID 18354437.
- ^ Miller, J. R.; Berger, M.; Alonso, L.; Cerovic, Z.; et al. Progress on the development of an integrated canopy fluorescence model. Geoscience and Remote Sensing Symposium, 2003. IGARSS '03. Proceedings. 2003 IEEE International. doi:10.1109/IGARSS.2003.1293855.
- ^ Fenical 1983, "Marine Plants"
- ^ Brown 2003, 958
- ^ a b Raven 2005, 115–27
- ^ CO2 dilepaskan di bagian lain hemoglobin (lihat efek Bohr)
- ^ ""Untuk manusia, volume normal adalah 6-8 liter per menit."". Diarsipkan dari versi asli tanggal 2012-09-14. Diakses tanggal 2009-03-20.
- ^ a b c d Derived from mmHg values using 0.133322 kPa/mmHg
- ^ a b Normal Reference Range Table from The University of Texas Southwestern Medical Center at Dallas. Used in Interactive Case Study Companion to Pathologic basis of disease.
- ^ a b The Medical Education Division of the Brookside Associates--> ABG (Arterial Blood Gas) Retrieved on December 6, 2009
- ^ Charles Henrickson (2005). Chemistry. Cliffs Notes. ISBN 978-0-7645-7419-1.
- ^ Campbell 2005, 522–23
- ^ Freeman 2005, 214, 586
- ^ a b Berner 1999, 10955–57
- ^ Christopher J. Poulsen, Clay Tabor, Joseph D. White (2015). "Long-term climate forcing by atmospheric oxygen concentrations". Science. 348 (6240): 1238–1241. Bibcode:2015Sci...348.1238P. doi:10.1126/science.1260670. PMID 26068848. Diarsipkan dari versi asli tanggal 2017-07-13. Diakses tanggal 2020-09-23.
- ^ Dole 1965, 5–27
- ^ a b c d e Emsley 2001, p. 300
- ^ "Non-Cryogenic Air Separation Processes". UIG Inc. 2003. Diarsipkan dari versi asli tanggal 2018-10-03. Diakses tanggal December 16, 2007.
- ^ a b c Emsley 2001, p.301
- ^ a b Cook & Lauer 1968, p.510
- ^ Sim MA; Dean P; Kinsella J; Black R; et al. (2008). "Performance of oxygen delivery devices when the breathing pattern of respiratory failure is simulated". Anaesthesia. 63 (9): 938–40. doi:10.1111/j.1365-2044.2008.05536.x. PMID 18540928.
- ^ Stephenson RN; Mackenzie I; Watt SJ; Ross JA (1996). "Measurement of oxygen concentration in delivery systems used for hyperbaric oxygen therapy". Undersea Hyperb Med. 23 (3): 185–8. PMID 8931286. Diarsipkan dari versi asli tanggal 2011-08-11. Diakses tanggal September 22, 2008.
- ^ Undersea and Hyperbaric Medical Society. "Indications for hyperbaric oxygen therapy". Diarsipkan dari versi asli tanggal September 12, 2008. Diakses tanggal September 22, 2008.
- ^ a b Undersea and Hyperbaric Medical Society. "Carbon Monoxide". Diarsipkan dari versi asli tanggal July 25, 2008. Diakses tanggal September 22, 2008.
- ^ a b Piantadosi CA (2004). "Carbon monoxide poisoning". Undersea Hyperb Med. 31 (1): 167–77. PMID 15233173. Diarsipkan dari versi asli tanggal 2011-02-03. Diakses tanggal September 22, 2008.
- ^ Undersea and Hyperbaric Medical Society. "Decompression Sickness or Illness and Arterial Gas Embolism". Diarsipkan dari versi asli tanggal July 5, 2008. Diakses tanggal September 22, 2008.
- ^ Acott, C. (1999). "A brief history of diving and decompression illness". South Pacific Underwater Medicine Society Journal. 29 (2). Diarsipkan dari versi asli tanggal 2011-09-05. Diakses tanggal September 22, 2008.
- ^ Longphre, JM; Denoble, PJ; Moon, RE; Vann, RD; Freiberger, JJ (2007). "First aid normobaric oxygen for the treatment of recreational diving injuries" (PDF). Undersea & Hyperbaric Medicine. 34 (1): 43–49. PMID 17393938. Diarsipkan dari versi asli (PDF) tanggal 2018-10-01. Diakses tanggal 2020-09-26 – via Rubicon Research Repository.
- ^ "Emergency Oxygen for Scuba Diving Injuries". Divers Alert Network. Diarsipkan dari versi asli tanggal 2020-04-20. Diakses tanggal October 1, 2018.
- ^ "Oxygen First Aid for Scuba Diving Injuries". Divers Alert Network Europe. Diarsipkan dari versi asli tanggal 2020-06-10. Diakses tanggal October 1, 2018.
- ^ a b Morgenthaler GW; Fester DA; Cooley CG (1994). "As assessment of habitat pressure, oxygen fraction, and EVA suit design for space operations". Acta Astronautica. 32 (1): 39–49. Bibcode:1994AcAau..32...39M. doi:10.1016/0094-5765(94)90146-5. PMID 11541018.
- ^ Webb JT; Olson RM; Krutz RW; Dixon G; Barnicott PT (1989). "Human tolerance to 100% oxygen at 9.5 psia during five daily simulated 8-hour EVA exposures". Aviat Space Environ Med. 60 (5): 415–21. doi:10.4271/881071. PMID 2730484.
- ^ a b c Acott, C. (1999). "Oxygen toxicity: A brief history of oxygen in diving". South Pacific Underwater Medicine Society Journal. 29 (3). Diarsipkan dari versi asli tanggal 2010-12-25. Diakses tanggal September 21, 2008.
- ^ Longphre, J. M.; Denoble, P. J.; Moon, R. E.; Vann, R. D.; et al. (2007). "First aid normobaric oxygen for the treatment of recreational diving injuries". Undersea Hyperb. Med. 34 (1): 43–49. PMID 17393938. Diarsipkan dari versi asli tanggal June 13, 2008. Diakses tanggal September 21, 2008.
- ^ a b Bren, Linda (November–December 2002). "Oxygen Bars: Is a Breath of Fresh Air Worth It?". FDA Consumer Magazine. U.S. Food and Drug Administration. 36 (6): 9–11. PMID 12523293. Diarsipkan dari versi asli tanggal October 18, 2007. Diakses tanggal December 23, 2007.
- ^ "Ergogenic Aids". Peak Performance Online. Diarsipkan dari versi asli tanggal September 28, 2007. Diakses tanggal January 4, 2008.
- ^ "George Goble's extended home page (mirror)". Diarsipkan dari versi asli tanggal February 11, 2009. Diakses tanggal March 14, 2008.
- ^ a b c d Kesalahan pengutipan: Tag
<ref>tidak sah; tidak ditemukan teks untuk ref bernamaNBB3014 - ^ Guseinova, E. A.; Adzhamov, K. Yu.; Safarova, S. R. (1 April 2020). "Kinetic parameters of the formation of oxygen-containing compounds in the vacuum gas oil oxycracking process". Reaction Kinetics, Mechanisms and Catalysis (dalam bahasa Inggris). 129 (2): 925–939. doi:10.1007/s11144-020-01725-8. ISSN 1878-5204.
- ^ Hävecker, Michael; Wrabetz, Sabine; Kröhnert, Jutta; Csepei, Lenard-Istvan; Naumann d'Alnoncourt, Raoul; Kolen'Ko, Yury V.; Girgsdies, Frank; Schlögl, Robert; Trunschke, Annette (2012). "Surface chemistry of phase-pure M1 MoVTeNb oxide during operation in selective oxidation of propane to acrylic acid". J. Catal. 285: 48–60. doi:10.1016/j.jcat.2011.09.012. hdl:11858/00-001M-0000-0012-1BEB-F
 . Diarsipkan dari versi asli tanggal 2020-07-13. Diakses tanggal 2020-10-01.
. Diarsipkan dari versi asli tanggal 2020-07-13. Diakses tanggal 2020-10-01.
- ^ Rodikova, Yulia; Zhizhina, Elena (1 June 2020). "Catalytic oxidation of 5-hydroxymethylfurfural into 2,5-diformylfuran using V-containing heteropoly acid catalysts". Reaction Kinetics, Mechanisms and Catalysis (dalam bahasa Inggris). 130 (1): 403–415. doi:10.1007/s11144-020-01782-z. ISSN 1878-5204.
- ^ Amakawa, Kazuhiko; Kolen'Ko, Yury V.; Villa, Alberto; Schuster, Manfred E/; Csepei, Lénárd-István; Weinberg, Gisela; Wrabetz, Sabine; Naumann d'Alnoncourt, Raoul; Girgsdies, Frank; Prati, Laura; Schlögl, Robert; Trunschke, Annette (2013). "Multifunctionality of Crystalline MoV(TeNb) M1 Oxide Catalysts in Selective Oxidation of Propane and Benzyl Alcohol". ACS Catal. 3 (6): 1103–1113. doi:10.1021/cs400010q. Diarsipkan dari versi asli tanggal 2018-10-22. Diakses tanggal 2020-10-01.
- ^ "Salinan arsip". Diarsipkan dari versi asli tanggal 2020-06-13. Diakses tanggal 2023-01-02.
- ^ Elizalde-Martínez, I.; Ramírez-López, R.; Mederos-Nieto, F. S.; Monterrubio-Badillo, M. C.; Vázquez Medina, R.; Manríquez-Ramírez, M. E. (1 October 2019). "Optimization of O2/CH4 to oxide methane at 823 K by alumina-ceria supported Pt catalysts". Reaction Kinetics, Mechanisms and Catalysis (dalam bahasa Inggris). 128 (1): 149–161. doi:10.1007/s11144-019-01641-6. ISSN 1878-5204.
- ^ Todorova, Silviya; Barbov, Borislav; Todorova, Totka; Kolev, Hristo; Ivanova, Ivanka; Shopska, Maya; Kalvachev, Yuri (1 April 2020). "CO oxidation over Pt-modified fly ash zeolite X". Reaction Kinetics, Mechanisms and Catalysis (dalam bahasa Inggris). 129 (2): 773–786. doi:10.1007/s11144-020-01730-x. ISSN 1878-5204.
- ^ Cook & Lauer 1968, p.508
- ^ Greenwood & Earnshaw 1997, 28
- ^ IUPAC: Red Book. p. 73 and 320.
- ^ Maksyutenko et al. 2006
- ^ Chaplin, Martin (2008-01-04). "Water Hydrogen Bonding". Diarsipkan dari versi asli tanggal 2007-10-10. Diakses tanggal 2008-01-06.
- ^ Smart 2005, 214
- ^ a b Cook & Lauer 1968, p.507
- ^ Crabtree, R. (2001). The Organometallic Chemistry of the Transition Metals (edisi ke-3rd). John Wiley & Sons. hlm. 152. ISBN 978-0-471-18423-2.
- ^ Cook & Lauer 1968, p.505
- ^ Cook & Lauer 1968, p.506
- ^ "NFPA 704 ratings and id numbers for common hazardous materials" (PDF). Riverside County Department of Environmental Health. Diarsipkan dari versi asli (PDF) tanggal 2019-07-11. Diakses tanggal August 22, 2017.
- ^ Dharmeshkumar N Patel; Ashish Goel; SB Agarwal; Praveenkumar Garg; et al. (2003). "Oxygen Toxicity" (PDF). Indian Academy of Clinical Medicine. 4 (3): 234. Diarsipkan dari versi asli (PDF) tanggal 2015-09-22. Diakses tanggal 2020-10-05.
- ^ Cook & Lauer 1968, p.511
- ^ a b c Emsley 2001, p.299
- ^ Wade, Mark (2007). "Space Suits". Encyclopedia Astronautica. Diarsipkan dari versi asli tanggal December 13, 2007. Diakses tanggal December 16, 2007.
- ^ Martin, Lawrence. "The Four Most Important Equations In Clinical Practice". GlobalRPh. David McAuley. Diarsipkan dari versi asli tanggal 2018-09-05. Diakses tanggal June 19, 2013.
- ^ Kesalahan pengutipan: Tag
<ref>tidak sah; tidak ditemukan teks untuk ref bernamaAcott2 - ^ a b Wilmshurst P (1998). "Diving and oxygen". BMJ. 317 (7164): 996–9. doi:10.1136/bmj.317.7164.996. PMC 1114047
 . PMID 9765173.
. PMID 9765173.
- ^ Donald, Kenneth (1992). Oxygen and the Diver. England: SPA in conjunction with K. Donald. ISBN 978-1-85421-176-7.
- ^ Donald K. W. (1947). "Oxygen Poisoning in Man: Part I". Br Med J. 1 (4506): 667–72. doi:10.1136/bmj.1.4506.667. PMC 2053251
 . PMID 20248086.
. PMID 20248086.
- ^ Donald K. W. (1947). "Oxygen Poisoning in Man: Part II". Br Med J. 1 (4507): 712–7. doi:10.1136/bmj.1.4507.712. PMC 2053400
 . PMID 20248096.
. PMID 20248096.
- ^ Kesalahan pengutipan: Tag
<ref>tidak sah; tidak ditemukan teks untuk ref bernamaWeiss20082 - ^ a b c d Werley, Barry L., ed. (1991). ASTM Technical Professional training. Fire Hazards in Oxygen Systems. Philadelphia: ASTM International Subcommittee G-4.05.
- ^ Schmidt-Rohr, K. (2015). "Why Combustions Are Always Exothermic, Yielding About 418 kJ per Mole of O2". J. Chem. Educ. 92 (12): 2094–2099. Bibcode:2015JChEd..92.2094S. doi:10.1021/acs.jchemed.5b00333
 .
.
- ^ (Report of Apollo 204 Review Board NASA Historical Reference Collection, NASA History Office, NASA HQ, Washington, DC)
- ^ Chiles, James R. (2001). Inviting Disaster: Lessons from the edge of Technology: An inside look at catastrophes and why they happen
 . New York: HarperCollins Publishers Inc. ISBN 978-0-06-662082-4.
. New York: HarperCollins Publishers Inc. ISBN 978-0-06-662082-4.
Daftar pustaka
[sunting | sunting sumber]- Cook, Gerhard A.; Lauer, Carol M. (1968). "Oxygen". Dalam Clifford A. Hampel. The Encyclopedia of the Chemical Elements. New York: Reinhold Book Corporation. hlm. 499–512. LCCN 68-29938.
- Emsley, John (2001). "Oxygen". Nature's Building Blocks: An A-Z Guide to the Elements. Oxford, England: Oxford University Press. hlm. 297–304. ISBN 978-0-19-850340-8.
- Raven, Peter H.; Evert, Ray F.; Eichhorn, Susan E. (2005). Biology of Plants (edisi ke-7th). New York: W.H. Freeman and Company Publishers. hlm. 115–27. ISBN 978-0-7167-1007-3.
| (besar) | |||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | ||||||||||||||||
| 1 | H | He | |||||||||||||||||||||||||||||||
| 2 | Li | Be | B | C | N | O | F | Ne | |||||||||||||||||||||||||
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar | |||||||||||||||||||||||||
| 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | |||||||||||||||
| 5 | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | |||||||||||||||
| 6 | Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | |
| 7 | Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | |
|
| |||||||||||||||||||||||||||||||||



