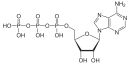Anhidrida asam
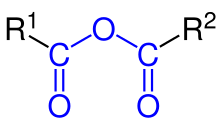
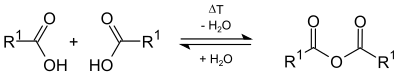
Anhidrida asam merupakan suatu senyawa organik yang memiliki dua gugus asil yang terikat pada atom oksigen yang sama.[1] Jenis anhidrida asam organik yang umum adalah anhidrida karboksilat, di mana asam induknya adalah asam karboksilat, rumus kimia yang umum pada senyawa ini adalah (RC(O))2O. Anhidrida asam simetris pada jenis ini dinamai dengan mengganti kata asam pada nama asam karboksilat induknya dengan kata anhidrida.[2] Karenanya, (CH3CO)2O disebut sebagai anhidrida asetat. Anhidrida asam campuran (atau tidak simetris), seperti anhidrida asetat format (lihat di bawah), juga dikenal.
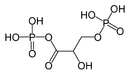
Satu atau kedua gugus asil pada anhidrida asam mungkin juga dapat berasal dari asam organik yang lain, seperti asam sulfonat atau asam fosfonat. Satu gugus asil pada anhidrida asam dapat pula berasal dari asam anorganik seperti asam fosfat. Anhidrida campuran 1,3-bisfosfogliserat merupakan suatu zat antara pada pembentukan ATP melalui glikolisis,[3] adalah suatu anhidrida campuran antara asam 3-fosfogliserat dan asam fosfat. Oksida asam juga terkadang dikelompokkan sebagai suatu anhidrida asam.
Preparasi[sunting | sunting sumber]
Anhidrida asam dipreparasi dalam industri dengan berbagai cara. Anhidrida asetat utamanya diproduksi melalui karbonilasi metil asetat.[4] Anhidrida maleat diproduksi melalui oksidasi benzena atau butana. Rute laboratorium menyarankan reaksi dehidrasi pada asam yang bersangkutan.
Kondisi yang digunakan beragam tergantung pada asam yang digunakan, namun fosfor pentoksida merupakan agen pendehidrasi yang umum digunakan:
- 2 CH3COOH + P4O10 → CH3C(O)OC(O)CH3 + "P4O9(OH)2"
Klorida asam juga merupakan prekursor yang efektif:[5]
- CH3C(O)Cl + HCO2Na → HCO2COCH3 + NaCl
Anhidrida campuran yang mengandung gugus asetil dapat dipreparasi menggunakan ketena:
Reaksi[sunting | sunting sumber]
Anhidrida asam merupan sumber bagi gugus asil yang reaktif, dan reaksi serta penggunaannya mirip dengan asil halida. Dalam reaksi dengan substrat protik, reaksi tersebut membutuhkan produk asilasi dan asam karboksilat dengan jumlah yang sama:
- RC(O)OC(O)R + HY → RC(O)Y + RCO2H
untuk HY = HOR (alkohol), HNR'2 (amonia, amina primer, sekunder), cincin aromatik (lihat asilasi Friedel-Crafts).
Anhidrida asam cenderung kurang elektrofilik dibandingkan dengan asil klorida, dan hanya satu gugus asil yang dipindahkan per molekul anhidrida asam, mengarahkannya pada efisiensi atom yang rendah. Biaya yang rendah, namun, pada anhidrida asetat membuatnya pilihan utama pada reaksi asetilasi.
Aplikasi[sunting | sunting sumber]
- Ilustrasi anhidrida asam
-
Anhidrida asetat diproduksi ada skala besar untuk berbagai aplikasi.
-
Anhidrida naftalentetrakarboksilat, sebuah blok pembangun pada senyawa organik kompleks, adalah contoh dari suatu dianhidrida.
-
Anhidrida maleat adalah suatu anhidrida siklik, umum digunakan pada industri pelapis.
-
"Anhidrida campuran" 1,3-bisfosfogliserat (dalam bentuk terprotonasi) terdapat secara luas dalam jalur metabolisme.
-
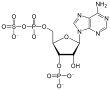
3'-fosfoadenosin-5'-fosfosulfat (PAPS) adalah suatu anhidrida campuran dari asam sulfat dan asam fosfat serta merupakan koenzim yang paling umum dalam reaksi transfer sulfat biologis.
Anhidrida asetat adalah suatu zat kimia industri utama yang banyak digunakan untuk preparasi ester asetat, seperti selulosa asetat. Anhidrida maleat adalah prekursor bagi berbagai resin melalui kopolimerisasi dengan stirena. Anhidrida maleat merupakan suatu dienofil dalam reaksi Diels-Alder.[6]
Dianhidrida, molekul yang mengandung dua anhidrida fungsional, digunakan untuk mensintesis poliimida dan terkadang poliester dan poliamida. Berbagai contoh dianhidrida diantaranya seperti pyromellitic dianhydride (PMDA), 3,3’, 4,4’ - oxydiphtalic dianhydride (ODPA), 3,3’, 4,4’-benzophenone tetracarboxylic dianhydride (BTDA), 4,4’-diphtalic (hexafluoroisopropylidene) anhydride (6FDA), dianhidrida benzokuinontetrakarboksilat, dianhidrida etilentetrakarboksilat. Polianhidrida adalah suatu kelas polimer yang dicirikan oleh ikatan anhidrida yang menghungkan satuan berulang pada rantai tulang punggung polimer tersebut.
Lihat pula[sunting | sunting sumber]
Referensi[sunting | sunting sumber]
- ^ IUPAC, Compendium of Chemical Terminology, edisi ke-2 ("Buku Emas") (1997). Versi koreksi daring: (2006–) "acid anhydrides".
- ^ Panico R, Powell WH, Richer JC, ed. (1993). "Recommendation R-5.7.7". A Guide to IUPAC Nomenclature of Organic Compounds. IUPAC/Blackwell Science. hlm. 123–25. ISBN 0-632-03488-2.
- ^ Nelson, D. L.; Cox, M. M. "Lehninger, Principles of Biochemistry" 3rd Ed. Worth Publishing: New York, 2000. ISBN 1-57259-153-6.
- ^ Zoeller, J. R.; Agreda, V. H.; Cook, S. L.; Lafferty, N. L.; Polichnowski, S. W.; Pond, D. M. "Eastman Chemical Company Acetic Anhydride Process" Catalysis Today (1992), volume 13, pp.73-91. DOI:10.1016/0920-5861(92)80188-S
- ^ Lewis I. Krimen (1988). "Acetic Formic Anhydride". Org. Synth.; Coll. Vol. 6: 8.
- ^ Heimo Held, Alfred Rengstl, Dieter Mayer "Acetic Anhydride and Mixed Fatty Acid Anhydrides" Ullmann's Encyclopedia of Industrial Chemistry 2002, Wiley-VCH, Weinheim. doi:10.1002/14356007.a01_065