Natrium
11Na Natrium | |||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 Logam natrium murni | |||||||||||||||||||||
Garis spektrum natrium | |||||||||||||||||||||
| Sifat umum | |||||||||||||||||||||
| Pengucapan | /natrium/[1] | ||||||||||||||||||||
| Penampilan | metalik putih keperakan | ||||||||||||||||||||
| Natrium dalam tabel periodik | |||||||||||||||||||||
| |||||||||||||||||||||
| Nomor atom (Z) | 11 | ||||||||||||||||||||
| Golongan | golongan 1 (logam alkali) | ||||||||||||||||||||
| Periode | periode 3 | ||||||||||||||||||||
| Blok | blok-s | ||||||||||||||||||||
| Kategori unsur | logam alkali | ||||||||||||||||||||
| Berat atom standar (Ar) |
| ||||||||||||||||||||
| Konfigurasi elektron | [Ne] 3s1 | ||||||||||||||||||||
| Elektron per kelopak | 2,8,1 | ||||||||||||||||||||
| Sifat fisik | |||||||||||||||||||||
| Fase pada STS (0 °C dan 101,325 kPa) | padat | ||||||||||||||||||||
| Titik lebur | 370,944 K (97,794 °C, 208,029 °F) | ||||||||||||||||||||
| Titik didih | 1156,090 K (882,940 °C, 1621,292 °F) | ||||||||||||||||||||
| Kepadatan mendekati s.k. | 0,968 g/cm3 | ||||||||||||||||||||
| saat cair, pada t.l. | 0,927 g/cm3 | ||||||||||||||||||||
| Titik kritis | 2573 K, 35 MPa (diekstrapolasi) | ||||||||||||||||||||
| Kalor peleburan | 2,60 kJ/mol | ||||||||||||||||||||
| Kalor penguapan | 97,42 kJ/mol | ||||||||||||||||||||
| Kapasitas kalor molar | 28,230 J/(mol·K) | ||||||||||||||||||||
Tekanan uap
| |||||||||||||||||||||
| Sifat atom | |||||||||||||||||||||
| Bilangan oksidasi | −1, +1 (oksida basa kuat) | ||||||||||||||||||||
| Elektronegativitas | Skala Pauling: 0,93 | ||||||||||||||||||||
| Energi ionisasi | ke-1: 495,8 kJ/mol ke-2: 4562 kJ/mol ke-3: 6910,3 kJ/mol (artikel) | ||||||||||||||||||||
| Jari-jari atom | empiris: 186 pm | ||||||||||||||||||||
| Jari-jari kovalen | 166±9 pm | ||||||||||||||||||||
| Jari-jari van der Waals | 227 pm | ||||||||||||||||||||
| Lain-lain | |||||||||||||||||||||
| Kelimpahan alami | primordial | ||||||||||||||||||||
| Struktur kristal | kubus berpusat badan (bcc) | ||||||||||||||||||||
| Kecepatan suara batang ringan | 3200 m/s (suhu 20 °C) | ||||||||||||||||||||
| Ekspansi kalor | 71 µm/(m·K) (suhu 25 °C) | ||||||||||||||||||||
| Konduktivitas termal | 142 W/(m·K) | ||||||||||||||||||||
| Resistivitas listrik | 47,7 nΩ·m (suhu 20 °C) | ||||||||||||||||||||
| Arah magnet | paramagnetik[2] | ||||||||||||||||||||
| Suseptibilitas magnetik molar | +16,0×10−6 cm3/mol (298 K)[3] | ||||||||||||||||||||
| Modulus Young | 10 GPa | ||||||||||||||||||||
| Modulus Shear | 3,3 GPa | ||||||||||||||||||||
| Modulus curah | 6,3 GPa | ||||||||||||||||||||
| Skala Mohs | 0,5 | ||||||||||||||||||||
| Skala Brinell | 0,69 MPa | ||||||||||||||||||||
| Nomor CAS | 7440-23-5 | ||||||||||||||||||||
| Sejarah | |||||||||||||||||||||
| Penamaan | dari Jerman Natron, 'natron' | ||||||||||||||||||||
| Penemuan | H. Davy (1807) | ||||||||||||||||||||
| Isolasi pertama | H. Davy (1807) | ||||||||||||||||||||
| Isotop natrium yang utama | |||||||||||||||||||||
| |||||||||||||||||||||
Natrium, yang juga disebut sodium, adalah unsur kimia dengan lambang Na dan nomor atom 11. Natrium merupakan logam lunak, putih keperakan, dan sangat reaktif. Natrium termasuk dalam logam alkali, berada pada golongan 1 tabel periodik, karena memiliki satu elektron di kulit terluarnya yang mudah disumbangkannya, menciptakan atom bermuatan positif—kation Na+. Satu-satunya isotop stabil adalah 23Na. Logam bebasnya tidak terdapat di alam, tapi harus dibuat dari senyawanya. Natrium adalah unsur keenam paling melimpah dalam kerak bumi, dan terdapat di banyak mineral seperti feldspar, sodalit dan halit (garam batu, NaCl). Banyak garam natrium sangat larut dalam air: ion natrium telah dilindi oleh aksi air dari mineral Bumi selama ribuan tahun, dan dengan demikian natrium Dan klorin adalah unsur terlarut yang paling umum terjadi di lautan (berdasarkan berat).
Natrium pertama kali diisolasi oleh Humphry Davy pada tahun 1807 melalui elektrolisis natrium hidroksida. Di antara banyak senyawa natrium lain yang berguna, natrium hidroksida (lindi, bahasa Inggris: lye) digunakan dalam pembuatan sabun, dan natrium klorida (garam dapur) adalah zat pencair es dan nutrisi untuk hewan termasuk manusia.
Natrium adalah unsur esensial untuk semua hewan dan beberapa tumbuhan. Ion natrium adalah kation utama pada cairan ekstraselular (extracellular fluid, ECF) dan karena itu merupakan penyumbang utama tekanan osmotik ECF dan volume kompartemen ECF. Hilangnya air dari kompartemen ECF meningkatkan konsentrasi natrium, suatu kondisi yang disebut hipernatremia. Kehilangan isotonik air dan natrium dari kompartemen ECF mengurangi ukuran kompartemen tersebut dalam kondisi yang disebut hipovolemia ECF.
Dengan cara pompa natrium-kalium, sel manusia hidup memompa tiga ion natrium keluar dari sel sebagai ganti dua ion kalium yang dipompa masuk; membandingkan konsentrasi ion yang melintasi membran sel, dari dalam ke luar, kalium sekitar 40:1, dan natrium, sekitar 1:10. Pada sel saraf, muatan listrik melintasi membran sel sehingga memungkinkan transmisi impuls saraf—sebuah aksi potensial—ketika muatan itu dihamburkan; natrium memainkan peran penting dalam aktivitas itu.
Karakteristik
[sunting | sunting sumber]Fisika
[sunting | sunting sumber]
Natrium pada suhu dan tekanan standar adalah logam lunak keperakan yang jika bereaksi dengan oksigen di udara dan membentuk natrium oksida berwarna putih keabu-abun kecuali direndam dalam minyak atau gas inert, yang merupakan kondisi penyimpanan umumnya. Logam natrium dapat dengan mudah dipotong menggunakan pisau dan merupakan konduktor listrik dan panas yang baik, karena hanya memiliki satu elektron pada kelopak valensinya, sehingga menghasilkan ikatan logam dan elektron bebas yang lemah, yang membawa energi. Akibat massa atomnya yang rendah dan jari-jari atomnya yang panjang, natrium adalah unsur logam dengan densitas paling rendah ke-3 di antara seluruh logam dan salah satu dari tiga logam yang dapat terapung di air, dua lainnya adalah litium dan kalium.[4] Titik lebur (98 °C) dan didih (883 °C) natrium lebih rendah daripada litium tetapi lebih tinggi daripada logam alkali yang lebih berat (kalium, rubidium, dan sesium), mengikuti tren periodik sepanjang golongan dari atas ke bawah.[5] Sifat ini berubah secara dramatis pada kenaikan tekanan: pada 1,5 Mbar, warna berubah dari keperakan menjadi hitam; pada 1,9 Mbar menjadi transparan dengan warna merah; dan pada 3 Mbar, natrium berupa padatan jernih dan transparan. Semua alotropi tekanan tinggi ini bersifat isolator dan elektrida.[6]

Dalam uji nyala api, natrium dan senyawanya menghasilkan warna kuning[7] karena elektron 3s natrium yang tereksitasi memancarkan foton ketika mereka kembali dari 3p ke 3s; panjang gelombang foton ini berada pada garis D sekitar 589,3 nm. interaksi spin–orbit yang melibatkan elektron pada orbital 3p memecah garis D menjadi dua, pada 589,0 dan 589,6 nm; struktur hiperhalus yang melibatkan kedua orbital menyebabkan garis lebih banyak.[8]
Isotop
[sunting | sunting sumber]Ada dua puluh isotop natrium yang diketahui, namun hanya 23Na yang stabil. 23Na dibuat dalam proses pembakaran karbon dalam bintang-bintang melalui peleburan dua atom karbon bersama-sama; ini memerlukan suhu di atas 600 megakelvin dan sebuah bintang bermassa sekurang-kurangnya tiga kali massa matahari.[9] Dua isotop kosmogenik, radioaktif adalah produk sampingan dari spalasi sinar kosmis: 22Na dengan waktu paruh 2,6 tahun dan 24Na, waktu paruh 15 jam; semua isotop lainnya memiliki waktu paruh kurang dari satu menit.[10] Dua isomer nuklir telah ditemukan, yang memiliki umur terpanjang adalah 24mNa dengan waktu paruh sekitar 20,2 milidetik. Radiasi neutron akut, seperti dari kecelakaan kegentingan, mengubah beberapa 23Na yang stabil dalam darah manusia menjadi 24Na; dosis radiasi neutron pada korban dapat dihitung dengan mengukur konsentrasi 24Na relatif terhadap 23Na.[11]
Kimia
[sunting | sunting sumber]Atom natrium memiliki 11 elektron, lebih banyak satu daripada konfigurasi gas mulia neon yang sangat stabil. Oleh karena itu, dan katena energi ionisasi pertamanya yang rendah pada 495,8 kJ/mol, atom natrium jauh lebih mudah kehilangan elektron terakhir dan menjadi bermuatan positif daripada mendapatkan satu elektron untuk menjadi bermuatan negatif.[12] Proses ini membutuhkan sangat sedikit energi sehingga natrium mudah teroksidasi dengan melepaskan elektron ke-11nya. Sebaliknya, energi ionisasi kedua sangat tinggi (4562 kJ/mol), karena elektron ke-10 lebih dekat ke inti atom daripada elektron ke-11. Akibatnya, natrium biasanya membentuk senyawa ionik sebagai kation Na+.[13]
Tingkat oksidasi natrium yang paling umum adalah +1. Ia umumnya tidak sereaktif kalium tetapi lebih reaktif daripada litium.[14] Logam natrium adalah reduktor kuat, dengan potensial reduksi standar untuk pasangan Na+/Na adalah −2.71 volt,[15] meskipun kalium dan litium memiliki potensial yang lebih negatif.[16]
Garam dan oksida
[sunting | sunting sumber]
Senyawa natrium memiliki kepentingan komersial yang sangat besar, terutama bagi industri yang memproduksi kaca, kertas, sabun, dan tekstil.[17] Senyawa natrium yang paling penting adalah garam dapur (NaCl), soda abu (Na2CO3), baking soda (NaHCO3), soda api (NaOH), natrium nitrat (NaNO3), di- dan tri-natrium fosfate, natrium tiosulfat (Na2S2O3·5H2O), serta boraks (Na2B4O7·10H2O).[18] Dalam senyawa, natrium biasanya berikatan ionik dengan air dan anion, serta dianggap sebagai sebuah asam Lewis kuat.[19]
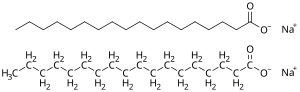
Sebagian besar sabun adalah garam natrium dari asam lemak. Sabun natrium memiliki titik leleh lebih tinggi (dan tampaknya "lebih kuat") daripada sabun kalium.[18]
Seperti semua logam alkali, natrium bereaksi eksotermik dengan air, dan potongan yang cukup besar meleleh dan bisa meledak. Reaksinya menghasilkan soda api (natrium hidroksida) dan gas hidrogen yang mudah terbakar. Ketika terbakar di udara, ia membentuk, terutama, natrium peroksida dan natrium oksida.[20]
Larutan air
[sunting | sunting sumber]Natrium cenderung membentuk senyawa yang larut dalam air, seperti halida, sulfat, nitrat, karboksilat dan karbonat. Spesies akuatik utama adalah kompleks akuo [Na(H2O)n]+, di mana n = 4–8; dengan n = 6 menunjukkan data dari difraksi sinar X dan simulasi komputer.[21]
Presipitasi langsung garam natrium dari larutan akuatik jarang terjadi karena garam natrium biasanya memiliki afinitas tinggi terhadap air; kecuali natrium bismutat (NaBiO3).[22] Oleh karena itu, garam natrium biasanya diisolasi sebagai padatan dengan penguapan atau melalui presipitasi dengan pelarut organik, seperti etanol; sebagai contoh, hanya 0,35 g/L natrium klorida yang akan larut dalam etanol.[23] Eter mahkota, seperti 15-mahkota-5, dapat digunakan sebagai katalis transfer fase.[24]
Kandungan natrium dalam jumlah besar dapat ditentukan dengan perlakuan menggunakan uranil seng asetat sangat berlebih; heksa hidratnya, (UO''";·6H2O mengendap dan dapat ditimbang. Sesium dan rubidium tidak mengganggu reaksi ini, tapi kalium dan litium mengganggu.[25] Konsentrasi natrium yang lebih rendah dapat ditentukan dengan spektrofotometri serapan atom[26] atau dengan potensiometri menggunakan elektrode ion selektif.[27]
Elektrida dan sodida
[sunting | sunting sumber]Seperti logam alkali lainnya, natrium larut dalam amonia dan beberapa amina menghasilkan larutan berwarna; penguapan larutan ini meninggalkan film natrium berkilau metalik. Larutannya mengandung kompleks koordinasi (Na(NH3)6)+, dengan muatan positif yang diimbangi oleh elektrida (elektron sebagai anion); kriptan memungkinkan isolasi kompleks ini sebagai padatan kristal. Natrium membentuk kompleks dengan eter mahkota, kriptan dan ligan lainnya.[28] Contohnya, 15-mahkota-5 memiliki afinitas tinggi terhadap natrium karena ukuran rongga (cavity) 15-mahkota-5 adalah 1,7–2,2 Å, yang cukup pas untuk ion natrium (1,9 Å).[29][30] Kriptan, seperti eter mahkota dan ion ionofor lainnya, juga memiliki afinitas tinggi terhadap ion natrium; derivat alkalida Na− dapat diperoleh[31] dengan adisi kriptan pada larutan natrium dalam amonia melalui disproporsionasi.[32]
Senyawa organonatrium
[sunting | sunting sumber]
Banyak senyawa organonatrium yang telah dibuat. Mereka berperilaku seperti sumber karbanion (garam dengan anion organik), karena polaritas ikatan C-Na yang tinggi. Beberapa derivat yang terkenal termasuk natrium siklopentadienida (NaC5H5) dan tritil natrium ((C6H5)3CNa).[33] Oleh karena kation Na+ berukuran besar dan memiliki kekuatan polarisasi yang sangat rendah, ia dapat menstabilkan radikal anion besar, aromatik, terpolarisasi, seperti pada natrium naftalenida, Na+[C10H8•]−, sebuah reduktor kuat.[34]
Senyawa intermetalik
[sunting | sunting sumber]Natrium membentuk paduan dengan banyak logam, seperti kalium, kalsium, timbal, dan unsur golongan 11 serta 12. Natrium dan kalium membentuk KNa2 dan NaK. NaK adalah kalium 40-90% dan berwujud cair pada suhu ambien. Ia adalah penghantar panas dan listrik yang sangat baik. Paduan natrium-kalsium adalah produk sampingan dari produksi elektrolitik natrium dari campuran garam biner NaCl-CaCl2 dan campuran terner NaCl-CaCl2-BaCl2. Ketercampuran kalsium dengan natrium hanya sebagian. Dalam keadaan cair, natrium bercampur sempurna dengan timbal. Terdapat beberapa metode untuk membuat paduan natrium-timbal. Salah satunya adalah mencairkan keduanya bersama-sama dan yang lainnya adalah mendepositkan natrium secara elektrolitik pada katoda timbal cair. NaPb3, NaPb, Na9Pb4, Na5Pb2, dan Na15Pb4 adalah beberapa paduan natrium-timbal yang diketahui. Natrium juga membentuk paduan dengan emas (NaAu2) dan perak (NaAg2). Logam golongan 12 (seng, kadmium dan raksa diketahui membuat paduan dengan natrium. NaZn13 dan NaCd2 adalah paduan dengan seng dan kadmium. Natrium dan raksa membentuk NaHg, NaHg4, NaHg2, Na3Hg2, dan Na3Hg.[35]
Sejarah
[sunting | sunting sumber]Oleh karena pentingnya dalam metabolisme manusia, garam telah lama menjadi komoditas penting, seperti yang ditunjukkan oleh kata bahasa Inggris salary (bahasa Indonesia: gaji), yang berasal dari salarium, wafer garam (garam bata) kadang diberikan kepada tentara Romawi bersamaan dengan upah mereka lainnya. Di Eropa abad pertengahan, senyawa natrium dengan nama Latin sodanum digunakan sebagai obat sakit kepala. Nama soda diperkirakan berasal dari bahasa Arab suda, yang berarti sakit kepala, karena sifat natrium karbonat atau soda yang dapat mengurangi sakit kepala sudah dikenal sejak awal.[36] Meskipun natrium, kadang-kadang disebut soda, telah lama dikenal dalam senyawanya, logam itu sendiri baru diisolasi pada tahu 1807 oleh Sir Humphry Davy melalui elektrolisis natrium hidroksida.[37][38] Pada tahun 1809, fisikawan sekaligus kimiawan Jerman Ludwig Wilhelm Gilbert mengusulkan nama Natronium untuk "natrium" temuan Humphry Davy dan Kalium untuk "kalium" temuan Davy.[39] Singkatan kimia untuk natrium pertama kali diterbitkan pada tahun 1814 oleh Jöns Jakob Berzelius dalam sistem simbol atomnya,[40][41] dan merupakan singkatan dari nama unsur Neo Latin natrium, yang mengacu pada bahasa Mesir natron,[36] garam mineral alami yang kandungan utamanya adalah natrium karbonat terhidrasi. Natron secara historis memiliki beberapa keperluan industri dan rumah tangga yang penting, kemudian digantikan oleh senyawa natrium lainnya.[42]
Natrium memberi warna kuning yang kuat pada nyala api. Pada awal 1860, Kirchhoff dan Bunsen mencatat sensitivitas natrium yang tinggi terhadap uji nyala api, dan dinyatakan dalam Annalen der Physik und Chemie:[43]
Di sudut terjauh dari aparatus di dalam kamar 60 m3 kami, kami meledakkan 3 mg natrium klorat dengan gula susu sambil mengamati nyala api yang tidak bercahaya dari balik celah. Setelah beberapa saat, ia bersinar kuning cerah dan menunjukkan garis natrium kuat yang hilang hanya setelah 10 menit. Dari berat garam natrium dan volume udara di dalam ruangan, kita dengan mudah menghitung bahwa satu bagian berat udara tidak boleh mengandung lebih dari 1/20 juta bagian berat natrium.
Keterjadian
[sunting | sunting sumber]Kerak bumi mengandung 2,27% natrium, membuatnya unsur paling melimpah ke-7 di Bumi dan logam paling melimpah ke-5, setelah aluminium, besi, kalsium, dan magnesium, dan sebelum kalium.[44] Estimasi kelimpahan natrium di lautan adalah 1,08×104 miligram per liter.[45] Oleh karena reaktivitasnya yang tinggi, ia tidak pernah dijumpai sebagai unsur murni. Ia dijumpai dalam banyak mineral yang berbeda, beberapa sangat mudah larut, seperti halit dan natron, lainnya kurang mudah larut, seperti amfibol dan zeolit. Ketaklarutan mineral natrium tertentu seperti kriolit dan felspar muncul dari anion polimernya, yang dalam kasus feldspar adalah polisilikat.
Pengamatan astronomi
[sunting | sunting sumber]Dalam medium antarbintang, natrium diidentifikasi melalui garis spektrum D; meskipun ia memiliki suhu penguapan tinggi, kelimpahannya dalam atmosfer planet Merkurius memungkinkannya terdeteksi oleh Potter dan Morgan menggunakan spektroskopi stasiun bumi berresolusi tinggi.[butuh rujukan] Natrium telah terdeteksi dalam sekurang-kurangnya satu komet; para astronom yang menyaksikan Komet Hale-Bopp pada tahun 1997 mengamati ekor natrium yang mengandung atom-atom netral (bukan ion) dan mencapai jarak hingga 50 juta kilometer di belakang kepala.[46]
Produksi komersial
[sunting | sunting sumber]Hanya dapat digunakan untuk aplikasi yang agak khusus, hanya sekitar 100.000 ton logam natrium yang diproduksi setiap tahunnya.[17] Logam natrium pertama kali diproduksi secara komersial pada akhir abad ke-19[47] melalui reduksi karbotermal natrium karbonat pada 1100 °C, sebagai tahap pertama proses Deville untuk produksi aluminium:[48][49][50]
Tingginya kebutuhan aluminium membuat produksi natrium menjadi penting. Setelah diperkenalkannya proses Hall–Héroult untuk produksi aluminium melalui elektrolisis, penangas lelehan garam mengakhiri kebutuhan besar natrium. Proses terkait yang berdasarkan reduksi natrium hidroksida dikembangkan pada tahun 1886.[48]
Produksi komersial natrium saat ini menggunakan metode elektrolisis lelehan natrium klorida, berdasarkan proses yang dipatenkan pada tahun 1924.[51][52] Proses ini dilakukan dalam sel Downs dengan mencampur NaCl dengan kalsium klorida untuk menurunkan titik lebur di bawah 700 °C. Oleh karena kalsium kurang elektropositif daripada natrium, tidak ada kalsium yang akan menumpuk di katode.[53] Metode ini lebih efisien (dari sisi biaya) daripada proses sebelumnya (proses Castner, elektrolisis natrium hidroksida).[54]
Pasar natrium berfluktuasi karena kesulitan dalam penyimpanan dan pengiriman; ia harus disimpan di bawah atmosfer gas lembam kering atau minyak mineral anhidrat untuk mencegah pembentukan lapisan permukaan natrium oksida atau natrium superoksida.[55]
Aplikasi
[sunting | sunting sumber]Meskipun logam natrium memiliki beberapa kegunaan penting, aplikasi utama natrium menggunakan senyawanya; jutaan ton natrium klorida, hidroksida, dan karbonat diproduksi setiap tahunnya. Natrium klorida digunakan secara luas untuk anties dan pencair es dan sebagai pengawet; natrium bikarbonat terutama digunakan untuk memasak. Bersama kalium, banyak obat-obatan penting yang ditambahkan natrium untuk meningkatkan bioavailabilitas; meskipun kalium merupakan ion yang lebih baik dalam banyak kasus, natrium dipilih karena harganya yang murah dan bobot atomnya yang rendah.[56] Natrium hidrida digunakan sebagai basa untuk beragam reaksi (misalnya reaksi aldol) dalam kimia organik, dan sebagai reduktor dalam kimia anorganik.[57]
Logam natrium terutama digunakan untuk produksi natrium borohidrida, natrium azida, indigo, dan trifenilfosfina. Kegunaan yang pernah meluas adalah dalam pembuatan tetraetiltimbal dan logam titanium; tetapi produksi natrium menurun sejak 1970-an karena ditinggalkannya TEL dan adanya metode produksi titanium yang baru.[17] Natrium juga digunakan sebagai logam pemadu, zat pelunak air[58] dan sebagai reduktor untuk logam ketika bahan lain tidak efektif. Perlu diperhatikan bahwa unsur bebas tidak digunakan sebagai zat pengendap, ion di air ditukar dengan ion natrium. Lampu ("uap") plasma natrium sering digunakan untuk penerangan jalan di kota, memancarkan cahaya yang berkisar dari kuning-jingga hingga peach saat tekanan meningkat.[59] Sebagai Na tunggal atau dengan kalium, natrium adalah desikan; ia memberi warna biru kuat dengan benzofenon saat yang dikeringkan kering.[60] Dalam sintesis organik, natrium digunakan dalam berbagai reaksi seperti reduksi Birch, dan uji fusi natrium dilakukan untuk menganalisis senyawa secara kualitatif.[61] Natrium bereaksi dengan alkohol menghasilkan alkoksida, dan bila natrium dilarutkan dalam larutan amonia, ia dapat digunakan untuk mereduksi alkuna menjadi trans-alkena.[62][63]
Pemindahan kalor
[sunting | sunting sumber]
Natrium cair digunakan sebagai fluida perpindahan panas pada beberapa reaktor cepat berpendingin natrium[65] karena memiliki konduktivitas termal yang tinggi dan penyerapan tampang-lintang neutron rendah yang diperlukan untuk mencapai fluks neutron tinggi di dalam reaktor.[66] Titik didih natrium yang tinggi memungkinkan reaktor beroperasi pada tekanan ambien (normal),[66] tetapi kekurangannya meliputi opasitasnya, yang menghambat perawatan visual, dan sifatnya yang mudah meledak.[67] Natrium-24 radioaktif dapat dibuat melalui bombardir neutron selama operasi, menimbulkan bahaya radiasi ringan; radioaktivitas berhenti dalam beberapa hari setelah dikeluarkan dari reaktor.[68] Jika sebuah reaktor perlu sering dimatikan, digunakan NaK; karena NaK adalah cairan pada suhu kamar, pendingin ini tidak memadat di dalam pipa.[69] Dalam kasus ini, piroforisitas kalium memerlukan tindakan pencegahan ekstra untuk mencegah dan mendeteksi kebocoran.[70] Aplikasi perpindahan kalor lainnya adalah katup poppet pada mesin pembakaran internal berkinerja tinggi; batang katup sebagian diisi dengan natrium dan bekerja sebagai pipa kalor untuk mendinginkan katup.[71]
Peran biologis
[sunting | sunting sumber]Pada manusia, natrium adalah mineral penting yang mengatur volume darah, tekanan darah, kesetimbangan osmotik dan pH; persyaratan fisiologis minimum natrium adalah 500 miligram per hari.[72] Natrium klorida adalah sumber utama natrium dalam makanan, dan digunakan sebagai bumbu dan pengawet dalam komoditas seperti pengawet acar dan dendeng; bagi orang Amerika, kebanyakan natrium klorida berasal dari makanan olahan.[73] Sumber natrium lainnya adalah keberadaan alami pada makanan dan bahan tambahan makanan seperti monosodium glutamat (MSG), natrium nitrit, natrium sakarin, soda kue (natrium bikarbonat), dan natrium benzoat.[74]
Kementerian Kesehatan Republik Indonesia menetapkan Angka Kecukupan Gizi natrium adalah adalah 1500 mg per orang per hari,[75] tetapi rata-rata orang Indonesia mengkonsumsi natrium (dari garam saja) sekitar 5300 mg/hari (setara dengan 15 gram garam dengan kadar NaCl 90%); belum termasuk sumber natrium lainnya seperti MSG.[76] Penelitian mengungkapkan bahwa menurunkan asupan natrium hingga 2 g per hari cenderung menurunkan tekanan darah sistolik sekitar dua hingga empat mm Hg.[77] Telah diperkirakan bahwa penurunan asupan natrium sebesar itu akan menurunkan kasus tekanan darah tinggi sebesar 9 hingga 17%.[77]
Tekanan darah tinggi menyebabkan 7,6 juta kematian dini di seluruh dunia setiap tahunnya.[78] (Sebagai catatan, garam mengandung sekitar 39,3% natrium[79]—sisanya adalah klorin dan zat renik lainnya; sehingga 2,3 g natrium setara dengan sekitar 5,9 g, atau 2,7 mL garam—sekitar setengah sendok teh[80][81]). American Heart Association merekomendasikan asupan natrium tidak lebih dari 1,5 g per hari,[82] sesuai dengan Permenkes RI no 75 tahun 2013[75]
Satu studi menemukan bahwa orang dengan atau tanpa hipertensi yang mengekskresikan kurang dari 3 gram natrium per hari dalam urin mereka (dan karena itu mengasup kurang dari 3 g/hari) memiliki risiko kematian, stroke, atau serangan jantung yang lebih tinggi daripada yang mengekskresikan 4 sampai 5 gram per hari. Tingkat 7 g per hari atau lebih pada orang dengan hipertensi dikaitkan dengan kematian dan kejadian kardiovaskular yang lebih tinggi, namun hal ini tidak diketahui kebenarannya untuk orang-orang tanpa hipertensi.[83] US FDA menyatakan bahwa orang dewasa dengan hipertensi dan prahipertensi harus mengurangi asupan harian menjadi 1,5 g.[81]
Sistem renin–angiotensin mengatur jumlah cairan dan konsentrasi natrium dalam tubuh. Pengurangan tekanan darah dan konsentrasi natrium dalam ginjal mengakibatkan produksi renin, yang pada gilirannya menghasilkan aldosteron dan angiotensin, mempertahankan natrium dalam urin. Ketika konsentrasi natrium meningkat, produksi renin menurun, dan konsentrasi natrium kembali normal.[84] Ion natrium (Na+) adalah elektrolit penting dalam fungsi neuron, dan pada osmoregulasi antara sel dan cairan ekstrasel. Hal ini berlaku pada semua hewan oleh Na+/K+-ATPase, transporter aktif yang memompa ion melawan gradien, dan kanal natrium/kalium.[85] Natrium adalah ion logam yang paling lazim dalam cairan ekstrasel.[86]
Tingkat natrium yang sangat rendah atau sangat tinggi pada manusia dikenali dalam dunia kedokteran sebagai hiponatremia dan hipernatremia. Kondisi ini mungkin disebabkan oleh faktor genetik, penuaan, atau muntah atau diare berkepanjangan.[87]
Pada tanaman C4, natrium adalah mikronutrien yang membantu metabolisme, khususnya dalam regenerasi fosfoenolpiruvat dan sintesis klorofil.[88] Pada tanaman lain, ia menggantikan beberapa peran kalium, seperti mempertahankan tekanan turgor dan membantu pembukaan dan penutupan stomata.[89] Kelebihan natrium di dalam tanah dapat membatasi penyerapan air dengan menurunkan potensi air, yang dapat menyebabkan tanaman layu; konsentrasi berlebih pada sitoplasma dapat menyebabkan inhibisi enzim, yang pada gilirannya menyebabkan nekrosis dan klorosis.[90] Sebagai reaksinya, beberapa tanaman telah mengembangkan mekanisme untuk membatasi pengambilan natrium di akar, untuk menyimpannya di dalam sel vakuola, dan membatasi pengangkutan garam dari akar ke daun;[91] kelebihan natrium juga dapat disimpan di jaringan tanaman tua, sehingga membatasi kerusakan pada sel yang baru tumbuh. Halofit telah menyesuaikan diri untuk dapat berkembang di lingkungan yang kaya akan natrium.[91]
Keselamatan dan pencegahan
[sunting | sunting sumber]Natrium membentuk hidrogen yang mudah terbakar dan natrium hidroksida ketika kontak dengan air;[92] jika tertelan dan terkena uap air pada kulit, mata atau membran mukosa dapat menyebabkan luka bakar yang parah.[93][94] Natrium secara spontan meledak dengan adanya oksidator seperti air.[95] Alat pemadam kebakaran berbasis air mempercepat pembakaran natrium; sedangkan yang berbasis karbon dioksida dan bromoklorodifluorometana tidak boleh digunakan pada kebakaran natrium.[94] Kebakaran logam adalah kebakaran Kelas D, namun tidak semua alat pemadam Kelas D dapat digunakan untuk natrium. Bahan pemadam kebakaran yang efektif untuk kebakaran natrium adalah Met-L-X.[94] Zat efektif lainnya termasuk Lith-X, yang memiliki bubuk grafit dan penghambat nyala organofosfat, dan pasir kering.[96] Kebakaran natrium dicegah pada reaktor nuklir dengan mengisolasi natrium dari oksigen dengan melingkupi pipa natrium menggunakan gas lembam.[97] Kebakaran natrium tipe kolam dicegah dengan menggunakan berbagai ukuran perancangan yang disebut sistem tangkapan panci. Mereka mengumpulkan natrium yang bocor ke dalam tangki pemulih kebocoran yang diisolasi dari oksigen.[97]
Lihat juga
[sunting | sunting sumber]Referensi
[sunting | sunting sumber]- ^ (Indonesia) "Natrium". KBBI Daring. Diakses tanggal 17 Juli 2022.
- ^ Magnetic susceptibility of the elements and inorganic compounds, in Lide, D. R., ed. (2005). CRC Handbook of Chemistry and Physics (edisi ke-86). Boca Raton (FL): CRC Press. ISBN 0-8493-0486-5.
- ^ Weast, Robert (1984). CRC, Handbook of Chemistry and Physics. Boca Raton, Florida: Chemical Rubber Company Publishing. hlm. E110. ISBN 0-8493-0464-4.
- ^ Greenwood and Earnshaw, p. 75
- ^ ""Alkali Metals." Science of Everyday Things". Encyclopedia.com. Diakses tanggal 15 October 2016.
- ^ Gatti, M.; Tokatly, I.; Rubio, A. (2010). "Sodium: A Charge-Transfer Insulator at High Pressures". Physical Review Letters. 104 (21): 216404. arXiv:1003.0540
 . Bibcode:2010PhRvL.104u6404G. doi:10.1103/PhysRevLett.104.216404. PMID 20867123.
. Bibcode:2010PhRvL.104u6404G. doi:10.1103/PhysRevLett.104.216404. PMID 20867123.
- ^ Schumann, Walter (5 August 2008). Minerals of the World (edisi ke-2nd). Sterling. hlm. 28. ISBN 978-1-4027-5339-8. OCLC 637302667.
- ^ Citron, M. L.; Gabel, C.; Stroud, C.; Stroud, C. (1977). "Experimental Study of Power Broadening in a Two-Level Atom". Physical Review A. 16 (4): 1507–1512. Bibcode:1977PhRvA..16.1507C. doi:10.1103/PhysRevA.16.1507.
- ^ Denisenkov, P. A.; Ivanov, V. V. (1987). "Sodium Synthesis in Hydrogen Burning Stars". Soviet Astronomy Letters. 13: 214. Bibcode:1987SvAL...13..214D.
- ^ Audi, Georges; Bersillon, O.; Blachot, J.; Wapstra, A. H. (2003). "The NUBASE Evaluation of Nuclear and Decay Properties". Nuclear Physics A. 729: 3–128. Bibcode:2003NuPhA.729....3A. doi:10.1016/j.nuclphysa.2003.11.001.
- ^ Sanders, F. W.; Auxier, J. A. (1962). "Neutron Activation of Sodium in Anthropomorphous Phantoms". HealthPhysics. 8 (4): 371–379. doi:10.1097/00004032-196208000-00005. PMID 14496815.
- ^ Sobrasua Ibim. Biology: Threads of Life. Xlibris Corporation, 2010. hlm. 27. ISBN 1-4535-2068-6.
- ^ Lawrie Ryan; Roger Norris (2014). Cambridge International AS and A Level Chemistry Coursebook (edisi ke-illustrated). Cambridge University Press, 2014. hlm. 36. ISBN 1-107-63845-3.
- ^ De Leon, N. "Reactivity of Alkali Metals". Indiana University Northwest. Diarsipkan dari versi asli tanggal 2018-10-16. Diakses tanggal 2007-12-07.
- ^ Atkins, Peter W.; de Paula, Julio (2002). Physical Chemistry (edisi ke-7th). W. H. Freeman. ISBN 978-0-7167-3539-7. OCLC 3345182.
- ^ Davies, Julian A. (1996). Synthetic Coordination Chemistry: Principles and Practice. World Scientific. hlm. 293. ISBN 978-981-02-2084-6. OCLC 717012347.
- ^ a b c Alfred Klemm, Gabriele Hartmann, Ludwig Lange, "Sodium and Sodium Alloys" in Ullmann's Encyclopedia of Industrial Chemistry 2005, Wiley-VCH, Weinheim. doi:10.1002/14356007.a24_277
- ^ a b Holleman, Arnold F.; Wiberg, Egon; Wiberg, Nils (1985). Lehrbuch der Anorganischen Chemie (dalam bahasa German) (edisi ke-91–100). Walter de Gruyter. hlm. 931–943. ISBN 3-11-007511-3.
- ^ Cowan, James A. (1997). Inorganic Biochemistry: An Introduction. Wiley-VCH. hlm. 7. ISBN 978-0-471-18895-7. OCLC 34515430.
- ^ Greenwoood and Earnshaw, p. 84
- ^ Lincoln, S. F.; Richens, D. T.; Sykes, A. G. (2004). "Metal Aqua Ions". Comprehensive Coordination Chemistry II. hlm. 515. doi:10.1016/B0-08-043748-6/01055-0. ISBN 978-0-08-043748-4.
- ^ Dean, John Aurie; Lange, Norbert Adolph (1998). Lange's Handbook of Chemistry. McGraw-Hill. ISBN 0-07-016384-7.
- ^ Burgess, J. (1978). Metal Ions in Solution. New York: Ellis Horwood. ISBN 0-85312-027-7.
- ^ Starks, Charles M.; Liotta, Charles L.; Halpern, Marc (1994). Phase-Transfer Catalysis: Fundamentals, Applications, and Industrial Perspectives. Chapman & Hall. hlm. 162. ISBN 978-0-412-04071-9. OCLC 28027599.
- ^ Barber, H. H.; Kolthoff, I. M. (1929). "Gravimetric Determination of Sodium by the Uranyl Zinc Acetate Method. Ii. Application in the Presence of Rubidium, Cesium, Potassium, Lithium, Phosphate or Arsenate". J. Am. Chem. Soc. 51 (11): 3233–3237. doi:10.1021/ja01386a008.
- ^ Kingsley, G. R.; Schaffert, R. R. (1954). "Micro-flame Photometric Determination of Sodium, Potassium and Calcium in Serum with Solvents". J. Biol. Chem. 206 (2): 807–15. PMID 13143043.
- ^ Levy, G. B. (1981). "Determination of Sodium with Ion-Selective Electrodes". Clinical Chemistry. 27 (8): 1435–1438. PMID 7273405.
- ^ Ivor L. Simmons (ed.). Applications of the Newer Techniques of Analysis. Springer Science & Business Media, 2012. hlm. 160. ISBN 1-4684-3318-0.
- ^ Xu Hou (ed.). Design, Fabrication, Properties and Applications of Smart and Advanced Materials (edisi ke-illustrated). CRC Press, 2016. hlm. 175. ISBN 1-4987-2249-0.
- ^ Nikos Hadjichristidis; Akira Hirao (ed.). Anionic Polymerization: Principles, Practice, Strength, Consequences and Applications (edisi ke-illustrated). Springer, 2015. hlm. 349. ISBN 4-431-54186-1.
- ^ Dye, J. L.; Ceraso, J. M.; Mei Lok Tak; Barnett, B. L.; Tehan, F. J. (1974). "Crystalline Salt of the Sodium Anion (Na−)". J. Am. Chem. Soc. 96 (2): 608–609. doi:10.1021/ja00809a060.
- ^ Holleman, A. F.; Wiberg, E.; Wiberg, N. (2001). Inorganic Chemistry. Academic Press. ISBN 978-0-12-352651-9. OCLC 48056955.
- ^ (1943) "Triphenylmethylsodium". Org. Synth.; Coll. Vol. 2: 607.
- ^ Greenwood and Earnshaw, p. 111
- ^ Habashi, Fathi. Alloys: Preparation, Properties, Applications. John Wiley & Sons, 2008. hlm. 278–280. ISBN 3-527-61192-4.
- ^ a b Newton, David E. (1999). Baker, Lawrence W., ed. Chemical Elements. ISBN 978-0-7876-2847-5. OCLC 39778687.
- ^ Davy, Humphry (1808). "On some new phenomena of chemical changes produced by electricity, particularly the decomposition of the fixed alkalies, and the exhibition of the new substances which constitute their bases; and on the general nature of alkaline bodies". Philosophical Transactions of the Royal Society of London. 98: 1–44. doi:10.1098/rstl.1808.0001.
- ^ Weeks, Mary Elvira (1932). "The discovery of the elements. IX. Three alkali metals: Potassium, sodium, and lithium". Journal of Chemical Education. 9 (6): 1035. Bibcode:1932JChEd...9.1035W. doi:10.1021/ed009p1035.
- ^ Humphry Davy (1809) "Ueber einige neue Erscheinungen chemischer Veränderungen, welche durch die Electricität bewirkt werden; insbesondere über die Zersetzung der feuerbeständigen Alkalien, die Darstellung der neuen Körper, welche ihre Basen ausmachen, und die Natur der Alkalien überhaupt" (On some new phenomena of chemical changes that are achieved by electricity; particularly the decomposition of flame-resistant alkalis [i.e., alkalies that cannot be reduced to their base metals by flames], the preparation of new substances that constitute their [metallic] bases, and the nature of alkalies generally), Annalen der Physik, 31 (2): 113–175 ; see footnote p. 157. From p. 157: "In unserer deutschen Nomenclatur würde ich die Namen Kalium und Natronium vorschlagen, wenn man nicht lieber bei den von Herrn Erman gebrauchten und von mehreren angenommenen Benennungen Kali-Metalloid and Natron-Metalloid, bis zur völligen Aufklärung der chemischen Natur dieser räthzelhaften Körper bleiben will. Oder vielleicht findet man es noch zweckmässiger fürs Erste zwei Klassen zu machen, Metalle und Metalloide, und in die letztere Kalium und Natronium zu setzen. — Gilbert." (In our German nomenclature, I would suggest the names Kalium and Natronium, if one would not rather continue with the appellations Kali-metalloid and Natron-metalloid which are used by Mr. Erman and accepted by several [people], until the complete clarification of the chemical nature of these puzzling substances. Or perhaps one finds it yet more advisable for the present to create two classes, metals and metalloids, and to place Kalium and Natronium in the latter — Gilbert.)
- ^ J. Jacob Berzelius, Försök, att, genom användandet af den electrokemiska theorien och de kemiska proportionerna, grundlägga ett rent vettenskapligt system för mineralogien [Attempt, by the use of electrochemical theory and chemical proportions, to found a pure scientific system for mineralogy] (Stockholm, Sweden: A. Gadelius, 1814), p. 87.
- ^ van der Krogt, Peter. "Elementymology & Elements Multidict". Diakses tanggal 2007-06-08.
- ^ Andrew Shortland, Lukas Schachner, Ian Freestone, and Michael Tite. "Natron as a flux in the early vitreous materials industry: sources, beginnings and reasons for decline". Journal of Archaeological Science. 33: 521–530. doi:10.1016/j.jas.2005.09.011.
- ^ Kirchhoff, G.; Bunsen, R. (1860). "Chemische Analyse durch Spectralbeobachtungen". Annalen der Physik und Chemie. 186 (6): 161–189. Bibcode:1860AnP...186..161K. doi:10.1002/andp.18601860602.
- ^ Greenwood and Earnshaw, p. 69
- ^ Lide, David R. (2003-06-19). CRC Handbook of Chemistry and Physics, 84th Edition. CRC Handbook (dalam bahasa Inggris). CRC Press. 14: Abundance of Elements in the Earth's Crust and in the Sea. ISBN 978-0-8493-0484-2.
- ^ Cremonese, G; Boehnhardt, H; Crovisier, J; Rauer, H; Fitzsimmons, A; Fulle, M; Licandro, J; Pollacco, D; et al. (1997). "Neutral Sodium from Comet Hale–Bopp: A Third Type of Tail". The Astrophysical Journal Letters. 490 (2): L199–L202. arXiv:astro-ph/9710022
 . Bibcode:1997ApJ...490L.199C. doi:10.1086/311040.
. Bibcode:1997ApJ...490L.199C. doi:10.1086/311040.
- ^ B. Pearson (ed.). Speciality Chemicals: Innovations in industrial synthesis and applications (edisi ke-illustrated). Springer Science & Business Media, 1991. hlm. 260. ISBN 1-85166-646-X.
- ^ a b Eggeman, Tim; Updated By Staff (2007). "Sodium and Sodium Alloys". Kirk-Othmer Encyclopedia of Chemical Technology. John Wiley & Sons. doi:10.1002/0471238961.1915040912051311.a01.pub3. ISBN 0-471-23896-1.
- ^ Oesper, R. E.; Lemay, P. (1950). "Henri Sainte-Claire Deville, 1818–1881". Chymia. 3: 205–221. doi:10.2307/27757153. JSTOR 27757153.
- ^ Banks, Alton (1990). "Sodium". Journal of Chemical Education. 67 (12): 1046. Bibcode:1990JChEd..67.1046B. doi:10.1021/ed067p1046.
- ^ Pauling, Linus, General Chemistry, 1970 ed., Dover Publications
- ^ "Los Alamos National Laboratory – Sodium". Diakses tanggal 2007-06-08.
- ^ Sodium Metal from France. DIANE Publishing. ISBN 1-4578-1780-2.
- ^ Mark Anthony Benvenuto. Industrial Chemistry: For Advanced Students (edisi ke-illustrated). Walter de Gruyter GmbH & Co KG, 2015. ISBN 3-11-038339-X.
- ^ Stanley Nusim (ed.). Active Pharmaceutical Ingredients: Development, Manufacturing, and Regulation, Second Edition (edisi ke-2, illustrated, revised). CRC Press, 2016. hlm. 303. ISBN 1-4398-0339-0.
- ^ Remington, Joseph P. (2006). Beringer, Paul, ed. Remington: The Science and Practice of Pharmacy (edisi ke-21st). Lippincott Williams & Wilkins. hlm. 365–366. ISBN 978-0-7817-4673-1. OCLC 60679584.
- ^ Wiberg, Egon; Wiberg, Nils; Holleman, A. F. (2001). Inorganic Chemistry. Academic Press. hlm. 1103–1104. ISBN 978-0-12-352651-9. OCLC 48056955.
- ^ Harris, Jay C. (1949). Metal cleaning: bibliographical abstracts, 1842–1951. American Society for Testing and Materials. hlm. 76. OCLC 1848092.
- ^ Lindsey, Jack L. (1997). Applied illumination engineering. Fairmont Press. hlm. 112–114. ISBN 978-0-88173-212-2. OCLC 22184876.
- ^ Lerner, Leonid (2011-02-16). Small-Scale Synthesis of Laboratory Reagents with Reaction Modeling. CRC Press. hlm. 91–92. ISBN 978-1-4398-1312-6. OCLC 669160695.
- ^ Sethi, Arun (1 January 2006). Systematic Laboratory Experiments in Organic Chemistry. New Age International. hlm. 32–35. ISBN 978-81-224-1491-2. OCLC 86068991.
- ^ Smith, Michael. Organic Synthesis (edisi ke-3). Academic Press, 2011. hlm. 455. ISBN 0-12-415884-6.
- ^ Solomons & Fryhle. Organic Chemistry (edisi ke-8). John Wiley & Sons, 2006. hlm. 272. ISBN 81-265-1050-1.
- ^ van Rossen, G. L. C. M.; van Bleiswijk, H. (1912). "Über das Zustandsdiagramm der Kalium-Natriumlegierungen". Zeitschrift für anorganische Chemie. 74: 152–156. doi:10.1002/zaac.19120740115.
- ^ Sodium as a Fast Reactor Coolant presented by Thomas H. Fanning. Nuclear Engineering Division. U.S. Department of Energy. U.S. Nuclear Regulatory Commission. Topical Seminar Series on Sodium Fast Reactors. May 3, 2007
- ^ a b "Sodium-cooled Fast Reactor (SFR)" (PDF). Office of Nuclear Energy, U.S. Department of Energy. 18 February 2015.
- ^ Fire and Explosion Hazards. Research Publishing Service, 2011. hlm. 363. ISBN 981-08-7724-2.
- ^ Pavel Solomonovich Knopov, Panos M. Pardalos (ed.). Simulation and Optimization Methods in Risk and Reliability Theory. Nova Science Publishers, 2009. hlm. 150. ISBN 1-60456-658-2.
- ^ McKillop, Allan A. (1976). Proceedings of the Heat Transfer and Fluid Mechanics Institute. Stanford University Press, 1976. hlm. 97. ISBN 0-8047-0917-3.
- ^ U.S. Atomic Energy Commission. Reactor Handbook: Engineering (edisi ke-2). Interscience Publishers. hlm. 325.
- ^ A US US2949907 A, Tauschek Max J, "Coolant-filled poppet valve and method of making same", diterbitkan tanggal 23 Aug 1960
- ^ "Sodium" (PDF). Northwestern University. Diarsipkan dari versi asli (PDF) tanggal 2011-08-23. Diakses tanggal 2011-11-21.
- ^ "Sodium and Potassium Quick Health Facts". health.ltgovernors.com.
- ^ "Sodium in diet". MedlinePlus, US National Library of Medicine. 5 October 2016.
- ^ a b Kementerian Kesehatan Republik Indonesia (2013), "Angka Kecukupan Mineral yang dianjurkan untuk orang Indonesia (perorang perhari)" (PDF), PERATURAN MENTERI KESEHATAN REPUBLIK INDONESIA NOMOR 75 TAHUN 2013 TENTANG ANGKA KECUKUPAN GIZI YANG DIANJURKAN BAGI BANGSA INDONESIA, diarsipkan dari versi asli (PDF) tanggal 2017-08-09, diakses tanggal 2017-08-22
- ^ "Konsumsi Garam Masyarakat Indonesia Berlebihan", panji1102.wordpress.com, 2010-05-29, diakses tanggal 2017-08-22
- ^ a b Geleijnse, J. M.; Kok, F. J.; Grobbee, D. E. (2004). "Impact of dietary and lifestyle factors on the prevalence of hypertension in Western populations" (PDF). European Journal of Public Health. 14 (3): 235–239. doi:10.1093/eurpub/14.3.235. PMID 15369026.
- ^ Lawes, C. M.; Vander Hoorn, S.; Rodgers, A.; International Society of Hypertension (2008). "Global burden of blood-pressure-related disease, 2001". Lancet. 371 (9623): 1513–1518. doi:10.1016/S0140-6736(08)60655-8. PMID 18456100.
- ^ Armstrong, James (2011). General, Organic, and Biochemistry: An Applied Approach. Cengage Learning. hlm. 48–. ISBN 1-133-16826-4.
- ^ Table Salt Conversion. Traditionaloven.com. Retrieved on 2015-11-11.
- ^ a b "Sodium in Your Diet: Use the Nutrition Facts Label and Reduce Your Intake". US Food and Drug Administration. 2 June 2016. Diakses tanggal 15 October 2016.
- ^ "How much sodium should I eat per day?". American Heart Association. 2016. Diarsipkan dari versi asli tanggal 2016-09-28. Diakses tanggal 15 October 2016.
- ^ Andrew Mente; et al. (2016). "Associations of urinary sodium excretion with cardiovascular events in individuals with and without hypertension: a pooled analysis of data from four studies". The Lancet. 388: 465–75. doi:10.1016/S0140-6736(16)30467-6. PMID 27216139.
- ^ McGuire, Michelle; Beerman, Kathy A. (2011). Nutritional Sciences: From Fundamentals to Food. Cengage Learning. hlm. 546. ISBN 978-0-324-59864-3. OCLC 472704484.
- ^ Campbell, Neil (1987). Biology. Benjamin/Cummings. hlm. 795. ISBN 0-8053-1840-2.
- ^ Srilakshmi, B. (2006). Nutrition Science (edisi ke-2nd). New Age International. hlm. 318. ISBN 978-81-224-1633-6. OCLC 173807260.
- ^ Pohl, Hanna R.; Wheeler, John S.; Murray, H. Edward (2013). Astrid Sigel; Helmut Sigel; Roland K. O. Sigel, ed. Interrelations between Essential Metal Ions and Human Diseases. Metal Ions in Life Sciences. 13. Springer. hlm. 29–47. doi:10.1007/978-94-007-7500-8_2.
- ^ Kering, M. K. (2008). "Manganese Nutrition and Photosynthesis in NAD-malic enzyme C4 plants Ph.D. dissertation" (PDF). University of Missouri-Columbia. Diakses tanggal 2011-11-09.
- ^ Subbarao, G. V.; Ito, O.; Berry, W. L.; Wheeler, R. M. (2003). "Sodium—A Functional Plant Nutrient". Critical Reviews in Plant Sciences. 22 (5): 391–416. doi:10.1080/07352680390243495.
- ^ Zhu, J. K. (2001). "Plant salt tolerance". Trends in Plant Science. 6 (2): 66–71. doi:10.1016/S1360-1385(00)01838-0. PMID 11173290.
- ^ a b "Plants and salt ion toxicity". Plant Biology. Diakses tanggal 2010-11-02.
- ^ Angelici, R. J. (1999). Synthesis and Technique in Inorganic Chemistry. Mill Valley, CA: University Science Books. ISBN 0-935702-48-2.
- ^ Routley, J. Gordon. Sodium Explosion Critically Burns Firefighters: Newton, Massachusetts. U. S. Fire Administration. FEMA, 2013.
- ^ a b c Prudent Practices in the Laboratory: Handling and Disposal of Chemicals. National Research Council (U.S.). Committee on Prudent Practices for Handling, Storage, and Disposal of Chemicals in Laboratories. National Academies, 1995. 1995. hlm. 390.
- ^ "Sodium and Salt". www.heart.org. Diakses tanggal 2016-09-05.
- ^ Ladwig, Thomas H. (1991). Industrial fire prevention and protection. Van Nostrand Reinhold, 1991. hlm. 178. ISBN 0-442-23678-6.
- ^ a b Günter Kessler (2012). Sustainable and Safe Nuclear Fission Energy: Technology and Safety of Fast and Thermal Nuclear Reactors (edisi ke-illustrated). Springer Science & Business Media, 2012. hlm. 446. ISBN 3-642-11990-5.
Daftar pustaka
[sunting | sunting sumber]- Greenwood, Norman N.; Earnshaw, A. (1997), Chemistry of the Elements (edisi ke-2), Oxford: Butterworth-Heinemann, ISBN 0-7506-3365-4
Pranala luar
[sunting | sunting sumber]- Sodium at The Periodic Table of Videos (University of Nottingham)
- Etymology of "natrium" – source of symbol Na
- The Wooden Periodic Table Table's Entry on Sodium
- Sodium isotopes data from The Berkeley Laboratory Isotopes Project's Diarsipkan 2007-07-12 di Wayback Machine.
| (besar) | |||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | ||||||||||||||||
| 1 | H | He | |||||||||||||||||||||||||||||||
| 2 | Li | Be | B | C | N | O | F | Ne | |||||||||||||||||||||||||
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar | |||||||||||||||||||||||||
| 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | |||||||||||||||
| 5 | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | |||||||||||||||
| 6 | Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | |
| 7 | Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | |
|
| |||||||||||||||||||||||||||||||||




