Natrium nitrida
| |
| Nama | |
|---|---|
| Nama IUPAC
Natrium nitrida
| |
| Penanda | |
| 3DMet | {{{3DMet}}} |
| Nomor EC | |
| Nomor RTECS | {{{value}}} |
| |
| Sifat | |
| Na3N | |
| Senyawa terkait | |
Anion lain
|
Natrium imida Natrium amida |
Kecuali dinyatakan lain, data di atas berlaku pada suhu dan tekanan standar (25 °C [77 °F], 100 kPa). | |
| Referensi | |
Natrium nitrida (Na3N) adalah senyawa anorganik dengan rumus Na3N. Berbeda dengan litium nitrida dan beberapa nitrida lain, natrium nitrida merupakan nitrida logam alkali yang sangat tidak stabil. Senyawa ini dapat dihasilkan dari penggabungan sinar atomik natrium dan nitrogen yang ditanam pada substrat safir bersuhu rendah.[1] Senyawa ini mudah terurai menjadi unsur-unsur penyusunnya:
- 2 Na3N → 6 Na + N2
Sintesis
[sunting | sunting sumber]Natrium nitrida dapat disintesis dalam dua cara berbeda: dekomposisi termal NaNH2 atau melalui reaksi langsung dari unsur-unsur penyusunnya.[2] Cara paling umum untuk mensintesis natrium nitrida dengan sukses telah dilakukan oleh Dieter Fischer & Martin Jansen serta Grigori Vajenine menggunakan metode terakhir.
Metode pertama adalah dengan membawa rasio Na dan N2 yang diinginkan dalam fase gas secara terpisah dan menanamnya di dalam ruang vakum pada substrat terdinginkan, yang kemudian dipanaskan pada suhu ruangan (298 K) agar mengkristal.[1]
Metode kedua adalah dengan mereaksikan natrium elemental dengan nitrogen yang teraktivasi plasma pada permukaan logam. Sintesis ini dapat lebih jauh difasilitasi dengan membawa paduan logam Na-K cair pada senyawa dengan cairan berlebih dihilangkan dan dibilas dengan paduan segar. Padatan tersebut kemudian dipisahkan dari cairannya menggunakan sentrifugasi. Namun, metode Vajenine sangat sensitif terhadap udara serta mampu terurai dan terbakar secara cepat, kecuali bila terpapar pada lingkungan oksigen murni (O2).[3]
Karakteristik
[sunting | sunting sumber]Natrium nitrida dapat berwarna coklat kemerahan atau biru gelap tergantung pada sintesis senyawa tersebut akibat sifat intrinsiknya.[1][3] Senyawa ini tidak memperlihatkan penguraian setelah beberapa minggu ketika berada pada suhu ruangan.[3] Senyawa ini tidak memiliki titik leleh karena ia terurai kembali menjadi bentuk unsurnya seperti diperlihatkan menggunakan spektrometri massa pada sekitar 360 K.[1][2] Entalpi pembentukan senyawa ini diperkirakan sebesar +64 kJ/mol.[3]
Struktur
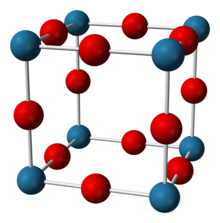
[sunting | sunting sumber]Natrium nitrida terlihat 90% ionik pada suhu ruangan, namun memiliki celah pita yang khas bagi semikonduktor.[2][3] Senyawa ini mengadopsi struktur anti-ReO3 dengan suatu kisi sederhana yang tersusun dari oktahedra NNa6.[1][2][3][4] Senyawa ini memiliki panjang ikatan N-Na sebesar 236.6 pm.[1][3] Struktur ini telah dikonfirmasi menggunakan difraksi sinar-X dan yang terkini dengan difraksi neutron pada bubuk dan kristal tunggalnya.[1][2][3][4]
Referensi
[sunting | sunting sumber]- ^ a b c d e f g Fischer, D., Jansen, M. (2002). "Synthesis and structure of Na3N". Angew Chem (dalam bahasa Inggris). 41 (10): 1755. doi:10.1002/1521-3773(20020517)41:10<1755::AID-ANIE1755>3.0.CO;2-C. Fischer, D.; Cancarevic, Z.; Schön, J. C.; Jansen, M. Z. (2004). "Synthesis and structure of K3N". Z. Anorg. Allg. Chem. (dalam bahasa Inggris). 630 (1): 156. doi:10.1002/zaac.200300280.. 'Elusive Binary Compound Prepared' Chemical & Engineering News 80 No. 20 (20 Mei 2002)
- ^ a b c d e Sangster, J. (2004). "N-Na(Nitrogen-Sodium) System". Journal of Phase Equilibria and Diffusion (dalam bahasa Inggris). 25 (6): 560–563. doi:10.1007/s11669-004-0082-0.
- ^ a b c d e f g h Vajenine, G.V. (2007). "Plasma-Assisted Synthesis and Properties of Na3N". Inorganic Chemistry (dalam bahasa Inggris). 46 (13): 5146–5148. doi:10.1021/ic700406q. PMID 17530752.
- ^ a b Vajenine, G.V., Hoch, C., Dinnebier, R.E., Senyshyn, A., Niewa, R. (2009). "Plasma-A Temperature-dependent Structural Study of anti-ReO3-type Na3N: to Distort or not to Distort?". Zeitschrift für Anorganische und Allgemeine Chemie (dalam bahasa Inggris). 636 (1): 94–99. doi:10.1002/zaac.200900488.
