Berilium
4Be Berilium | |||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 Sampel berilium | |||||||||||||||||||||||
Garis spektrum berilium | |||||||||||||||||||||||
| Sifat umum | |||||||||||||||||||||||
| Pengucapan | /bèrilium/[1] | ||||||||||||||||||||||
| Penampilan | metalik putih abu-abu | ||||||||||||||||||||||
| Berilium dalam tabel periodik | |||||||||||||||||||||||
| |||||||||||||||||||||||
| Nomor atom (Z) | 4 | ||||||||||||||||||||||
| Golongan | golongan 2 (logam alkali tanah) | ||||||||||||||||||||||
| Periode | periode 2 | ||||||||||||||||||||||
| Blok | blok-s | ||||||||||||||||||||||
| Kategori unsur | logam alkali tanah | ||||||||||||||||||||||
| Berat atom standar (Ar) |
| ||||||||||||||||||||||
| Konfigurasi elektron | 1s2 2s2 | ||||||||||||||||||||||
| Elektron per kelopak | 2, 2 | ||||||||||||||||||||||
| Sifat fisik | |||||||||||||||||||||||
| Fase pada STS (0 °C dan 101,325 kPa) | padat | ||||||||||||||||||||||
| Titik lebur | 1560 K (1287 °C, 2349 °F) | ||||||||||||||||||||||
| Titik didih | 2742 K (2469 °C, 4476 °F) | ||||||||||||||||||||||
| Kepadatan mendekati s.k. | 1,85 g/cm3 | ||||||||||||||||||||||
| saat cair, pada t.l. | 1,690 g/cm3 | ||||||||||||||||||||||
| Titik kritis | 5205 K, MPa (diekstrapolasi) | ||||||||||||||||||||||
| Kalor peleburan | 12,2 kJ/mol | ||||||||||||||||||||||
| Kalor penguapan | 292 kJ/mol | ||||||||||||||||||||||
| Kapasitas kalor molar | 16,443 J/(mol·K) | ||||||||||||||||||||||
Tekanan uap
| |||||||||||||||||||||||
| Sifat atom | |||||||||||||||||||||||
| Bilangan oksidasi | 0,[2] +1,[3] +2 (oksida amfoter) | ||||||||||||||||||||||
| Elektronegativitas | Skala Pauling: 1,57 | ||||||||||||||||||||||
| Energi ionisasi | ke-1: 899,5 kJ/mol ke-2: 1757,1 kJ/mol ke-3: 14.848,7 kJ/mol (artikel) | ||||||||||||||||||||||
| Jari-jari atom | empiris: 112 pm | ||||||||||||||||||||||
| Jari-jari kovalen | 96±3 pm | ||||||||||||||||||||||
| Jari-jari van der Waals | 153 pm | ||||||||||||||||||||||
| Lain-lain | |||||||||||||||||||||||
| Kelimpahan alami | primordial | ||||||||||||||||||||||
| Struktur kristal | heksagon | ||||||||||||||||||||||
| Kecepatan suara batang ringan | 12.890[4] m/s (pada s.k.) | ||||||||||||||||||||||
| Ekspansi kalor | 11,3 µm/(m·K) (suhu 25 °C) | ||||||||||||||||||||||
| Konduktivitas termal | 200 W/(m·K) | ||||||||||||||||||||||
| Resistivitas listrik | 36 Ω·m (suhu 20 °C) | ||||||||||||||||||||||
| Arah magnet | diamagnetik | ||||||||||||||||||||||
| Suseptibilitas magnetik molar | −9,0×10−6 cm3/mol[5] | ||||||||||||||||||||||
| Modulus Young | 287 GPa | ||||||||||||||||||||||
| Modulus Shear | 132 GPa | ||||||||||||||||||||||
| Modulus curah | 130 GPa | ||||||||||||||||||||||
| Rasio Poisson | 0,032 | ||||||||||||||||||||||
| Skala Mohs | 5,5 | ||||||||||||||||||||||
| Skala Vickers | 1670 MPa | ||||||||||||||||||||||
| Skala Brinell | 590–1320 MPa | ||||||||||||||||||||||
| Nomor CAS | 7440-41-7 | ||||||||||||||||||||||
| Sejarah | |||||||||||||||||||||||
| Penemuan | L. Vauquelin (1798) | ||||||||||||||||||||||
| Isolasi pertama | F. Wöhler & A. Bussy (1828) | ||||||||||||||||||||||
| Isotop berilium yang utama | |||||||||||||||||||||||
| |||||||||||||||||||||||
Berilium (bahasa Latin: beryllium) adalah unsur kimia dengan lambang Be dan nomor atom 4. Berilium merupakan logam alkali tanah berwarna abu-abu-baja yang kuat dan ringan, tetapi rapuh. Berilium merupakan unsur divalen yang terbentuk secara alami hanya dalam kombinasi dengan unsur lain untuk membentuk mineral. Batu permata terkenal yang mengandung berilium tinggi adalah beril (akuamarin, zamrud) dan krisoberil. Ia adalah unsur yang relatif langka di alam semesta, biasanya terjadi sebagai produk dari pemisahan inti atom yang lebih besar yang bertabrakan dengan sinar kosmik. Di dalam inti bintang, berilium dihabiskan karena menyatu menjadi unsur yang lebih berat. Jumlah berilium di kerak Bumi adalah sekitar 0,0004 persen massa kerak Bumi. Produksi berilium tahunan dunia sebesar 220 ton biasanya diproduksi melalui ekstraksi dari mineral beril, proses yang sulit karena berilium berikatan kuat dengan oksigen.
Dalam aplikasi struktural, kombinasi dari kekakuan lentur, stabilitas termal, konduktivitas termal yang tinggi dan massa jenis yang rendah (1,85 kali dari air) menjadikan logam berilium sebagai bahan kedirgantaraan yang diinginkan untuk komponen pesawat terbang, rudal, wahana antariksa, dan satelit.[6] Karena massa jenis dan massa atomnya yang rendah, berilium relatif transparan terhadap sinar-X dan bentuk radiasi pengion lainnya; oleh karena itu, ia adalah bahan jendela paling umum untuk peralatan sinar-X dan komponen detektor partikel.[6] Ketika ditambahkan sebagai unsur paduan ke aluminium, tembaga (terutama paduan tembaga berilium), besi, atau nikel, berilium meningkatkan banyak sifat fisik.[6] Misalnya, perkakas dan komponen yang terbuat dari paduan tembaga berilium bersifat kuat dan keras serta tidak menimbulkan percikan api saat membentur permukaan baja. Di udara, permukaan berilium mudah teroksidasi pada suhu kamar untuk membentuk lapisan pasivasi setebal 1–10 nm yang melindunginya dari oksidasi dan korosi lebih lanjut. Logam berilium teroksidasi secara massal (di luar lapisan pasivasi) saat dipanaskan di atas 500 °C (932 °F), dan terbakar cemerlang saat dipanaskan hingga sekitar 2.500 °C (4.530 °F).
Penggunaan berilium secara komersial memerlukan penggunaan peralatan pengontrol debu yang sesuai dan kontrol industri setiap saat karena toksisitas debu yang mengandung berilium yang dihirup dapat menyebabkan penyakit alergi kronis yang mengancam jiwa pada beberapa orang, yang disebut beriliosis.[7] Beriliosis dapat menyebabkan pneumonia dan penyakit pernapasan terkait lainnya.
Karakteristik
[sunting | sunting sumber]Sifat fisik
[sunting | sunting sumber]Berilium adalah logam berwarna abu-abu-baja yang keras dan rapuh pada suhu kamar dan memiliki struktur kristal heksagonal tetal-rapat.[6] Ia memiliki kekakuan yang luar biasa (modulus Young 287 GPa) dan titik lebur 1287 °C. Modulus elastisitas berilium kira-kira 50% lebih besar daripada baja. Kombinasi modulus ini dan massa jenis yang relatif rendah menghasilkan kecepatan konduksi suara yang luar biasa cepat pada berilium – sekitar 12,9 km/dtk pada kondisi sekitar. Sifat penting lainnya adalah panas spesifik (1925 J·kg−1·K−1) dan konduktivitas termal yang tinggi (216 W·m−1·K−1), yang menjadikan berilium sebagai logam dengan karakteristik pembuangan panas terbaik per satuan berat. Dalam kombinasi dengan koefisien ekspansi termal linear yang relatif rendah (11,4×10−6 K−1), karakteristik ini menghasilkan stabilitas yang unik di bawah kondisi beban termal.[8]
Sifat nuklir
[sunting | sunting sumber]Berilium alami, kecuali sedikit kontaminasi oleh radioisotop kosmogenik, adalah isotop berilium-9 murni, yang memiliki spin nuklir 32. Berilium memiliki penampang hamburan yang besar untuk neutron berenergi tinggi, sekitar 6 barn untuk energi di atas kira-kira 10 keV. Oleh karena itu, ia berfungsi sebagai reflektor neutron dan moderator neutron, secara efektif memperlambat neutron ke kisaran energi termal di bawah 0,03 eV, di mana total penampang setidaknya lebih rendah; nilai pastinya sangat bergantung pada kemurnian dan ukuran kristalit dalam material.
Isotop berilium primordial tunggal 9Be juga mengalami reaksi neutron (n,2n) dengan energi neutron sekitar 1,9 MeV, menghasilkan 8Be, yang segera pecah menjadi dua partikel alfa. Jadi, untuk neutron berenergi tinggi, berilium adalah pengganda neutron, melepaskan lebih banyak neutron daripada yang diserapnya. Reaksi nuklir ini adalah:[9]
- 9
4Be + n → 2 4
2He + 2 n
Neutron dibebaskan ketika inti berilium dipukul oleh partikel alfa energetik[8] yang menghasilkan reaksi nuklir
- 9
4Be + 4
2He → 12
6C + n
di mana 4
2He adalah partikel alfa dan 12
6C adalah inti karbon-12.[9]
Berilium juga melepaskan neutron saat dibombardir oleh sinar gama. Dengan demikian, berilium alami yang dibombardir oleh partikel alfa atau sinar gama dari radioisotop yang cocok adalah komponen kunci dari sebagian besar sumber neutron reaksi nuklir bertenaga radioisotop untuk produksi laboratorium neutron bebas.
Sejumlah kecil tritium dibebaskan ketika inti 9
4Be menyerap neutron berenergi rendah dalam reaksi nuklir tiga langkah
- 9
4Be + n → 4
2He + 6
2He, 6
2He → 6
3Li + β−, 6
3Li + n → 4
2He + 3
1H
6
2He memiliki waktu paruh hanya 0,8 detik, β− adalah sebuah elektron, dan 6
3Li memiliki penampang serapan neutron yang tinggi. Tritium adalah radioisotop yang menjadi perhatian dalam aliran limbah reaktor nuklir.[10]
Sifat optis
[sunting | sunting sumber]Sebagai logam, berilium transparan atau tembus cahaya ke sebagian besar panjang gelombang sinar-X dan sinar gama, membuatnya berguna untuk jendela keluaran tabung sinar-X dan peralatan sejenis lainnya.[11]
Isotop dan nukleosintesis
[sunting | sunting sumber]Isotop berilium yang stabil dan tidak stabil dibuat di bintang, tetapi radioisotopnya tidak bertahan lama. Dipercayai bahwa sebagian besar berilium yang stabil di alam semesta pada awalnya tercipta di medium antarbintang ketika sinar kosmik menginduksi fisi pada unsur-unsur yang lebih berat yang ditemukan dalam gas dan debu antarbintang.[12] Berilium primordial hanya mengandung satu isotop stabil, 9Be, dan karena itu berilium adalah unsur monoisotop dan mononuklida.

Isotop kosmogenik yang radioaktif 10Be diproduksi di atmosfer Bumi oleh spalasi sinar kosmik dari oksigen.[13] 10Be terakumulasi di permukaan tanah, di mana waktu paruhnya yang relatif panjang (1,36 juta tahun) memungkinkan waktu tinggal yang lama sebelum meluruh menjadi boron-10. Dengan demikian, 10Be dan produk turunannya digunakan untuk memeriksa erosi tanah, pembentukan tanah dan perkembangan tanah laterit alami, dan sebagai proksi untuk pengukuran variasi aktivitas matahari dan usia inti es.[14] Produksi 10Be berbanding terbalik dengan aktivitas matahari, karena peningkatan angin matahari selama periode aktivitas matahari tinggi menurunkan fluks sinar kosmik galaksi yang mencapai Bumi.[13] Ledakan nuklir juga membentuk 10Be melalui reaksi neutron cepat dengan 13C dalam karbon dioksida di udara. Ini adalah salah satu indikator aktivitas masa lalu di lokasi uji coba senjata nuklir.[15] Isotop 7Be (waktu paruh 53 hari) juga kosmogenik, dan menunjukkan kelimpahan atmosfer terkait dengan bintik matahari, seperti 10Be.
8Be memiliki waktu paruh yang sangat singkat, sekitar 8×10−17 detik, yang berkontribusi pada peran kosmologisnya yang signifikan, karena unsur yang lebih berat dari berilium tidak mungkin dihasilkan oleh fusi nuklir pada Ledakan Dahsyat.[16] Hal ini disebabkan kurangnya waktu yang cukup selama fase nukleosintesis Ledakan Dahsyat untuk menghasilkan karbon melalui fusi inti 4He dan rendahnya konsentrasi berilium-8 yang tersedia. Astronom Inggris Sir Fred Hoyle pertama kali menunjukkan bahwa tingkat energi 8Be dan 12C memungkinkan produksi karbon melalui proses alfa tripel dalam bintang berbahan bakar helium di mana lebih banyak waktu nukleosintesis tersedia. Proses ini memungkinkan karbon diproduksi di bintang, tetapi tidak pada Ledakan Dahsyat. Dengan demikian, karbon yang diciptakan bintang (dasar kehidupan berbasis karbon) merupakan komponen dalam unsur-unsur dalam gas dan debu yang dikeluarkan oleh bintang AGB dan supernova (lihat pula nukleosintesis Ledakan Dahsyat), serta penciptaan semua unsur lain dengan nomor atomnya lebih besar dari pada karbon.[17]
Elektron 2s berilium dapat berkontribusi pada ikatan kimia. Oleh karena itu, ketika 7Be meluruh melalui penangkapan elektron-L, ia melakukannya dengan mengambil elektron dari orbital atomnya yang mungkin berpartisipasi dalam ikatan. Hal ini membuat tingkat peluruhannya bergantung pada tingkat yang dapat diukur pada lingkungan kimiawinya – kejadian langka dalam peluruhan nuklir.[18]
Isotop berilium berumur paling pendek yang diketahui adalah 16Be, yang meluruh melalui emisi neutron dengan waktu paruh 6,5×10−22 detik.[19] Isotop eksotis 11Be dan 14Be diketahui menunjukkan halo nuklir.[20] Fenomena ini dapat dipahami karena inti 11Be dan 14Be masing-masing memiliki 1 dan 4 neutron yang mengorbit secara substansial di luar model inti 'tetesan air' Fermi klasik.
Keterjadian
[sunting | sunting sumber]

Matahari memiliki konsentrasi 0,1 bagian per miliar (ppb) berilium.[21] Berilium memiliki konsentrasi 2 hingga 6 bagian per juta (ppm) di kerak Bumi.[22] Ia paling terkonsentrasi di tanah, 6 ppm.[23] Jumlah jejak 9Be ditemukan di atmosfer Bumi.[23] Konsentrasi berilium dalam air laut adalah 0,2–0,6 bagian per triliun (ppt).[23][24] Namun, di air sungai, berilium lebih melimpah dengan konsentrasi 0,1 ppb.[25]
Berilium ditemukan di lebih dari 100 mineral,[26] tetapi sebagian besar tidak umum hingga langka. Mineral yang mengandung berilium yang lebih umum meliputi: bertrandit (Be4Si2O7(OH)2), beril (Al2Be3Si6O18), krisoberil (Al2BeO4), dan fenakit (Be2SiO4). Bentuk beril yang berharga adalah akuamarin, beril merah, dan zamrud.[8][27][28] Warna hijau dalam bentuk beril berkualitas permata berasal dari jumlah kromium yang bervariasi (sekitar 2% untuk zamrud).[29]
Dua bijih utama berilium, beril dan bertrandit, ditemukan di Amerika Serikat, Argentina, Brasil, India, Madagaskar, dan Rusia.[29] Total cadangan bijih berilium dunia lebih besar dari 400.000 ton.[29]
Produksi
[sunting | sunting sumber]Ekstraksi berilium dari senyawanya merupakan proses yang sulit karena afinitasnya yang tinggi terhadap oksigen pada suhu tinggi, dan kemampuannya untuk mereduksi air saat film oksidanya dihilangkan. Saat ini Amerika Serikat, Tiongkok, dan Kazakhstan adalah tiga negara yang terlibat dalam ekstraksi berilium skala industri.[30] Kazakhstan menghasilkan berilium dari konsentrat yang ditimbun sebelum pecahnya Uni Soviet sekitar tahun 1991. Sumber daya ini hampir habis pada pertengahan 2010-an.[31]
Produksi berilium di Rusia dihentikan pada tahun 1997, dan direncanakan akan dilanjutkan pada tahun 2020-an.[32][33]
Berilium paling sering diekstraksi dari mineral beril, yang disinter menggunakan zat ekstraksi atau dilebur menjadi campuran yang larut. Proses penyinteran melibatkan pencampuran beril dengan natrium fluorosilikat dan soda pada suhu 770 °C (1.420 °F) untuk membentuk natrium fluoroberilat, aluminium oksida, dan silikon dioksida.[6] Berilium hidroksida diendapkan dari larutan natrium fluoroberilat dan natrium hidroksida dalam air. Ekstraksi berilium menggunakan metode peleburan melibatkan penggilingan beril menjadi bubuk dan memanaskannya hingga suhu 1.650 °C (3.000 °F).[6] Lelehan tersebut dengan cepat didinginkan dengan air dan kemudian dipanaskan kembali 250 hingga 300 °C (482 hingga 572 °F) dalam asam sulfat pekat, sebagian besar menghasilkan berilium sulfat dan aluminium sulfat.[6] Amonia berair kemudian digunakan untuk menghilangkan aluminium dan belerang, meninggalkan berilium hidroksida.
Berilium hidroksida yang dibuat menggunakan metode sinter atau peleburan kemudian diubah menjadi berilium fluorida atau berilium klorida. Untuk membentuk fluorida, amonium hidrogen fluorida encer ditambahkan ke berilium hidroksida untuk menghasilkan endapan amonium tetrafluoroberilat, yang dipanaskan hingga 1.000 °C (1.830 °F) untuk membentuk berilium fluorida.[6] Memanaskan fluorida hingga 900 °C (1.650 °F) dengan magnesium akan membentuk berilium yang terbagi halus, dan pemanasan tambahan hingga 1.300 °C (2.370 °F) akan menghasilkan logam padat.[6] Memanaskan berilium hidroksida akan membentuk oksida, yang menjadi berilium klorida bila dikombinasikan dengan karbon dan klorin. Elektrolisis berilium klorida cair kemudian digunakan untuk mendapatkan logam berilium.[6]
Sifat kimia
[sunting | sunting sumber]Atom berilium memiliki konfigurasi elektron [He] 2s2. Keadaan oksidasi utama berilium adalah +2; atom berilium telah kehilangan kedua elektron valensinya. Keadaan oksidasi yang lebih rendah telah ditemukan, misalnya, senyawa bis(karbena).[34] Perilaku kimia berilium sebagian besar disebabkan oleh jari-jari atom dan ioniknya yang kecil. Dengan demikian, ia memiliki potensi ionisasi yang sangat tinggi dan polarisasi yang kuat saat terikat pada atom lain, itulah sebabnya semua senyawanya bersifat kovalen. Sifat kimiawinya mirip dengan aluminium, contoh dari hubungan diagonal.
Pada suhu kamar, permukaan berilium membentuk lapisan pasivasi oksida setebal 1−10 nm yang mencegah reaksi lebih lanjut dengan udara, kecuali untuk penebalan oksida secara bertahap hingga sekitar 25 nm. Ketika dipanaskan di atas sekitar 500 °C, oksidasi menjadi logam curah berlangsung di sepanjang batas butir.[35] Setelah logam dinyalakan di udara dengan pemanasan di atas titik lebur oksida sekitar 2500 °C, berilium terbakar dengan cemerlang, membentuk campuran berilium oksida dan berilium nitrida. Berilium mudah larut dalam asam nonpengoksidasi, seperti HCl dan H2SO4 encer, tetapi tidak dalam asam nitrat atau air karena ini membentuk oksida. Perilaku ini mirip dengan logam aluminium. Berilium juga larut dalam larutan alkali.[6][36]
Senyawa biner berilium(II) bersifat polimer dalam keadaan padat. BeF2 memiliki struktur seperti silika dengan tetrahedra BeF4 yang dibagi sudut. BeCl2 dan BeBr2 memiliki struktur rantai dengan tetrahedra yang berbagi tepi. Berilium oksida, BeO, adalah padatan refraktori putih, yang memiliki struktur kristal wurtzit dan konduktivitas termal setinggi beberapa logam. BeO bersifat amfoter. Berilium sulfida, selenida, dan telurida telah diketahui, dan semuanya memiliki struktur bijih seng.[37] Berilium nitrida, Be3N2 adalah senyawa dengan titik lebur tinggi yang mudah dihidrolisis. Berilium azida, BeN6 telah dikenal dan berilium fosfida, Be3P2 memiliki struktur yang mirip dengan Be3N2. Sejumlah berilium borida telah dikenal, seperti Be5B, Be4B, Be2B, BeB2, BeB6, dan BeB12. Berilium karbida, Be2C, adalah senyawa merah bata refraktori yang bereaksi dengan air dan menghasilkan metana.[37] Tidak ada berilium silisida yang telah diidentifikasi.[36]
Halida BeX2 (X = F, Cl, Br, I) memiliki struktur molekul monomer linear dalam fase gas.[36] Kompleks halida terbentuk dengan satu atau lebih ligan yang menyumbangkan total dua pasang elektron. Senyawa seperti itu mematuhi aturan oktet. Kompleks 4-koordinat lainnya seperti ion-akua [Be(H2O)4]2+ juga mematuhi aturan oktet.
Larutan berair
[sunting | sunting sumber]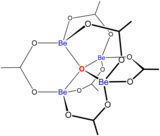
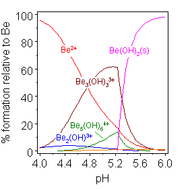
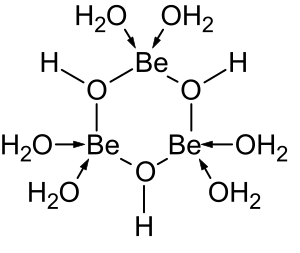
Kimia larutan berair dari berilium adalah subjek tinjauan komprehensif.[38] Larutan garam berilium, seperti berilium sulfat dan berilium nitrat, bersifat asam karena hidrolisis ion [Be(H2O)4]2+. Konsentrasi produk hidrolisis pertama, [Be(H2O)3(OH)]+, kurang dari 1% konsentrasi berilium. Produk hidrolisis yang paling stabil adalah ion trimerik [Be3(OH)3(H2O)6]3+. Berilium hidroksida, Be(OH)2, tidak larut dalam air pada pH 5 atau lebih. Akibatnya, senyawa berilium umumnya tidak larut pada pH biologis. Karena itu, penghirupan debu logam berilium oleh manusia menyebabkan berkembangnya kondisi beriliosis yang fatal. Be(OH)2 larut dalam larutan alkalin kuat.
Berilium(II) membentuk beberapa kompleks dengan ligan monodentat karena molekul air dalam ion akuo, terikat sangat kuat dengan ion berilium. Pengecualian penting adalah rangkaian kompleks yang larut dalam air dengan ion fluorida.[39]
Berilium(II) membentuk banyak kompleks dengan ligan bidentat yang mengandung atom donor oksigen.[38] Spesies terkenal karena memiliki ion oksida 3-koordinat di pusatnya. Berilium oksida asetat, , memiliki ion oksida yang dikelilingi oleh tetrahedron atom berilium.
Dengan ligan organik, seperti ion malonat, asam tersebut terdeprotonasi saat membentuk kompleks. Atom donor adalah dua oksigen.
Pembentukan kompleks bersaing dengan reaksi hidrolisis ion logam dan kompleks campuran dengan anion dan ion hidroksida juga terbentuk. Misalnya, turunan dari trimer siklik telah diketahui, dengan ligan bidentat menggantikan satu atau lebih pasang molekul air. Ligan seperti EDTA berperilaku sebagai asam dikarboksilat.
Asam hidroksikarboksilat seperti asam glikolat membentuk kompleks monodentat yang agak lemah dalam larutan di mana gugus hidroksil tetap utuh. Sebuah heksamer, , di mana gugus hidroksil terdeprotonasi telah lama diisolasi, dalam keadaan padat.[40] Ligan di-hidroksi aromatik membentuk kompleks yang relatif kuat. Misalnya, nilai log K1 dan log K2 sebesar 12,2 dan 9,3 telah dilaporkan untuk kompleks dengan tiron.[41]
Ada banyak laporan awal tentang kompleks dengan asam amino, tetapi sayangnya mereka tidak dapat diandalkan karena reaksi hidrolisis yang menyertainya tidak dipahami pada saat publikasi. Nilai untuk log β dari sekitar 6 sampai 7 telah dilaporkan.[42] Derajat pembentukannya kecil karena kompetisi dengan reaksi hidrolisis.
Kimia organik
[sunting | sunting sumber]Kimia organoberilium terbatas pada penelitian akademik karena biaya dan toksisitas berilium, turunan berilium, dan reagen yang diperlukan untuk pengenalan berilium, seperti berilium klorida. Senyawa berilium organologam dikenal sangat reaktif.[43] Contoh senyawa organoberilium yang diketahui adalah dineopentilberilium,[44] berilosena (Cp2Be),[45][46][47][48] dialilberilium (melalui reaksi pertukaran dietil berilium dengan trialil boron),[49] bis(1,3-trimetilsililalil)berilium,[50] dan Be(mes)2.[43] Ligan juga bisa berupa aril[51] dan alkinil.[52]
Sejarah
[sunting | sunting sumber]Mineral beril, yang mengandung berilium, telah digunakan setidaknya sejak dinasti Ptolemeus di Mesir.[53] Pada abad pertama CE, naturalis Romawi Plinius Tua menyebutkan dalam ensiklopedianya Naturalis Historia bahwa beril dan zamrud ("smaragdus") serupa.[54] Papirus Graecus Holmiensis, yang ditulis pada abad ketiga atau keempat CE, memuat catatan tentang cara membuat zamrud dan beril buatan.[54]

Analisis awal zamrud dan beril oleh Martin Heinrich Klaproth, Torbern Olof Bergman, Franz Karl Achard, dan Johann Jakob Bindheim selalu menghasilkan unsur yang serupa, yang mengarah pada kesimpulan keliru bahwa kedua zat tersebut adalah aluminium silikat.[55] Ahli mineralogi René Just Haüy menemukan bahwa kedua kristal identik secara geometris, dan dia meminta ahli kimia Louis-Nicolas Vauquelin untuk analisis kimia.[53]
Dalam makalah tahun 1798 yang dibacakan di hadapan Institut de France, Vauquelin melaporkan bahwa ia menemukan "tanah" baru dengan melarutkan aluminium hidroksida dari zamrud dan beril dalam alkali tambahan.[56] Editor jurnal Annales de Chimie et de Physique menamakan tanah baru ini "glucine" karena rasa manis dari beberapa senyawanya.[57] Klaproth lebih suka nama "beryllina" karena itria juga membentuk garam manis.[58][59] Nama "berilium" pertama kali digunakan oleh Wöhler pada tahun 1828.[60]

Friedrich Wöhler[61] dan Antoine Bussy[62] secara terpisah mengisolasi berilium pada tahun 1828 melalui reaksi kimia logam kalium dengan berilium klorida, sebagai berikut:
- BeCl2 + 2 K → 2 KCl + Be
Dengan menggunakan lampu alkohol, Wöhler memanaskan lapisan-lapisan berilium klorida dan kalium secara berselang-seling dalam wadah platina tertutup kabel. Reaksi di atas segera terjadi dan menyebabkan krus menjadi putih panas. Setelah mendinginkan dan mencuci bubuk hitam keabu-abuan yang dihasilkan, dia melihat bahwa itu terbuat dari partikel halus dengan kilau logam gelap.[63] Kalium yang sangat reaktif telah diproduksi dengan elektrolisis senyawanya, sebuah proses yang ditemukan 21 tahun sebelumnya. Metode kimia yang menggunakan kalium hanya menghasilkan butiran kecil berilium yang tidak dapat dituang atau dipalu.
Elektrolisis langsung dari campuran cair berilium fluorida dan natrium fluorida oleh Paul Lebeau pada tahun 1898 menghasilkan sampel berilium murni pertama (99,5 hingga 99,8%).[63] Namun, produksi industri baru dimulai setelah Perang Dunia Pertama. Keterlibatan industri asli termasuk anak perusahaan dan ilmuwan yang terkait dengan Union Carbide and Carbon Corporation di Cleveland, Ohio, dan Siemens & Halske AG di Berlin. Di AS, proses tersebut dipimpin oleh Hugh S. Cooper, direktur The Kemet Laboratories Company. Di Jerman, proses produksi berilium pertama yang berhasil secara komersial dikembangkan pada tahun 1921 oleh Alfred Stock dan Hans Goldschmidt.[64]
Sampel berilium dibombardir dengan sinar alfa dari peluruhan radium dalam percobaan tahun 1932 oleh James Chadwick yang mengungkap keberadaan neutron.[29] Metode yang sama ini digunakan dalam satu kelas sumber neutron laboratorium berbasis radioisotop yang menghasilkan 30 neutron untuk setiap juta partikel α.[22]
Produksi berilium mengalami peningkatan pesat selama Perang Dunia II, karena meningkatnya permintaan paduan berilium-tembaga keras dan fosfor untuk lampu fluoresen. Sebagian besar lampu fluoresen awal menggunakan seng ortosilikat dengan berbagai kandungan berilium untuk memancarkan cahaya kehijauan. Penambahan kecil magnesium wolframat meningkatkan bagian biru dari spektrum untuk menghasilkan cahaya putih yang dapat diterima. Fosfor berbasis halofosfat menggantikan fosfor berbasis berilium setelah berilium ditemukan beracun.[65]
Elektrolisis campuran berilium fluorida dan natrium fluorida digunakan untuk mengisolasi berilium selama abad ke-19. Titik lebur logam yang tinggi membuat proses ini lebih memakan energi daripada proses serupa yang digunakan untuk logam alkali. Pada awal abad ke-20, produksi berilium melalui dekomposisi termal berilium iodida diselidiki menyusul keberhasilan proses serupa untuk produksi zirkonium, tetapi proses ini terbukti tidak ekonomis untuk produksi besar.[66]
Logam berilium murni tidak tersedia sampai tahun 1957, meskipun telah digunakan sebagai logam paduan untuk mengeraskan tembaga jauh lebih awal.[29] Berilium dapat diproduksi dengan mereduksi senyawa berilium seperti berilium klorida dengan logam kalium atau natrium. Saat ini, sebagian besar berilium diproduksi dengan mereduksi berilium fluorida dengan magnesium.[67] Harga di pasar Amerika untuk berilium batangan cor vakum adalah sekitar AS$338 per pon (AS$745 per kilogram) pada tahun 2001.[68]
Antara tahun 1998 dan 2008, produksi berilium dunia menurun dari 343 menjadi sekitar 200 ton. Kemudian meningkat menjadi 230 ton pada tahun 2018, dimana 170 ton berasal dari Amerika Serikat.[69][70]
Etimologi
[sunting | sunting sumber]Dinamai dari beril, mineral semimulia, dari mana ia pertama kali diisolasi.[71][72][73]
Aplikasi
[sunting | sunting sumber]Jendela radiasi
[sunting | sunting sumber]

Karena nomor atomnya yang rendah dan penyerapan yang sangat rendah untuk sinar-X, aplikasi berilium tertua dan masih yang paling penting adalah jendela radiasi untuk tabung sinar-X.[29] Tuntutan ekstrim ditempatkan pada kemurnian dan kebersihan berilium untuk menghindari artefak dalam gambar sinar-X. Foil berilium tipis digunakan sebagai jendela radiasi untuk detektor sinar-X, dan penyerapan yang sangat rendah meminimalkan efek pemanasan yang disebabkan oleh intensitas tinggi, sinar-X berenergi rendah yang khas dari radiasi sinkrotron. Jendela kedap vakum dan tabung sinar untuk eksperimen radiasi pada sinkrotron diproduksi secara eksklusif dari berilium. Dalam pengaturan ilmiah untuk berbagai studi emisi sinar-X (misalnya spektroskopi sinar-X dispersif energi) pemegang sampel biasanya terbuat dari berilium karena sinar-X yang dipancarkan memiliki energi yang jauh lebih rendah (≈100 eV) daripada sinar-X dari kebanyakan materi yang dipelajari.[8]
Nomor atom yang rendah juga membuat berilium relatif transparan terhadap partikel energetik. Oleh karena itu, ini digunakan untuk membuat pipa berkas di sekitar daerah tumbukan dalam pengaturan fisika partikel, seperti keempat eksperimen detektor utama di Penumbuk Hadron Raksasa (ALICE, ATLAS, CMS, LHCb),[74] Tevatron, dan di SLAC. Massa jenis berilium yang rendah memungkinkan produk tabrakan mencapai detektor di sekitarnya tanpa interaksi yang signifikan, kekakuannya memungkinkan vakum yang kuat dihasilkan di dalam pipa untuk meminimalkan interaksi dengan gas, stabilitas termalnya memungkinkannya berfungsi dengan benar pada suhu hanya beberapa derajat di atas nol mutlak, dan sifat diamagnetiknya membuatnya tidak mengganggu sistem magnet multikutub kompleks yang digunakan untuk mengarahkan dan memfokuskan berkas partikel.[75]
Aplikasi mekanis
[sunting | sunting sumber]Karena kekakuannya, beratnya yang ringan, dan stabilitas dimensi pada rentang suhu yang luas, logam berilium digunakan untuk komponen struktural ringan dalam industri pertahanan dan kedirgantaraan pada pesawat berkecepatan tinggi, rudal, wahana antariksa, dan satelit, termasuk Teleskop Luar Angkasa James Webb. Beberapa roket berbahan bakar cair telah menggunakan nosel roket yang terbuat dari berilium murni.[76][77] Serbuk berilium sendiri dipelajari sebagai bahan bakar roket, tetapi penggunaan ini tidak pernah terwujud.[29] Sejumlah kecil kerangka sepeda kelas atas yang ekstrem telah dibuat dengan berilium.[78] Dari tahun 1998 hingga 2000, tim Formula Satu McLaren menggunakan mesin Mercedes-Benz dengan piston paduan berilium-aluminium.[79] Penggunaan komponen mesin berilium dilarang menyusul protes dari Scuderia Ferrari.[80]
Mencampur sekitar 2,0% berilium dengan tembaga membentuk paduan yang disebut tembaga berilium yang enam kali lebih kuat dari tembaga saja.[81] Paduan berilium digunakan dalam banyak aplikasi karena kombinasi elastisitasnya, konduktivitas listrik dan konduktivitas termal yang tinggi, kekuatan dan kekerasan yang tinggi, sifat nonmagnetik, serta ketahanan terhadap korosi dan kelelahan.[29][6] Beberapa aplikasinya adalah alat tanpa percikan yang digunakan di dekat gas yang mudah terbakar (nikel berilium), pada pegas dan membran (nikel berilium dan besi berilium) yang digunakan dalam instrumen bedah dan perangkat suhu tinggi.[29][6] Sedikitnya 50 bagian per juta paduan berilium dengan magnesium cair menyebabkan peningkatan ketahanan oksidasi yang signifikan dan penurunan sifat mudah terbakar.[6]

Kekakuan elastis berilium yang tinggi telah menyebabkan penggunaannya yang luas dalam instrumentasi presisi, seperti dalam sistem pemandu inersia dan dalam mekanisme pendukung untuk sistem optik.[8] Paduan berilium-tembaga juga digunakan sebagai bahan pengeras dalam "pistol Jason", yang digunakan untuk mengelupas cat dari lambung kapal.[82]
Berilium juga digunakan untuk kantilever dalam styli kartrid fonograf berkinerja tinggi, di mana kekakuannya yang ekstrem dan massa jenisnya yang rendah memungkinkan bobot pelacakan dikurangi menjadi 1 gram, namun tetap melacak bagian frekuensi tinggi dengan distorsi minimal.[83]
Aplikasi utama berilium sebelumnya adalah untuk rem pesawat militer karena kekerasannya, titik leburnya yang tinggi, dan kemampuannya yang luar biasa untuk menghilangkan panas. Pertimbangan lingkungan telah menyebabkan substitusi dengan bahan lain.[8]
Untuk mengurangi biaya, berilium dapat dipadukan dengan aluminium dalam jumlah yang signifikan, menghasilkan paduan AlBeMet (nama dagang). Campuran ini lebih murah daripada berilium murni, namun tetap mempertahankan banyak sifat yang diinginkan.
Cermin
[sunting | sunting sumber]Cermin berilium sangatlah menarik. Cermin berarea besar, seringkali dengan struktur pendukung sarang lebah, digunakan, misalnya, pada satelit meteorologi di mana berat rendah dan stabilitas dimensi jangka panjang sangat penting. Cermin berilium yang lebih kecil digunakan dalam sistem panduan optik dan sistem pengendali tembakan, misalnya pada tank tempur utama Leopard 1 dan Leopard 2 buatan Jerman. Dalam sistem ini, diperlukan gerakan cermin yang sangat cepat yang sekali lagi menentukan massa rendah dan kekakuan tinggi. Biasanya cermin berilium dilapisi dengan pelapisan nikel nirlistrik yang keras yang dapat lebih mudah dipoles hingga hasil akhir optik yang lebih halus daripada berilium. Namun, dalam beberapa aplikasi, blanko berilium dipoles tanpa lapisan apa pun. Hal ini terutama berlaku untuk operasi kriogenik di mana ketidaksesuaian ekspansi termal dapat menyebabkan lapisan tertekuk.[8]
Teleskop Luar Angkasa James Webb memiliki 18 bagian berilium heksagonal untuk cerminnya, masing-masing dilapisi dengan lapisan emas tipis.[84] Karena JWST akan menghadapi suhu 33 K, cermin tersebut terbuat dari berilium berlapis emas, yang mampu menangani dingin ekstrem lebih baik daripada kaca. Berilium berkontraksi dan berubah bentuk lebih kecil dari kaca – dan tetap lebih seragam – dalam suhu seperti itu.[85] Untuk alasan yang sama, optika Teleskop Ruang Angkasa Spitzer seluruhnya terbuat dari logam berilium.[86]
Aplikasi magnetis
[sunting | sunting sumber]
Berilium adalah nonmagnetik. Oleh karena itu, alat-alat yang dibuat dari bahan berbasis berilium digunakan oleh tim penjinak bahan peledak angkatan laut atau militer yang bekerja di atau dekat ranjau laut, karena ranjau ini umumnya memiliki murang magnetis.[88] Mereka juga ditemukan dalam bahan pemeliharaan dan konstruksi di dekat mesin pencitraan resonansi magnetik (MRI) karena medan magnet tinggi yang dihasilkan.[89] Di bidang komunikasi radio dan radar yang kuat (biasanya militer, perkakas tangan yang terbuat dari berilium digunakan untuk menyetel klistron, magnetron, dan tabung gelombang berjalan yang sangat magnetis, yang digunakan untuk menghasilkan daya gelombang mikro tingkat tinggi pada pemancar.[90]
Aplikasi nuklir
[sunting | sunting sumber]Pelat tipis atau foil berilium kadang-kadang digunakan dalam desain senjata nuklir sebagai lapisan paling luar dari biji plutonium pada tahap utama bom termonuklir, ditempatkan untuk mengelilingi bahan fisil. Lapisan-lapisan berilium ini adalah "pendorong" yang baik untuk delakan plutonium-239, dan mereka adalah reflektor neutron yang baik, seperti pada reaktor nuklir yang dimoderasi berilium.[91]
Berilium juga biasa digunakan di beberapa sumber neutron pada perangkat laboratorium yang membutuhkan relatif sedikit neutron (daripada harus menggunakan reaktor nuklir, atau generator neutron bertenaga akselerator partikel). Untuk tujuan ini, target berilium-9 dibombardir dengan partikel alfa energetik dari sebuah radioisotop seperti polonium-210, radium-226, plutonium-238, atau amerisium-241. Dalam reaksi nuklir yang terjadi, inti berilium ditransmutasikan menjadi karbon-12, dan satu neutron bebas dipancarkan, bergerak ke arah yang sama dengan arah partikel alfa. Sumber-sumber neutron berilium yang digerakkan oleh peluruhan alfa, yang dinamai inisiator neutron "urchin" digunakan dalam beberapa bom atom awal.[91] Sumber neutron di mana berilium dibombardir dengan sinar gama dari sebuah radioisotop yang meluruh melalui peluruhan gama, juga digunakan untuk menghasilkan neutron laboratorium.[92]

Berilium juga digunakan dalam pembuatan bahan bakar untuk reaktor CANDU. Elemen bahan bakar memiliki pelengkap kecil yang resistan dibrazing ke kelongsong bahan bakar menggunakan proses pematerian induksi dengan Be sebagai bahan pengisi brazing. Bantalan bearing dibrazing di tempat untuk mencegah kontak antara bundel bahan bakar dan tabung tekanan yang mengandungnya, dan bantalan spacer antarelemen dibrazing untuk mencegah kontak elemen ke elemen.
Berilium juga digunakan di laboratorium penelitian fusi nuklir Joint European Torus, dan akan digunakan di ITER yang lebih maju untuk mengondisikan komponen yang berhadapan dengan plasma.[93] Berilium juga telah diusulkan sebagai bahan kelongsong untuk batang bahan bakar nuklir, karena kombinasi sifat mekanik, kimia, dan nuklirnya yang baik.[8] Berilium fluorida adalah salah satu garam konstituen dari campuran garam eutektik FLiBe, yang digunakan sebagai pelarut, moderator, dan pendingin dalam banyak desain reaktor garam cair, termasuk reaktor fluorida torium cair (LFTR).[94]
Akustika
[sunting | sunting sumber]Berat yang rendah dan kekakuan berilium yang tinggi membuatnya berguna sebagai bahan untuk speaker driver frekuensi tinggi. Karena berilium berharga mahal (berkali-kali lebih mahal daripada titanium), sulit dibentuk karena kerapuhannya, dan beracun jika salah penanganan, tweeter berilium terbatas pada aplikasi rumah kelas atas,[95][96][97] audio pro, dan alamat publik.[98][99] Beberapa produk fidelitas tinggi secara curang diklaim terbuat dari bahan tersebut.[100]
Beberapa kartrid fonograf kelas atas menggunakan kantilever berilium untuk meningkatkan pelacakan dengan mengurangi massa.[101]
Elektronika
[sunting | sunting sumber]Berilium adalah dopan tipe-p dala senyawa semikonduktor III-V. Ia banyak digunakan dalam bahan-bahan seperti GaAs, AlGaAs, InGaAs, dan InAlAs yang ditanam oleh epitaksi berkas molekul (MBE).[102] Lembar berilium yang digulung silang adalah dukungan struktural yang sangat baik untuk papan sirkuit cetak pada teknologi pemasangan permukaan. Dalam aplikasi elektronika kritis, berilium merupakan penopang struktural dan pembuang panas. Aplikasi ini juga membutuhkan koefisien thermal expansion ekspansi termal yang cocok dengan substrat alumina dan kaca polimida. Komposit berilium-berilium oksida "E-Material" telah dirancang khusus untuk aplikasi elektronika ini dan memiliki keuntungan tambahan bahwa koefisien ekspansi termal dapat disesuaikan agar sesuai dengan bahan substrat yang beragam.[8]
Berilium oksida berguna untuk banyak aplikasi yang memerlukan sifat gabungan dari insulator listrik dan konduktor panas yang sangat baik, dengan kekuatan dan kekerasan tinggi, serta titik lebur yang sangat tinggi. Berilium oksida sering digunakan sebagai pelat dasar insulator pada transistor daya tinggi pada pemancar frekuensi radio untuk telekomunikasi. Berilium oksida juga sedang dipelajari untuk digunakan dalam meningkatkan konduktivitas termal pelet bahan bakar nuklir uranium dioksida.[103] Senyawa berilium digunakan dalam tabung lampu fluoresen, tetapi penggunaan ini dihentikan karena penyakit beriliosis yang berkembang pada pekerja yang membuat tabung.[104]
Kesehatan
[sunting | sunting sumber]Berilium adalah komponen dari beberapa paduan gigi.[105][106]
Toksisitas dan keamanan
[sunting | sunting sumber]| Bahaya | |
|---|---|
| Piktogram GHS |  
|
| Keterangan bahaya GHS | {{{value}}} |
| H301, H315, H317, H319, H330, H335, H350, H372 | |
| P201, P202, P280, P302, P352, P304, P340, P310, P305+351+338 | |
Efek biologis
[sunting | sunting sumber]Sekitar 35 mikrogram berilium ditemukan dalam tubuh manusia rata-rata, jumlah yang tidak dianggap berbahaya.[108] Berilium secara kimiawi mirip dengan magnesium dan karenanya dapat menggantikannya dari enzim, yang menyebabkannya tidak berfungsi.[108] Karena Be2+ adalah ion yang bermuatan tinggi dan sangat kecil, ia dapat dengan mudah masuk ke banyak jaringan dan sel, di mana ia secara khusus menargetkan inti sel, menghambat banyak enzim, termasuk enzim yang digunakan untuk menyintesis DNA. Toksisitasnya diperburuk oleh fakta bahwa tubuh tidak memiliki sarana untuk mengontrol kadar berilium, dan begitu berada di dalam tubuh, berilium tidak dapat dihilangkan.[109]
Inhalation
[sunting | sunting sumber]Beriliosis kronis adalah penyakit granuloma paru-paru dan sistemik granuloma yang disebabkan oleh penghirupan debu atau asap yang terkontaminasi berilium; jumlah besar dalam waktu singkat atau jumlah kecil dalam waktu lama dapat menyebabkan penyakit ini. Gejala penyakit ini bisa memakan waktu hingga lima tahun untuk berkembang; sekitar sepertiga pasien yang mengidapnya meninggal dan yang selamat menjadi cacat.[108] Badan Penelitian Kanker Internasional (IARC) mencantumkan berilium dan senyawa berilium sebagai karsinogen Kategori 1.[110]
Paparan pekerjaan
[sunting | sunting sumber]Di AS, Administrasi Keselamatan dan Kesehatan Kerja (Occupational Safety and Health Administration, OSHA) telah menetapkan batas paparan yang diizinkan (permissible exposure limit, PEL) untuk berilium dan senyawa berilium sebesar 0,2 µg/m3 sebagai rata-rata tertimbang waktu (time-weighted average, TWA) 8 jam, dan 2,0 µg/m3 sebagai batas paparan jangka pendek selama periode pengambilan sampel 15 menit. Institut Nasional untuk Keselamatan dan Kesehatan Kerja (National Institute for Occupational Safety and Health, NIOSH) telah menetapkan ambang batas atas batas paparan yang direkomendasikan (recommended exposure limit, REL) sebesar 0,5 µg/m3. Nilai IDLH (immediately dangerous to life and health, langsung berbahaya bagi kehidupan dan kesehatan) adalah 4 mg/m3.[111] Toksisitas berilium setara dengan metaloid/logam beracun lainnya, seperti arsen dan raksa.[112][113]
Paparan berilium di tempat kerja dapat menyebabkan respons imun sensitisasi dan seiring waktu dapat mengembangkan penyakit berilium kronis (chronic beryllium disease, CBD).[114] NIOSH di Amerika Serikat meneliti efek ini bekerja sama dengan produsen besar produk berilium. NIOSH juga melakukan penelitian genetik tentang sensitisasi dan CBD, terlepas dari kolaborasi ini.[114]
Penyakit berilium akut dalam bentuk pneumonitis kimia pertama kali dilaporkan di Eropa pada tahun 1933 dan di Amerika Serikat pada tahun 1943. Sebuah survei menemukan bahwa sekitar 5% pekerja di pabrik yang memproduksi lampu fluoresen pada tahun 1949 di Amerika Serikat menderita penyakit paru-paru yang berhubungan dengan berilium.[115] Beriliosis kronis menyerupai sarkoidosis dalam banyak hal, dan diagnosis banding seringkali sulit untuk dilakukan. Penyakit ini membunuh beberapa pekerja awal dalam desain senjata nuklir, seperti Herbert L. Anderson.[116]
Berilium dapat ditemukan dalam terak batubara. Saat terak diformulasikan menjadi bahan abrasif untuk meledakkan cat dan karat dari permukaan yang keras, berilium dapat terbawa udara dan menjadi sumber paparan.[117]
Meskipun penggunaan senyawa berilium dalam tabung lampu fluoresen dihentikan pada tahun 1949, potensi paparan berilium ada dalam industri nuklir dan kedirgantaraan serta dalam pemurnian logam berilium dan peleburan paduan yang mengandung berilium, pembuatan perangkat elektronik, dan penanganan bahan lain yang mengandung berilium.[118]
Deteksi
[sunting | sunting sumber]Peneliti awal melakukan praktik yang sangat berbahaya untuk mengidentifikasi berilium dan berbagai senyawanya dari rasanya yang manis. Identifikasi sekarang dilakukan dengan menggunakan teknik diagnostik modern yang aman.[6] Sebuah tes yang berhasil untuk berilium di udara dan di permukaan telah dikembangkan dan diterbitkan sebagai standar konsensus sukarela internasional ASTM D7202. Prosedur ini menggunakan amonium bifluorida encer untuk disolusi dan deteksi fluoresensi dengan berilium yang terikat pada hidroksibenzokuinolin tersulfonasi, yang memungkinkan deteksi sensitif hingga 100 kali lebih banyak daripada batas yang direkomendasikan untuk konsentrasi berilium di tempat kerja. Fluoresensi meningkat seiring dengan meningkatnya konsentrasi berilium. Prosedur baru ini telah berhasil diuji pada berbagai permukaan dan efektif untuk disolusi dan deteksi berilium oksida refraktori dan berilium silika dalam konsentrasi kecil (ASTM D7458).[119][120] Manual Metode Analitik NIOSH berisi metode untuk mengukur paparan berilium di tempat kerja.[121]
Referensi
[sunting | sunting sumber]- ^ (Indonesia) "Berilium". KBBI Daring. Diakses tanggal 17 Juli 2022.
- ^ Be(0) telah teramati; lihat "Beryllium(0) Complex Found". Chemistry Europe. 13 Juni 2016.
- ^ "Beryllium: Beryllium(I) Hydride compound data" (PDF). bernath.uwaterloo.ca. Diakses tanggal 16 Juli 2022.
- ^ Lide, D. R., ed. (2005). CRC Handbook of Chemistry and Physics (edisi ke-86). Boca Raton (FL): CRC Press. hlm. 14-39. ISBN 0-8493-0486-5.
- ^ Weast, Robert (1984). CRC, Handbook of Chemistry and Physics. Boca Raton, Florida: Chemical Rubber Company Publishing. hlm. E110. ISBN 0-8493-0464-4.
- ^ a b c d e f g h i j k l m n o Jakubke, Hans-Dieter; Jeschkeit, Hans, ed. (1994). Concise Encyclopedia Chemistry. trans. rev. Eagleson, Mary. Berlin: Walter de Gruyter.
- ^ Puchta, Ralph (2011). "A brighter beryllium". Nature Chemistry. 3 (5): 416. Bibcode:2011NatCh...3..416P. doi:10.1038/nchem.1033. PMID 21505503.
- ^ a b c d e f g h i Behrens, V. (2003). "11 Beryllium". Dalam Beiss, P. Landolt-Börnstein – Group VIII Advanced Materials and Technologies: Powder Metallurgy Data. Refractory, Hard and Intermetallic Materials. Landolt-Börnstein - Group VIII Advanced Materials and Technologies. 2A1. Berlin: Springer. hlm. 667–677. doi:10.1007/10689123_36. ISBN 978-3-540-42942-5.
- ^ a b Hausner, Henry H. (1965). "Nuclear Properties". Beryllium its Metallurgy and Properties. University of California Press. hlm. 239. Diarsipkan dari versi asli tanggal 27 Juli 2020. Diakses tanggal 22 Maret 2023.
- ^ Tomberlin, T. A. (15 November 2004). "Beryllium – A Unique Material in Nuclear Applications" (PDF). Idaho National Laboratory. Idaho National Engineering and Environmental Laboratory. Diarsipkan dari versi asli (PDF) tanggal 22 Desember 2015.
- ^ "About Beryllium". US Department of Energy. Diarsipkan dari versi asli tanggal 22 Desember 2021. Diakses tanggal 22 Maret 2023.
- ^ Ekspong, G. (1992). Physics: 1981–1990. World Scientific. hlm. 172 ff. ISBN 978-981-02-0729-8. Diarsipkan dari versi asli tanggal 27 Juli 2020. Diakses tanggal 22 Maret 2023.
- ^ a b Emsley 2001, hlm. 56.
- ^ "Beryllium: Isotopes and Hydrology". University of Arizona, Tucson. Diarsipkan dari versi asli tanggal 26 Mei 2013. Diakses tanggal 22 Maret 2023.
- ^ Whitehead, N; Endo, S; Tanaka, K; Takatsuji, T; Hoshi, M; Fukutani, S; Ditchburn, Rg; Zondervan, A (Feb 2008). "A preliminary study on the use of (10)Be in forensic radioecology of nuclear explosion sites". Journal of Environmental Radioactivity. 99 (2): 260–70. doi:10.1016/j.jenvrad.2007.07.016. PMID 17904707.
- ^ Boyd, R. N.; Kajino, T. (1989). "Can Be-9 provide a test of cosmological theories?". The Astrophysical Journal. 336: L55. Bibcode:1989ApJ...336L..55B. doi:10.1086/185360.
- ^ Arnett, David (1996). Supernovae and nucleosynthesis. Princeton University Press. hlm. 223. ISBN 978-0-691-01147-9. Diarsipkan dari versi asli tanggal 27 Juli 2020. Diakses tanggal 22 Maret 2023.
- ^ Johnson, Bill (1993). "How to Change Nuclear Decay Rates". University of California, Riverside. Diarsipkan dari versi asli tanggal 29 Juni 2013. Diakses tanggal 22 Maret 2023.
- ^ Hammond, C. R. "Elements" dalam Lide, D. R., ed. (2005). CRC Handbook of Chemistry and Physics (edisi ke-86). Boca Raton (FL): CRC Press. ISBN 0-8493-0486-5.
- ^ Hansen, P. G.; Jensen, A. S.; Jonson, B. (1995). "Nuclear Halos". Annual Review of Nuclear and Particle Science. 45 (45): 591–634. Bibcode:1995ARNPS..45..591H. doi:10.1146/annurev.ns.45.120195.003111
 .
.
- ^ "Abundance in the sun". Mark Winter, The University of Sheffield and WebElements Ltd, UK. WebElements. Diarsipkan dari versi asli tanggal 27 Agustus 2011. Diakses tanggal 23 Maret 2023.
- ^ a b O'Neil, Marydale J.; Heckelman, Patricia E.; Roman, Cherie B., ed. (2006). The Merck Index: An Encyclopedia of Chemicals, Drugs, and Biologicals (edisi ke-14). Whitehouse Station, NJ, USA: Merck Research Laboratories, Merck & Co., Inc. ISBN 978-0-911910-00-1.
- ^ a b c Emsley 2001, hlm. 59.
- ^ "Abundance in oceans". Mark Winter, The University of Sheffield and WebElements Ltd, UK. WebElements. Diarsipkan dari versi asli tanggal 5 Agustus 2011. Diakses tanggal 23 Maret 2023.
- ^ "Abundance in stream water". Mark Winter, The University of Sheffield and WebElements Ltd, UK. WebElements. Diarsipkan dari versi asli tanggal 4 Agustus 2011. Diakses tanggal 23 Maret 2023.
- ^ "Search Minerals By Chemistry". www.mindat.org. Diarsipkan dari versi asli tanggal 6 Agustus 2021. Diakses tanggal 23 Maret 2023.
- ^ Walsh, Kenneth A (2009). "Sources of Beryllium". Beryllium chemistry and processing. hlm. 20–26. ISBN 978-0-87170-721-5. Diarsipkan dari versi asli tanggal 13 Mei 2016. Diakses tanggal 23 Maret 2023.
- ^ Mining, Society for Metallurgy, Exploration (U.S) (5 Maret 2006). "Distribution of major deposits". Industrial minerals & rocks: commodities, markets, and uses. hlm. 265–269. ISBN 978-0-87335-233-8. Diarsipkan dari versi asli tanggal 4 Mei 2016. Diakses tanggal 23 Maret 2023.
- ^ a b c d e f g h i Emsley 2001, hlm. 58.
- ^ "Sources of Beryllium". Materion Corporation. Diarsipkan dari versi asli tanggal 24 Desember 2016. Diakses tanggal 23 Maret 2023.
- ^ "Beryllim" Diarsipkan 3 Juli 2021 di Wayback Machine. in 2016 Minerals Yearbook. USGS (September 2018).
- ^ Уральский производитель изумрудов планирует выпускать стратегический металл бериллий Diarsipkan 11 Oktober 2021 di Wayback Machine.. TASS.ru (15 Mei 2019)
- ^ "Russia restarts beryllium production after 20 years". Eurasian Business Briefing. 20 Februari 2015. Diarsipkan dari versi asli tanggal 31 Juli 2017. Diakses tanggal 23 Maret 2023.
- ^ Arrowsmith, Merle; Braunschweig, Holger; Celik, Mehmet Ali; Dellermann, Theresa; Dewhurst, Rian D.; Ewing, William C.; Hammond, Kai; Kramer, Thomas; Krummenacher, Ivo (2016). "Neutral zero-valent s-block complexes with strong multiple bonding". Nature Chemistry. 8 (9): 890–894. Bibcode:2016NatCh...8..890A. doi:10.1038/nchem.2542. PMID 27334631.
- ^ Tomastik, C.; Werner, W.; Stori, H. (2005). "Oxidation of beryllium—a scanning Auger investigation". Nucl. Fusion. 45 (9): 1061. Bibcode:2005NucFu..45.1061T. doi:10.1088/0029-5515/45/9/005.
- ^ a b c Greenwood, Norman N.; Earnshaw, A. (1997), Chemistry of the Elements (edisi ke-2), Oxford: Butterworth-Heinemann, ISBN 0-7506-3365-4
- ^ a b Wiberg, Egon; Holleman, Arnold Frederick (2001). Inorganic Chemistry. Elsevier. ISBN 978-0-12-352651-9.
- ^ a b Alderghi, Lucia; Gans, Peter; Midollini, Stefano; Vacca, Alberto (2000). Sykes, A.G; Cowley, Alan, H., ed. "Aqueous Solution Chemistry of Beryllium". Advances in Inorganic Chemistry. San Diego: Academic Press. 50: 109–172. doi:10.1016/S0898-8838(00)50003-8. ISBN 9780120236503.
- ^ Bell, N.A. (1972). Advances in Inorganic Chemistry and Radiochemistry. 14. New York: Academic Press. hlm. 256–277. doi:10.1016/S0065-2792(08)60008-4. ISBN 978-0-12-023614-5.
- ^ Rosenheim, Arthur; Lehmann, Fritz (1924). "Über innerkomplexe Beryllate". Liebigs Ann. Chem. 440: 153–166. doi:10.1002/jlac.19244400115.
- ^ Schmidt, M.; Bauer, A.; Schier, A.; Schmidtbauer, H (1997). "Beryllium Chelation by Dicarboxylic Acids in Aqueous Solution". Z. Naturforsch. 53b (10): 2040–2043. doi:10.1021/ic961410k. PMID 11669821.
- ^ Mederos, A.; Dominguez, S.; Chinea, E.; Brito, F.; Middolini, S.; Vacca, A. (1997). "Recent aspects of the coordination chemistry of the very toxic cation beryllium(II): The search for sequestering agents". Bol. Soc. Chil. Quim. 42: 281.
- ^ a b Naglav, D.; Buchner, M. R.; Bendt, G.; Kraus, F. and Schulz, S. (2016). "Off the Beaten Track—A Hitchhiker's Guide to Beryllium Chemistry". Angew. Chem. Int. Ed. 55 (36): 10562–10576. doi:10.1002/anie.201601809. PMID 27364901.
- ^ Coates, G. E.; Francis, B. R. (1971). "Preparation of base-free beryllium alkyls from trialkylboranes. Dineopentylberyllium, bis((trimethylsilyl)methyl)beryllium, and an ethylberyllium hydride". Journal of the Chemical Society A: Inorganic, Physical, Theoretical: 1308. doi:10.1039/J19710001308.
- ^ Fischer, Ernst Otto; Hofmann, Hermann P. (1959). "Über Aromatenkomplexe von Metallen, XXV. Di-cyclopentadienyl-beryllium". Chemische Berichte. 92 (2): 482. doi:10.1002/cber.19590920233.
- ^ Nugent, K. W.; Beattie, J. K.; Hambley, T. W.; Snow, M. R. (1984). "A precise low-temperature crystal structure of Bis(cyclopentadienyl)beryllium". Australian Journal of Chemistry. 37 (8): 1601. doi:10.1071/CH9841601.
- ^ Almenningen, A.; Haaland, Arne; Lusztyk, Janusz (1979). "The molecular structure of beryllocene, (C5H5)2Be. A reinvestigation by gas phase electron diffraction". Journal of Organometallic Chemistry. 170 (3): 271. doi:10.1016/S0022-328X(00)92065-5.
- ^ Wong, C. H.; Lee, T. Y.; Chao, K. J.; Lee, S. (1972). "Crystal structure of bis(cyclopentadienyl)beryllium at −120 °C". Acta Crystallographica Section B. 28 (6): 1662. doi:10.1107/S0567740872004820.
- ^ Wiegand, G.; Thiele, K.-H. (1974). "Ein Beitrag zur Existenz von Allylberyllium- und Allylaluminiumverbindungen". Zeitschrift für Anorganische und Allgemeine Chemie (dalam bahasa Jerman). 405: 101–108. doi:10.1002/zaac.19744050111.
- ^ Chmely, Stephen C.; Hanusa, Timothy P.; Brennessel, William W. (2010). "Bis(1,3-trimethylsilylallyl)beryllium". Angewandte Chemie International Edition. 49 (34): 5870–5874. doi:10.1002/anie.201001866. PMID 20575128.
- ^ Ruhlandt-Senge, Karin; Bartlett, Ruth A.; Olmstead, Marilyn M.; Power, Philip P. (1993). "Synthesis and structural characterization of the beryllium compounds [Be(2,4,6-Me3C6H2)2(OEt2)], [Be{O(2,4,6-tert-Bu3C6H2)}2(OEt2)], and [Be{S(2,4,6-tert-Bu3C6H2)}2(THF)]⋅PhMe and determination of the structure of [BeCl2(OEt2)2]". Inorganic Chemistry. 32 (9): 1724–1728. doi:10.1021/ic00061a031.
- ^ Morosin, B.; Howatson, J. (1971). "The crystal structure of dimeric methyl-1-propynyl- beryllium-trimethylamine". Journal of Organometallic Chemistry. 29: 7–14. doi:10.1016/S0022-328X(00)87485-9.
- ^ a b Weeks 1968, hlm. 535.
- ^ a b Weeks 1968, hlm. 536.
- ^ Weeks 1968, hlm. 537.
- ^ Vauquelin, Louis-Nicolas (1798). "De l'Aiguemarine, ou Béril; et découverie d'une terre nouvelle dans cette pierre" [Akuamarin atau beril; dan penemuan tanah baru di batu ini]. Annales de Chimie. 26: 155–169. Diarsipkan dari versi asli tanggal 27 April 2016. Diakses tanggal 23 Maret 2023.
- ^ Dalam catatan kaki di page 169 Diarsipkan 23 Juni 2016 di Wayback Machine. dari (Vauquelin, 1798), editor menulis: "(1) La propriété la plus caractéristique de cette terre, confirmée par les dernières expériences de notre collègue, étant de former des sels d'une saveur sucrée, nous proposons de l'appeler glucine, de γλυκυς, doux, γλυκύ, vin doux, γλυκαιτω, rendre doux … Note des Rédacteurs." ((1) Sifat paling khas dari tanah ini, dikonfirmasi oleh percobaan terbaru dari rekan kami [Vauquelin], untuk membentuk garam dengan rasa manis, kami mengusulkan untuk menyebutnya glucine dari γλυκυς, manis, γλυκύ, anggur manis, γλυκαιτω, untuk membuat manis … Catatan editor.)
- ^ Klaproth, Martin Heinrich, Beitrage zur Chemischen Kenntniss der Mineralkörper (Kontribusi pada pengetahuan kimia zat mineral), vol. 3, (Berlin, (Jerman): Heinrich August Rottmann, 1802), pages 78–79 Diarsipkan 26 April 2016 di Wayback Machine.: "Als Vauquelin der von ihm im Beryll und Smaragd entdeckten neuen Erde, wegen ihrer Eigenschaft, süsse Mittelsalze zu bilden, den Namen Glykine, Süsserde, beilegte, erwartete er wohl nicht, dass sich bald nachher eine anderweitige Erde finden würde, welche mit völlig gleichem Rechte Anspruch an diesen Namen machen können. Um daher keine Verwechselung derselben mit der Yttererde zu veranlassen, würde es vielleicht gerathen seyn, jenen Namen Glykine aufzugeben, und durch Beryllerde (Beryllina) zu ersetzen; welche Namensveränderung auch bereits vom Hrn. Prof. Link, und zwar aus dem Grunde empfohlen worden, weil schon ein Pflanzengeschlecht Glycine vorhanden ist." (Ketika Vauquelin menganugerahkan – karena sifatnya membentuk garam manis – nama glycine, tanah-manis, pada tanah baru yang telah ditemukan olehnya di beryl dan smaragd, dia tentu tidak menyangka bahwa segera setelah itu akan ditemukan bumi lain yang dengan hak yang sama sepenuhnya dapat mengklaim nama ini. Oleh karena itu, untuk menghindari kebingungan dengan tanah-itria, mungkin disarankan untuk meninggalkan nama glycine dan menggantinya dengan tanah-beril (beryllina); perubahan nama yang mana juga direkomendasikan oleh Prof. Link, dan karena sudah ada genus tanaman Glycine.)
- ^ Weeks 1968, hlm. 538.
- ^ Wöhler, F. (1828). "Ueber das Beryllium und Yttrium" [On beryllium and yttrium]. Annalen der Physik und Chemie. 13 (89): 577–582. Bibcode:1828AnP....89..577W. doi:10.1002/andp.18280890805. Diarsipkan dari versi asli tanggal 26 April 2016. Diakses tanggal 23 Maret 2023.
- ^ Wöhler, Friedrich (1828). "Ueber das Beryllium und Yttrium". Annalen der Physik und Chemie. 89 (8): 577–582. Bibcode:1828AnP....89..577W. doi:10.1002/andp.18280890805. Diarsipkan dari versi asli tanggal 27 Mei 2016. Diakses tanggal 23 Maret 2023.
- ^ Bussy, Antoine (1828). "D'une travail qu'il a entrepris sur le glucinium". Journal de Chimie Médicale (4): 456–457. Diarsipkan dari versi asli tanggal 22 Mei 2016. Diakses tanggal 23 Maret 2023.
- ^ a b Weeks 1968, hlm. 539.
- ^ Boillat, Johann (27 Agustus 2016). From Raw Material to Strategic Alloys. The Case of the International Beryllium Industry (1919–1939). 1st World Congress on Business History, At Bergen – Norway. doi:10.13140/rg.2.2.35545.11363. Diarsipkan dari versi asli tanggal 30 Oktober 2021. Diakses tanggal 23 Maret 2023.
- ^ Kane, Raymond; Sell, Heinz (2001). "A Review of Early Inorganic Phosphors". Revolution in lamps: a chronicle of 50 years of progress. hlm. 98. ISBN 978-0-88173-378-5. Diarsipkan dari versi asli tanggal 7 Mei 2016. Diakses tanggal 23 Maret 2023.
- ^ Babu, R. S.; Gupta, C. K. (1988). "Beryllium Extraction – A Review". Mineral Processing and Extractive Metallurgy Review. 4: 39–94. doi:10.1080/08827508808952633.
- ^ Hammond, C.R. (2003). "The Elements". CRC handbook of chemistry and physics (edisi ke-84). Boca Raton, FL: CRC Press. hlm. 4–5. ISBN 978-0-8493-0595-5. Diarsipkan dari versi asli tanggal 13 Maret 2020. Diakses tanggal 23 Maret 2023.
- ^ "Beryllium Statistics and Information". United States Geological Survey. Diarsipkan dari versi asli tanggal 16 September 2008. Diakses tanggal 23 Maret 2023.
- ^ "Commodity Summary: Beryllium" (PDF). United States Geological Survey. Diarsipkan dari versi asli (PDF) tanggal 1 Juni 2010. Diakses tanggal 23 Maret 2023.
- ^ "Commodity Summary 2000: Beryllium" (PDF). United States Geological Survey. Diarsipkan dari versi asli (PDF) tanggal 16 Juli 2010. Diakses tanggal 23 Maret 2023.
- ^ "etymology online". Diarsipkan dari versi asli tanggal 30 Oktober 2020. Diakses tanggal 23 Maret 2023.
- ^ "Encyclopædia Britannica". Diarsipkan dari versi asli tanggal 23 Oktober 2021. Diakses tanggal 23 Maret 2023.
- ^ "Elemental Matter". Diarsipkan dari versi asli tanggal 29 November 2020. Diakses tanggal 23 Maret 2023.
- ^ Veness, R.; Ramos, D.; Lepeule, P.; Rossi, A.; Schneider, G.; Blanchard, S. "Installation and commissioning of vacuum systems for the LHC particle detectors" (PDF). CERN. Diarsipkan dari versi asli (PDF) tanggal 14 November 2011. Diakses tanggal 23 Maret 2023.
- ^ Wieman, H; Bieser, F.; Kleinfelder, S.; Matis, H. S.; Nevski, P.; Rai, G.; Smirnov, N. (2001). "A new inner vertex detector for STAR" (PDF). Nuclear Instruments and Methods in Physics Research Section A. 473 (1–2): 205. Bibcode:2001NIMPA.473..205W. doi:10.1016/S0168-9002(01)01149-4. Diarsipkan dari versi asli (PDF) tanggal 17 Oktober 2020. Diakses tanggal 23 Maret 2023.
- ^ Davis, Joseph R. (1998). "Beryllium". Metals handbook. ASM International. hlm. 690–691. ISBN 978-0-87170-654-6. Diarsipkan dari versi asli tanggal 27 Juli 2020. Diakses tanggal 23 Maret 2023.
- ^ Schwartz, Mel M. (2002). Encyclopedia of materials, parts, and finishes. CRC Press. hlm. 62. ISBN 978-1-56676-661-6. Diarsipkan dari versi asli tanggal 27 Juli 2020. Diakses tanggal 23 Maret 2023.
- ^ "Museum of Mountain Bike Art & Technology: American Bicycle Manufacturing". Diarsipkan dari versi asli tanggal 20 Juli 2011. Diakses tanggal 23 Maret 2023.
- ^ Ward, Wayne. "Aluminium-Beryllium". Ret-Monitor. Diarsipkan dari versi asli tanggal 1 Agustus 2010. Diakses tanggal 23 Maret 2023.
- ^ Collantine, Keith (8 Februari 2007). "Banned! – Beryllium". Diarsipkan dari versi asli tanggal 21 Juli 2012. Diakses tanggal 23 Maret 2023.
- ^ Geller, Elizabeth, ed. (2004). Concise Encyclopedia of Chemistry. New York City: McGraw-Hill. ISBN 978-0-07-143953-4.
- ^ "Defence forces face rare toxic metal exposure risk". The Sydney Morning Herald. 1 Februari 2005. Diarsipkan dari versi asli tanggal 30 Desember 2007. Diakses tanggal 23 Maret 2023.
- ^ Shure V15VxMR user's guide, Halaman 2
- ^ "The Webb Space Telescope Will Rewrite Cosmic History. If It Works". Quanta Magazine. 3 Desember 2021. Diarsipkan dari versi asli tanggal 5 Desember 2021. Diakses tanggal 23 Maret 2023.
- ^ Gardner, Jonathan P. (2007). "The James Webb Space Telescope" (PDF). Proceedings of Science: 5. Bibcode:2007mru..confE...5G. doi:10.22323/1.052.0005. Diarsipkan dari versi asli (PDF) tanggal 4 Juni 2016. Diakses tanggal 23 Maret 2023.
- ^ Werner, M. W.; Roellig, T. L.; Low, F. J.; Rieke, G. H.; Rieke, M.; Hoffmann, W. F.; Young, E.; Houck, J. R.; et al. (2004). "The Spitzer Space Telescope Mission". Astrophysical Journal Supplement. 154 (1): 1–9. arXiv:astro-ph/0406223
 . Bibcode:2004ApJS..154....1W. doi:10.1086/422992.
. Bibcode:2004ApJS..154....1W. doi:10.1086/422992.
- ^ Gray, Theodore. Gyroscope sphere. An example of the element Beryllium Diarsipkan 14 April 2021 di Wayback Machine.. periodictable.com
- ^ Kojola, Kenneth; Lurie, William (9 Agustus 1961). "The selection of low-magnetic alloys for EOD tools". Naval Weapons Plant Washington DC. Diarsipkan dari versi asli tanggal 23 Agustus 2011. Diakses tanggal 23 Maret 2023.
- ^ Dorsch, Jerry A.; Dorsch, Susan E. (2007). Understanding anesthesia equipment. Lippincott Williams & Wilkins. hlm. 891. ISBN 978-0-7817-7603-5. Diarsipkan dari versi asli tanggal 27 Juli 2020. Diakses tanggal 23 Maret 2023.
- ^ Ropp, Richard C. (31 Desember 2012). Encyclopedia of the Alkaline Earth Compounds. hlm. 7. ISBN 9780444595539. Diarsipkan dari versi asli tanggal 11 Mei 2016. Diakses tanggal 23 Maret 2023.
- ^ a b Barnaby, Frank (1993). How nuclear weapons spread. Routledge. hlm. 35. ISBN 978-0-415-07674-6. Diarsipkan dari versi asli tanggal 27 Juli 2020. Diakses tanggal 23 Maret 2023.
- ^ Byrne, J. Neutrons, Nuclei, and Matter, Dover Publications, Mineola, NY, 2011, ISBN 0486482383, hlm. 32–33.
- ^ Clark, R. E. H.; Reiter, D. (2005). Nuclear fusion research. Springer. hlm. 15. ISBN 978-3-540-23038-0. Diarsipkan dari versi asli tanggal 27 Juli 2020. Diakses tanggal 23 Maret 2023.
- ^ Petti, D.; Smolik, G.; Simpson, M.; Sharpe, J.; Anderl, R.; Fukada, S.; Hatano, Y.; Hara, M.; et al. (2006). "JUPITER-II molten salt Flibe research: An update on tritium, mobilization and redox chemistry experiments". Fusion Engineering and Design. 81 (8–14): 1439. doi:10.1016/j.fusengdes.2005.08.101. OSTI 911741. Diarsipkan dari versi asli tanggal 26 April 2021. Diakses tanggal 23 Maret 2023.
- ^ "Scan Speak offers Be tweeters to OEMs and Do-It-Yourselfers" (PDF). Scan Speak. Mei 2010. Diarsipkan dari versi asli (PDF) tanggal 3 Maret 2016.
- ^ Johnson, John E. Jr. (12 November 2007). "Usher Be-718 Bookshelf Speakers with Beryllium Tweeters". Diarsipkan dari versi asli tanggal 13 Juni 2011. Diakses tanggal 23 Maret 2023.
- ^ "Exposé E8B studio monitor". KRK Systems. Diarsipkan dari versi asli tanggal 10 April 2011. Diakses tanggal 12 Februari 2009.
- ^ "Beryllium use in pro audio Focal speakers". Diarsipkan dari versi asli tanggal 31 Desember 2012.
- ^ "VUE Audio announces use of Be in Pro Audio loudspeakers". VUE Audiotechnik. Diarsipkan dari versi asli tanggal 10 Mei 2012. Diakses tanggal 23 Maret 2023.
- ^ Svilar, Mark (8 Januari 2004). "Analysis of "Beryllium" Speaker Dome and Cone Obtained from China". Diarsipkan dari versi asli tanggal 17 Mei 2013. Diakses tanggal 23 Maret 2023.
- ^ "Shure V15 VXmR User Guide" (PDF). Diarsipkan dari versi asli (PDF) tanggal 10 Januari 2017. Diakses tanggal 23 Maret 2023.
- ^ Diehl, Roland (2000). High-power diode lasers. Springer. hlm. 104. ISBN 978-3-540-66693-6. Diarsipkan dari versi asli tanggal 27 Juli 2020. Diakses tanggal 23 Maret 2023.
- ^ "Purdue engineers create safer, more efficient nuclear fuel, model its performance". Purdue University. 27 September 2005. Diarsipkan dari versi asli tanggal 27 Mei 2012. Diakses tanggal 23 Maret 2023.
- ^ Breslin AJ (1966). "Ch. 3. Exposures and Patterns of Disease in the Beryllium Industry". Dalam Stokinger, HE. Beryllium: Its Industrial Hygiene Aspects. Academic Press, New York. hlm. 30–33. ISBN 978-0126718508.
- ^ OSHA Hazard Information Bulletin HIB 4 Februari 2019 (rev. 14 Mei 2002) Preventing Adverse Health Effects From Exposure to Beryllium in Dental Laboratories
- ^ Elshahawy, W.; Watanabe, I. (2014). "Biocompatibility of dental alloys used in dental fixed prosthodontics". Tanta Dental Journal. 11 (2): 150–159. doi:10.1016/j.tdj.2014.07.005
 .
.
- ^ "Beryllium 265063". Sigma-Aldrich. 24 Juli 2021. Diarsipkan dari versi asli tanggal 11 April 2021. Diakses tanggal 23 Maret 2023.
- ^ a b c Emsley 2001, hlm. 57.
- ^ Venugopal, B. (14 Maret 2013). Physiologic and Chemical Basis for Metal Toxicity. Springer. hlm. 167–8. ISBN 9781468429527.
- ^ "Beryllium and Beryllium Compounds". IARC Monograph. 58. International Agency for Research on Cancer. 1993. Diarsipkan dari versi asli tanggal 31 Juli 2012. Diakses tanggal 23 Maret 2023.
- ^ "NIOSH Pocket Guide to Chemical Hazards #0054". National Institute for Occupational Safety and Health (NIOSH).
- ^ "CDC - NIOSH Pocket Guide to Chemical Hazards - Arsenic (inorganic compounds, as As)". Diarsipkan dari versi asli tanggal 11 Mei 2017. Diakses tanggal 23 Maret 2023.
- ^ NIOSH Pocket Guide to Chemical Hazards - Mercury compounds. The National Institute for Occupational Safety and Health (NIOSH). Diarsipkan 7 Mei 2021 di Wayback Machine.
- ^ a b "CDC – Beryllium Research- NIOSH Workplace Safety and Health Topic". www.cdc.gov. Diarsipkan dari versi asli tanggal 16 Desember 2016. Diakses tanggal 23 Maret 2023.
- ^ Emsley 2001, hlm. 5.
- ^ "Photograph of Chicago Pile One Scientists 1946". Office of Public Affairs, Argonne National Laboratory. 19 Juni 2006. Diarsipkan dari versi asli tanggal 11 Desember 2008. Diakses tanggal 23 Maret 2023.
- ^ Newport News Shipbuilding Workers Face a Hidden Toxin Diarsipkan 13 Januari 2014 di Wayback Machine., Daily Press Virginia, Michael Welles Shapiro, 31 Agustus 2013
- ^ International Programme on Chemical Safety (1990). "Beryllium: ENVIRONMENTAL HEALTH CRITERIA 106". World Health Organization. Diarsipkan dari versi asli tanggal 9 Juni 2011. Diakses tanggal 23 Maret 2023.
- ^ "ASTM D7458 –08". American Society for Testing and Materials. Diarsipkan dari versi asli tanggal 12 Juli 2010. Diakses tanggal 23 Maret 2023.
- ^ Minogue, E. M.; Ehler, D. S.; Burrell, A. K.; McCleskey, T. M.; Taylor, T. P. (2005). "Development of a New Fluorescence Method for the Detection of Beryllium on Surfaces". Journal of ASTM International. 2 (9): 13168. doi:10.1520/JAI13168.
- ^ "CDC – NIOSH Publications and Products – NIOSH Manual of Analytical Methods (2003–154) – Alpha List B". www.cdc.gov. Diarsipkan dari versi asli tanggal 16 Desember 2016. Diakses tanggal 23 Maret 2023.
Sumber yang dikutip
[sunting | sunting sumber]- Emsley, John (2001). Nature's Building Blocks: An A–Z Guide to the Elements
 . Oxford, Inggris, Britania Raya: Oxford University Press. ISBN 978-0-19-850340-8.
. Oxford, Inggris, Britania Raya: Oxford University Press. ISBN 978-0-19-850340-8. - Mackay, Kenneth Malcolm; Mackay, Rosemary Ann; Henderson, W. (2002). Introduction to modern inorganic chemistry (edisi ke-6). CRC Press. ISBN 978-0-7487-6420-4.
- Weeks, Mary Elvira; Leichester, Henry M. (1968). Discovery of the Elements
 . Easton, PA: Journal of Chemical Education. LCCCN 68-15217.
. Easton, PA: Journal of Chemical Education. LCCCN 68-15217.
Bacaan lebih lanjut
[sunting | sunting sumber]- Newman LS (2003). "Beryllium". Chemical & Engineering News. 81 (36): 38. doi:10.1021/cen-v081n036.p038.
- Mroz MM, Balkissoon R, Newman LS. "Beryllium". In: Bingham E, Cohrssen B, Powell C (eds.) Patty's Toxicology, Edisi kelima. New York: John Wiley & Sons 2001, 177–220.
- Walsh, KA, Beryllium Chemistry and Processing. Vidal, EE. dkk. Eds. 2009, Materials Park, OH:ASM International.
- Beryllium Lymphocyte Proliferation Testing (BeLPT). DOE Specification 1142–2001. Washington, DC: U.S. Department of Energy, 2001.
Pranala luar
[sunting | sunting sumber]| Cari tahu mengenai Berilium pada proyek-proyek Wikimedia lainnya: | |
| Definisi dan terjemahan dari Wiktionary | |
| Gambar dan media dari Commons | |
| Berita dari Wikinews | |
| Kutipan dari Wikiquote | |
| Teks sumber dari Wikisource | |
| Buku dari Wikibuku | |
- (Inggris) ATSDR Case Studies in Environmental Medicine: Beryllium Toxicity Departemen Kesehatan dan Layanan Masyarakat AS
- (Inggris) It's Elemental – Beryllium
- (Inggris) MSDS: ESPI Metals
- (Inggris) Beryllium di The Periodic Table of Videos (Universitas Nottingham)
- (Inggris) National Institute for Occupational Safety and Health – Beryllium Page
- (Inggris) National Supplemental Screening Program (Oak Ridge Associated Universities)
- (Inggris) Historic Price of Beryllium in USA
| (besar) | |||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | ||||||||||||||||
| 1 | H | He | |||||||||||||||||||||||||||||||
| 2 | Li | Be | B | C | N | O | F | Ne | |||||||||||||||||||||||||
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar | |||||||||||||||||||||||||
| 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | |||||||||||||||
| 5 | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | |||||||||||||||
| 6 | Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | |
| 7 | Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | |
|
| |||||||||||||||||||||||||||||||||



![{\displaystyle {\ce {[Be(H_2O)_4]^{2+}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/8c300bc0a3682a741d256b1a6a8dcb246a855239)
![{\displaystyle {\ce {[Be(H_{2}O)_{4}]^{2+}{+}nF^{-}\leftrightharpoons Be[(H_{2}O)_{2-n}F_{n}]^{(2-n)\pm }{+}nH_{2}O}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/9a912c3571a62ed845ae0e535cb0a611b1b19518)
![{\displaystyle {\ce {[Be_3O(H_2PO_4)_6]^{2-}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/4a5d9b088328a7ec7a57f65641f44ab8eab4e152)

![{\displaystyle {\ce {H_{2}A{+}[Be(H_{2}O)_{4}]^{2+}\leftrightharpoons [BeA(H_{2}O)_{2}]{+}2H^{+}{+}2H_{2}O}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/88afd13645c1b2eca86d7ba9ba8586abca494284)
![{\displaystyle {\ce {H_{2}A{+}[BeA(H_{2}O)_{2}]\leftrightharpoons [BeA_{2}]^{2-}{+}2H^{+}{+}2H_{2}O}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/a36992a15f44668eff511201715607bfbbfcdfaa)
![{\displaystyle {\ce {Na_4[Be_6(OCH_2(O)O)_6]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/eb11d9d4fdbfc6972b29c3f0da2932c7af31f59a)