Bromin
35Br Bromin | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 Bromin cair dan gas di dalam kubus transparan | ||||||||||||||||
Garis spektrum bromin | ||||||||||||||||
| Sifat umum | ||||||||||||||||
| Pengucapan | /bromin/[1] | |||||||||||||||
| Penampilan | gas/cairan: coklat kemerahan padatan: metalik | |||||||||||||||
| Bromin dalam tabel periodik | ||||||||||||||||
| ||||||||||||||||
| Nomor atom (Z) | 35 | |||||||||||||||
| Golongan | golongan 17 (halogen) | |||||||||||||||
| Periode | periode 4 | |||||||||||||||
| Blok | blok-p | |||||||||||||||
| Kategori unsur | nonlogam diatomik | |||||||||||||||
| Berat atom standar (Ar) |
| |||||||||||||||
| Konfigurasi elektron | [Ar] 4s2 3d10 4p5 | |||||||||||||||
| Elektron per kelopak | 2, 8, 18, 7 | |||||||||||||||
| Sifat fisik | ||||||||||||||||
| Fase pada STS (0 °C dan 101,325 kPa) | cair | |||||||||||||||
| Titik lebur | (Br2) 265,8 K (−7,2 °C, 19 °F) | |||||||||||||||
| Titik didih | (Br2) 332,0 K (58,8 °C, 137,8 °F) | |||||||||||||||
| Kepadatan mendekati s.k. | Br2, cairan: 3,1028 g/cm3 | |||||||||||||||
| Titik tripel | 265,90 K, 5,8 kPa[2] | |||||||||||||||
| Titik kritis | 588 K, 10,34 MPa[2] | |||||||||||||||
| Kalor peleburan | (Br2) 10,571 kJ/mol | |||||||||||||||
| Kalor penguapan | (Br2) 29,96 kJ/mol | |||||||||||||||
| Kapasitas kalor molar | (Br2) 75,69 J/(mol·K) | |||||||||||||||
Tekanan uap
| ||||||||||||||||
| Sifat atom | ||||||||||||||||
| Bilangan oksidasi | −1, +1, +3, +4, +5, +7 (oksida asam kuat) | |||||||||||||||
| Elektronegativitas | Skala Pauling: 2,96 | |||||||||||||||
| Energi ionisasi | ke-1: 1139,9 kJ/mol ke-2: 2103 kJ/mol ke-3: 3470 kJ/mol | |||||||||||||||
| Jari-jari atom | empiris: 120 pm | |||||||||||||||
| Jari-jari kovalen | 120±3 pm | |||||||||||||||
| Jari-jari van der Waals | 185 pm | |||||||||||||||
| Lain-lain | ||||||||||||||||
| Kelimpahan alami | primordial | |||||||||||||||
| Struktur kristal | ortorombus | |||||||||||||||
| Kecepatan suara | 206 m/s (suhu 20 °C) | |||||||||||||||
| Konduktivitas termal | 0,122 W/(m·K) | |||||||||||||||
| Resistivitas listrik | 7,8×1010 Ω·m (suhu 20 °C) | |||||||||||||||
| Arah magnet | diamagnetik[3] | |||||||||||||||
| Suseptibilitas magnetik molar | −56,4×10−6 cm3/mol[4] | |||||||||||||||
| Nomor CAS | 7726-95-6 | |||||||||||||||
| Sejarah | ||||||||||||||||
| Penemuan dan isolasi pertama | Antoine J. Balard dan Carl J. Löwig (1825) | |||||||||||||||
| Isotop bromin yang utama | ||||||||||||||||
| ||||||||||||||||
Bromin atau brom adalah sebuah unsur kimia dengan lambang Br dan nomor atom 35. Ia adalah cairan berwarna merah-cokelat yang bersifat volatil pada suhu kamar yang mudah menguap membentuk uap berwarna serupa. Sifat-sifatnya berada di antara klorin dan iodin. Ia diisolasi secara independen oleh dua kimiawan, Carl J. Löwig (pada tahun 1825) dan Antoine J. Balard (pada tahun 1826). Nama unsur ini berasal dari bahasa Yunani Kuno βρῶμος (bromos) yang berarti "bau busuk" atau "berbau pesing", merujuk pada baunya yang tajam dan menyengat.
Bromin elemental sangat bersifat reaktif sehingga ia tidak terjadi sebagai unsur asli di alam, melainkan terjadi pada garam halida mineral kristalin yang nirwarna dan larut, analog dengan garam dapur. Faktanya, bromin dan semua halogen sangatlah reaktif sehingga mereka akan membentuk ikatan yang berpasangan—tidak pernah dalam atom tunggal. Meskipun agak jarang di kerak Bumi, kelarutan ion bromida (Br−) yang tinggi telah menyebabkan akumulasinya di lautan. Secara komersial, unsur ini mudah diekstraksi dari kolam evaporasi air asin, kebanyakan di Amerika Serikat dan Israel. Massa bromin di lautan kira-kira 1⁄300 dari klorin.
Pada kondisi standar untuk suhu dan tekanan, ia adalah cairan; satu-satunya unsur lain yang cair dalam kondisi ini adalah raksa. Pada suhu tinggi, senyawa organobromin mudah berdisosiasi untuk menghasilkan atom bromin bebas, sebuah proses yang menghentikan reaksi rantai kimia radikal bebas. Efek ini membuat senyawa organobromin bermanfaat sebagai penghambat api, dan lebih dari separuh bromin yang diproduksi di seluruh dunia setiap tahun digunakan untuk tujuan ini. Sifat yang sama ini dapat menyebabkan sinar matahari ultraungu memisahkan senyawa organobromin yang volatil di atmosfer untuk menghasilkan atom bromin bebas, menyebabkan penipisan ozon. Akibatnya, banyak senyawa organobromin—seperti pestisida metil bromida—tidak lagi digunakan. Senyawa bromin masih digunakan dalam fluida pengeboran sumur, film gulung, dan sebagai intermediat dalam pembuatan bahan kimia organik.
Sejumlah besar garam bromida bersifat racun dari aksi ion bromida terlarut, menyebabkan bromisme. Namun, peran biologis yang jelas untuk ion bromida dan asam hipobromit baru-baru ini telah dijelaskan, dan sekarang tampak bahwa bromin merupakan unsur yang penting pada manusia. Peran senyawa organobromin biologis dalam kehidupan laut seperti alga telah dikenal jauh lebih lama. Sebagai obat-obatan, ion bromida sederhana (Br−) memiliki efek penghambatan pada sistem saraf pusat, dan garam bromida pernah menjadi obat penenang medis utama, sebelum diganti dengan obat yang bekerja lebih pendek. Mereka mempertahankan penggunaan ceruk sebagai antiepilepsi.
Sejarah
[sunting | sunting sumber]
Bromin ditemukan secara terpisah oleh dua kimiawan, Carl J. Löwig[5] dan Antoine J. Balard,[6][7] masing-masing pada tahun 1825 dan 1826.[8]
Löwig mengisolasi bromin dari mata air mineral dari kampung halamannya di Bad Kreuznach pada tahun 1825. Löwig menggunakan sebuah larutan garam mineral jenuh dengan klorin dan mengekstraksi bromin dengan dietil eter. Setelah penguapan eter, cairan cokelat tetap ada. Dengan cairan ini sebagai sampel karyanya, dia melamar posisi di laboratorium Leopold Gmelin di Heidelberg. Publikasi hasilnya ditunda dan Balard menerbitkan hasilnya terlebih dahulu.[9]
Balard menemukan bahan kimia bromin dalam abu rumput laut dari rawa garam Montpellier. Rumput laut itu digunakan untuk menghasilkan iodin, tetapi juga mengandung bromin. Balard kemudian mendistilasi bromin dari larutan abu rumput laut jenuh dengan klorin. Sifat-sifat zat yang dihasilkan berada di antara klorin dan iodin; jadi dia mencoba membuktikan bahwa zat itu adalah iodin monoklorida (ICl), tetapi setelah gagal melakukannya dia yakin bahwa dia telah menemukan unsur baru dan menamainya muride, berasal dari kata Latin muria ("air asin").[7][10][11]
Setelah kimiawan Prancis Louis N. Vauquelin, Louis J. Thénard, dan Joseph L. Gay-Lussac menyetujui percobaan apoteker muda Balard, hasilnya dipresentasikan pada kuliah di Académie des Sciences dan dipublikasikan di Annales de Chimie et Physique.[6] Dalam publikasinya, Balard menyatakan bahwa dia mengubah nama unsur itu dari muride menjadi brôme atas usul M. Anglada. Nama brôme (bromin) berasal dari bahasa Yunani βρῶμος (brômos, "bau busuk").[6][10][12][13] Sumber lain mengklaim bahwa kimiawan dan fisikawan Prancis Joseph L. Gay-Lussac mengusulkan nama brôme karena bau uapnya yang khas.[14][15] Bromin tidak diproduksi dalam jumlah besar hingga tahun 1858, ketika penemuan endapan garam di Stassfurt memungkinkan produksinya sebagai produk sampingan dari garam abu.[16]
Terlepas dari beberapa aplikasi medis kecil, penggunaan komersial pertamanya adalah daguerreotype. Pada tahun 1840, bromin ditemukan memiliki beberapa keunggulan dibandingkan uap iodin yang digunakan sebelumnya untuk membuat lapisan perak halida peka cahaya pada daguerreotype.[17]
Kalium bromida dan natrium bromida digunakan sebagai antikonvulsan dan obat penenang pada akhir abad ke-19 dan awal abad ke-20, tetapi secara bertahap digantikan oleh hidrat kloral dan kemudian oleh barbiturat.[18] Pada tahun-tahun awal Perang Dunia Pertama, senyawa bromin seperti xilil bromida digunakan sebagai gas beracun.[19]
Sifat
[sunting | sunting sumber]Bromin adalah halogen ketiga, dan merupakan nonlogam dalam golongan 17 dari tabel periodik. Dengan demikian, sifat-sifatnya mirip dengan fluorin, klorin, dan iodin, dan cenderung menjadi perantara antara dua halogen tetangganya, klorin, dan iodin. Bromin memiliki konfigurasi elektron [Ar]4s23d104p5, dengan tujuh elektron di kulit keempat dan terluar bertindak sebagai elektron valensi. Seperti semua halogen, ia kekurangan satu elektron dari oktet penuh, sehingga ia merupakan zat pengoksidasi yang kuat, bereaksi dengan banyak elemen untuk melengkapi kulit terluarnya.[20] Sesuai dengan tren periodik, elektronegativitasnya berada di antara klorin dan iodin (F: 3,98, Cl: 3,16, Br: 2,96, I: 2,66), sehingga ia kurang reaktif daripada klorin dan lebih reaktif daripada iodin. Ia juga merupakan zat pengoksidasi yang lebih lemah daripada klorin, tetapi lebih kuat daripada iodin. Sebaliknya, ion bromida adalah zat pereduksi yang lebih lemah daripada iodida, tetapi lebih kuat daripada klorida.[20] Kesamaan ini menyebabkan klorin, bromin, dan iodin bersama-sama diklasifikasikan sebagai salah satu tritunggal asli dari Johann W. Döbereiner, yang karyanya meramalkan hukum periodik unsur kimia.[21][22] Jari-jari atomnya berada di antara klorin dan iodin, dan ini menyebabkan banyak dari sifat atomnya yang memiliki nilai perantara yang sama antara klorin dan iodin, seperti energi ionisasi pertama, afinitas elektron, entalpi disosiasi molekul X2 (X = Cl, Br, I), jari-jari ionik, dan panjang ikatan X–X.[20] Volatilitas bromin menonjolkan baunya yang sangat tajam, mencekik, dan tidak sedap.[23]
Keempat halogen stabil mengalami gaya tarik-menarik gaya van der Waals antarmolekul, dan kekuatannya meningkat seiring dengan jumlah elektron di antara semua molekul halogen diatomik homonuklir. Dengan demikian, titik lebur dan titik didih bromin berada di antara klorin dan iodin. Sebagai hasil dari peningkatan berat molekul halogen ke bawah golongan, kepadatan serta kalor fusi dan penguapan bromin lagi-lagi berada di antara klorin dan iodin, meskipun semua kalor penguapan mereka cukup rendah (menyebabkan volatilitas tinggi) berkat struktur molekul diatomik mereka.[20] Semakin ke bawah golongan, warna halogen akan menjadi semakin gelap: fluorin adalah gas berwarna kuning sangat pucat, klorin berwarna kuning kehijauan, dan bromin adalah cairan volatil berwarna cokelat kemerahan yang melebur pada suhu −7,2 °C dan mendidih pada suhu 58,8 °C. (Iodin adalah padatan hitam mengilap.) Tren ini terjadi karena panjang gelombang cahaya tampak yang diserap oleh halogen akan semakin meningkat ke bawah golongan.[20] Secara khusus, warna halogen, seperti bromin, dihasilkan dari transisi elektron antara orbital molekul antiikatan πg terisi tertinggi dan orbital molekul σu antiikatan kosong terendah.[24] Warnanya akan memudar pada suhu rendah sehingga bromin padat pada suhu −195 °C berwarna kuning pucat.[20]
Seperti klorin dan iodin padat, bromin padat mengkristal dalam sistem kristal ortorombus, dalam susunan molekul Br2 berlapis. Jarak Br–Br adalah 227 pm (dekat dengan jarak gas Br–Br sebesar 228 pm) dan jarak Br···Br antarmolekul adalah 331 pm dalam satu lapisan dan 399 pm antarlapisan (bandingkan dengan jari-jari van der Waals dari bromin sebesar 195 pm). Struktur ini mengartikan bahwa bromin adalah konduktor listrik yang sangat buruk, dengan konduktivitas sekitar 5 × 10−13 Ω−1 cm−1 tepat di bawah titik lebur, meskipun nilai ini lebih tinggi daripada konduktivitas klorin yang pada dasarnya tidak terdeteksi.[20]
Pada tekanan 55 GPa (kira-kira 540.000 kali tekanan atmosfer), bromin mengalami transisi insulator-menjadi-logam. Pada tekanan 75 GPa, ia berubah menjadi struktur ortorombus berpusat-muka. Pada tekanan 100 GPa, ia berubah menjadi bentuk ortorombus berpusat-badan monoatomik.[25]
Isotop
[sunting | sunting sumber]Bromin memiliki dua isotop stabil, 79Br dan 81Br. Mereka berdua adalah satu-satunya isotop alami bromin, dengan 79Br membentuk 51% bromin alami dan 81Br membentuk 49% sisanya. Keduanya memiliki spin inti 3/2− sehingga dapat digunakan untuk resonansi magnet inti, meskipun 81Br lebih diminati. Distribusi relatif 1:1 dari dua isotop ini di alam sangat membantu dalam identifikasi senyawa yang mengandung bromin menggunakan spektroskopi massa. Semua isotop bromin lainnya bersifat radioaktif, dengan waktu paruh yang terlalu untuk terjadi di alam. Dari mereka, yang paling penting adalah 80Br (t1/2 = 17,7 menit), 80mBr (t1/2 = 4,421 jam), dan 82Br (t1/2 = 35,28 jam), yang mungkin dihasilkan dari aktivasi neutron dari bromin alami.[20] Radioisotop bromin yang paling stabil adalah 77Br (t1/2 = 57,04 jam). Mode peluruhan utama isotop yang lebih ringan dari 79Br adalah penangkapan elektron menjadi isotop selenium; isotop yang lebih berat dari 81Br mengalami peluruhan beta menjadi isotop kripton; dan 80Br dapat meluruh melalui salah satu dari dua mode tersebut menjadi 80Se atau 80Kr yang stabil. Isotop bromin mulai dari 87Br dan yang lebih berat mengalami peluruhan beta dengan emisi neutron sehingga secara praktis dianggap penting karena merupakan produk fisi; 87Br dengan waktu paruh 55 detik dikenal sebagai pemancar neutron tertunda yang berumur paling panjang.[26]
Kimia dan senyawa
[sunting | sunting sumber]| X | XX | HX | BX3 | AlX3 | CX4 |
|---|---|---|---|---|---|
| F | 159 | 574 | 645 | 582 | 456 |
| Cl | 243 | 428 | 444 | 427 | 327 |
| Br | 193 | 363 | 368 | 360 | 272 |
| I | 151 | 294 | 272 | 285 | 239 |
Reaktivitas bromin berada di antara klorin dan iodin, dan merupakan salah satu unsur yang paling reaktif. Energi ikatan bromin cenderung lebih rendah daripada klorin tetapi lebih tinggi daripada iodin, dan bromin adalah zat pengoksidasi yang lebih lemah daripada klorin tetapi lebih kuat daripada iodin. Hal ini dapat dilihat dari potensial elektroda standar pasangan X2/X− (F, +2,866 V; Cl, +1,395 V; Br, +1,087 V; I, +0,615 V; At, kira-kira +0,3 V). Brominasi sering menyebabkan keadaan oksidasi yang lebih tinggi daripada iodinasi tetapi menyebabkan keadaan oksidasi yang lebih rendah atau sama dengan klorinasi. Bromin cenderung bereaksi dengan senyawa meliputi ikatan M–M, M–H, atau M–C untuk membentuk ikatan M–Br.[24]
Hidrogen bromida
[sunting | sunting sumber]Senyawa bromin yang paling sederhana adalah hidrogen bromida, HBr. Ia digunakan terutama dalam produksi bromida anorganik dan alkil bromida, dan sebagai katalis untuk banyak reaksi dalam kimia organik. Secara industri, ia diproduksi terutama melalui pereaksian gas hidrogen dengan gas bromin pada suhu 200–400 °C dengan katalis platina. Namun, pereduksian bromin dengan fosforus merah merupakan cara yang lebih praktis untuk menghasilkan hidrogen bromida di laboratorium:[27]
- 2 P + 6 H2O + 3 Br2 → 6 HBr + 2 H3PO3
- H3PO3 + H2O + Br2 → 2 HBr + H3PO4
Pada suhu kamar, hidrogen bromida adalah gas nirwarna, seperti semua hidrogen halida selain hidrogen fluorida, karena hidrogen tidak dapat membentuk ikatan hidrogen yang kuat dengan atom bromin yang besar dan hanya sedikit elektronegatif; namun, ikatan hidrogen yang lemah terdapat dalam hidrogen bromida kristalin padat pada suhu rendah, serupa dengan struktur hidrogen fluorida, sebelum ketidakteraturan mulai berlaku saat suhu dinaikkan.[27] Hidrogen bromida berair dikenal sebagai asam bromida, yang merupakan asam kuat (pKa = −9) karena ikatan hidrogen dengan bromin terlalu lemah untuk menghambat disosiasi. Sistem HBr/H2O juga melibatkan banyak hidrat HBr·nH2O untuk n = 1, 2, 3, 4, dan 6, yang pada dasarnya adalah garam anion bromin dan kation hidronium. Asam bromida akan membentuk azeotrop dengan titik didih 124,3 °C pada 47,63 g HBr per 100 g larutan; dengan demikian asam bromida tidak dapat dipekatkan di luar titik ini melalui distilasi.[28]
Tidak seperti hidrogen fluorida, hidrogen bromida cair anhidrat sulit untuk digunakan sebagai pelarut, karena titik didihnya rendah, kisaran cairannya kecil, konstanta dielektriknya rendah, serta tidak terdisosiasi menjadi ion H2Br+ dan HBr−2 – namun, ion HBr−2 jauh lebih tidak stabil daripada ion bifluorida (HF−2) karena ikatan hidrogen yang sangat lemah antara hidrogen dan bromin, meskipun garamnya dengan kation yang sangat besar dan terpolarisasi lemah seperti Cs+ dan NR+4 (R = Me, Et, Bun) mungkin masih dapat diisolasi. Hidrogen bromida anhidrat adalah pelarut yang buruk, hanya mampu melarutkan senyawa molekul kecil seperti nitrosil klorida dan fenol, atau garam dengan energi kisi yang sangat rendah seperti tetraalkilamonium halida.[28]
Bromida biner lainnya
[sunting | sunting sumber]
Hampir semua unsur dalam tabel periodik membentuk bromida biner. Pengecualiannya jelas hanya sedikit dan dalam setiap kasus berasal dari salah satu dari tiga penyebab: kelengaian ekstrem dan keengganan untuk berpartisipasi dalam reaksi kimia (gas mulia, dengan pengecualian xenon dalam XeBr2); ketidakstabilan nuklir ekstrem yang menghambat penyelidikan kimia sebelum peluruhan dan transmutasi (banyak unsur terberat setelah bismut); dan memiliki keelektronegatifan yang lebih tinggi daripada bromin (oksigen, nitrogen, fluorin, dan klorin), sehingga senyawa biner yang dihasilkan secara formal bukanlah bromida melainkan oksida, nitrida, fluorida, atau klorida dari bromin. (Meski demikian, nitrogen tribromida dinamai sebagai bromida karena ia analog dengan nitrogen trihalida lainnya.)[29]
Brominasi logam dengan Br2 cenderung menghasilkan keadaan oksidasi yang lebih rendah daripada klorinasi dengan Cl2 ketika berbagai keadaan oksidasi tersedia. Bromida dapat dibuat dengan mereaksikan suatu unsur atau oksida, hidroksida, atau karbonatnya dengan asam bromida, dan kemudian didehidrasi dengan suhu agak tinggi serta dikombinasikan dengan tekanan rendah atau gas hidrogen bromida anhidrat. Metode ini bekerja paling baik bila produk bromida stabil terhadap hidrolisis; jika tidak, kemungkinannya meliputi brominasi oksidatif suhu tinggi dari unsur tersebut dengan bromin atau hidrogen bromida, brominasi suhu tinggi dari oksida atau halida logam lainnya oleh bromida, logam bromida yang volatil, karbon tetrabromida, atau sebuah bromida organik. Sebagai contoh, niobium(V) oksida akan bereaksi dengan karbon tetrabromida pada suhu 370 °C untuk membentuk niobium(V) bromida.[29] Metode lain adalah pertukaran halogen dengan adanya "reagen halogenasi" berlebih, misalnya:[29]
- FeCl3 + BBr3 (kelebihan) → FeBr3 + BCl3
Ketika bromida yang lebih rendah diinginkan, halida yang lebih tinggi dapat direduksi menggunakan hidrogen atau logam sebagai zat pereduksi, atau dekomposisi atau disproporsionasi termal dapat digunakan, sebagai berikut:[29]
- 3 WBr5 + Al 3 WBr4 + AlBr3
- EuBr3 + 12 H2 → EuBr2 + HBr
- 2 TaBr4 TaBr3 + TaBr5
Sebagian besar bromida logam dengan logam dalam keadaan oksidasi rendah (+1 hingga +3) bersifat ionik. Nonlogam cenderung membentuk molekul bromida kovalen, seperti halnya logam dalam keadaan oksidasi tinggi, mulai dari +3 ke atas. Bromida ionik dan kovalen dikenal untuk logam dalam keadaan oksidasi +3 (misalnya, skandium bromida hampir bersifat ionik, tetapi aluminium bromida tidak). Perak bromida sangat tidak larut dalam air sehingga sering digunakan sebagai uji kualitatif untuk bromin.[29]
Bromin halida
[sunting | sunting sumber]Halogen membentuk banyak senyawa antarhalogen diamagnetik biner dengan stoikiometri XY, XY3, XY5, dan XY7 (di mana X lebih berat dari Y), dan tak terkecuali bromin. Bromin membentuk monofluorida dan monoklorida, serta trifluorida dan pentafluorida. Beberapa turunan kationik dan anionik juga telah dikarakterisasi, seperti BrF−2, BrCl−2, BrF+2, BrF+4, dan BrF+6. Selain itu, beberapa pseudohalida juga dikenal, seperti sianogen bromida (BrCN), bromin tiosianat (BrSCN), dan bromin azida (BrN3).[30]
Bromin monofluorida (BrF) berwarna cokelat pucat bersifat tidak stabil pada suhu kamar, akan mengalami disproporsi dengan cepat dan ireversibel menjadi bromin, bromin trifluorida, dan bromin pentafluorida. Dengan demikian, ia tidak dapat diperoleh dalam bentuk murni. Ia dapat disintesis melalui reaksi langsung dari unsur-unsurnya, atau melalui komproporsionasi bromin dan bromin trifluorida pada suhu tinggi.[30] Bromin monoklorida (BrCl), gas berwarna merah-cokelat, cukup mudah berdisosiasi secara reversibel menjadi bromin dan klorin pada suhu kamar dan juga tidak dapat diperoleh dalam bentuk murni, meskipun ia dapat dibuat melalui reaksi langsung reversibel dari unsur-unsurnya dalam fase gas atau dalam karbon tetraklorida.[29] Bromin monofluorida dalam etanol dengan mudah mengarah ke monobrominasi senyawa aromatik PhX (para-brominasi terjadi untuk X = Me, But, OMe, Br; meta-brominasi terjadi untuk penonaktifan X = –CO2Et, –CHO, –NO2); hal ini disebabkan oleh fisi heterolitik ikatan Br–F, yang menyebabkan brominasi elektrofilik cepat oleh Br+.[29]
Pada suhu kamar, bromin trifluorida (BrF3) adalah cairan berwarna jerami. Ia dapat dibentuk dengan fluorinasi bromin langsung pada suhu kamar dan dimurnikan melalui distilasi. Ia akan bereaksi hebat dengan air dan meledak saat bersentuhan dengan bahan yang mudah terbakar, tetapi ia merupakan pereaksi fluorinasi yang kurang kuat dibandingkan klorin trifluorida. Ia bereaksi kuat dengan boron, karbon, silikon, arsen, antimon, iodin, dan belerang untuk menghasilkan fluorida, dan juga akan mengubah sebagian besar logam dan banyak senyawa logam menjadi fluorida; dengan demikian, ia digunakan untuk mengoksidasi uranium menjadi uranium heksafluorida dalam industri tenaga nuklir. Oksida tahan api cenderung hanya terfluorinasi sebagian, tetapi di sini turunan KBrF4 dan BrF2SbF6 tetap reaktif. Bromin trifluorida adalah pelarut pengion nonberair yang berguna, karena mudah terdisosiasi membentuk BrF+2 dan BrF−4 sehingga dapat menghantarkan listrik.[31]
Bromin pentafluorida (BrF5) pertama kali disintesis pada tahun 1930. Bromin pentafluorida diproduksi dalam skala besar melalui reaksi langsung bromin dengan kelebihan fluorin pada suhu lebih tinggi dari 150 °C, dan dalam skala kecil melalui fluorinasi kalium bromida pada suhu 25 °C. Ia juga akan bereaksi hebat dengan air dan merupakan agen fluorinasi yang sangat kuat, meskipun klorin trifluorida masih lebih kuat.[32]
Senyawa polibromin
[sunting | sunting sumber]Meskipun dibromin adalah zat pengoksidasi kuat dengan energi ionisasi pertama yang tinggi, pengoksidasi yang sangat kuat seperti peroksidisulfuril fluorida (S2O6F2) dapat mengoksidasinya untuk membentuk kation Br+2 berwarna merah ceri. Beberapa kation bromin lainnya telah diketahui, seperti Br+3 berwarna cokelat dan Br+5 berwarna cokelat tua.[33] Anion tribromida, Br−3, juga telah dikarakterisasi; ia analog dengan triiodida.[30]
Bromin oksida dan asam okso
[sunting | sunting sumber]| E°(pasangan) | a(H+) = 1 (asam) |
E°(pasangan) | a(OH−) = 1 (basa) |
|---|---|---|---|
| Br2/Br− | +1,052 | Br2/Br− | +1,065 |
| HOBr/Br− | +1,341 | BrO−/Br− | +0,760 |
| BrO−3/Br− | +1,399 | BrO−3/Br− | +0,584 |
| HOBr/Br2 | +1,604 | BrO−/Br2 | +0,455 |
| BrO−3/Br2 | +1,478 | BrO−3/Br2 | +0,485 |
| BrO−3/HOBr | +1,447 | BrO−3/BrO− | +0,492 |
| BrO−4/BrO−3 | +1,853 | BrO−4/BrO−3 | +1,025 |
Bromin oksida tidak dicirikan dengan baik seperti klorin oksida atau iodin oksida, karena semuanya cukup tidak stabil: ia pernah dianggap tidak ada sama sekali. Dibromin monoksida adalah padatan berwarna cokelat gelap yang cukup stabil pada suhu −60 °C, dan akan terurai pada titik leburnya, −17,5 °C; ia berguna dalam reaksi brominasi[35] dan dapat dibuat melalui dekomposisi suhu rendah dari bromin dioksida dalam ruang hampa. Ia dapat mengoksidasi iodin menjadi iodin pentoksida dan benzena menjadi 1,4-benzouinon; dalam larutan alkalin, ia akan memberikan anion hipobromit.[36]
Apa yang disebut "bromin dioksida", padatan kristalin berwarna kuning pucat, mungkin lebih baik diformulasikan sebagai bromin perbromat, BrOBrO3. Secara termal, ia tidak stabil di atas suhu −40 °C, dan akan terurai secara hebat menjadi unsur-unsurnya pada suhu 0 °C. Dibromin trioksida, sin-BrOBrO2, juga telah dikenal; ia adalah anhidrida dari asam hipobromit dan asam bromat. Ia adalah padatan kristalin berwarna oranye yang terurai di atas −40 °C; jika dipanaskan terlalu cepat, ia akan meledak pada suhu sekitar 0 °C. Beberapa radikal oksida tidak stabil lainnya juga telah dikenal, seperti juga beberapa oksida yang dikarakterisasi secara buruk, seperti dibromin pentoksida, tribromin oktoksida, dan bromin trioksida.[36]
Empat asam okso, asam hipobromit (HOBr), asam bromit (HOBrO), asam bromat (HOBrO2), dan asam perbromat (HOBrO3), telah dipelajari lebih baik karena kestabilan mereka yang lebih baik, meskipun hanya dalam larutan berair. Ketika bromin dilarutkan dalam larutan berair, reaksi berikut akan terjadi:[34]
Br2 + H2O  HOBr + H+ + Br−
HOBr + H+ + Br−Kac = 7,2 × 10−9 mol2 l−2 Br2 + 2 OH−  OBr− + H2O + Br−
OBr− + H2O + Br−Kalk = 2 × 108 mol−1 l
Asam hipobromit tidak stabil terhadap disproporsionasi. Dengan demikian, ion hipobromit akan membentuk disproporsional dengan mudah untuk menghasilkan bromida dan bromat:[34]
3 BrO−  2 Br− + BrO−3
2 Br− + BrO−3K = 1015
Asam bromit dan bromit sangat tidak stabil, meskipun stronsium dan barium bromit telah diketahui.[37] Yang lebih penting adalah bromat, yang dibuat dalam skala kecil melalui oksidasi bromida oleh hipoklorit berair, dan merupakan oksidator kuat. Tidak seperti klorat, yang terdisproporsi secara sangat lambat menjadi klorida dan perklorat, anion bromat bersifat stabil terhadap disproporsionasi baik dalam larutan asam maupun berair. Asam bromat adalah asam kuat. Bromida dan bromat dapat berkomproporsionasi menjadi bromin sebagai berikut:[37]
- BrO−3 + 5 Br− + 6 H+ → 3 Br2 + 3 H2O
Ada banyak usaha yang gagal untuk mendapatkan perbromat dan asam perbromat, yang menyebabkan beberapa rasionalisasi mengapa mereka seharusnya tidak ada, hingga tahun 1968 ketika anion bromat pertama kali dari peluruhan beta radioaktif 83SeO2−4 yang tidak stabil. Saat ini, perbromat diproduksi melalui oksidasi larutan bromat alkali oleh gas fluorin. Kelebihan bromat dan fluorida diendapkan sebagai perak bromat dan kalsium fluorida, dan larutan asam perbromat dapat dimurnikan. Ion perbromat cukup lengai pada suhu kamar, tetapi secara termodinamika sangat mengoksidasi, dengan zat pengoksidasi yang sangat kuat diperlukan untuk menghasilkannya, seperti fluorin atau xenon difluorida. Ikatan Br–O pada BrO−4 cukup lemah, yang sesuai dengan keengganan umum dari unsur-unsur 4p seperti arsen, selenium, dan bromin untuk mencapai keadaan oksidasi golongannya, karena mereka muncul setelah kontraksi skandida yang ditandai dengan pelindungan yang buruk yang dihasilkan oleh orbital 3d radial-simpul.[38]
Senyawa organobromin
[sunting | sunting sumber]
Seperti ikatan karbon–halogen lainnya, ikatan C–Br adalah gugus fungsi umum yang membentuk bagian dari kimia organik inti. Secara formal, senyawa dengan gugus fungsi ini dapat dianggap sebagai turunan organik dari anion bromida. Karena perbedaan keelektronegatifan antara bromin (2,96) dan karbon (2,55), atom karbon dalam ikatan C–Br kekurangan elektron sehingga bersifat elektrofilik. Reaktivitas senyawa organobromin menyerupai tetapi merupakan perantara antara reaktivitas senyawa organoklorin dan organoiodin. Untuk banyak aplikasi, organobromida mewakili kompromi reaktivitas dan biaya.[39]
Organobromida biasanya diproduksi melalui brominasi aditif atau substitutif dari prekursor organik lainnya. Bromin itu sendiri dapat digunakan, tetapi karena toksisitas dan volatilitasnya, biasanya digunakan reagen brominasi yang lebih aman, seperti N-bromosuksinimida. Reaksi utama untuk organobromida meliputi dehidrobrominasi, reaksi Grignard, kopling reduktif, dan substitusi nukleofilik.[39]
Organobromida adalah organohalida yang paling umum di alam, meskipun konsentrasi bromida hanya 0,3% dari konsentrasi klorida dalam air laut, karena oksidasi bromida yang mudah menjadi ekuivalen Br+, sebuah elektrofil kuat. Enzim bromoperoksidase mengatalisis reaksi ini.[40] Lautan diperkirakan melepaskan 1–2 juta ton bromoform dan 56.000 ton bromometana setiap tahunnya.[41]
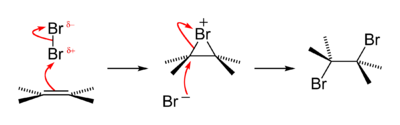
Uji kualitatif lama untuk menguji keberadaan gugus fungsi alkena adalah bahwa alkena dapat mengubah larutan bromin berair berwarna cokelat menjadi tidak berwarna, membentuk bromohidrin dengan beberapa dibromoalkana juga dihasilkan. Reaksi ini melewati perantara bromonium elektrofilik yang berumur pendek. Ini adalah salah satu contoh reaksi adisi halogen.[42]
Keterjadian dan produksi
[sunting | sunting sumber]
Bromin secara signifikan kurang melimpah di kerak Bumi daripada fluorin atau klorin, yang hanya terdiri dari 2,5 bagian per juta batuan kerak Bumi, dan kemudian hanya sebagai garam bromida. Ia adalah unsur paling melimpah ke-46 di kerak Bumi. Ia secara signifikan lebih melimpah di lautan, akibat dari pelindian jangka panjang. Di sana, ia memiliki konsentrasi sebesar 65 bagian per juta, sesuai dengan rasio sekitar satu atom bromin untuk setiap 660 atom klorin. Danau garam dan sumur air asin mungkin memiliki konsentrasi bromin yang lebih tinggi: misalnya, Laut Mati mengandung 0,4% ion bromida.[43] Dari sumber inilah ekstraksi bromin sebagian besar dinilai layak secara ekonomi.[44][45][46]
Sumber utama produksi bromin adalah Israel dan Yordania.[47] Unsur ini dibebaskan melalui pertukaran halogen, menggunakan gas klorin untuk mengoksidasi Br− menjadi Br2. Ia kemudian dihilangkan dengan semburan uap atau udara, dan kemudian dipadatkan dan dimurnikan.[48] Saat ini, bromin diangkut dalam drum logam berkapasitas besar atau tangki berlapis timbal yang dapat menampung ratusan kilogram atau bahkan berton-ton bromin. Industri bromin berukuran sekitar seperseratus dari industri klorin. Produksi laboratorium tidak diperlukan karena brom tersedia secara komersial dan memiliki umur simpan yang lama.[49]
Aplikasi
[sunting | sunting sumber]Berbagai macam senyawa organobromin digunakan dalam industri. Beberapa di antaranya dibuat dari bromin dan lainnya dibuat dari hidrogen bromida, yang diperoleh dengan membakar hidrogen dalam bromin.[50]
Penghambat nyala
[sunting | sunting sumber]
Penghambat nyala terbrominasi mewakili komoditas yang semakin penting, dan merupakan penggunaan bromin komersial terbesar. Ketika bahan brominasi terbakar, penghambat nyala akan menghasilkan asam bromida yang dapat mengganggu reaksi rantai radikal dari reaksi oksidasi api. Mekanismenya adalah radikal hidrogen, radikal oksigen, dan radikal hidroksi yang sangat reaktif bereaksi dengan asam bromida untuk membentuk radikal bromin yang kurang reaktif (yaitu atom bromin bebas). Atom bromin juga dapat bereaksi langsung dengan radikal lain untuk membantu menghentikan reaksi berantai radikal bebas yang menjadi ciri pembakaran.[51][52]
Untuk membuat polimer dan plastik terbrominasi, senyawa yang mengandung bromin dapat dimasukkan ke dalam polimer selama polimerisasi. Salah satu metodenya adalah dengan memasukkan sejumlah kecil monomer terbrominasi selama proses polimerisasi. Misalnya, vinil bromida dapat digunakan dalam produksi polietilena, polivinil klorida, atau polipropilena. Molekul khusus yang sangat terbrominasi juga dapat ditambahkan yang akan berpartisipasi dalam proses polimerisasi. Misalnya, tetrabromobisfenol A dapat ditambahkan pada poliester atau resin epoksi, di mana ia akan menjadi bagian dari polimer tersebut. Epoksi yang digunakan dalam papan sirkuit cetak biasanya dibuat dari resin penghambat nyala tersebut, ditunjukkan dengan singkatan FR dalam produk (FR-4 dan FR-2). Dalam beberapa kasus, senyawa yang mengandung bromin dapat ditambahkan setelah polimerisasi. Misalnya, dekabromodifenil eter dapat ditambahkan pada polimer akhir.[53]
Sejumlah senyawa halometana terbrominasi yang berbentuk gas atau sangat volatil bersifat tidak beracun dan membuat agen penekan api yang unggul dengan mekanisme yang sama, serta sangat efektif digunakan di dalam ruangan tertutup seperti kapal selam, pesawat terbang, dan wahana antariksa. Namun, mereka berharga mahal serta produksi dan penggunaannya telah sangat dibatasi karena efeknya sebagai agen perusak ozon. Mereka tidak lagi digunakan dalam alat pemadam api rutin, tetapi mempertahankan penggunaan ceruk dalam aplikasi pencegah kebakaran otomatis kedirgantaraan dan militer. Mereka meliputi bromoklorometana (Halon 1011, CH2BrCl), bromoklorodifluorometana (Halon 1211, CBrClF2), dan bromotrifluorometana (Halon 1301, CBrF3).[54]
Kegunaan lainnya
[sunting | sunting sumber]
Perak bromida digunakan, baik sendiri atau dalam kombinasi dengan perak klorida dan perak iodida, sebagai konstituen yang peka cahaya dari emulsi fotografi.[49]
Etilena bromida adalah sebuah zat aditif dalam bensin yang mengandung zat timbal anti-ketukan mesin. Ia mengais timbal dengan membentuk timbal bromida yang volatil, yang habis dari mesin. Aplikasi ini menyumbang 77% dari penggunaan bromin pada tahun 1966 di Amerika Serikat. Aplikasi ini telah menurun sejak tahun 1970 karena peraturan lingkungan (lihat di bawah).[55]
Minyak nabati terbrominasi (BVO), sebuah campuran kompleks trigliserida yang berasal dari tumbuhan yang telah direaksikan untuk mengandung atom unsur bromin yang terikat pada molekul, digunakan terutama untuk membantu mengemulsi minuman ringan rasa jeruk, mencegahnya terpisah selama distribusi.
Bromometana beracun banyak digunakan sebagai pestisida untuk mengasapi tanah dan mengasapi perumahan, dengan metode penendaan. Etilena bromida juga digunakan dengan cara yang sama.[56] Senyawa organobromin yang volatil ini semuanya sekarang diatur sebagai agen penipisan ozon. Protokol Montreal tentang Zat yang Merusak Lapisan Ozon menjadwalkan penghapusan bahan kimia perusak ozon secara bertahap pada tahun 2005, dan pestisida organobromida tidak lagi digunakan (dalam fumigasi perumahan mereka telah digantikan oleh senyawa seperti sulfuril fluorida, yang tidak mengandung bahan organik klorin atau bromin yang dapat merusak ozon). Sebelum protokol Montreal pada tahun 1991 (misalnya) diperkirakan bahwa 35.000 ton bahan kimia tersebut digunakan untuk mengendalikan nematoda, jamur, gulma dan penyakit yang ditularkan melalui tanah lainnya.[57][58]
Dalam farmakologi, senyawa bromida anorganik, terutama kalium bromida, sering digunakan sebagai obat penenang umum pada abad ke-19 dan awal abad ke-20. Bromida dalam bentuk garam sederhana masih digunakan sebagai antikonvulsan baik dalam pengobatan hewan maupun manusia, meskipun penggunaan pada manusia bervariasi dari satu negara ke negara lain. Misalnya, Badan Pengawas Obat dan Makanan A.S. (FDA) tidak menyetujui penggunaan bromida untuk pengobatan penyakit apa pun, sehingga ia dihapus dari produk obat penenang yang dijual bebas seperti Bromo-Seltzer, pada tahun 1975.[59] Obat-obatan organobromin yang tersedia secara komersial meliputi vasodilator nisergolin, obat penenang brotizolam, agen antikanker pipobroman, dan antiseptik merbromin. Selain dari itu, senyawa organobromin jarang berguna secara farmasi, beda halnya dengan senyawa organofluorin. Beberapa obat diproduksi sebagai garam bromida (atau yang setara, hidrobromida), tetapi dalam kasus seperti itu, bromida berfungsi sebagai penangkal yang tidak berbahaya tanpa signifikansi biologis.[39]
Kegunaan lain dari senyawa organobromin meliputi fluida pengeboran kepadatan tinggi, pewarna (seperti ungu Tirus dan indikator bromotimol biru), dan obat-obatan. Bromin itu sendiri, serta beberapa senyawanya, digunakan dalam pengolahan air, dan merupakan prekursor dari berbagai senyawa anorganik dengan aplikasi yang sangat banyak (misalnya perak bromida untuk fotografi).[49] Baterai seng–bromin adalah baterai aliran hibrid yang digunakan untuk cadangan dan penyimpanan daya listrik stasioner; dari skala rumah tangga hingga skala industri.
Bromin digunakan dalam menara pendingin (sebagai pengganti klorin) untuk mengendalikan bakteri, ganggang, jamur, dan remis zebra.[60]
Karena memiliki kualitas antiseptik yang mirip dengan klorin, bromin dapat digunakan dengan cara yang sama seperti klorin sebagai disinfektan atau antimikroba pada aplikasi seperti kolam renang. Namun, bromin biasanya tidak digunakan di luar ruangan untuk aplikasi ini karena ia relatif lebih mahal daripada klorin dan tidak adanya penstabil untuk melindunginya dari sinar matahari. Untuk kolam dalam ruangan, ia bisa menjadi pilihan yang baik karena efektif pada kisaran pH yang lebih luas. Ia juga lebih stabil di kolam air panas atau bak mandi air panas.
Peran biologis dan toksisitas
[sunting | sunting sumber]| Bahaya | |
|---|---|
| Piktogram GHS |   
|
| Keterangan bahaya GHS | {{{value}}} |
Sebuah studi tahun 2014 menunjukkan bahwa bromin (dalam bentuk ion bromida) adalah kofaktor yang diperlukan dalam biosintesis kolagen IV, menjadikan unsur ini penting untuk arsitektur membran basal dan perkembangan jaringan pada hewan.[63] Namun demikian, tidak ada gejala atau sindrom deprivasi yang jelas yang telah didokumentasikan.[64] Dalam fungsi biologis lainnya, bromin mungkin tidak penting tetapi tetap bermanfaat jika menggantikan klorin. Misalnya, dengan adanya hidrogen peroksida, H2O2, yang dibentuk oleh eosinofil, dan baik ion klorida ataupun bromida, eosinofil peroksidase dapat memberikan mekanisme kuat di mana eosinofil membunuh parasit (seperti cacing nematoda yang terlibat dalam filariasis) dan beberapa bakteri (seperti bakteri tuberkulosis). Eosinofil peroksidase adalah sebuah haloperoksidase yang lebih disukai menggunakan bromida daripada klorida untuk tujuan ini, menghasilkan hipobromit (asam hipobromit), meskipun penggunaan klorida juga dimungkinkan.[65]
α-Haloester umumnya dianggap sebagai perantara yang sangat reaktif dan akibatnya beracun dalam sintesis organik. Namun demikian, mamalia, termasuk manusia, kucing, dan tikus, tampaknya melakukan biosintesis sejumlah kecil α-bromoester, 2-oktil 4-bromo-3-oksobutanoat, yang ditemukan dalam cairan serebrospinal mereka dan tampaknya memainkan peran yang belum jelas dalam menginduksi tidur REM.[41] Neutrofil mieloperoksidase dapat menggunakan H2O2 dan Br− untuk brominasi deoksisitidina, yang dapat mengakibatkan mutasi DNA.[66] Organisme laut adalah sumber utama senyawa organobromin, dan pada organisme inilah bromin terbukti lebih penting. Lebih dari 1.600 senyawa organobromin diidentifikasi pada tahun 1999. Yang paling melimpah adalah metil bromida (CH3Br), dengan perkiraan 56.000 ton diproduksi oleh ganggang laut setiap tahun.[41] Minyak atsiri dari alga Hawaii Asparagopsis taxiformis terdiri dari 80% bromoform.[67] Sebagian besar senyawa organobromin di laut dibuat oleh aksi enzim alga unik, vanadium bromoperoksidase.[68]
Anion bromida tidak terlalu beracun: asupan harian normalnya adalah 2 hingga 8 miligram.[64] Namun, kadar bromida yang tinggi secara kronis dapat merusak membran neuron, yang secara progresif merusak transmisi saraf, menyebabkan toksisitas, yang dikenal sebagai bromisme. Bromida memiliki waktu paruh eliminasi 9 hingga 12 hari, yang dapat menyebabkan akumulasi berlebihan. Dosis bromida 0,5 hingga 1 gram per hari dapat menyebabkan bromisme. Secara historis, dosis terapeutik bromida adalah sekitar 3 hingga 5 gram bromida, sehingga menjelaskan mengapa toksisitas kronis (bromisme) dulunya begitu umum. Walaupun gangguan signifikan dan terkadang serius terjadi pada fungsi neurologis, psikiatrik, dermatologis, dan gastrointestinal, kematian akibat bromisme jarang terjadi.[69] Bromisme disebabkan oleh efek neurotoksik pada otak yang mengakibatkan somnolensi, psikosis, sawan, dan delirium.[70]
Bromin elemetal bersifat racun dan dapat menyebabkan luka bakar kimia pada daging manusia. Menghirup gas bromin akan mengakibatkan iritasi serupa pada saluran pernapasan, menyebabkan batuk, tersedak, sesak napas, dan kematian jika terhirup dalam jumlah yang cukup banyak. Paparan kronis dapat menyebabkan infeksi bronkial yang sering dan penurunan kesehatan secara umum. Sebagai agen pengoksidasi kuat, bromin tidak cocok dengan sebagian besar senyawa organik dan anorganik.[71] Perhatian diperlukan saat mengangkut bromin; ia biasanya dibawa dalam tangki baja yang dilapisi timbal, didukung oleh rangka logam yang kuat.[49] Administrasi Keselamatan dan Kesehatan Kerja (OSHA) Amerika Serikat telah menetapkan batas paparan yang diizinkan (PEL) untuk bromin pada rata-rata tertimbang waktu (TWA) sebesar 0,1 ppm. Institut Nasional untuk Keselamatan dan Kesehatan Kerja (NIOSH) telah menetapkan batas paparan yang direkomendasikan (REL) pada TWA sebesar 0,1 ppm dan batas jangka pendek sebesar 0,3 ppm. Paparan terhadap bromin yang langsung berbahaya bagi kehidupan dan kesehatan (IDLH) adalah sebesar 3 ppm.[72] Bromin diklasifikasikan sebagai zat yang sangat berbahaya di Amerika Serikat sebagaimana didefinisikan dalam Bagian 302 Undang-Undang Perencanaan Darurat dan Hak-untuk-Mengetahui Komunitas Amerika Serikat (42 U.S.C. 11002), dan tunduk pada persyaratan pelaporan yang ketat oleh fasilitas yang memroduksi, menyimpan, atau menggunakannya dalam jumlah yang signifikan.[73]

Referensi
[sunting | sunting sumber]- ^ (Indonesia) "Bromin". KBBI Daring. Diakses tanggal 17 Juli 2022.
- ^ a b Haynes, William M., ed. (2011). CRC Handbook of Chemistry and Physics (edisi ke-92). Boca Raton, FL: CRC Press. hlm. 4.121. ISBN 1439855110.
- ^ Lide, D. R., ed. (2005). "Magnetic susceptibility of the elements and inorganic compounds". CRC Handbook of Chemistry and Physics (PDF) (edisi ke-86). Boca Raton, Florida: CRC Press. ISBN 0-8493-0486-5.
- ^ Weast, Robert (1984). CRC, Handbook of Chemistry and Physics. Boca Raton, Florida: Chemical Rubber Company Publishing. hlm. E110. ISBN 0-8493-0464-4.
- ^ Löwig, Carl Jacob (1829). Das Brom und seine chemischen Verhältnisse [Bromin dan hubungan kimianya] (dalam bahasa Jerman). Heidelberg: Carl Winter.
- ^ a b c Balard, A. J. (1826). "Mémoire sur une substance particulière contenue dans l'eau de la mer" [Memoar tentang zat aneh yang terkandung dalam air laut]. Annales de Chimie et de Physique. 2 (dalam bahasa Prancis). 32: 337–381. Diarsipkan dari versi asli tanggal 5 Mei 2016. Diakses tanggal 22 Juni 2023.
- ^ a b Balard, Antoine (1826). "Memoir on a peculiar Substance contained in Sea Water". Annals of Philosophy. 28: 381–387 and 411–426. Diarsipkan dari versi asli tanggal 17 Juli 2021. Diakses tanggal 22 Juni 2023.
- ^ Weeks, Mary Elvira (1932). "The discovery of the elements: XVII. The halogen family". Journal of Chemical Education. 9 (11): 1915. Bibcode:1932JChEd...9.1915W. doi:10.1021/ed009p1915.
- ^ Landolt, Hans Heinrich (1890). "Nekrolog: Carl Löwig". Berichte der deutschen chemischen Gesellschaft. 23 (3): 905–909. doi:10.1002/cber.18900230395. Diarsipkan dari versi asli tanggal 9 Februari 2022. Diakses tanggal 22 Juni 2023.
- ^ a b Harper, Douglas. "bromine". Online Etymology Dictionary.
- ^ muria. Charlton T. Lewis and Charles Short. An Elementary Latin Dictionary pada Perseus Project.
- ^ Vauquelin, L. N.; Thenard, L.J.; Gay-Lussac, J.L. (1826). "Rapport sur la Mémoire de M. Balard relatif à une nouvelle Substance" [Laporkan memoar oleh Tn. Balard mengenai substansi baru]. Annales de Chimie et de Physique. 2 (dalam bahasa Prancis). 32: 382–384. Diarsipkan dari versi asli tanggal 11 Mei 2016. Diakses tanggal 22 Juni 2023.
- ^ βρῶμος. Liddell, Henry George; Scott, Robert; A Greek–English Lexicon at the Perseus Project.
- ^ Pada halaman 341 dalam artikelnya, A. J. Balard (1826) "Mémoire sur une substance particulière contenue dans l'eau de la mer" [Memoar tentang zat aneh yang terkandung dalam air laut], Annales de Chimie et de Physique, seri ke-2, vol. 32, hlm. 337–381 Diarsipkan 5 Mei 2016 di Wayback Machine., Balard menyatakan bahwa Tuan Anglada membujuknya untuk menamai unsur barunya sebagai brôme. Namun, di halaman 382 dalam jurnal yang sama – "Rapport sur la Mémoire de M. Balard relatif à une nouvelle Substance" [Laporkan memoar oleh Tn. Balard mengenai substansi baru], Annales de Chimie et de Physique, seri 2, vol. 32, hlm. 382–384. Diarsipkan 11 Mei 2016 di Wayback Machine. – sebuah komite dari Akademi Sains Prancis mengklaim bahwa mereka telah mengganti nama unsur baru tersebut menjadi brôme.
- ^ Wisniak, Jaime (2004). "Antoine-Jerôme Balard. The discoverer of bromine" (PDF). Revista CENIC Ciencias Químicas. 35 (1): 35–40. Diarsipkan dari versi asli (PDF) tanggal 25 Maret 2016. Diakses tanggal 22 Juni 2023.
- ^ Greenwood dan Earnshaw, hlm. 790
- ^ Barger, M. Susan; White, William Blaine (2000). "Technological Practice of Daguerreotypy". The Daguerreotype: Nineteenth-century Technology and Modern Science. JHU Press. hlm. 31–35. ISBN 978-0-8018-6458-2.
- ^ Shorter, Edward (1997). A History of Psychiatry: From the Era of the Asylum to the Age of Prozac. John Wiley and Sons. hlm. 200. ISBN 978-0-471-24531-5.
- ^ Corey J Hilmas; Jeffery K Smart; Benjamin A Hill (2008). "Chapter 2: History of Chemical Warfare (pdf)" (PDF). Medical Aspects of Chemical Warfare. Borden Institute. hlm. 12–14. Diarsipkan dari versi asli (PDF) tanggal 26 Agustus 2012. Diakses tanggal 22 Juni 2023.
- ^ a b c d e f g h Greenwood dan Earnshaw, hlm. 800–4
- ^ "Johann Wolfgang Dobereiner". Purdue University. Diarsipkan dari versi asli tanggal 14 November 2014. Diakses tanggal 22 Juni 2023.
- ^ "A Historic Overview: Mendeleev and the Periodic Table" (PDF). NASA. Diarsipkan dari versi asli (PDF) tanggal 7 April 2021. Diakses tanggal 22 Juni 2023.
- ^ Greenwood dan Earnshaw, hlm. 793–4
- ^ a b c Greenwood dan Earnshaw, hlm. 804–9
- ^ Duan, Defang; et al. (26 September 2007). "Ab initio studies of solid bromine under high pressure". Physical Review B. 76 (10): 104113. Bibcode:2007PhRvB..76j4113D. doi:10.1103/PhysRevB.76.104113.
- ^ Audi, Georges; Bersillon, Olivier; Blachot, Jean; Wapstra, Aaldert Hendrik (2003), "The NUBASE evaluation of nuclear and decay properties", Nuclear Physics A, 729: 3–128, Bibcode:2003NuPhA.729....3A, doi:10.1016/j.nuclphysa.2003.11.001
- ^ a b Greenwood dan Earnshaw, hlm. 809–12
- ^ a b Greenwood dan Earnshaw, hlm. 812–6
- ^ a b c d e f g Greenwood dan Earnshaw, hlm. 821–4
- ^ a b c Greenwood dan Earnshaw, hlm. 824–8
- ^ Greenwood dan Earnshaw, hlm. 828–31
- ^ Greenwood dan Earnshaw, hlm. 832–5
- ^ Greenwood dan Earnshaw, hlm. 842–4
- ^ a b c Greenwood dan Earnshaw, hlm. 853–9
- ^ Perry, Dale L.; Phillips, Sidney L. (1995), Handbook of Inorganic Compounds, CRC Press, hlm. 74, ISBN 978-0-8493-8671-8, diarsipkan dari versi asli tanggal 25 Juli 2021, diakses tanggal 22 Juni 2023
- ^ a b Greenwood dan Earnshaw, hlm. 850–1
- ^ a b Greenwood dan Earnshaw, hlm. 862–5
- ^ Greenwood dan Earnshaw, hlm. 871–2
- ^ a b c Ioffe, David and Kampf, Arieh (2002) "Bromine, Organic Compounds" in Kirk-Othmer Encyclopedia of Chemical Technology. John Wiley & Sons. DOI:10.1002/0471238961.0218151325150606.a01 10.1002/0471238961.0218151325150606.a01.
- ^ Carter-Franklin, Jayme N.; Butler, Alison (2004). "Vanadium Bromoperoxidase-Catalyzed Biosynthesis of Halogenated Marine Natural Products". Journal of the American Chemical Society. 126 (46): 15060–6. doi:10.1021/ja047925p. PMID 15548002.
- ^ a b c Gribble, Gordon W. (1999). "The diversity of naturally occurring organobromine compounds". Chemical Society Reviews. 28 (5): 335–346. doi:10.1039/a900201d.
- ^ Clayden, Jonathan; Greeves, Nick; Warren, Stuart (2012). Organic Chemistry (edisi ke-2). Oxford University Press. hlm. 427–9. ISBN 978-0-19-927029-3.
- ^ Greenwood dan Earnshaw, hlm. 795–6
- ^ Tallmadge, John A.; Butt, John B.; Solomon Herman J. (1964). "Minerals From Sea Salt". Ind. Eng. Chem. 56 (7): 44–65. doi:10.1021/ie50655a008.
- ^ Oumeish, Oumeish Youssef (1996). "Climatotherapy at the Dead Sea in Jordan". Clinics in Dermatology. 14 (6): 659–664. doi:10.1016/S0738-081X(96)00101-0. PMID 8960809.
- ^ Al-Weshah, Radwan A. (2008). "The water balance of the Dead Sea: an integrated approach". Hydrological Processes. 14 (1): 145–154. Bibcode:2000HyPr...14..145A. doi:10.1002/(SICI)1099-1085(200001)14:1<145::AID-HYP916>3.0.CO;2-N.
- ^ "Major countries in worldwide bromine production from 2018 to 2022". Statista. Diakses tanggal 22 Juni 2023.
- ^ "Process operations at Octel Amlwch". Octel Bromine Works. Diarsipkan dari versi asli tanggal 27 Juli 2021. Diakses tanggal 22 Juni 2023.
- ^ a b c d Greenwood dan Earnshaw, hlm. 798–9
- ^ Mills, Jack F. (2002). "Bromine". Bromine: in Ullmann's Encyclopedia of Chemical Technology. Weinheim: Wiley-VCH Verlag. doi:10.1002/14356007.a04_391. ISBN 978-3527306732.
- ^ Green, Joseph (1996). "Mechanisms for Flame Retardancy and Smoke suppression – A Review". Journal of Fire Sciences. 14 (6): 426–442. doi:10.1177/073490419601400602.
- ^ Kaspersma, Jelle; Doumena, Cindy; Munrob Sheilaand; Prinsa, Anne-Marie (2002). "Fire retardant mechanism of aliphatic bromine compounds in polystyrene and polypropylene". Polymer Degradation and Stability. 77 (2): 325–331. doi:10.1016/S0141-3910(02)00067-8.
- ^ Weil, Edward D.; Levchik, Sergei (2004). "A Review of Current Flame Retardant Systems for Epoxy Resins". Journal of Fire Sciences. 22: 25–40. doi:10.1177/0734904104038107.
- ^ Günter Siegemund, Werner Schwertfeger, Andrew Feiring, Bruce Smart, Fred Behr, Herward Vogel, Blaine McKusick "Fluorine Compounds, Organic" Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH, Weinheim, 2002. DOI:10.1002/14356007.a11_349
- ^ Alaeea, Mehran; Ariasb, Pedro; Sjödinc, Andreas; Bergman, Åke (2003). "An overview of commercially used brominated flame retardants, their applications, their use patterns in different countries/regions and possible modes of release". Environment International. 29 (6): 683–9. doi:10.1016/S0160-4120(03)00121-1. PMID 12850087.
- ^ Lyday, Phyllis A. "Mineral Yearbook 2007: Bromine" (PDF). United States Geological Survey. Diarsipkan dari versi asli (PDF) tanggal 19 Oktober 2017. Diakses tanggal 22 Juni 2023.
- ^ Messenger, Belinda; Braun, Adolf (2000). "Alternatives to Methyl Bromide for the Control of Soil-Borne Diseases and Pests in California" (PDF). Pest Management Analysis and Planning Program. Diarsipkan dari versi asli (PDF) tanggal 21 April 2010. Diakses tanggal 22 Juni 2023.
- ^ Decanio, Stephen J.; Norman, Catherine S. (2008). "Economics of the "Critical Use" of Methyl bromide under the Montreal Protocol". Contemporary Economic Policy. 23 (3): 376–393. doi:10.1093/cep/byi028.
- ^ Samuel Hopkins Adams (1905). The Great American fraud. Press of the American Medical Association. Diakses tanggal 22 Juni 2023.
- ^ [1] Diarsipkan 10 Agustus 2021 di Wayback Machine. Choose the Right Cooling Tower Chemicals | Power Engineering |1998
- ^ "Bromine 207888". Sigma-Aldrich. 17 Oktober 2019. Diarsipkan dari versi asli tanggal 25 Juli 2021. Diakses tanggal 22 Juni 2023.
- ^ "Msds - 207888". Diarsipkan dari versi asli tanggal 27 Oktober 2020. Diakses tanggal 22 Juni 2023.
- ^ McCall AS; Cummings CF; Bhave G; Vanacore R; Page-McCaw A; et al. (2014). "Bromine Is an Essential Trace Element for Assembly of Collagen IV Scaffolds in Tissue Development and Architecture". Cell. 157 (6): 1380–92. doi:10.1016/j.cell.2014.05.009. PMC 4144415
 . PMID 24906154.
. PMID 24906154.
- ^ a b Nielsen, Forrest H. (2000). "Possibly Essential Trace Elements". Clinical nutrition of the essential trace elements and minerals : The guide for health professionals. Clinical Nutrition of the Essential Trace Elements and Minerals. hlm. 11–36. doi:10.1007/978-1-59259-040-7_2. ISBN 978-1-61737-090-8.
- ^ Mayeno AN; Curran AJ; Roberts RL; Foote CS (1989). "Eosinophils preferentially use bromide to generate halogenating agents". J. Biol. Chem. 264 (10): 5660–8. doi:10.1016/S0021-9258(18)83599-2
 . PMID 2538427.
. PMID 2538427.
- ^ Henderson JP; Byun J; Williams MV; Mueller DM (2001). "Production of brominating intermediates by myeloperoxidase". J. Biol. Chem. 276 (11): 7867–75. doi:10.1074/jbc.M005379200
 . PMID 11096071.
. PMID 11096071.
- ^ Burreson, B. Jay; Moore, Richard E.; Roller, Peter P. (1976). "Volatile halogen compounds in the alga Asparagopsis taxiformis (Rhodophyta)". Journal of Agricultural and Food Chemistry. 24 (4): 856–861. doi:10.1021/jf60206a040.
- ^ Butler, Alison; Carter-Franklin, Jayme N. (2004). "The role of vanadium bromoperoxidase in the biosynthesis of halogenated marine natural products". Natural Product Reports. 21 (1): 180–8. doi:10.1039/b302337k. PMID 15039842.
- ^ Olson, Kent R. (1 November 2003). Poisoning & drug overdose (edisi ke-4). Appleton & Lange. hlm. 140–141. ISBN 978-0-8385-8172-8. Diarsipkan dari versi asli tanggal 24 Desember 2016. Diakses tanggal 22 Juni 2023.
- ^ Galanter, Marc; Kleber, Herbert D. (1 Juli 2008). The American Psychiatric Publishing Textbook of Substance Abuse Treatment (edisi ke-4). United States of America: American Psychiatric Publishing Inc. hlm. 217. ISBN 978-1-58562-276-4. Diarsipkan dari versi asli tanggal 27 April 2021. Diakses tanggal 22 Juni 2023.
- ^ Science Lab.com. "Material Safety Data Sheet: Bromine MSDS". sciencelab.com. Diarsipkan dari versi asli tanggal 15 November 2017. Diakses tanggal 22 Juni 2023.
- ^ "NIOSH Pocket Guide to Chemical Hazards #0064". National Institute for Occupational Safety and Health (NIOSH).
- ^ "40 C.F.R.: Appendix A to Part 355—The List of Extremely Hazardous Substances and Their Threshold Planning Quantities" (PDF). Federal Register (edisi ke-1 Juli 2008). Government Printing Office. Diarsipkan dari versi asli (PDF) tanggal 25 Februari 2012. Diakses tanggal 22 Juni 2023.
Referensi umum dan kutipan
[sunting | sunting sumber]- Greenwood, Norman N.; Earnshaw, A. (1997), Chemistry of the Elements (edisi ke-2), Oxford: Butterworth-Heinemann, ISBN 0-7506-3365-4
| (besar) | |||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | ||||||||||||||||
| 1 | H | He | |||||||||||||||||||||||||||||||
| 2 | Li | Be | B | C | N | O | F | Ne | |||||||||||||||||||||||||
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar | |||||||||||||||||||||||||
| 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | |||||||||||||||
| 5 | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | |||||||||||||||
| 6 | Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | |
| 7 | Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | |
|
| |||||||||||||||||||||||||||||||||


