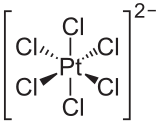Platina
78Pt Platina | |||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 Kristal platina | |||||||||||||||||||||||||||||||||||||||||
Garis spektrum platina | |||||||||||||||||||||||||||||||||||||||||
| Sifat umum | |||||||||||||||||||||||||||||||||||||||||
| Pengucapan | |||||||||||||||||||||||||||||||||||||||||
| Penampilan | putih keperakan | ||||||||||||||||||||||||||||||||||||||||
| Platina dalam tabel periodik | |||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||
| Nomor atom (Z) | 78 | ||||||||||||||||||||||||||||||||||||||||
| Golongan | golongan 10 | ||||||||||||||||||||||||||||||||||||||||
| Periode | periode 6 | ||||||||||||||||||||||||||||||||||||||||
| Blok | blok-d | ||||||||||||||||||||||||||||||||||||||||
| Kategori unsur | logam transisi | ||||||||||||||||||||||||||||||||||||||||
| Berat atom standar (Ar) |
| ||||||||||||||||||||||||||||||||||||||||
| Konfigurasi elektron | [Xe] 4f14 5d9 6s1 | ||||||||||||||||||||||||||||||||||||||||
| Elektron per kelopak | 2, 8, 18, 32, 17, 1 | ||||||||||||||||||||||||||||||||||||||||
| Sifat fisik | |||||||||||||||||||||||||||||||||||||||||
| Fase pada STS (0 °C dan 101,325 kPa) | padat | ||||||||||||||||||||||||||||||||||||||||
| Titik lebur | 2041,4 K (1768,3 °C, 3214,9 °F) | ||||||||||||||||||||||||||||||||||||||||
| Titik didih | 4098 K (3825 °C, 6917 °F) | ||||||||||||||||||||||||||||||||||||||||
| Kepadatan mendekati s.k. | 21,45 g/cm3 | ||||||||||||||||||||||||||||||||||||||||
| saat cair, pada t.l. | 19,77 g/cm3 | ||||||||||||||||||||||||||||||||||||||||
| Kalor peleburan | 22,17 kJ/mol | ||||||||||||||||||||||||||||||||||||||||
| Kalor penguapan | 510 kJ/mol | ||||||||||||||||||||||||||||||||||||||||
| Kapasitas kalor molar | 25,86 J/(mol·K) | ||||||||||||||||||||||||||||||||||||||||
Tekanan uap
| |||||||||||||||||||||||||||||||||||||||||
| Sifat atom | |||||||||||||||||||||||||||||||||||||||||
| Bilangan oksidasi | −3, −2, −1, 0, +1, +2, +3, +4, +5, +6 (oksida agak basa) | ||||||||||||||||||||||||||||||||||||||||
| Elektronegativitas | Skala Pauling: 2,28 | ||||||||||||||||||||||||||||||||||||||||
| Energi ionisasi | ke-1: 870 kJ/mol ke-2: 1791 kJ/mol | ||||||||||||||||||||||||||||||||||||||||
| Jari-jari atom | empiris: 139 pm | ||||||||||||||||||||||||||||||||||||||||
| Jari-jari kovalen | 136±5 pm | ||||||||||||||||||||||||||||||||||||||||
| Jari-jari van der Waals | 175 pm | ||||||||||||||||||||||||||||||||||||||||
| Lain-lain | |||||||||||||||||||||||||||||||||||||||||
| Kelimpahan alami | primordial | ||||||||||||||||||||||||||||||||||||||||
| Struktur kristal | kubus berpusat muka (fcc) | ||||||||||||||||||||||||||||||||||||||||
| Kecepatan suara batang ringan | 2800 m/s (pada s.k.) | ||||||||||||||||||||||||||||||||||||||||
| Ekspansi kalor | 8,8 µm/(m·K) (suhu 25 °C) | ||||||||||||||||||||||||||||||||||||||||
| Konduktivitas termal | 71,6 W/(m·K) | ||||||||||||||||||||||||||||||||||||||||
| Resistivitas listrik | 105 nΩ·m (suhu 20 °C) | ||||||||||||||||||||||||||||||||||||||||
| Arah magnet | paramagnetik | ||||||||||||||||||||||||||||||||||||||||
| Suseptibilitas magnetik molar | 201,9×10−6 cm3/mol (290 K)[3] | ||||||||||||||||||||||||||||||||||||||||
| Modulus Young | 168 GPa | ||||||||||||||||||||||||||||||||||||||||
| Modulus Shear | 61 GPa | ||||||||||||||||||||||||||||||||||||||||
| Modulus curah | 230 GPa | ||||||||||||||||||||||||||||||||||||||||
| Rasio Poisson | 0,38 | ||||||||||||||||||||||||||||||||||||||||
| Skala Mohs | 3,5 | ||||||||||||||||||||||||||||||||||||||||
| Skala Vickers | 400–550 MPa | ||||||||||||||||||||||||||||||||||||||||
| Skala Brinell | 300–500 MPa | ||||||||||||||||||||||||||||||||||||||||
| Nomor CAS | 7440-06-4 | ||||||||||||||||||||||||||||||||||||||||
| Sejarah | |||||||||||||||||||||||||||||||||||||||||
| Penemuan | A. Ulloa (1735) | ||||||||||||||||||||||||||||||||||||||||
| Isotop platina yang utama | |||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||
Platina adalah unsur kimia dengan lambang Pt dan nomor atom 78. Logam transisi putih abu-abu ini padat, lunak, ulet, sangat tidak reaktif, dan berharga. Namanya berasal dari istilah Spanyol platina, yang jika diterjemahkan secara harfiah berarti "perak kecil".[4][5]
Platina adalah anggota unsur golongan platina dan unsur dalam golongan 10 pada tabel periodik. Ia memiliki enam isotop alami. Logam ini adalah salah satu unsur langka di kerak bumi dengan kelimpahan rata-rata sekitar 5 μg/kg. Ia terdapat dalam beberapa bijih nikel dan tembaga bersama dengan beberapa deposit alami, sebagian besar di Afrika Selatan, yang menyumbang 80% dari produksi dunia. Karena kelangkaan dalam kerak bumi, hanya beberapa ratus ton yang diproduksi setiap tahun, dan memberikan manfaat penting, logam ini menjadi sangat berharga dan merupakan komoditas logam mulia[n 1] utama.
Platina adalah logam yang paling kurang reaktif. Daya tahannya yang mengagumkan terhadap korosi, bahkan pada suhu tinggi, membuatnya dinobatkan sebagai logam mulia. Konsekuensinya, platina sering ditemukan sebagai unsur platina alami. Oleh karena ia terdapat secara alami dalam pasir aluvium di berbagai sungai, maka ia digunakan pertama kali oleh penduduk asli Amerika Selatan pra-Kolombia untuk membuat artefak. Tulisan Eropa merujuk pada abad ke-16, tetapi laporan Antonio de Ulloa yang mempublikasikan logam baru di Kolombia pada tahun 1748 menjadi objek penelitian para ilmuwan.
Platina digunakan dalam pengubah katalitik, peralatan laboratorium, kontak listrik dan elektrode, termometer resistensi platina, peralatan kedokteran gigi, dan perhiasan. Oleh karena termasuk logam berat, platina memiliki masalah kesehatan jika terpapar garamnya, namun karena ketahanannya terhadap korosi, platina tidak beracun seperti beberapa logam lainnya.[6] Senyawa yang mengandung platina, seperti sisplatin, oksaliplatin dan karboplatin, digunakan dalam kemoterapi untuk melawan kanker jenis tertentu.[7]
Karakteristik
[sunting | sunting sumber]Sifat fisika
[sunting | sunting sumber]Platina murni adalah logam putih keperakan yang berkilau, ulet, dan dapat ditempa.[8] Platina lebih ulet daripada emas, perak atau tembaga, sehingga paling ulet dibandingkan kebanyakan logam murni lainnya, tetapi kurang lunak daripada emas.[9][10] Logam ini memiliki ketahanan yang sangat baik terhadap korosi, stabil pada suhu tinggi dan memiliki sifat listrik yang stabil. Platinum bereaksi lambat dengan oksigen pada suhu yang sangat tinggi.[11] Logam ini bereaksi hebat dengan fluor pada 500 °C (932 °F) membentuk tetrafluorida.[12] Logam ini juga diserang oleh klor, brom, iodin, dan belerang. Platina tidak larut dalam asam klorida dan asam nitrat, tetapi larut dalam aqua regia panas membentuk asam kloroplatinat, H.[13]
Karakter fisika serta kestabilan kimianya menjadikannya berguna untuk aplikasi industri.[14] Ketahanannya terhadap keausan dan noda cocok untuk digunakan sebagai perhiasan.
Sifat kimia
[sunting | sunting sumber]
Tingkat oksidasi platina yang paling umum adalah +2 dan +4. Tingkat oksidasi +1 dan +3 kurang umum, dan kadang distabilkan oleh ikatan logam dalam spesies bimetalik (atau polimetalik). Sesuai perkiraan, senyawa platina(II) tetrakoordinasi cenderung mengadopsi geometri segiempat planar 16 elektron. Meskipun unsur platina biasanya tak reaktif, ia larut dalam aqua regia panas membentuk asam kloroplatinat (H):[15]
Sebagai suatu asam lemah, platina mempunyai afinitas besar terhadap belerang, seperti terhadap dimetil sulfoksida (DMSO); sejumlah kompleks DMSO telah dilaporkan dan pemilihan pelarut reaksi harus dilakukan dengan sangat hati-hati.[16]
Isotop
[sunting | sunting sumber]Platina mempunyai enam isotop alami: 190Pt, 192Pt, 194Pt, 195Pt, 196Pt, dan 198Pt. Isotop yang paling melimpah adalah 195Pt, menyusun 33,83% dari seluruh platina. Itu adalah satu-satunya isotop stabil tanpa spin nol; dengan spin ½, puncak satelit 195Pt sering teramati dalam spektroskopi NMR 1H dan 31P (yaitu, Pt-fosfin dan kompleks Pt-alkil).190Pt adalah yang paling sedikit, hanya 0,01%. Di antara isotop alami, hanya 190Pt yang tidak stabil, meskipun meluruh dengan waktu paruh 6,5×1011 tahun, menyebabkan aktivitas menjadi 15 Bq/kg dari platina alami.198Pt dapat mengalami peluruhan alfa, tetapi peluruhannya tidak pernah teramati (waktu paruh diketahui lebih dari 3,2×1014 tahun); oleh karena itu, ia dianggap stabil. Platina juga memiliki 31 isotop sintetis dalam rentang massa atom dari 166 hingga 202, sehingga total jumlah isotop yang diketahui sebanyak 37. Di antara ini, yang paling tidak stabil adalah 166Pt, dengan waktu paruh 300 µs, sementara yang paling stabil adalah 193Pt dengan waktu paruh 50 tahun. Sebagian besar isotop platina meluruh dengan beberapa kombinasi peluruhan beta dan alfa.188Pt, 191Pt, dan 193Pt meluruh dengan (terutama) tangkapan elektron.190Pt dan 198Pt mengalami jalur peluruhan beta berganda.[17]
Keberadaan
[sunting | sunting sumber]

Platina adalah suatu logam yang sangat langka,[18] hanya terdapat dengan konsentrasi 0,005 ppm pada kerak Bumi.[19][20] Ia kadang keliru dengan perak (Ag). Platina sering dijumpai tersendiri secara kimia sebagai platina alami dan sebagai alloy dengan logam golongan platina lainnya serta dengan besi. Platina paling sering dijumpai sebagai deposit sekunder pada deposit aluvial. Deposit aluvial yang digunakan oleh bangsa pra-Kolombia di Chocó Department, Kolombia masih merupakan sumber logam golongan platina hingga sekarang. Deposit aluvial besar lainnya adalah di Pegunungan Ural, Rusia, dan masih ditambang hingga sekarang.[13]
Pada deposit nikel dan tembaga, logam golongan platina terdapat sebagai sulfida (misalnya, (Pt,Pd)S), telurida (misalnya, PtBiTe), antimonida (PdSb), dan arsenida (misalnya, PtAs2), dan sebagai alloy dengan nikel atau tembaga. Platina arsenida, sperrylite (PtAs2), adalah sumber platina utama yang terkait dengan bijih nikel dalam deposit Sudbury Basin di Ontario, Canada. Di Platinum, Alaska, sekitar 17.000 kg (550.000 ozt) telah ditambang antara tahun 1927 dan 1975. Tambang tersebut berhenti beroperasi pada tahun 1990.[21] Mineral sulfida yang langka, cooperite, (Pt,Pd,Ni)S, mengandung platina bersama dengan paladium dan nikel. Cooperite terdapat di Merensky Reef di sekitar kompleks Bushveld, Gauteng, South Africa.[22]
Pada tahun 1865, chromite diidentifikasi di region Bushveld, Afrika Selatan, diikuti dengan penemuan platina pada tahun 1906.[23] Cadangan primer terbesar yang diketahui berada di kompleks Bushveld di Afrika Selatan.[24] Deposit tembaga–nikel yang besar di dekat Norilsk, Russia, dan Sudbury Basin, Canada, adalah dua lokasi deposit besar lainnya. Di Sudbury Basin, jumlah bijih nikel yang sangat besar yang diproses membuktikan fakta bahwa platina hanya ada sekitar 0,5 ppm di dalam bijih. Cadangan yang lebih kecil dapat dijumpai di Amerika Serikat,[24] misalnya di Absaroka Range, Montana.[25] Pada tahun 2010, Afrika Selatan adalah produsen puncak platina, dengan pangsa pasar hampir 77%, diikuti oleh Rusia dengan 13%; produksi dunia pada tahun 2010 adalah 192.000 kg (423.000 pon; 192 t).[26]
Deposit platina terdapat di negara bagian Tamil Nadu, India.[27] dan sebuah MOU telah ditandatangani antara Geological Survey of India dengan TAMIN – Tamil Nadu Minerals Ltd.[28]
Platina dengan kelimpahan yang lebih tinggi terdapat di Bulan dan meteorit. Sejalan dengan itu, platina ditemukan sedikit lebih melimpah di situs benturan bolide dengan Bumi yang terkait dengan hasil vulkanisme pasca-benturan, dan dapat ditambang secara ekonomis; Sudbury Basin adalah salah satu contohnya.[29]
Senyawa
[sunting | sunting sumber]Halida
[sunting | sunting sumber]Asam heksakloroplatinat yang disebut di atas kemungkinan adalah senyawa platina paling penting, karena ia bertindak selaku prekursor untuk banyak senyawa platina lainnya. Asam heksakloroplatinat sendiri memiliki beragam aplikasi dalam fotografi, seng etsa (bahasa Inggris: zinc etchings), tinta yang tak dapat dihapus, pelapisan, cermin, porselin, pewarna, dan katalis.[30]
Perlakuan asam heksakloroplatinat dengan garam amonium, seperti amonium klorida, menghasilkan amonium heksakloroplatinat,[15] yang relatif tak larut dalam larutan amonium. Pemanasan garam amonium ini dengan adanya hidrogen mereduksinya menjadi unsur platina. Kalium heksakloroplatinat juga tak larut, dan asam heksakloroplatinat telah digunaka dalam penentuan ion kalium dengan cara gravimetri.[31]
Ketika asam heksakloroplatinat dipanaskan, ia terdekomposisi menjadi unsur platina melalui tahapan pembentukan platina(IV) klorida dan platina(II) klorida terlebih dahulu, meskipun reaksinya tidak terjadi secara bertahap:[32]
Ketiga reaksi di atas adalah reaksi bolak-balik. Platina(II) dan platina(IV) bromida juga telah dikenal. Platina heksafluorida adalah oksidator kuat yang mampu mengoksidasi oksigen.
Oksida
[sunting | sunting sumber]Platina(IV) oksida, PtO2, dikenal juga sebagai katalis Adams, adalah suatu serbuk hitam yang larut dalam larutan KOH dan asam pekat.[33] PtO2 dan PtO, yang kurang umum, keduanya terdekomposisi pada pemanasan.[8] Platina(II,IV) oksida, Pt3O4, terbentuk melalui reaksi berikut:
Senyawa lain
[sunting | sunting sumber]Tidak seperti paladium asetat, platina(II) asetat tidak tersedia secara komersial. Jika diinginkan dalam bentuk basa, halida ini telah digunakan dalam gabungan dengan natrium asetat.[16] Penggunaan platina(II) asetilasetonat telah pula dilaporkan.[34]
Beberapa barium platinida telah disintesis di mana platina menunjukkan tingkat oksidasi negatif antara −1 hingga −2. Ini termasuk BaPt, Ba, dan Ba.[35] Sesium platinida, Cs, suatu senyawa kristal transparan berwarna merah gelap[36] menunjukkan mengandung anion Pt2−.[37] Platina juga menunjukkan tingkat oksidasi negatif pada permukaan yang direduksi secara elektrokimia.[38] Tingkat oksidasi negatif yang ditunjukkan oleh platina tidak biasa untuk unsur-unsur logam, dan mereka teratribusi dengan stabilisasi relatif orbital 6s.[37]
Garam Zeise, mengandung ligan etilena, adalah salah satu dari first senyawa organologam pertama yang ditemukan. Dikloro(siklookta-1,5-diena)platina(II) adalah kompleks olefin yang tersedia secara komersial, yang mengandung ligan cod yang dapat diganti (cod singkatan dari (Inggris) 1,5-cyclooctadiene). Kompleks cod dan halidanya cocok sebagai titik awal menuju kimia platina.[16]
Cisplatin, atau cis-diaminadikloroplatina(II) adalah senyawa pertama dalam deret platina(II) segiempat planar yang mengandung obat kemoterapi, termasuk carboplatin dan oxaliplatin. Senyawa-senyawa ini mampu membentuk ikatan silang dengan DNA, dan membunuh sel-sel dengan cara yang sama dengan zat kemoterapi pengalkilasi.[39]
-
Ion heksakloroplatinat
-
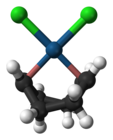
Anion garam Zeise
-
Dikloro(siklookta-1,5-diena)platina(II)
-
Cisplatin
Sejarah
[sunting | sunting sumber]Penggunaan awal
[sunting | sunting sumber]Para arkeolog telah menemukan jejak platina dalam emas yang digunakan dalam makam Mesir kuno dan huruf hieroglif berkalender awal 1200 SM. Namun, keberlanjutan pengetahuan Mesir tentang logam ini masih belum jelas. Cukup mungkin mereka tidak mengenali adanya platina dalam emas mereka.[40]
Logam ini digunakan oleh bangsa Amerika pra-Kolombia di dekat Esmeraldas, Ekuador saat ini untuk membuat artefak berbahan aloy emas putih-platina. Mereka menerapkan sistem metalurgi serbuk yang relatif canggih. Platina yang digunakan dalam objek-objek semacam ini bukanlah unsur murni, tetapi merupakan campuran alami logam-logam golongan platina, dengan sejumlah kecil paladium, rodium, dan iridium.[41]
Penemuan di Eropa
[sunting | sunting sumber]Referensi Eropa pertama tentang platina muncul pada 1557 dalam tulisan-tulisan humanis Italia Julius Caesar Scaliger yang dideskripsikan sebagai logam mulia yang tidak diketahui ditemukan di antara Darién dan Meksiko, "belum ada api maupun kecerdasan Spanyol yang mampu mencairkannya".[42] Sejak penemuan pertama mereka dengan platina, bangsa Spanyol umumnya melihat logam ini sebagai semacam pengotor dalam emas, dan diperlakukan seperti itu. Logam itu sering hanya dibuang, dan ada keputusan resmi yang melarang pemalsuan emas dengan pengotor platina.[41]


Pada tahun 1741, Charles Wood,[43] seorang ilmuwan metalurgi berkebangsaan Inggris, menemukan beragam berbagai sampel platina Kolombia di Jamaika, sehingga mengirim William Brownrigg untuk penyelidikan lebih lanjut. Antonio de Ulloa, yang juga berjasa dengan penemuan platina, kembali ke Spanyol dari French Geodesic Mission pada tahun 1746 setelah berada di lokasi misi selama delapan tahun. Catatan sejarahnya tentang ekspedisi termasuk deskripsi platina sebagai tidak dapat dipisahkan maupun dikalsinasi. Ulloa juga mengantisipasi penemuan tambang platina. Setelah mempublikasikan penelitiannya pada tahun 1748, Ulloa tidak melanjutkan penyelidikan logam baru tersebut. Pada tahun 1758, ia dikirim untuk memimpin operasi tambang raksa di Huancavelica.[42]
Pada tahun 1750, setelah meneliti platina yang dikirim oleh Wood, Brownrigg mempresentasikan detail penelitian logam ini kepada Royal Society, dan menyatakan bahwa ia belum melihat penelitian sebelumnya, tentang mineral-mineral yang telah diketahui, yang menyebutkan logam hasil temuannya itu.[44] Brownrigg juga mencatat tentang titik lebur platina yang sangat tinggi. Kimiawan lain seantero Eropa segera mulai meneliti platina, termasuk Andreas Sigismund Marggraf,[45] Torbern Bergman, Jöns Jakob Berzelius, William Lewis, dan Pierre Macquer. Pada tahun 1752, Henrik Scheffer mempublikasikan sebuah deskripsi ilmiah terperinci tentang logam ini, yang ia rujuk sebagai "emas putih", termasuk sebuah penelitian tentang keberhasilannya melebur bijih platina dengan bantuan arsen. Scheffer menjelaskan platina sebagai logam yang lebih sulit dipotong daripada emas, tetapi memiliki ketahanan yang sama terhadap korosi.[42]
Upaya pelenturan
[sunting | sunting sumber]Carl von Sickingen meneliti platina lebih mendalam pada tahun 1772. Ia berhasil membuat platina lentur dengan memadukannya dengan emas, melarutkan aloy tersebut dengan aqua regia, mengendapkan platina dengan amonium klorida, menyalakan amonium kloroplatinat, dan memalu platina yang terpisah untuk membuatnya menyatu. Franz Karl Achard membuat krus platina pertama pada tahun 1784. Ia menggunakan platina dengan cara meleburnya menggunakan arsen, kemudian menguapkan arsennya.[42]
Oleh karena anggota keluarga platina lainnya belum diketemukan (platina adalah yang pertama), Scheffer dan Sickingen membuat asumsi yang keliru tentang kekerasannya—yang lebih disebabkan oleh besi murni—platina menjadi bahan yang relatif keras, bahkan rapuh, ketika kelenturan dan elastisitasnya mendekati emas. Asumsi mereka tidak dapat dihindari karena platina yang digunakan dalam percobaan mereka sangat terkontaminasi dengan unsur-unsur keluarga platina lainnya seperti osmium dan iridium, yang menyebabkan aloy platina menjadi rapuh. Perpaduan residu platina tak murni ini, disebut "plyoksen", dengan emas merupakan satu-satunya cara pada saat itu untuk mendapatkan senyawa yang lunak, tetapi sekarang, platina dengan tingkat kemurnian tinggi telah tersedia dan kabel yang sangat panjang dapat dibuat dari platina murni, sangat mudah karena struktur kristalnya yang sama dengan kebanyakan logam lunak lainnya.[46]
Pada tahun 1786, Charles III dari Spanyol menyediakan sebuah perpustakaan dan laboratorium kepada Pierre-François Chabaneau untuk membantu penelitiannya pada platina. Chabaneau berhasil menghilangkan sejumlah ketakmurnian dari bijih, termasuk emas, raksa, timbal, tembaga, dan besi. Ini membuatnya meyakini bahwa ia tengah bekerja dengan sebuat logam tunggal, tetapi pada kenyataannya bijih tersebut masih mengandung logam-logam golongan platina yang belum diketahui. Hal ini mengakibatkan hasil percobaannya tidak konsisten. Suatu saat, platina tampak lunak, tetapi ketika dipadu dengan iridium, ia menjadi sangat rapuh. Kadang-kadang logamnya tidak dapat terbakar, tetapi ketika dipadu dengan osmium, menjadi menguap. Setelah beberapa bulan, Chabaneau berhasil memproduksi 23 kg (50,71 pon) platina murni serta lunak dengan cara memalu dan menekan sponsnya ketika masih putih membara. Chabeneau menyadari platina akan berharga dalam pembuatan berbagai objek, sehingga ia segera memulai bisnis dengan Joaquin Cabezas untuk memproduksi platina ingot dan perkakas platina. Ini merupakan dimulainya "abad platina" di Spanyol.[42]
Pada tahun 2007, Gerhard Ertl memenangkan Nobel Kimia untuk penentuan detail mekanisme molekular oksidasi katalitik karbon monoksida menggunakan platina (sebagai pengubah katalitik).[47]
Produksi
[sunting | sunting sumber]

Platina, bersama dengan logam golongan platina sisanya, secara komersial diperoleh sebagai produk samping dari penambangan dan pemrosesan nikel dan tembaga. Selama elektrorefining tembaga, logam mulia seperti perak, emas dan logam golongan platina serta selenium dan telurium mengendap di dasar sel sebagai "lumpur anode", yang merupakan titik tolak ekstraksi logam golongan platina.[50]
Jika platina murni ditemukan dalam placer deposit atau bijih lainnya, ia dapat diisolasi dari mereka dengan berbagai metode pengurangan ketakmurnian. Karena platina secara signifikan lebih padat daripada banyak ketakmurnian, ketakmurnian yang lebih ringan dapat dihilangkan dengan hanya mengapungsingkirkan mereka dalam cairan. Platina bersifat paramagnetik, sedangkan nikel dan besi keduanya feromagnetik. Kedua ketakmurnian ini kemudian dihilangkan dengan mengalirkan elektromagnet di atas campuran. Oleh karena platina mempunyai titik leleh lebih tinggi daripada sebagian besar zat lainnya, banyak ketakmurnian yang dapat dibakar atau dilebur tanpa melelehkan platina. Terakhir, platina tahan terhadap asam klorida dan asam sulfat, sementara zat lain mudah diserang oleh kedua asam ini. Ketakmurnian logam dapat dihilangkan dengan mengaduk campuran dalam salah satu dari kedua asam ini, dan memulihkan platina yang tertinggal.[51]
Satu metode yang mudah untuk pemurnian platina kasar, yang mengandung platina, emas, dan logam golongan platina lainnya, adalah dengan mengolahnya menggunakan aqua regia, yang dapat melarutkan paladium, emas dan platina, sementara osmium, iridium, rutenium dan rodium tidak bereaksi. Emas diendapkan dengan penambahan besi(II) klorida dan setelah emas dipisahkan dengan cara penyaringan, platina diendapkan sebagai amonium kloroplatinat dengan penambahan amonium klorida. Amonium kloroplatinat dapat dikonversi menjadi platina dengan pemanasan.[52] Heksakloroplatinat(IV) yang tak mengendap dapat direduksi dengan seng unsur, dan platina diperoleh dengan metode yang sama seperti yang dilakukan dalam pemulihan residu platina skala laboratorium.[53]
Aplikasi
[sunting | sunting sumber]
Dari 224 ton platina yang dijual pada tahun 2013, 101 ton digunakan untuk peralatan pengendali emisi kendaraan (45%), 66,3 ton untuk perhiasan (30%), 19,4 ton untuk produksi bahan kimia dan pengolahan minyak bumi (8,7%), dan 5.88 ton untuk aplikasi elektronik seperti hard disk drive (2,6%). Sebanyak 31,4 ton sisanya digunakan untuk beragam aplikasi minor lainnya, seperti obat-obatan dan biomedis, pembuatan peralatan gelas, investasi, elektrode, obat antikanker, sensor oksigen, busi dan mesin turbin.[54]
Katalis
[sunting | sunting sumber]Platina paling banyak digunakan sebagai katalis dalam reaksi kimia, sering kali sebagai platina hitam. Unsur ini telah digunakan sebagai katalis sejak awal abad ke-19, ketika serbuk platina digunakan untuk mengkatalisis pengapian hidrogen. Aplikasi paling penting adalah dalam otomotif sebagai pengubah katalitik (catalytic converter), yang memungkinkan pembakaran lengkap hidrokarbon yang tak terbakar berkonsentrasi rendah dari knalpot menjadi karbon dioksida dan uap air. Platina juga digunakan dalam industri minyak bumi sebagai katalis dalam sejumlah proses pemisahan, tetapi terutama dalam pembentukan ulang berkatalisis (catalytic reforming) nafta rantai lurus menjadi bensin berkadar oktana yang lebih tinggi sehingga menjadi kaya senyawa aromatik. PtO2, yang juga dikenal sebagai katalis Adams, digunakan sebagai katalis hidrogenasi, terutama untuk minyak sayur.[30] Platina juga mengkatalisis dekomposisi hidrogen peroksida menjadi air dan oksigen[55] dan digunakan dalam sel bahan bakar[56] sebagai katalis untuk mereduksi oksigen.[57]
Standar
[sunting | sunting sumber]
Mulai 1889 hingga 1960, meter didefinisikan sebagai panjang batang logam paduan platina-iridium (90:10), dikenal sebagai batang Meter Prototipe Internasional. Batang sebelumnya dibuat dari platina pada tahun 1799. Kilogram Prototipe Internasional tetap didefinisikan dengan tabung logam paduan platina-iridium yang dibuat pada tahun 1879.[58]
Elektrode hidrogen standar juga menggunakan elektrode platina berlapis platina mengingat ketahanannya terhadap korosi serta sifat-sifat lainnya.[59]
Sebagai investasi
[sunting | sunting sumber]Platina adalah komoditas logam berharga; bulionnya mempunyai kode mata uang ISO XPT. Koin, batangan, dan ingot diperdagangkan atau dikoleksi. Platina juga digunakan dalam perhiasan, biasanya sebagai logam paduan 90–95%, karena sifat inertnya. Ia digunakan untuk investasi sebagai prestise dan nilai bulionnya yang inheren. Publikasi perdagangan perhiasan menyarankan para pengrajin perhiasan untuk menunjukkan goresan-goresan kecil pada permukaan (yang mereka sebut patina) sebagai fitur yang diinginkan dalam percobaan untuk mendongkrak nilai produk platina.[60][61]
Dalam industri arloji, Vacheron Constantin, Patek Philippe, Rolex, Breitling, dan perusahaan lainnya menggunakan platina untuk memproduksi seri limited edition arloji mereka. Para pengrajin arloji mengapresiasi sifat-sifat unik platina, karena tidak mudah bernoda maupun aus (yang disebut terakhir relatif terhadap emas).[62]

Harga platina, seperti komoditas industri lainnya, lebih volatil daripada emas. Pada tahun 2008, harga platina terpuruh dari $2.252 ke $774 per oz,[64] kerugian hampir ⅔ dari nilainya. Sebaliknya, harga emas jatuh dari ~$1,000 ke ~$700/oz pada periode yang sama, hanya kehilangan ⅓ dari nilainya.
Selama periode ekonomi stabil dan tumbuh secara berkelanjutan, harga platina cenderung dua kali harga emas, sementara selama periode ekonomi tak menentu,[65] harga platina cenderung turun karena berkurangnya permintaan industri, jatuh di bawah harga emas. Harga emas lebih stabil dalam periode ekonomi yang melambat, karena emas dianggap sebagai perlindungan yang aman. Meskipun emas digunakan dalam aplikasi industri, permintaannya tidak terlalu terpengaruh oleh penggunaan industri, Pada abad ke-18, kelangkaan platina membuat Raja Louis XV dari Prancis menitahkan bahwa platina adalah satu-satunya logam yang cocok bagi raja.[66]
Penggunaan lain
[sunting | sunting sumber]Dalam laboratorium, kawat platina digunakan sebagai elektrode, cawan dan penyangga platina digunakan dalam analisis termogravimetri karena persyaratan ketat tentang keinertan bahan kimia pada pemanasan temperatur tinggi (~1000 °C). Platina digunakan sebagai logam pemadu dalam beragam produk logam, termasuk kabel berkualitas tinggi, wadah laboratorium tahan korosi, peralatan medis, prostesis gigi, kontak listrik, dan termokopel. Platina-kobalt, suatu logam paduan dengan komposisi tiga bagian platina dan satu bagian kobalt, digunakan untuk membuat magnet permanen yang relatif kuat.[30] Anode berbasis platina digunakan pada kapal, pipa, dan dermaga baja.[13]
Simbol prestise
[sunting | sunting sumber]
Langkanya platina sebagai logam menyebabkan marketing mengasosiasikannya dengan eksklusivitas dan kemakmuran. Kartu kredit dan debit "Platinum" memiliki keistimewaan lebih besar daripada kartu "gold".[67] "Penghargaan platinum" adalah rangking kedua tertinggi di atas "emas", "perak" dan "perunggu", tetapi berada di bawah "diamond". Misalnya, di Amerika Serikat, album musik yang terjual lebih dari 1 juta kopi akan diberi penghargaan "platinum", sementara albuh yang terjual lebih dari 10 juta kopi mendapat penghargaan "diamond".[68] Beberapa produk, seperti blender dan kendaraan, dengan aksen warna putih keperakan diidentifikasi sebagai "platinum". Platina dianggap sebagai logam berharga, meskipun pemanfaatannya tidak selumrah penggunaan emas atau perak. Bingkai Mahkota Ratu Elizabeth The Queen Mother, yang dibuat untuk penobatan dirinya sebagai Permaisuri Raja George VI, terbuat dari platina. Itu merupakan mahkota pertama kerajaan Inggris yang terbuat dari logam ini.[69]
Masalah kesehatan
[sunting | sunting sumber]Menurut Pusat Pengendalian dan Pencegahan Penyakit, paparan jangka pendek pada garam-garam platina dapat menyebabkan iritasi mata, hidung, dan tenggorokan, sementara paparan jangka panjang akan menyebabkan alergi pada saluran pernapasan dan kulit. Standar K3 saat ini adalah 2 mikrogram per meter kubik udara rata-rata selama 8 jam kerja per hari.[70] National Institute for Occupational Safety and Health telah menetapkan batas paparan yang direkomendasikan untuk platina adalah 1 mg/m3 selama 8 jam kerja.[71]
Zat antineoplastik berbasis platina digunakan dalam kemoterapi, dan menunjukkan aktivitas yang baik melawan beberapa tumor.
Oleh karena platina adalah katalis dalam pembuatan karet silikon dan komponen gel beberapa jenis implan medis (implan payudara, prostetik pengganti sendi, cakram lumbar buatan, port akses vaskular, dll.), kemungkinan platina dapat masuk ke dalam tubuh dan menyebabkan efek kesehatan menjadi penelitian serius. Badan Pengawas Obat dan Makanan Amerika Serikat dan institusi lainnya telah meninjau isu dan menemukan tidak ada bukti yang mengarah pada keracunan in vivo.[72][73]
Lihat pula
[sunting | sunting sumber]- Elektrode campuran oksida logam
- Platina di Afrika
- Platina nanopartikel
- Cetak platina
- Ledakan komoditas tahun 200an
Catatan kaki
[sunting | sunting sumber]- ^ Istilah logam mulia di Indonesia memiliki makna yang berbeda menurut bidang kimia/fisika dan bidang ekonomi. Logam mulia menurut kimia/fisika diturunkan dari bahasa Inggris: noble metal yang merujuk pada sifat inert golongan logam ini. Sedangkan meurut ilmu ekonomi, logam mulia yang diturunkan dari bahasa Inggris: precious metal lebih cocok jika dimaknai sebagai Logam berharga karena merujuk pada kelangkaan dan nilai ekonominya yang tinggi. Namun demikian, seluruh unsur logam berharga (ekonomi) secara kimia masuk dalam golongan logam mulia (kimia)
Referensi
[sunting | sunting sumber]- ^ (Indonesia) "Platina". KBBI Daring. Diakses tanggal 17 Juli 2022.
- ^ (Indonesia) "Platinum". KBBI Daring. Diakses tanggal 17 Juli 2022.
- ^ Weast, Robert (1984). CRC, Handbook of Chemistry and Physics. Boca Raton, Florida: Chemical Rubber Company Publishing. hlm. E110. ISBN 0-8493-0464-4.
- ^ "platinum (Pt)." Encyclopædia Britannica Online. Encyclopædia Britannica Inc., 2012. Web. 24 April 2012
- ^ Harper, Douglas. "platinum". Online Etymology Dictionary.
- ^ "Air Quality Guidelines" (PDF) (edisi ke-Second). WHO Regional Office for Europe, Copenhagen, Denmark. 2000. Parameter
|chapter=akan diabaikan (bantuan) - ^ Wheate, NJ; Walker, S; Craig, GE; Oun, R (2010). "The status of platinum anticancer drugs in the clinic and in clinical trials". Dalton transactions (Cambridge, England : 2003). 39 (35): 8113–27. doi:10.1039/C0DT00292E. PMID 20593091.
- ^ a b Lagowski, J. J., ed. (2004). Chemistry Foundations and Applications. 3. Thomson Gale. hlm. 267–268. ISBN 0-02-865724-1.
- ^ Mel Schwartz (2002), CRC press encyclopedia of materials and finishes (edisi ke-2nd), CRC Press
- ^ John Vaccari (2002), Materials handbook (edisi ke-15th), McGraw-Hill
- ^ "Salinan arsip". Diarsipkan dari versi asli Periksa nilai
|url=(bantuan) tanggal 2010-06-17. Diakses tanggal 2021-03-04. - ^ Sir Norman Lockyer (1891). Nature. Macmillan Journals Limited. hlm. 625–.
- ^ a b c CRC contributors (2007–2008). "Platinum". Dalam Lide, David R. CRC Handbook of Chemistry and Physics. 4. New York: CRC Press. hlm. 26. ISBN 978-0-8493-0488-0.
- ^ Craig, Bruce D; Anderson, David S; International, A.S.M. (January 1995). "Platinum". Handbook of corrosion data. hlm. 8–9. ISBN 978-0-87170-518-1.
- ^ a b Kauffman, George B.; Thurner, Joseph J.; Zatko, David A. (1967). "Ammonium Hexachloroplatinate(IV)". Inorganic Syntheses. Inorganic Syntheses. 9: 182–185. doi:10.1002/9780470132401.ch51. ISBN 978-0-470-13240-1.
- ^ a b c Han, Y.; Huynh, H. V.; Tan, G. K. (2007). "Mono- vs Bis(carbene) Complexes: A Detailed Study on Platinum(II)−Benzimidazolin-2-ylidenes". Organometallics. 26 (18): 4612. doi:10.1021/om700543p.
- ^ Audi, G.; Bersillon, O.; Blachot, J.; Wapstra, A.H. (2003). "The NUBASE Evaluation of Nuclear and Decay Properties". Nuclear Physics A. Atomic Mass Data Center. 729: 3–128. Bibcode:2003NuPhA.729....3A. doi:10.1016/j.nuclphysa.2003.11.001.
- ^ Earth's natural wealth: an audit. New Scientist. 23 May 2007.
- ^ Stellman, Jeanne Mager (1998). Encyclopaedia of Occupational Health and Safety: Chemical, industries and occupations. International Labour Organization. hlm. 141. ISBN 92-2-109816-8.
- ^ Murata, K. J. (1958). in Symposium on Spectrocemical Analysis for Trace Elements. ASTM International. hlm. 71.
- ^ "The History of Platinum". Alaska Community Database Online. ExploreNorth. Diakses tanggal 12 April 2011.
Platinum is located on the Bering Sea coast, below Red Mountain on the south spit of Goodnews Bay.
- ^ Xiao, Z.; Laplante, A. R. (2004). "Characterizing and recovering the platinum group minerals—a review". Minerals Engineering. 17 (9–10): 961–979. doi:10.1016/j.mineng.2004.04.001.
- ^ Dan Oancea Platinum In South Africa. MINING.com. September 2008
- ^ a b Seymour, R. J.; O'Farrelly, J. I. (2001). "Platinum-group metals". Kirk Othmer Encyclopedia of Chemical Technology. Wiley. doi:10.1002/0471238961.1612012019052513.a01.pub2.
- ^ "Mining Platinum in Montana". New York Times. 13 August 1998. Diakses tanggal 9 September 2008.
- ^ Loferski, P. J. (July 2012). "Platinum–Group Metals" (PDF). USGS Mineral Resources Program. Diakses tanggal 17 July 2012.
- ^ "Evidence of huge deposits of platinum in State". The Hindu. Chennai, India. 2 July 2010.
- ^ MOU for platinum exploration in Tamil Nadu signed Diarsipkan 2016-03-04 di Wayback Machine.. thaindian.com. 1 July 2010
- ^ Koeberl, Christian (1998). "Identification of meteoritic components in imactites". Meteorites: flux with time and impact effects. hlm. 133–155. ISBN 978-1-86239-017-1.
- ^ a b c Krebs, Robert E. (1998). "Platinum". The History and Use of our Earth's Chemical Elements. Greenwood Press. hlm. 124–127. ISBN 0-313-30123-9.
- ^ Smith, G. F.; Gring, J. L. (1933). "The Separation and Determination of the Alkali Metals Using Perchloric Acid. V. Perchloric Acid and Chloroplatinic Acid in the Determination of Small Amounts of Potassium in the Presence of Large Amounts of Sodium". Journal of the American Chemical Society. 55 (10): 3957–3961. doi:10.1021/ja01337a007.
- ^ Schweizer, A. E.; Kerr, G. T. (1978). "Thermal Decomposition of Hexachloroplatinic Acid". Inorganic Chemistry. 17 (8): 2326–2327. doi:10.1021/ic50186a067.
- ^ Perry, D. L. (1995). Handbook of Inorganic Compounds. CRC Press. hlm. 296–298. ISBN 0-8493-8671-3.
- ^ Ahrens, Sebastian; Strassner, Thomas (2006). "Detour-free synthesis of platinum-bis-NHC chloride complexes, their structure and catalytic activity in the CH activation of methane". Inorganica Chimica Acta. 359 (15): 4789. doi:10.1016/j.ica.2006.05.042.
- ^ Karpov, Andrey; Konuma, Mitsuharu; Jansen, Martin (2006). "An experimental proof for negative oxidation states of platinum: ESCA-measurements on barium platinides". Chemical Communications (8): 838–840. doi:10.1039/b514631c. PMID 16479284.
- ^ Karpov, Andrey; Nuss, Jürgen; Wedig, Ulrich; Jansen, Martin (2003). "Cs2Pt: A Platinide(-II) Exhibiting Complete Charge Separation". Angewandte Chemie International Edition. 42 (39): 4818. doi:10.1002/anie.200352314.
- ^ a b Jansen, Martin (2005). "Effects of relativistic motion of electrons on the chemistry of gold and platinum". Solid State Sciences. 7 (12): 1464. Bibcode:2005SSSci...7.1464J. doi:10.1016/j.solidstatesciences.2005.06.015.
- ^ Ghilane, J.; Lagrost, C.; Guilloux-Viry, M.; Simonet, J.; et al. (2007). "Spectroscopic Evidence of Platinum Negative Oxidation States at Electrochemically Reduced Surfaces". Journal of Physical Chemistry C. 111 (15): 5701. doi:10.1021/jp068879d.
- ^ Richards, A.D.; Rodger, A. (2007). "Synthetic metallomolecules as agents for the control of DNA structure". Chemical Society Reviews. 36 (3): 471–483. doi:10.1039/b609495c. PMID 17325786.
- ^ Rayner W. Hesse (2007). Jewelrymaking Through History: An Encyclopedia. Greenwood Publishing Group. hlm. 155–156. ISBN 0-313-33507-9.
- ^ a b Donald McDonald, Leslie B. Hunt (1982). A History of Platinum and its Allied Metals. Johnson Matthey Plc. hlm. 7–8. ISBN 0-905118-83-9.
- ^ a b c d e Weeks, M. E. (1968). Discovery of the Elements (edisi ke-7th). Journal of Chemical Education. hlm. 385–407. ISBN 0-8486-8579-2. OCLC 23991202.
- ^ Dixon, Joshua; Brownrigg, William (1801). The literary life of William Brownrigg. To which are added an account of the coal mines near Whitehaven: And Observations on the means of preventing epidemic fevers. hlm. 52.
- ^ Watson, Wm; Brownrigg, William (1749). "Several Papers concerning a New Semi-Metal, Called Platina; Communicated to the Royal Society by Mr. Wm. Watson F. R. S" (PDF). Philosophical Transactions. 46 (491–496): 584–596. doi:10.1098/rstl.1749.0110. Diarsipkan dari versi asli (PDF) tanggal 2013-10-21. Diakses tanggal 2016-03-15.
- ^ Marggraf, Andreas Sigismund (1760). Versuche mit dem neuen mineralischen Körper Platina del pinto genannt.
- ^ Platinum. mysite.du.edu
- ^ Ertl, Gerhard (2008). "Reactions at Surfaces: From Atoms to Complexity (Nobel Lecture)". Angewandte Chemie International Edition. 47 (19): 385–407. doi:10.1002/anie.200800480. PMID 18357601.
- ^ "21.09kg Pt". WolframAlpha. Diakses tanggal 14 July 2012.
- ^ Kelly, Thomas D.; Matos, Grecia R. (2013), Historical Statistics for Mineral and Material Commodities in the United States, U.S. Geological Survey
- ^ Loferski, P. J. (October 2011). "2010 Minerals Yearbook; Platinum-group metals" (PDF). USGS Mineral Resources Program. Diakses tanggal 17 July 2012.
- ^ Heiserman, David L. (1992). Exploring Chemical Elements and their Compounds. TAB Books. hlm. 272–274. ISBN 0-8306-3018-X.
- ^ Hunt, L. B.; Lever, F. M. (1969). "Platinum Metals: A Survey of Productive Resources to industrial Uses" (PDF). Platinum Metals Review. 13 (4): 126–138. Diarsipkan dari versi asli (PDF) tanggal 2008-10-29. Diakses tanggal 2016-03-15.
- ^ Kauffman, George B.; Teter, Larry A. & Rhoda, Richard N. (1963). "Recovery of Platinum from Laboratory Residues". Inorg. Synth. Inorganic Syntheses. 7: 232. doi:10.1002/9780470132388.ch61. ISBN 978-0-470-13238-8.
- ^ Loferski, P. J. (August 2015). "2013 Minerals Yearbook; Platinum-group metals" (PDF). USGS Mineral Resources Program. Diakses tanggal 1 March 2016.
- ^ Petrucci, Ralph H. (2007). General Chemistry: Principles & Modern Applications (edisi ke-9th). Prentice Hall. hlm. 606. ISBN 0-13-149330-2.
- ^ Laramie, James; Dicks, Andrew (2003). Fuel Cell System Explained. John Wiley & Sons Ltd. ISBN 0-470-84857-X.
- ^ Wang, C.; Daimon, H.; Onodera, T.; Koda, T.; Sun, S. (2008). "A general approach to the size- and shape-controlled synthesis of platinum nanoparticles and their catalytic reduction of oxygen". Angewandte Chemie - International Edition. 47 (19): 3588–3591. doi:10.1002/anie.200800073.
- ^ Gupta, S. V. (2010). "Chapter 4. Metre Convention and Evolution of Base Units". Springer Series in Materials Science, Volume 122. hlm. 47. doi:10.1007/978-3-642-00738-5_4.
- ^ Feltham, A. M.; Spiro, Michael (1971). "Platinized platinum electrodes". Chemical Reviews. 71 (2): 177. doi:10.1021/cr60270a002.
- ^ "Professional Jeweler's Magazine Archives, issue of August 2004". Diakses tanggal 19 June 2011.
- ^ "Platinum primer". Diamond Cutters International. Diakses tanggal 18 June 2011.
- ^ "Unknown Facts about Platinum". watches.infoniac.com. Diarsipkan dari versi asli tanggal 2017-11-10. Diakses tanggal 9 September 2008.
- ^ "Fixing Statistics". The London Platinum and Palladium Market. Diarsipkan dari versi asli tanggal 2010-01-25. Diakses tanggal 13 June 2010.
- ^ "One Year Platinum". Kitco. Diakses tanggal 28 June 2011.
- ^ "Platinum versus Gold". The Speculative Invertor. 14 April 2002. Diarsipkan dari versi asli tanggal 2008-10-26. Diakses tanggal 2016-03-15.
- ^ "Platinum". Minerals Zone. Diarsipkan dari versi asli tanggal 2008-10-12. Diakses tanggal 9 September 2008.
- ^ Gwin, John (1986). "Pricing Financial Institution Products". Journal of Professional Services Marketing. 1 (3): 91. doi:10.1300/J090v01n03_07.
- ^ Crouse, Richard (1 May 2000). Big Bang Baby: The Rock Trivia Book. hlm. 126. ISBN 978-0-88882-219-2.
- ^ Gauding, Madonna (6 October 2009). The Signs and Symbols Bible: The Definitive Guide to Mysterious Markings. ISBN 978-1-4027-7004-3.
- ^ "Occupational Health Guideline for Soluble Platinum Salts (as Platinum)" (PDF). Centers for Disease Control and Prevention. Diakses tanggal 9 September 2008.
- ^ "CDC - NIOSH Pocket Guide to Chemical Hazards - Platinum". www.cdc.gov. Diakses tanggal 2015-11-21.
- ^ "FDA Backgrounder on Platinum in Silicone Breast Implants". U.S. Food and Drug Administration. Diarsipkan dari versi asli tanggal 24 July 2008. Diakses tanggal 9 September 2008.
- ^ Brook, Michael (2006). "Platinum in silicone breast implants". Biomaterials. 27 (17): 3274–3286. doi:10.1016/j.biomaterials.2006.01.027. PMID 16483647.
Pranala luar
[sunting | sunting sumber]- Platinum at The Periodic Table of Videos (University of Nottingham)
- Nuclides and Isotopes Fourteenth Edition: Chart of the Nuclides, General Electric Company, 1989.
- NIOSH Pocket Guide to Chemical Hazards – Platinum Centers for Disease Control and Prevention
- "The PGM Database". Diarsipkan dari versi asli tanggal 2019-07-01. Diakses tanggal 2016-03-15.
- "A balanced historical account of the sequence of discoveries of platinum; illustrated".
- "Platinum Metals Review: A free, quarterly journal of research on the science and technology of the platinum group metals and developments in their application in industry". Diarsipkan dari versi asli tanggal 2015-05-29. Diakses tanggal 2005-11-05.
- "Platinum-Group Metals Statistics and Information". United States Geological Survey.
- What's the difference between bar, bullion, and ingot? from Quora
| (besar) | |||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | ||||||||||||||||
| 1 | H | He | |||||||||||||||||||||||||||||||
| 2 | Li | Be | B | C | N | O | F | Ne | |||||||||||||||||||||||||
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar | |||||||||||||||||||||||||
| 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | |||||||||||||||
| 5 | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | |||||||||||||||
| 6 | Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | |
| 7 | Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | |
|
| |||||||||||||||||||||||||||||||||