Karbon
| Karbon | ||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 Intan (kiri) dan grafit (kanan), 2 alotrop terkenal dari karbon | ||||||||||||||||||||||||||
Garis spektrum karbon | ||||||||||||||||||||||||||
| Sifat umum | ||||||||||||||||||||||||||
| Nama, lambang | karbon, C | |||||||||||||||||||||||||
| Pengucapan | /karbon/[1] | |||||||||||||||||||||||||
| Alotrop | grafit, intan dan lainnya (lihat alotrop karbon) | |||||||||||||||||||||||||
| Penampilan |
| |||||||||||||||||||||||||
| Karbon dalam tabel periodik | ||||||||||||||||||||||||||
| ||||||||||||||||||||||||||
| Nomor atom (Z) | 6 | |||||||||||||||||||||||||
| Golongan | golongan 14 (golongan karbon) | |||||||||||||||||||||||||
| Periode | periode 2 | |||||||||||||||||||||||||
| Blok | blok-p | |||||||||||||||||||||||||
| Kategori unsur | nonlogam poliatomik | |||||||||||||||||||||||||
| Berat atom standar (Ar) |
| |||||||||||||||||||||||||
| Konfigurasi elektron | 1s2 2s2 2p2 atau [He] 2s2 2p2 | |||||||||||||||||||||||||
| Elektron per kelopak | 2,4 | |||||||||||||||||||||||||
| Sifat fisik | ||||||||||||||||||||||||||
| Fase pada STS (0 °C dan 101,325 kPa) | padat | |||||||||||||||||||||||||
| Titik sublimasi | 3915 K (3642 °C, 6588 °F) | |||||||||||||||||||||||||
| Kepadatan mendekati s.k. | amorf:[2] 1,8–2,1 g/cm3 intan: 3,515 g/cm3 grafit: 2,267 g/cm3 | |||||||||||||||||||||||||
| Titik tripel | 4600 K, 10.800 kPa[3][4] | |||||||||||||||||||||||||
| Kalor peleburan | grafit: 117 kJ/mol | |||||||||||||||||||||||||
| Kapasitas kalor molar | intan: 6,155 J/(mol·K) grafit: 8,517 J/(mol·K) | |||||||||||||||||||||||||
| Sifat atom | ||||||||||||||||||||||||||
| Bilangan oksidasi | −4, −3, −2, −1, 0, +1,[5] +2, +3,[6] +4[7] (oksida agak asam) | |||||||||||||||||||||||||
| Elektronegativitas | Skala Pauling: 2,55 | |||||||||||||||||||||||||
| Energi ionisasi | ke-1: 1086,5 kJ/mol ke-2: 2352,6 kJ/mol ke-3: 4620,5 kJ/mol (artikel) | |||||||||||||||||||||||||
| Jari-jari kovalen | sp3: 77 pm sp2: 73 pm sp: 69 pm | |||||||||||||||||||||||||
| Jari-jari van der Waals | 170 pm | |||||||||||||||||||||||||
| Lain-lain | ||||||||||||||||||||||||||
| Kelimpahan alami | primordial | |||||||||||||||||||||||||
| Struktur kristal | intan: kubus-rombus acuan muka (bening) | |||||||||||||||||||||||||
| Struktur kristal | grafit: heksagon sederhana (hitam) | |||||||||||||||||||||||||
| Kecepatan suara batang ringan | intan: 18.350 m/s (suhu 20 °C) | |||||||||||||||||||||||||
| Ekspansi kalor | intan: 0,8 µm/(m·K) (suhu 25 °C)[8] | |||||||||||||||||||||||||
| Konduktivitas termal | intan: 900–2300 W/(m·K) grafit: 119–165 W/(m·K) | |||||||||||||||||||||||||
| Arah magnet | diamagnetik[9] | |||||||||||||||||||||||||
| Modulus Young | intan: 1050 GPa[8] | |||||||||||||||||||||||||
| Modulus Shear | intan: 478 GPa[8] | |||||||||||||||||||||||||
| Modulus curah | intan: 442 GPa[8] | |||||||||||||||||||||||||
| Rasio Poisson | intan: 0,1[8] | |||||||||||||||||||||||||
| Skala Mohs | grafit: 1–2 | |||||||||||||||||||||||||
| Nomor CAS | 7440-44-0 | |||||||||||||||||||||||||
| Sejarah | ||||||||||||||||||||||||||
| Penemuan | Mesir Kuno dan orang Sumeria[10] (3750 SM) | |||||||||||||||||||||||||
| Diketahui sebagai unsur kimia oleh | A. Lavoisier[11] (1789) | |||||||||||||||||||||||||
| Isotop karbon yang utama | ||||||||||||||||||||||||||
| ||||||||||||||||||||||||||
Karbon (dari bahasa Latin: carbo "arang") atau zat arang adalah sebuah unsur kimia dengan lambang C dan nomor atom 6. Ia merupakan nonlogam dan tetravalen—atomnya membuat empat elektron tersedia untuk membentuk ikatan kimia kovalen. Ia berada dalam golongan 14 dari tabel periodik.[12] Karbon hanya menyusun sekitar 0,025 persen dari kerak Bumi.[13] Tiga isotop terjadi secara alami, 12C dan 13C merupakan nuklida stabil, sedangkan 14C merupakan sebuah radionuklida, meluruh dengan waktu paruh sekitar 5.730 tahun.[14] Karbon merupakan salah satu dari sedikit unsur yang telah dikenal sejak zaman dahulu.[15]
Karbon merupakan unsur paling melimpah ke-15 di kerak Bumi, dan unsur paling melimpah keempat di alam semesta berdasarkan massa setelah hidrogen, helium, dan oksigen. Kelimpahan karbon, keragaman senyawa organiknya yang unik, dan kemampuannya yang tidak biasa untuk membentuk polimer pada suhu yang biasa ditemui di Bumi, memungkinkan unsur ini berfungsi sebagai unsur yang umum dari semua kehidupan yang diketahui. Ia merupakan unsur paling melimpah kedua dalam tubuh manusia berdasarkan massa (sekitar 18,5%) setelah oksigen.[16]
Atom-atom karbon dapat berikatan bersama dalam berbagai cara, menghasilkan berbagai alotrop karbon. Alotrop karbon yang paling terkenal termasuk grafit, intan, karbon amorf dan fulerena. Sifat fisik karbon sangat bervariasi dengan bentuk alotropisnya. Misalnya, grafit buram dan hitam sedangkan intan sangat transparan. Grafit cukup lunak untuk membentuk goresan di atas kertas (karena itu namanya berasal dari kata kerja Yunani "γράφειν" yang berarti "menulis"), sedangkan intan adalah bahan alami yang paling keras yang diketahui. Grafit merupakan penghantar listrik yang baik sedangkan intan memiliki konduktivitas listrik yang rendah. Dalam kondisi normal, intan, tabung nano karbon, dan grafena memiliki konduktivitas termal tertinggi dari semua bahan yang diketahui. Semua alotrop karbon merupakan padatan dalam kondisi normal, dengan grafit menjadi bentuk yang paling stabil secara termodinamika pada suhu dan tekanan standar. Mereka semua tahan kimia dan membutuhkan suhu tinggi untuk bereaksi bahkan dengan oksigen.
Bilangan oksidasi karbon yang paling umum dalam senyawa anorganik adalah +4, sedangkan +2 ditemukan pada karbon monoksida dan kompleks karbonil logam transisi. Sumber terbesar karbon anorganik adalah batu gamping, dolomit, dan karbon dioksida, tetapi jumlah yang signifikan terjadi pada deposit organik, yaitu batu bara, gambut, minyak, dan metana klatrat. Karbon membentuk senyawa dalam jumlah yang sangat besar, lebih dari unsur lainnya, dengan hampir sepuluh juta senyawa yang dijelaskan hingga saat ini,[17] namun, jumlah tersebut hanyalah sebagian kecil dari jumlah senyawa yang mungkin secara teoretis dalam kondisi standar. Karena alasan ini, karbon sering disebut sebagai "raja dari semua unsur".[18]
Karakteristik[sunting | sunting sumber]

Alotrop karbon termasuk grafit, salah satu zat paling lembut yang diketahui, dan intan, zat alami yang paling keras. Ia mudah mengikat dengan atom kecil lainnya, termasuk atom karbon lainnya, dan mampu membentuk beberapa ikatan kovalen stabil dengan atom multivalen yang sesuai. Karbon diketahui membentuk hampir sepuluh juta senyawa, sebagian besar dari semua senyawa kimia.[17] Karbon juga memiliki titik sublimasi tertinggi dari semua unsur. Pada tekanan atmosfer ia tidak memiliki titik leleh, karena titik tripelnya berada pada suhu 108 ± 02 megapascal (1.066 ± 20 atm; 15.660 ± 290 psi) dan 4.600 ± 300 K (4.330 ± 300 °C; 7.820 ± 540 °F),[3][4] sehingga ia menyublim pada suhu sekitar 3.900 K (3.630 °C; 6.560 °F).[20][21] Grafit jauh lebih reaktif daripada intan pada kondisi standar, meskipun lebih stabil secara termodinamika, karena sistem pi yang terdelokalisasinya jauh lebih rentan terhadap serangan. Sebagai contoh, grafit dapat dioksidasi oleh asam nitrat pekat panas pada kondisi standar menjadi asam melitat, C6(CO2H)6, yang mempertahankan unit heksagonal grafit sambil memecah struktur yang lebih besar.[22]
Karbon menyublim dalam busur karbon, yang memiliki suhu sekitar 5.800 K (5.530 °C atau 9.980 °F). Jadi, terlepas dari bentuk alotropisnya, karbon akan tetap padat pada suhu yang lebih tinggi daripada logam dengan titik lebur tertinggi seperti wolfram atau renium. Meskipun secara termodinamika rentan terhadap oksidasi, karbon menahan oksidasi lebih efektif daripada unsur-unsur seperti besi dan tembaga, yang merupakan zat pereduksi yang lebih lemah pada suhu kamar.
Karbon adalah unsur keenam, dengan konfigurasi elektron keadaan dasar 1s22s22p2, di mana empat elektron terluarnya adalah elektron valensi. Empat energi ionisasi pertamanya, 1086,5, 2352,6, 4620,5 dan 6222,7 kJ/mol, jauh lebih tinggi daripada unsur golongan 14 yang lebih berat. Keelektronegatifan karbon adalah 2,5, jauh lebih tinggi daripada unsur golongan 14 yang lebih berat (1,8–1,9), tetapi dekat dengan sebagian besar nonlogam terdekat, serta beberapa logam transisi baris kedua dan ketiga. Jari-jari kovalen karbon biasanya diambil sebagai 77,2 pm (C−C), 66,7 pm (C=C) dan 60,3 pm (C≡C), meskipun nilai ini dapat bervariasi tergantung pada bilangan koordinasi dan pada apa karbon terikat. Secara umum, jari-jari kovalen berkurang dengan bilangan koordinasi yang lebih rendah dan orde ikatan yang lebih tinggi.[23]
Senyawa berbasis karbon membentuk dasar dari semua kehidupan yang diketahui di Bumi, dan siklus karbon–nitrogen menyediakan sebagian energi yang dihasilkan oleh Matahari dan bintang-bintang lainnya. Meskipun ia membentuk berbagai senyawa yang luar biasa, sebagian besar bentuk karbon relatif tidak reaktif dalam kondisi normal. Pada suhu dan tekanan standar, ia menolak semuanya kecuali oksidator terkuat. Ia tidak bereaksi dengan asam sulfat, asam klorida, klorin, atau alkali apa pun. Pada suhu tinggi, karbon bereaksi dengan oksigen untuk membentuk oksida karbon dan akan merampas oksigen dari oksida logam untuk meninggalkan unsur logam tadi. Reaksi eksotermik ini digunakan dalam industri besi dan baja untuk melebur besi dan untuk mengontrol kandungan karbon pada baja:
- Fe3O4 + 4 C(s) + 2 O2 → 3 Fe(s) + 4 CO2(g).
Karbon bereaksi dengan belerang untuk membentuk karbon disulfida, dan bereaksi dengan uap dalam reaksi gas-batu bara yang digunakan dalam gasifikasi batu bara:
- C(s) + H2O(g) → CO(g) + H2(g).
Karbon bergabung dengan beberapa logam pada suhu tinggi untuk membentuk karbida logam, seperti besi karbida (sementit) dalam baja dan wolfram karbida, banyak digunakan sebagai ampelas dan untuk membuat ujung yang keras untuk alat pemotong.
Sistem alotrop karbon mencakup berbagai ekstrem:
| Grafit adalah salah satu bahan paling lembut yang diketahui. | Intan nanokristalin sintetis adalah bahan paling keras yang diketahui.[24] |
| Grafit adalah pelumas yang sangat baik, menampilkan superlubrisitas.[25] | Intan adalah ampelas utama. |
| Grafit adalah sebuah konduktor listrik.[26] | Intan adalah sebuah insulator listrik yang sangat baik,[27] dan memiliki medan listrik rusak tertinggi dari semua bahan yang diketahui. |
| Beberapa bentuk grafit digunakan untuk insulasi termal (yaitu sekat bakar dan pelindung panas), tetapi beberapa bentuk lain merupakan konduktor termal yang baik. | Intan adalah konduktor termal alami yang paling baik |
| Grafit tidak tembus cahaya. | Intan sangat transparan. |
| Grafit mengkristal dalam sistem heksagon.[28] | Intan mengkristal dalam sistem kubik. |
| Karbon amorf benar-benar isotropis. | Tabung nano karbon adalah salah satu bahan yang paling anisotropis yang diketahui. |
Alotrop[sunting | sunting sumber]
Karbon atomik adalah spesies yang berumur sangat pendek dan, oleh karena itu, karbon distabilkan dalam berbagai struktur multi-atom dengan konfigurasi molekul beragam yang disebut alotrop. Tiga alotrop karbon yang relatif terkenal adalah karbon amorf, grafit, dan intan. Setelah dianggap eksotis, fulerena saat ini umumnya disintesis dan digunakan dalam penelitian; mereka termasuk buckyball,[29][30] tabung nano karbon,[31] kuncup nano karbon,[32] dan serat nano karbon.[33][34] Beberapa alotrop eksotis lainnya juga telah ditemukan, seperti lonsdaleit,[35] karbon kaca,[36] busa nano karbon[37] dan karbon asetilenik linier (karbin).[38]
Grafena adalah lembaran karbon dua dimensi dengan atom-atom yang tersusun dalam kisi heksagon. Pada 2009, grafena tampaknya menjadi bahan terkuat yang pernah diuji.[39] Proses pemisahannya dari grafit akan membutuhkan beberapa pengembangan teknologi lebih lanjut sebelum ia menjadi ekonomis untuk proses industri.[40] Jika berhasil, grafena dapat digunakan dalam pembangunan lift luar angkasa. Ia juga dapat digunakan untuk menyimpan hidrogen dengan aman untuk digunakan dalam mesin berbasis hidrogen pada mobil.[41]

Bentuk amorf karbon adalah bermacam-macam atom karbon dalam keadaan nonkristal, tidak teratur, seperti kaca, tidak disimpan dalam struktur makro kristal. Ia hadir sebagai bubuk, dan merupakan konstituen utama dari zat seperti arang, lampblack (jelaga) dan karbon aktif. Pada tekanan normal, karbon berbentuk grafit, di mana setiap atom terikat secara trigonal dengan tiga atom lainnya dalam bidang yang terdiri dari cincin heksagonal yang menyatu, seperti yang ada pada hidrokarbon aromatik.[42] Jaringan yang dihasilkan berbentuk 2 dimensi, dan lembaran datar yang dihasilkan ditumpuk dan diikat secara longgar melalui gaya van der Waals yang lemah. Hal ini memberi grafit sifat kelembutan dan kebersihannya (lembarannya mudah tergelincir satu sama lain). Karena delokalisasi salah satu elektron terluar dari setiap atom untuk membentuk awan π, grafit menghantarkan listrik, tetapi hanya pada bidang yang setiap lembarannya terikat secara kovalen. Hal ini akan menghasilkan konduktivitas listrik curah yang lebih rendah untuk karbon daripada kebanyakan logam lainnya. Delokalisasi juga menyumbang stabilitas energik grafit di atas intan pada suhu kamar.

Pada tekanan yang sangat tinggi, karbon membentuk alotrop yang lebih kompak, intan, yang memiliki massa jenis hampir dua kali lipat massa jenis grafit. Di sini, setiap atom terikat secara tetrahedron ke empat atom lainnya, membentuk jaringan 3 dimensi dari cincin atom beranggota enam yang mengerut. Intan memiliki struktur kubik yang sama dengan silikon dan germanium, dan karena kekuatan ikatan karbon-karbon, intan merupakan zat alami yang paling sulit diukur dengan ketahanan terhadap goresan. Berlawanan dengan kepercayaan populer bahwa "intan ada selamanya", mereka secara termodinamika tidak stabil (ΔfG°(intan, 298 K) = 2,9 kJ/mol[43]) dalam kondisi normal (298 K, 105 Pa) dan secara teoretis harus berubah menjadi grafit.[44] Tetapi karena penghalang energi aktivasi yang tinggi, transisi menjadi grafit sangatlah lambat pada suhu normal sehingga tidak terlalu mencolok. Namun, pada suhu yang sangat tinggi intan akan berubah menjadi grafit, dan intan dapat terbakar dalam kebakaran rumah. Sudut kiri bawah dari diagram fase untuk karbon belum diteliti secara eksperimental. Meskipun studi komputasi menggunakan metode teori fungsi rapatan mencapai kesimpulan bahwa sebagai T → 0 K dan p → 0 Pa, intan menjadi lebih stabil daripada grafit sekitar 1,1 kJ/mol,[45] studi eksperimental dan komputasi yang lebih baru serta definitif menunjukkan bahwa grafit lebih stabil daripada intan untuk T < 400 K, tanpa tekanan, sebesar 2,7 kJ/mol pada T = 0 K dan 3,2 kJ/mol pada T = 298,15 K.[46] Dalam beberapa kondisi, karbon mengkristal menjadi lonsdaleit, sebuah kristal heksagon dengan semua atom terikat secara kovalen dan sifat yang mirip dengan intan.[35]
Fulerena adalah formasi kristal sintetis dengan struktur seperti grafit, tetapi tidak hanya sel heksagon datar saja, beberapa sel yang membentuk fulerena mungkin berbentuk segi lima, segi enam nonplanar, atau bahkan segi tujuh atom karbon. Lembaran-lembaran tadi demikian melengkung menjadi bola, elips, atau silinder. Sifat-sifat fulerena (dipecah menjadi buckyball, buckytube, dan kuncup nano) belum sepenuhnya dianalisis dan mewakili area penelitian yang intens dalam bahan nano. Nama fulerena dan buckyball diambil dari Richard Buckminster Fuller, pemopuler kubah geodesik, yang menyerupai struktur fulerena. Buckyball adalah molekul yang cukup besar yang terbentuk sepenuhnya dari karbon yang terikat secara trigonal, membentuk sferoid (yang paling terkenal dan paling sederhana adalah C60 bukminsterfulerena berbentuk bola sepak).[29] Tabung nano karbon (buckytube) secara struktural mirip dengan buckyball, kecuali bahwa setiap atom terikat secara trigonal dalam lembaran melengkung yang membentuk silinder berongga.[30][31] Kuncup nano pertama kali dilaporkan pada tahun 2007 dan merupakan bahan hibrid buckytube/buckyball (buckyball secara kovalen terikat pada dinding luar tabung nano) yang menggabungkan sifat keduanya dalam satu struktur.[32]

Dari alotrop-alotrop lain yang telah ditemukan, busa nano karbon adalah alotrop feromagnetik yang ditemukan pada tahun 1997. Ia terdiri dari kumpulan atom karbon berdensitas rendah yang dirangkai dalam jaring tiga dimensi yang longgar, di mana atom-atomnya terikat secara trigonal dalam cincin beranggota enam dan tujuh. Ia adalah salah satu padatan paling ringan yang diketahui, dengan massa jenis sekitar 2 kg/m3.[47] Demikian pula, karbon kaca mengandung proporsi porositas tertutup yang tinggi,[36] tetapi bertentangan dengan grafit normal, lapisan grafit tidak ditumpuk seperti halaman dalam buku, tetapi memiliki susunan yang lebih acak. Karbon asetilenik linier[38] memiliki struktur kimia[38] −(C:::C)n−. Karbon dalam modifikasi ini linier dengan hibridisasi orbital sp, dan merupakan polimer dengan ikatan tunggal dan rangkap tiga yang berselang-seling. Karbina ini sangat menarik bagi teknologi nano karena modulus Young-nya 40 kali lipat lebih besar daripada bahan terkeras yang diketahui – intan.[48]
Pada tahun 2015, sebuah tim di North Carolina State University mengumumkan pengembangan alotrop lain yang mereka namakan karbon Q, yang dibuat oleh pulsa laser durasi rendah berenergi tinggi pada debu karbon amorf. Karbon Q dilaporkan menunjukkan feromagnetisme, fluoresensi, dan kekerasan yang lebih tinggi daripada intan.[49]
Pada fase uap, sebagian karbon berbentuk dikarbon (C2). Ketika dieksitasi, gas ini bersinar hijau
Keterjadian[sunting | sunting sumber]


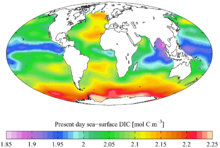
Karbon merupakan unsur kimia paling melimpah keempat di alam semesta teramati berdasarkan massa setelah hidrogen, helium, dan oksigen. Karbon berlimpah di Matahari, bintang, komet, dan di atmosfer pada sebagian besar planet.[50] Beberapa meteorit mengandung intan mikroskopis yang terbentuk ketika Tata Surya masih berupa piringan protoplanet.[51] Intan mikroskopis juga dapat dibentuk oleh tekanan kuat dan suhu tinggi di lokasi tumbukan meteorit.[52]
Pada tahun 2014, NASA mengumumkan basis data yang sangat ditingkatkan untuk melacak hidrokarbon aromatik polisiklik (polycyclic aromatic hydrocarbon, PAH) di alam semesta. Lebih dari 20% karbon di alam semesta mungkin terkait dengan PAH, senyawa kompleks karbon dan hidrogen tanpa oksigen.[53] Senyawa-senyawa ini muncul dalam hipotesis dunia PAH di mana mereka dihipotesiskan memiliki peran dalam abiogenesis dan pembentukan kehidupan. PAH tampaknya telah terbentuk "beberapa miliar tahun" setelah Ledakan Dahsyat, tersebar luas di seluruh alam semesta, dan dikaitkan dengan bintang baru serta planet luar surya.[50]
Diperkirakan bahwa bumi padat secara keseluruhan mengandung 730 ppm karbon, dengan 2000 ppm di inti dan 120 ppm dalam gabungan mantel dan kerak.[54] Karena massa Bumi adalah 5,972×1024 kg, ini berarti 4360 juta gigaton adalah karbon. Ini jauh lebih banyak daripada jumlah karbon di lautan atau atmosfer (di bawah).
Dalam kombinasi dengan oksigen dalam karbon dioksida, karbon ditemukan di atmosfer Bumi (sekitar 900 gigaton karbon — setiap ppm setara dengan 2,13 Gt) dan terlarut di semua badan air (sekitar 36.000 gigaton karbon). Karbon di biosfer diperkirakan mencapai 550 gigaton tetapi dengan ketidakpastian yang besar, sebagian besar disebabkan oleh ketidakpastian besar dalam jumlah bakteri bawah permukaan terestrial dalam.[55] Hidrokarbon (seperti batu bara, minyak bumi, dan gas alam) juga mengandung karbon. Cadangan batu bara berjumlah sekitar 900 gigaton dengan kemungkinan 18.000 Gt sumber daya.[56] Cadangan minyak bumi adalah sekitar 150 gigaton. Sumber gas alam yang terbukti adalah sekitar 175×1012 kubik meter (mengandung sekitar 105 gigaton karbon), tetapi penelitian memperkirakan 900×1012 kubik meter deposit "tidak konvensional" lainnya seperti gas serpih, mewakili sekitar 540 gigaton karbon.[57]
Karbon juga ditemukan dalam metana hidrat di daerah kutub dan di bawah laut. Berbagai perkiraan menempatkan karbon ini antara 500, 2500,[58] atau 3000 Gt.[59]
Di masa lalu, jumlah hidrokarbon lebih besar. Menurut satu sumber, dalam periode 1751 hingga 2008 sekitar 347 gigaton karbon dilepaskan sebagai karbon dioksida ke atmosfer dari pembakaran bahan bakar fosil.[60] Sumber lain menyebutkan jumlah yang ditambahkan ke atmosfer untuk periode sejak 1750 ialah sebesar 879 Gt, dan total yang masuk ke atmosfer, laut, dan darat (seperti rawa gambut) hampir 2.000 Gt.[61]
Karbon adalah konstituen (sekitar 12% massa) dari massa yang sangat besar dari batuan karbonat (batu gamping, dolomit, marmer dan sebagainya). Batu bara sangat kaya akan karbon (antrasit mengandung 92–98%)[62] dan merupakan sumber komersial terbesar karbon mineral, terhitung 4.000 gigaton atau 80% dari bahan bakar fosil.[63]
Adapun alotrop karbon individual, grafit ditemukan dalam jumlah besar di Amerika Serikat (kebanyakan di New York dan Texas), Rusia, Meksiko, Greenland, dan India. Intan alami terjadi pada batu kimberlit, ditemukan di "leher" atau "pipa" vulkanik kuno. Sebagian besar deposit intan berada di Afrika, terutama di Afrika Selatan, Namibia, Botswana, Republik Kongo, dan Sierra Leone. Deposit intan juga telah ditemukan di Arkansas, Kanada, Arktik Rusia, Brazil, dan di Australia Utara dan Barat. Intan sekarang juga ditemukan dari dasar laut di Tanjung Harapan. Intan ditemukan secara alami, tetapi sekitar 30% dari semua intan industri yang digunakan di AS sekarang diproduksi.
Karbon-14 terbentuk di lapisan atas troposfer dan stratosfer pada ketinggian 9–15 km melalui reaksi yang diendapkan oleh sinar kosmik.[64] Neutron termal dihasilkan dari tabrakan dengan inti nitrogen-14, membentuk karbon-14 dan proton. Dengan demikian, 1,5%×10−10 karbon dioksida atmosfer mengandung karbon-14.[65]
Asteroid yang kaya karbon relatif lebih dominan di bagian terluar sabuk asteroid di Tata Surya. Asteroid-asteroid ini belum diambil sampelnya secara langsung oleh para ilmuwan. Asteroid dapat digunakan dalam penambangan karbon hipotetis berbasis ruang angkasa, yang mungkin terjadi di masa depan, tetapi saat ini tidak mungkin secara teknologi.[66]
Isotop[sunting | sunting sumber]
Isotop karbon adalah inti atom yang mengandung enam proton ditambah sejumlah neutron (bervariasi dari 2 hingga 16). Karbon memiliki dua isotop alami yang stabil.[14] Isotop karbon-12 (12C) membentuk 98,93% karbon di Bumi, sedangkan karbon-13 (13C) membentuk 1,07% sisanya.[14] Konsentrasi 12C lebih meningkat dalam bahan biologis karena reaksi biokimia mendiskriminasi 13C.[67] Pada tahun 1961, Persatuan Kimia Murni dan Terapan Internasional (IUPAC) mengadopsi isotop karbon-12 sebagai dasar untuk berat atom.[68] Identifikasi karbon dalam percobaan resonansi magnet inti (nuclear magnetic resonance, NMR) dilakukan dengan isotop 13C.
Karbon-14 (14C) merupakan sebuah radioisotop alami, tercipta di atmosfer atas (stratosfer bawah dan troposfer atas) melalui interaksi nitrogen dengan sinar kosmik.[69] Ia ditemukan dalam jumlah jejak di Bumi sebesar 1 bagian per triliun (0,0000000001%) atau lebih, sebagian besar terbatas pada atmosfer dan deposito dangkal, terutama gambut dan bahan organik lainnya.[70] Isotop ini meluruh melalui emisi β− 0,158 MeV. Karena waktu paruhnya yang relatif pendek (5730 tahun), 14C hampir tidak ada di batuan purba. Jumlah 14C di atmosfer dan dalam organisme hidup hampir konstan, tetapi dapat diprediksi menurun dalam tubuh mereka setelah kematian. Prinsip ini digunakan dalam penanggalan radiokarbon, ditemukan pada tahun 1949, yang telah digunakan secara luas untuk menentukan usia bahan karbon dengan usia hingga sekitar 40.000 tahun.[71][72]
Ada 15 isotop karbon yang telah diketahui dan yang berumur paling pendek adalah 8C yang meluruh melalui emisi proton dan peluruhan alfa dan memiliki waktu paruh 1,98739×10−21 detik.[73] 19C yang eksotis menunjukkan halo nuklir, yang berarti jari-jarinya jauh lebih besar daripada yang diperkirakan jika intinya merupakan bola dengan massa jenis konstan.[74]
Pembentukan pada bintang[sunting | sunting sumber]
Pembentukan inti atom karbon terjadi di dalam bintang raksasa atau super raksasa melalui proses alfa tripel. Proses ini membutuhkan tumbukan hampir simultan dari tiga partikel alfa (inti helium), karena produk dari reaksi fusi nuklir lebih lanjut dari helium dengan hidrogen atau inti helium lainnya masing-masing menghasilkan litium-5 dan berilium-8, dengan keduanya sangat tidak stabil dan meluruh kembali hampir secara instan menjadi inti yang lebih kecil.[75] Proses alfa tripel terjadi dalam kondisi suhu di atas 100 megakelvin dan konsentrasi helium yang dilarang oleh ekspansi dan pendinginan cepat alam semesta awal, dan oleh karena itu tidak ada karbon signifikan yang tercipta selama Ledakan Dahsyat.
Menurut teori kosmologi fisik saat ini, karbon terbentuk di bagian dalam bintang pada cabang horizontal.[76] Ketika bintang masif mati sebagai supernova, karbon tersebar ke angkasa sebagai debu. Debu ini menjadi bahan komponen untuk pembentukan sistem bintang generasi berikutnya dengan planet-planet yang bertambah.[50][77] Tata Surya adalah salah satu sistem bintang dengan kelimpahan karbon, memungkinkan adanya kehidupan seperti yang kita kenal.
Siklus CNO adalah mekanisme fusi hidrogen tambahan yang menggerakkan bintang, di mana karbon beroperasi sebagai katalis.
Transisi rotasi berbagai bentuk isotop karbon monoksida (misalnya, 12CO, 13CO, dan 18CO) dapat dideteksi dalam rentang panjang gelombang submilimeter, dan digunakan dalam studi pembentukan bintang baru di awan molekul.[78]
Siklus karbon[sunting | sunting sumber]
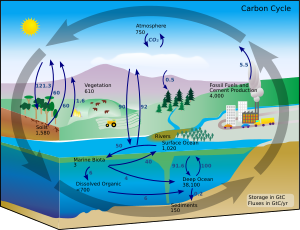
Dalam kondisi terestrial, konversi satu unsur menjadi unsur lain sangatlah jarang. Oleh karena itu, jumlah karbon di Bumi secara efektif ialah konstan. Jadi, proses yang menggunakan karbon harus mendapatkannya dari suatu tempat dan membuangnya di tempat lain. Jalur karbon di lingkungan membentuk siklus karbon.[79] Misalnya, tanaman fotosintesis menarik karbon dioksida dari atmosfer (atau air laut) dan membangunnya menjadi biomassa, seperti dalam siklus Calvin, sebuah proses fiksasi karbon.[80] Beberapa dari biomassa ini dimakan oleh hewan, sementara beberapa karbon dihembuskan oleh hewan sebagai karbon dioksida. Siklus karbon jauh lebih rumit daripada putaran pendek ini; misalnya, beberapa karbon dioksida terlarut di lautan; jika bakteri tidak mengkonsumsinya, tumbuhan atau hewan yang mati dapat menjadi minyak bumi atau batu bara, yang melepaskan karbon ketika dibakar.[81][82]
Senyawa[sunting | sunting sumber]
Senyawa organik[sunting | sunting sumber]


Karbon dapat membentuk rantai yang sangat panjang dari ikatan karbon–karbon yang saling berhubungan, suatu sifat yang disebut katenasi. Ikatan karbon–karbon kuat dan stabil. Melalui katenasi, karbon membentuk senyawa yang tak terhitung jumlahnya. Sebuah penghitungan senyawa unik menunjukkan bahwa lebih banyak senyawa yang mengandung karbon daripada yang tidak.[83] Klaim serupa dapat dibuat untuk hidrogen karena sebagian besar senyawa organik mengandung hidrogen yang terikat secara kimia dengan karbon atau unsur umum lainnya seperti oksigen atau nitrogen.
Bentuk paling sederhana dari molekul organik adalah hidrokarbon—sebuah keluarga besar molekul organik yang terdiri dari atom hidrogen yang terikat pada rantai atom karbon. Tulang punggung hidrokarbon dapat digantikan oleh atom lain, yang dikenal sebagai heteroatom. Heteroatom umum yang muncul dalam senyawa organik termasuk oksigen, nitrogen, belerang, fosforus, dan halogen nonradioaktif, serta logam litium dan magnesium. Senyawa organik yang mengandung ikatan dengan logam dikenal sebagai senyawa organologam (lihat di bawah). Pengelompokan atom tertentu, sering kali termasuk heteroatom, muncul kembali dalam sejumlah besar senyawa organik. Kumpulan ini, yang dikenal sebagai gugus fungsi, memberikan pola reaktivitas umum dan memungkinkan studi sistematis dan kategorisasi senyawa organik. Panjang rantai, bentuk dan gugus fungsi semuanya mempengaruhi sifat molekul organik.[84]
Pada sebagian besar senyawa karbon yang stabil (dan hampir semua senyawa organik yang stabil), karbon mematuhi kaidah oktet dan bersifat tetravalen, yang berarti bahwa atom karbon membentuk total empat ikatan kovalen (yang dapat mencakup ikatan rangkap dua dan rangkap tiga). Pengecualiannya ialah termasuk sejumlah kecil karbokation (tiga ikatan, muatan positif), radikal (tiga ikatan, netral), karbanion (tiga ikatan, muatan negatif) dan karbena (dua ikatan, netral) yang distabilkan, meskipun spesies-spesies ini jauh lebih mungkin ditemui sebagai zat antara yang tidak stabil dan reaktif.
Karbon terjadi di semua kehidupan organik yang diketahui dan merupakan dasar dari kimia organik. Ketika disatukan dengan hidrogen, ia membentuk berbagai hidrokarbon yang penting bagi industri sebagai pendingin, pelumas, pelarut, sebagai bahan baku kimia untuk pembuatan plastik dan petrokimia, serta sebagai bahan bakar fosil.
Ketika dikombinasikan dengan oksigen dan hidrogen, karbon dapat membentuk banyak kelompok senyawa biologis yang penting, seperti gula, lignan, kitin, alkohol, lemak, serta ester, karotenoid, dan terpena aromatik. Dengan nitrogen membentuk alkaloid, dan dengan penambahan belerang juga membentuk antibiotik, asam amino, dan produk karet. Dengan penambahan fosforus ke unsur-unsur lain ini, ia membentuk DNA dan RNA, pembawa kode kimia kehidupan, dan adenosina trifosfat (ATP), molekul transfer energi terpenting di semua sel hidup.[85]
Senyawa anorganik[sunting | sunting sumber]
Umumnya senyawa yang mengandung karbon yang berasosiasi dengan mineral atau yang tidak mengandung ikatan dengan atom karbon lain, halogen, atau hidrogen, diperlakukan secara terpisah dari senyawa organik klasik; definisi tidak kaku, dan klasifikasi beberapa senyawa dapat bervariasi dari penulis ke penulis (lihat artikel referensi di atas). Di antaranya adalah oksida karbon sederhana. Oksida yang paling menonjol adalah karbon dioksida (CO2). Ia pernah menjadi konstituen utama dari paleoatmosfer, tetapi merupakan komponen kecil dari atmosfer Bumi saat ini.[86] Dilarutkan dalam air, ia membentuk asam karbonat (H2CO3), tetapi karena kebanyakan senyawa dengan banyak oksigen yang terikat tunggal pada satu karbon, ia tidaklah stabil.[87] Namun, melalui zat antara ini, ion karbonat yang distabilkan resonansi dihasilkan. Beberapa mineral penting lainnya adalah karbonat, terutama kalsit. Karbon disulfida (CS2) juga serupa.[22] Namun demikian, karena sifat fisiknya dan hubungannya dengan sintesis organik, karbon disulfida terkadang diklasifikasikan sebagai pelarut organik.
Oksida umum lainnya adalah karbon monoksida (CO). Ia dibentuk oleh pembakaran yang tidak sempurna, dan merupakan gas yang tidak berwarna dan tidak berbau. Molekul ini masing-masing mengandung ikatan rangkap tiga dan cukup polar, menghasilkan kecenderungan untuk mengikat molekul hemoglobin secara permanen, menggantikan oksigen, yang memiliki afinitas pengikatan yang lebih rendah.[88][89] Sianida (CN−), memiliki struktur yang mirip, tetapi berperilaku seperti ion halida (pseudohalogen). Misalnya, ia dapat membentuk molekul sianogen nitrida ((CN)2), mirip dengan halida diatomik. Demikian juga, analog sianida yang lebih berat, siafida (CP−), juga dianggap anorganik, meskipun sebagian besar turunan sederhananya sangat tidak stabil. Oksida lain yang tidak umum adalah karbon suboksida (C3O2),[90] dikarbon monoksida (C2O) yang tidak stabil,[91][92] karbon trioksida (CO3),[93][94] siklopentanapentona (C5O5),[95] sikloheksanaheksona (C6O6),[95] dan anhidrida melitat (C12O9). Namun, anhidrida melitat adalah asil anhidrida tripel dari asam melitat; apalagi, ia mengandung cincin benzena. Jadi, banyak ahli kimia yang menganggapnya sebagai senyawa organik.
Dengan logam reaktif, seperti wolfram, karbon membentuk karbida (C4−) atau asetilida (C2−2) untuk membentuk paduan dengan titik lebur tinggi. Anion ini juga terkait dengan metana dan asetilena, keduanya merupakan asam yang sangat lemah. Dengan elektronegativitas 2,5,[96] karbon lebih suka membentuk ikatan kovalen. Beberapa karbida merupakan kisi kovalen, seperti karborundum (SiC), yang menyerupai intan. Namun demikian, bahkan karbida yang paling polar dan seperti garam bukanlah senyawa ionik sepenuhnya.[97]
Senyawa organologam[sunting | sunting sumber]
Menurut definisi, senyawa organologam mengandung setidaknya satu ikatan kovalen karbon-logam. Berbagai macam senyawa tersebut eksis; kelas utama meliputi senyawa alkil-logam sederhana (misalnya, tetra etil timbal), senyawa alkena η2 (misalnya, garam Zeise), dan senyawa alil η3 (misalnya, dimer alilpaladium klorida); metalosena yang mengandung ligan siklopentadienil (misalnya, ferosena); dan kompleks karbena logam transisi. Banyak karbonil logam dan sianida logam eksis (misalnya, nikel tetrakarbonil and kalium ferisianida); beberapa pekerja menganggap kompleks karbonil dan sianida logam tanpa ligan karbon lain sebagai murni anorganik, dan bukan organologam. Namun, sebagian besar ahli kimia organologam menganggap kompleks logam dengan ligan karbon, bahkan 'karbon anorganik' (misalnya, karbonil, sianida, dan beberapa jenis karbida dan asetilida tertentu) sebagai organologam di alam. Kompleks logam yang mengandung ligan organik tanpa ikatan kovalen karbon-logam (misalnya, karboksilat logam) disebut senyawa metalorganik.
Walaupun karbon dipahami sangat menyukai pembentukan empat ikatan kovalen, skema ikatan eksotik lainnya juga diketahui. Karborana merupakan turunan dodekahedron yang sangat stabil dari unit [B12H12]2-, dengan satu BH diganti dengan CH+. Dengan demikian, karbon terikat pada lima atom boron dan satu atom hidrogen. Kation [(Ph3PAu)6C]2+ mengandung karbon oktahedron yang terikat pada enam fragmen fosfin-emas. Fenomena ini telah dikaitkan dengan aurofilisitas ligan emas, yang memberikan stabilisasi tambahan dari spesies yang labil.[98] Di alam, kofaktor besi-molibdenum (FeMoco) yang bertanggung jawab atas fiksasi nitrogen mikroba juga memiliki pusat karbon oktahedron (secara formal sebuah karbida, C(-IV)) yang terikat pada enam atom besi. Pada tahun 2016, dipastikan bahwa, sesuai dengan prediksi teoretis sebelumnya, dikation heksametilbenzena mengandung atom karbon dengan enam ikatan. Lebih khusus, dikation ini dapat dijelaskan secara struktural dengan formulasi [MeC(η5-C5Me5)]2+, menjadikannya sebuah "metalosena organik" di mana fragmen MeC3+ terikat pada fragmen η5-C5Me5− melalui kelima karbon didalam cincin.[99]
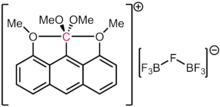
Penting untuk dicatat bahwa dalam kasus di atas, masing-masing ikatan pada karbon mengandung kurang dari dua pasangan elektron formal. Dengan demikian, jumlah elektron formal spesies ini tidak melebihi oktet. Hal ini membuat mereka hiperkoordinat tapi tidak hipervalen. Bahkan dalam kasus dugaan spesies 10-C-5 (yaitu, karbon dengan lima ligan dan jumlah elektron formal sepuluh), seperti yang dilaporkan oleh Akiba dan rekan kerjanya,[100] perhitungan struktur elektronik menyimpulkan bahwa populasi elektron di sekitar karbon masih kurang dari delapan, seperti yang berlaku untuk senyawa lain yang memiliki ikatan tiga pusat empat elektron.
Sejarah dan etimologi[sunting | sunting sumber]

Nama Inggris carbon berasal dari bahasa Latin carbo untuk batu bara dan arang,[101] yang juga berasal dari bahasa Prancis charbon, yang berarti arang. Dalam bahasa Jerman, Belanda, dan Denmark, nama karbon masing-masing adalah kohlenstoff, koolstof dan kulstof semuanya secara harfiah berarti zat batu bara.
Karbon ditemukan pada masa prasejarah dan dikenal dalam bentuk jelaga dan arang pada peradaban manusia paling awal. Intan mungkin sudah dikenal sejak 2500 SM di Tiongkok, sedangkan karbon dalam bentuk arang dibuat sekitar zaman Romawi dengan proses kimia yang sama seperti saat ini, dengan memanaskan kayu dalam sebuah piramida yang dilapisi tanah liat untuk menghilangkan udara.[102][103]

Pada tahun 1722, René Antoine Ferchault de Réaumur mendemonstrasikan bahwa besi diubah menjadi baja melalui penyerapan beberapa zat, yang sekarang dikenal sebagai karbon.[104] Pada tahun 1772, Antoine Lavoisier menunjukkan bahwa intan merupakan bentuk karbon; ketika dia membakar sampel arang dan intan dan menemukan bahwa keduanya tidak menghasilkan air dan keduanya melepaskan jumlah karbon dioksida yang sama per gramnya. Pada tahun 1779,[105] Carl Wilhelm Scheele menunjukkan bahwa grafit, yang dianggap sebagai bentuk timbal, ternyata identik dengan arang tetapi dengan sedikit campuran besi, dan memberikan "asam udara" (nama buatannya untuk karbon dioksida) ketika dioksidasi dengan asam nitrat.[106] Pada tahun 1786, ilmuwan Prancis Claude Louis Berthollet, Gaspard Monge dan C. A. Vandermonde menegaskan bahwa grafit sebagian besar merupakan karbon dengan mengoksidasinya dalam oksigen dengan cara yang sama seperti yang dilakukan Lavoisier dengan intan.[107] Beberapa besi tersisa lagi, yang menurut para ilmuwan Prancis tadi diperlukan untuk struktur grafit. Dalam publikasi mereka, mereka mengusulkan nama carbone (Latin carbonum) untuk unsur dalam grafit yang dilepaskan sebagai gas pada pembakaran grafit. Antoine Lavoisier kemudian mendaftarkan karbon sebagai unsur dalam buku teksnya tahun 1789.[106]
Sebuah alotrop karbon baru, fulerena, yang ditemukan pada tahun 1985[108] termasuk bentuk yang berstruktur nano seperti buckyball dan tabung nano.[29] Penemu mereka – Robert Curl, Harold Kroto dan Richard Smalley – menerima Penghargaan Nobel Kimia pada tahun 1996.[109] Ketertarikan baru yang dihasilkan dalam bentuk-bentuk baru mengarah pada penemuan alotrop eksotis lebih lanjut, termasuk karbon kaca, dan kesadaran bahwa "karbon amorf" tidak sepenuhnya amorf.[36]
Produksi[sunting | sunting sumber]
Grafit[sunting | sunting sumber]
Deposit alami grafit yang layak secara komersial terjadi di banyak bagian dunia, tetapi sumber terpenting secara ekonomi ada di Tiongkok, India, Brasil, dan Korea Utara. Endapan grafit berasal dari metamorf, ditemukan berasosiasi dengan kuarsa, mika, dan felspar dalam sekis, gneis serta batu pasir dan batu gamping termetamorfosis sebagai lensa atau vena, kadang-kadang dengan ketebalan satu meter atau lebih. Deposit grafit di Borrowdale, Cumberland, Inggris pada mulanya memiliki ukuran dan kemurnian yang cukup sehingga, hingga abad ke-19, pensil dibuat hanya dengan menggergaji blok grafit alam menjadi strip sebelum membungkus strip dalam kayu. Saat ini, deposit grafit yang lebih kecil diperoleh dengan menghancurkan batuan induk dan mengapungkan grafit yang lebih ringan di atas air.[110]
Ada tiga jenis grafit alami—amorf, serpihan atau serpihan kristal, dan vena atau gumpalan. Grafit amorf adalah kualitas terendah dan paling melimpah. Bertentangan dengan ilmu pengetahuan, dalam industri "amorf" mengacu pada ukuran kristal yang sangat kecil daripada kekurangan struktur kristal. Amorf digunakan untuk produk grafit bernilai rendah dan merupakan grafit dengan harga terendah. Deposit grafit amorf besar ditemukan di Tiongkok, Eropa, Meksiko, dan Amerika Serikat. Grafit serpihan kurang umum dan berkualitas lebih tinggi daripada amorf; ia terjadi sebagai pelat terpisah yang mengkristal dalam batuan metamorf. Grafit serpihan bisa empat kali lipat harga amorf. Serpihan berkualitas baik dapat diproses menjadi grafit yang dapat diperluas untuk banyak kegunaan, seperti penghambat nyala. Deposito terkemuka ditemukan di Austria, Brasil, Kanada, Tiongkok, Jerman, dan Madagaskar. Grafit vena atau gumpalan adalah jenis grafit alami yang paling langka, paling berharga, dan berkualitas tinggi. Ia terjadi pada vena sepanjang kontak intrusif dalam gumpalan padat, dan hanya ditambang secara komersial di Sri Lanka.[110]
Menurut USGS, produksi dunia grafit alam adalah 1,1 juta ton pada 2010, di mana Tiongkok menyumbang 800.000 t, India 130.000 t, Brasil 76.000 t, Korea Utara 30.000 t dan Kanada 25.000 t. Tidak ada grafit alami yang dilaporkan ditambang di Amerika Serikat, tetapi 118.000 t grafit sintetis dengan nilai perkiraan AS$998 juta diproduksi pada tahun 2009.[110]
Intan[sunting | sunting sumber]

Rantai pasokan intan dikendalikan oleh sejumlah kecil bisnis kuat, dan juga sangat terkonsentrasi di sejumlah kecil lokasi di seluruh dunia (lihat gambar).
Hanya sebagian kecil dari bijih intan yang terdiri dari intan yang sebenarnya. Bijih dihancurkan, di mana perawatan harus diambil untuk mencegah berlian yang lebih besar dihancurkan dalam proses ini dan selanjutnya partikel diurutkan berdasarkan kepadatan. Saat ini, intan terletak di fraksi kepadatan yang kaya berlian dengan bantuan fluoresensi sinar-X, setelah itu langkah penyortiran terakhir dilakukan dengan tangan. Sebelum penggunaan sinar-X menjadi biasa, pemisahan dilakukan dengan sabuk gemuk; intan memiliki kecenderungan yang lebih kuat untuk menempel pada minyak daripada mineral lain dalam bijih.[111]
Secara historis intan diketahui hanya ditemukan di endapan aluvial di India Selatan.[112] India memimpin dunia dalam produksi intan dari saat penemuan mereka sekitar abad ke-9 SM[113] hingga pertengahan abad ke-18, tetapi potensi komersial dari sumber-sumber ini telah habis pada akhir abad ke-18 dan pada saat itu India dikalahkan oleh Brasil di mana intan non-India pertama ditemukan pada tahun 1725.[114]
Produksi intan dari deposit primer (kimberlit dan lamproit) baru dimulai pada tahun 1870-an setelah penemuan ladang intan di Afrika Selatan. Produksi telah meningkat dari waktu ke waktu dan total akumulasi lebih dari 4,5 miliar karat telah ditambang sejak tanggal tersebut.[115] Deposit berlian yang paling layak secara komersial berada di Rusia, Botswana, Australia dan Republik Demokratik Kongo.[116] Pada tahun 2005, Rusia memproduksi hampir seperlima dari produksi intan global (kebanyakan di wilayah Yakutia; misalnya, pipa Mir dan pipa Udachnaya) tetapi tambang Argyle di Australia menjadi sumber tunggal terbesar, menghasilkan 14 juta karat pada tahun 2018.[117][118] Temuan baru, tambang Kanada di Diavik dan Ekati, diperkirakan menjadi lebih berharga karena produksi batu permata berkualitas mereka.[119]
Di Amerika Serikat, intan telah ditemukan di Arkansas, Colorado and Montana.[120] Pada tahun 2004, penemuan mengejutkan dari intan mikroskopis di Amerika Serikat[121] menyebabkan pengambilan sampel massal pipa kimberlit pada Januari 2008 di bagian terpencil Montana.[122]
Aplikasi[sunting | sunting sumber]






Karbon sangatlah penting untuk semua sistem kehidupan yang dikenal, dan tanpanya kehidupan seperti yang kita ketahui tidak akan ada (lihat biokimia alternatif). Penggunaan ekonomi utama karbon selain makanan dan kayu adalah dalam bentuk hidrokarbon, terutama gas metana bahan bakar fosil dan minyak mentah (minyak bumi). Minyak mentah disuling di kilang oleh industri petrokimia untuk menghasilkan bensin, minyak tanah, dan produk lainnya. Selulosa adalah polimer alami yang mengandung karbon yang diproduksi oleh tanaman dalam bentuk kayu, kapas, linen, dan rami. Selulosa digunakan terutama untuk mempertahankan struktur pada tanaman. Polimer karbon yang bernilai komersial yang berasal dari hewan termasuk wol, kasmir, dan sutra. Plastik dibuat dari polimer karbon sintetik, seringkali dengan atom oksigen dan nitrogen yang dimasukkan secara berkala dalam rantai polimer utama. Bahan baku untuk banyak zat sintetis ini berasal dari minyak mentah.
Penggunaan karbon dan senyawanya sangatlah bervariasi. Ia dapat membentuk paduan dengan besi, yang paling umum adalah baja karbon. Grafit dikombinasikan dengan tanah liat untuk membentuk 'ujung' yang digunakan dalam pensil yang digunakan untuk menulis dan menggambar. Ia juga digunakan sebagai pelumas dan pigmen, sebagai bahan cetakan dalam pembuatan kaca, dalam elektrode untuk baterai kering dan dalam pelapisan listrik serta pembentukan listrik, dalam sikat untuk motor listrik, serta sebagai moderator neutron dalam reaktor nuklir.
Arang digunakan sebagai bahan menggambar dalam karya seni pemanggangan, peleburan besi, dan dalam banyak aplikasi lainnya. Kayu, batu bara dan minyak digunakan sebagai bahan bakar untuk produksi energi dan pemanas. Intan kualitas permata digunakan dalam perhiasan, dan intan industri digunakan dalam alat pengeboran, pemotongan, dan pemolesan untuk pemesinan logam dan batu. Plastik dibuat dari hidrokarbon fosil, serta serat karbon, yang dibuat dengan pirolisis serat poliester sintetis digunakan untuk memperkuat plastik untuk membentuk material komposit yang canggih dan ringan.
Serat karbon dibuat melalui pirolisis filamen poliakrilonitril (PAN) yang diekstrusi dan diregangkan dan zat organik lainnya. Struktur kristalografi dan sifat mekanik serat tergantung pada jenis bahan awal, dan pada proses selanjutnya. Serat karbon yang dibuat dari PAN memiliki struktur yang menyerupai filamen sempit grafit, tetapi pemrosesan termal dapat menyusun ulang struktur menjadi lembaran gulung yang kontinu. Hasilnya adalah serat dengan kekuatan tarik spesifik yang lebih tinggi daripada baja.[123]
Karbon hitam digunakan sebagai pigmen hitam dalam tinta percetakan, cat minyak dan cat air seniman, kertas karbon, pelapis otomotif, tinta India, dan tinta bubuk pencetak laser. Karbon hitam juga digunakan sebagai pengisi dalam produk karet seperti ban dan senyawa plastik. Arang aktif digunakan sebagai absorben dan adsorben dalam bahan penyaring dalam berbagai aplikasi seperti masker gas, pemurnian air, dan sungkup udara dapur, serta dalam pengobatan untuk menyerap toksin, racun, atau gas dari sistem pencernaan. Karbon digunakan dalam reduksi kimia pada suhu tinggi. Kokas digunakan untuk mereduksi bijih besi menjadi besi (peleburan). Pengerasan pembungkus baja dicapai dengan memanaskan komponen baja jadi dalam bubuk karbon. Karbida silikon, wolfram, boron dan titanium, merupakan bahan terkeras yang paling dikenal, dan digunakan sebagai ampelas dalam alat pemotong dan gerinda. Senyawa karbon membentuk sebagian besar bahan yang digunakan dalam pakaian, seperti tekstil dan kulit alami dan sintetis, dan hampir semua permukaan interior di lingkungan binaan selain kaca, batu, dan logam.
Intan[sunting | sunting sumber]
Industri intan terbagi dalam dua kategori: yang pertama berurusan dengan intan kelas permata, dan yang kedua dengan intan kelas industri. Walaupun perdagangan besar di kedua jenis intan eksis, kedua pasar ini berbeda fungsi secara dramatis.
Tidak seperti logam berharga lainnya seperti emas atau platina, intan permata tidak diperdagangkan sebagai komoditas: ada peningkatan substansial dalam penjualan intan, dan tidak ada pasar yang sangat aktif untuk penjualan kembali intan.
Intan industri dinilai sebagian besar karena kekerasan dan konduktivitas panasnya, dengan kualitas permata dari kejelasan dan warna yang sebagian besar tidak relevan. Sekitar 80% intan yang ditambang (sama dengan sekitar 100 juta karat atau 20 ton per tahun) tidak cocok untuk digunakan karena batu permata diturunkan untuk keperluan industri (dikenal sebagai bort).[124] Intan sintetiss, ditemukan pada 1950-an, ditemukan dalam aplikasi industri hampir seketika; 3 miliar karat (600 ton) intan sintetis diproduksi setiap tahunnya.[125]
Penggunaan intan yang dominan dalam industri adalah dalam pemotongan, pengeboran, penggilingan, dan pemolesan. Sebagian besar aplikasi ini tidak memerlukan intan besar; pada kenyataannya, sebagian besar intan dengan kualitas permata kecuali ukurannya yang kecil dapat digunakan untuk industri. Intan disematkan pada ujung bor atau mata gergaji, atau digiling menjadi bubuk untuk digunakan dalam aplikasi penggilingan dan pemolesan.[126] Aplikasi khusus termasuk penggunaan di laboratorium sebagai penahanan untuk eksperimen tekanan tinggi (lihat sel paron intan), bantalan berkinerja tinggi, dan penggunaan terbatas pada jendela khusus.[127][128] Dengan kemajuan berkelanjutan dalam produksi intan sintetis, aplikasi baru menjadi layak. Mengumpulkan banyak kegembiraan adalah kemungkinan penggunaan intan sebagai semikonduktor yang cocok untuk cip mikro, dan karena sifat konduktansi panasnya yang luar biasa, sebagai pembuang panas dalam elektronika.[129]
Tindakan pencegahan[sunting | sunting sumber]

Karbon murni memiliki toksisitas yang sangat rendah terhadap manusia dan dapat ditangani dengan aman dalam bentuk grafit atau arang. Ia tahan terhadap pembubaran atau serangan kimia, bahkan dalam kandungan asam dari saluran pencernaan. Akibatnya, begitu masuk ke dalam jaringan tubuh, kemungkinan besar akan tetap ada di sana untuk waktu yang tak terdefinisi. Karbon hitam mungkin merupakan salah satu pigmen pertama yang digunakan untuk perajahan, dan Ötzi si Manusia Es ditemukan memiliki rajah karbon yang bertahan selama hidupnya dan selama 5200 tahun setelah kematiannya.[130] Menghirup debu batu bara atau jelaga (karbon hitam) dalam jumlah besar dapat berbahaya, mengiritasi jaringan paru-paru dan menyebabkan penyakit paru-paru kongestif, pneumokoniosis pekerja batu bara. Debu intan yang digunakan sebagai ampelas bisa berbahaya jika tertelan atau terhirup. Partikel mikro karbon diproduksi dalam asap knalpot mesin diesel, dan dapat terakumulasi di dalam paru-paru.[131] Dari beberapa contoh ini, kerusakan mungkin diakibatkan oleh kontaminan (misalnya, bahan kimia organik, logam berat) dan bukannya dari karbon itu sendiri.
Karbon umumnya memiliki toksisitas rendah terhadap kehidupan di Bumi; tapi partikel nano karbon mematikan bagi Drosophila.[132]
Karbon dapat terbakar dengan kuat dan terang di hadapan udara pada suhu tinggi. Akumulasi besar batu bara, yang tetap lengai selama ratusan juta tahun tanpa adanya oksigen, dapat terbakar secara spontan ketika terkena udara di ujung limbah tambang batubara, ruang kargo kapal dan bunker batu bara,[133][134] serta tempat pembuangan penyimpanan.
Dalam aplikasi nuklir di mana grafit digunakan sebagai moderator neutron, akumulasi energi Wigner diikuti dengan pelepasan spontan yang tiba-tiba dapat terjadi. Penganilan hingga paling tidak suhu 250 °C dapat melepaskan energi dengan aman, meskipun dalam bencana Windscale prosedurnya salah, menyebabkan bahan reaktor lain terbakar.
Berbagai macam senyawa karbon termasuk racun mematikan, seperti tetrodotoksin, lektin risin dari biji tanaman minyak jarak Ricinus communis, sianida (CN−), dan karbon monoksida; dan hal-hal penting bagi kehidupan, seperti glukosa dan protein.
Lihat pula[sunting | sunting sumber]
- Sauvinisme karbon
- Detonasi karbon
- Jejak karbon
- Bintang karbon
- Planet karbon
- Karbon gas
- Ekonomi rendah karbon
Referensi[sunting | sunting sumber]
- ^ (Indonesia) "Karbon". KBBI Daring. Diakses tanggal 17 Juli 2022.
- ^ Lide, D. R., ed. (2005). CRC Handbook of Chemistry and Physics (edisi ke-86). Boca Raton (FL): CRC Press. ISBN 0-8493-0486-5.
- ^ a b Haaland, D (1976). "Graphite-liquid-vapor triple point pressure and the density of liquid carbon". Carbon. 14 (6): 357. doi:10.1016/0008-6223(76)90010-5.
- ^ a b Savvatimskiy, A (2005). "Measurements of the melting point of graphite and the properties of liquid carbon (a review for 1963–2003)". Carbon. 43 (6): 1115. doi:10.1016/j.carbon.2004.12.027.
- ^ "Fourier Transform Spectroscopy of the Electronic Transition of the Jet-Cooled CCI Free Radical" (PDF). Diakses tanggal 16 Juli 2022.
- ^ "Fourier Transform Spectroscopy of the System of CP" (PDF). Diakses tanggal 16 Juli 2022.
- ^ "Carbon: Binary compounds". Diakses tanggal 16 Juli 2022.
- ^ a b c d e Properties of diamond, Ioffe Institute Database
- ^ Magnetic susceptibility of the elements and inorganic compounds, in Handbook of Chemistry and Physics 81st edition, CRC press.
- ^ "History of Carbon and Carbon Materials - Center for Applied Energy Research - University of Kentucky". Caer.uky.edu. Diakses tanggal 12 September 2008.
- ^ Senese, Fred (9 September 2000). "Who discovered carbon?". Frostburg State University. Diakses tanggal 24 November 2007.
- ^ "carbon | Facts, Uses, & Properties". Encyclopædia Britannica (dalam bahasa Inggris). Diarsipkan dari versi asli tanggal 24 Oktober 2017.
- ^ "carbon". Encyclopædia Britannica.
- ^ a b c "Carbon – Naturally occurring isotopes". WebElements Periodic Table. Diarsipkan dari versi asli tanggal 8 September 2008. Diakses tanggal 18 Agustus 2022.
- ^ "History of Carbon". Diarsipkan dari versi asli tanggal 1 November 2012. Diakses tanggal 18 Agustus 2022.
- ^ Reece, Jane B. (31 Oktober 2013). Campbell Biology (edisi ke-10). Pearson Education. ISBN 9780321775658.
- ^ a b Chemistry Operations (15 Desember 2003). "Carbon". Los Alamos National Laboratory. Diarsipkan dari versi asli tanggal 13 September 2008. Diakses tanggal 18 Agustus 2022.
- ^ Deming, Anna (2010). "King of the elements?". Nanotechnology. 21 (30): 300201. Bibcode:2010Nanot..21D0201D. doi:10.1088/0957-4484/21/30/300201
 . PMID 20664156.
. PMID 20664156.
- ^ J.H. Eggert; et al. (8 November 2009). "Melting temperature of diamond at ultrahigh pressure". Nature Physics. 6: 40–43. doi:10.1038/nphys1438.
- ^ Greenville Whittaker, A. (1978). "The controversial carbon solid−liquid−vapour triple point". Nature. 276 (5689): 695–696. Bibcode:1978Natur.276..695W. doi:10.1038/276695a0.
- ^ Zazula, J. M. (1997). "On Graphite Transformations at High Temperature and Pressure Induced by Absorption of the LHC Beam" (PDF). CERN. Diarsipkan dari versi asli (PDF) tanggal 25 Maret 2009. Diakses tanggal 18 Agustus 2022.
- ^ a b Greenwood and Earnshaw, hlm. 289–292.
- ^ Greenwood and Earnshaw, hlm. 276–8.
- ^ Irifune, Tetsuo; Kurio, Ayako; Sakamoto, Shizue; Inoue, Toru; Sumiya, Hitoshi (2003). "Materials: Ultrahard polycrystalline diamond from graphite". Nature. 421 (6923): 599–600. Bibcode:2003Natur.421..599I. doi:10.1038/421599b. PMID 12571587.
- ^ Dienwiebel, Martin; Verhoeven, Gertjan; Pradeep, Namboodiri; Frenken, Joost; Heimberg, Jennifer; Zandbergen, Henny (2004). "Superlubricity of Graphite" (PDF). Physical Review Letters. 92 (12): 126101. Bibcode:2004PhRvL..92l6101D. doi:10.1103/PhysRevLett.92.126101. PMID 15089689. Diarsipkan dari versi asli (PDF) tanggal 17 September 2011.
- ^ Deprez, N.; McLachan, D. S. (1988). "The analysis of the electrical conductivity of graphite conductivity of graphite powders during compaction". Journal of Physics D: Applied Physics. 21 (1): 101–107. Bibcode:1988JPhD...21..101D. doi:10.1088/0022-3727/21/1/015.
- ^ Collins, A. T. (1993). "The Optical and Electronic Properties of Semiconducting Diamond". Philosophical Transactions of the Royal Society A. 342 (1664): 233–244. Bibcode:1993RSPTA.342..233C. doi:10.1098/rsta.1993.0017.
- ^ Delhaes, P. (2001). Graphite and Precursors. CRC Press. ISBN 978-90-5699-228-6.
- ^ a b c Unwin, Peter. "Fullerenes(An Overview)". Diarsipkan dari versi asli tanggal 1 Desember 2007. Diakses tanggal 21 Agustus 2022.
- ^ a b Ebbesen, T. W., ed. (1997). Carbon nanotubes—preparation and properties. Boca Raton, Florida: CRC Press. ISBN 978-0-8493-9602-1.
- ^ a b Dresselhaus, M. S.; Dresselhaus, G.; Avouris, Ph., ed. (2001). Carbon nanotubes: synthesis, structures, properties and applications. Topics in Applied Physics. 80. Berlin. ISBN 978-3-540-41086-7.
- ^ a b Nasibulin, Albert G.; Pikhitsa, P. V.; Jiang, H.; Brown, D. P.; Krasheninnikov, A. V.; Anisimov, A. S.; Queipo, P.; Moisala, A.; et al. (2007). "A novel hybrid carbon material". Nature Nanotechnology. 2 (3): 156–161. Bibcode:2007NatNa...2..156N. doi:10.1038/nnano.2007.37
 . PMID 18654245.
. PMID 18654245.
- ^ Nasibulin, A.; Anisimov, Anton S.; Pikhitsa, Peter V.; Jiang, Hua; Brown, David P.; Choi, Mansoo; Kauppinen, Esko I. (2007). "Investigations of NanoBud formation". Chemical Physics Letters. 446 (1): 109–114. Bibcode:2007CPL...446..109N. doi:10.1016/j.cplett.2007.08.050.
- ^ Vieira, R; Ledoux, Marc-Jacques; Pham-Huu, Cuong (2004). "Synthesis and characterisation of carbon nanofibers with macroscopic shaping formed by catalytic decomposition of C2H6/H2 over nickel catalyst". Applied Catalysis A: General. 274 (1–2): 1–8. doi:10.1016/j.apcata.2004.04.008.
- ^ a b Frondel, Clifford; Marvin, Ursula B. (1967). "Lonsdaleite, a new hexagonal polymorph of diamond". Nature. 214 (5088): 587–589. Bibcode:1967Natur.214..587F. doi:10.1038/214587a0.
- ^ a b c Harris, PJF (2004). "Fullerene-related structure of commercial glassy carbons" (PDF). Philosophical Magazine. 84 (29): 3159–3167. Bibcode:2004PMag...84.3159H. CiteSeerX 10.1.1.359.5715
 . doi:10.1080/14786430410001720363. Diarsipkan dari versi asli (PDF) tanggal 19 Maret 2012. Diakses tanggal 21 Agustus 2022.
. doi:10.1080/14786430410001720363. Diarsipkan dari versi asli (PDF) tanggal 19 Maret 2012. Diakses tanggal 21 Agustus 2022.
- ^ Rode, A. V.; Hyde, S. T.; Gamaly, E. G.; Elliman, R. G.; McKenzie, D. R.; Bulcock, S. (1999). "Structural analysis of a carbon foam formed by high pulse-rate laser ablation". Applied Physics A: Materials Science & Processing. 69 (7): S755–S758. Bibcode:1999ApPhA..69S.755R. doi:10.1007/s003390051522.
- ^ a b c Heimann, Robert Bertram; Evsyukov, Sergey E.; Kavan, Ladislav (28 Februari 1999). Carbyne and carbynoid structures. Springer. hlm. 1–. ISBN 978-0-7923-5323-2. Diarsipkan dari versi asli tanggal 23 November 2012. Diakses tanggal 19 Agustus 2022.
- ^ Lee, C.; Wei, X.; Kysar, J. W.; Hone, J. (2008). "Measurement of the Elastic Properties and Intrinsic Strength of Monolayer Graphene". Science. 321 (5887): 385–8. Bibcode:2008Sci...321..385L. doi:10.1126/science.1157996. PMID 18635798.
- Phil Schewe (28 Juli 2008). "World's Strongest Material". Inside Science News Service (Siaran pers). Diarsipkan dari versi asli tanggal 31 Mei 2009. "Salinan arsip". Diarsipkan dari versi asli tanggal 2009-05-31. Diakses tanggal 2011-01-19.
- ^ Sanderson, Bill (25 Agustus 2008). "Toughest Stuff Known to Man : Discovery Opens Door to Space Elevator". nypost.com. Diarsipkan dari versi asli tanggal 6 September 2008. Diakses tanggal 19 Agustus 2022.
- ^ Jin, Zhong; Lu, Wei; O'Neill, Kevin J.; Parilla, Philip A.; Simpson, Lin J.; Kittrell, Carter; Tour, James M. (2011-02-22). "Nano-Engineered Spacing in Graphene Sheets for Hydrogen Storage". Chemistry of Materials. 23 (4): 923–925. doi:10.1021/cm1025188. ISSN 0897-4756.
- ^ Jenkins, Edgar (1973). The polymorphism of elements and compounds. Taylor & Francis. hlm. 30. ISBN 978-0-423-87500-3. Diarsipkan dari versi asli tanggal 23 November 2012. Diakses tanggal 19 Agustus 2022.
- ^ Rossini, F. D.; Jessup, R. S. (1938). "Heat and Free Energy of Formation of Carbon Dioxide and of the Transition Between Graphite and Diamond". Journal of Research of the National Bureau of Standards. 21 (4): 491. doi:10.6028/jres.021.028
 .
.
- ^ "World of Carbon – Interactive Nano-visulisation in Science & Engineering Education (IN-VSEE)". Diarsipkan dari versi asli tanggal 31 Mei 2001. Diakses tanggal 19 Agustus 2022.
- ^ Grochala, Wojciech (1 Aprilia 2014). "Diamond: Electronic Ground State of Carbon at Temperatures Approaching 0 K". Angewandte Chemie International Edition (dalam bahasa Inggris). 53 (14): 3680–3683. doi:10.1002/anie.201400131. ISSN 1521-3773. PMID 24615828.
- ^ White, Mary Anne; Kahwaji, Samer; Freitas, Vera L. S.; Siewert, Riko; Weatherby, Joseph A.; Ribeiro da Silva, Maria D. M. C.; Verevkin, Sergey P.; Johnson, Erin R.; Zwanziger, Josef W. (2021). "The Relative Thermal Stability of Diamond and Graphite". Angewandte Chemie International Edition (dalam bahasa Inggris). 60 (3): 1546–1549. doi:10.1002/anie.202009897. ISSN 1433-7851. PMID 32970365.
- ^ Schewe, Phil; Stein, Ben (26 Maret 2004). "Carbon Nanofoam is the World's First Pure Carbon Magnet". Physics News Update. 678 (1). Diarsipkan dari versi asli tanggal 7 Maret 2012.
- ^ Itzhaki, Lior; Altus, Eli; Basch, Harold; Hoz, Shmaryahu (2005). "Harder than Diamond: Determining the Cross-Sectional Area and Young's Modulus of Molecular Rods". Angew. Chem. Int. Ed. 44 (45): 7432–5. doi:10.1002/anie.200502448. PMID 16240306.
- ^ "Researchers Find New Phase of Carbon, Make Diamond at Room Temperature". news.ncsu.edu. 30 November 2015. Diarsipkan dari versi asli tanggal 6 April 2016. Diakses tanggal 19 Agustus 2022.
- ^ a b c Hoover, Rachel (21 Februari 2014). "Need to Track Organic Nano-Particles Across the Universe? NASA's Got an App for That". NASA. Diarsipkan dari versi asli tanggal 6 September 2015. Diakses tanggal 19 Agustus 2022.
- ^ Lauretta, D.S.; McSween, H.Y. (2006). Meteorites and the Early Solar System II. Space science series. University of Arizona Press. hlm. 199. ISBN 978-0-8165-2562-1. Diarsipkan dari versi asli tanggal 22 November 2017. Diakses tanggal 19 Agustus 2022.
- ^ Mark, Kathleen (1987). Meteorite Craters. University of Arizona Press. ISBN 978-0-8165-0902-7.
- ^ "Online Database Tracks Organic Nano-Particles Across the Universe". Sci Tech Daily. 24 Februari 2014. Diarsipkan dari versi asli tanggal 18 Maret 2015. Diakses tanggal 19 Agustus 2022.
- ^ William F McDonough The composition of the Earth Diarsipkan 28 September 2011 di Wayback Machine. in Majewski, Eugeniusz (2000). Earthquake Thermodynamics and Phase Transformation in the Earth's Interior. ISBN 978-0126851854.
- ^ Yinon Bar-On; et al. (19 Juni 2018). "The biomass distribution on Earth". PNAS. 115 (25): 6506–6511. doi:10.1073/pnas.1711842115
 . PMC 6016768
. PMC 6016768  . PMID 29784790.
. PMID 29784790.
- ^ Fred Pearce (15 Februari 2014). "Fire in the hole: After fracking comes coal". New Scientist. 221 (2956): 36–41. Bibcode:2014NewSc.221...36P. doi:10.1016/S0262-4079(14)60331-6. Diarsipkan dari versi asli tanggal 16 Maret 2015.
- ^ "Wonderfuel: Welcome to the age of unconventional gas" Diarsipkan 9 Desember 2014 di Wayback Machine. oleh Helen Knight, New Scientist, 12 Juni 2010, hlm. 44–7.
- ^ Ocean methane stocks 'overstated' Diarsipkan 25 April 2013 di Wayback Machine., BBC, 17 Februari 2004.
- ^ "Ice on fire: The next fossil fuel" Diarsipkan 22 Februari 2015 di Wayback Machine. oleh Fred Pearce, New Scientist, 27 Juni 2009, hlm. 30–33.
- ^ Calculated from file global.1751_2008.csv in "Index of /ftp/ndp030/CSV-FILES". Diarsipkan dari versi asli tanggal 22 Oktober 2011. Diakses tanggal 6 November 2011. dari Carbon Dioxide Information Analysis Center.
- ^ Rachel Gross (21 September 2013). "Deep, and dank mysterious". New Scientist: 40–43. Diarsipkan dari versi asli tanggal 21 September 2013.
- ^ Stefanenko, R. (1983). Coal Mining Technology: Theory and Practice. Society for Mining Metallurgy. ISBN 978-0-89520-404-2.
- ^ Kasting, James (1998). "The Carbon Cycle, Climate, and the Long-Term Effects of Fossil Fuel Burning". Consequences: The Nature and Implication of Environmental Change. 4 (1). Diarsipkan dari versi asli tanggal 24 Oktober 2008.
- ^ "Carbon-14 formation". Diarsipkan dari versi asli tanggal 1 Agustus 2015. Diakses tanggal 20 Agustus 2022.
- ^ Aitken, M.J. (1990). Science-based Dating in Archaeology. hlm. 56–58. ISBN 978-0-582-49309-4.
- ^ Nichols, Charles R. "Voltatile Products from Carbonaceous Asteroids" (PDF). UAPress.Arizona.edu. Diarsipkan dari versi asli (PDF) tanggal 2 Juli 2016. Diakses tanggal 20 Agustus 2022.
- ^ Gannes, Leonard Z.; Del Rio, Carlos Martı́nez; Koch, Paul (1998). "Natural Abundance Variations in Stable Isotopes and their Potential Uses in Animal Physiological Ecology". Comparative Biochemistry and Physiology – Part A: Molecular & Integrative Physiology. 119 (3): 725–737. doi:10.1016/S1095-6433(98)01016-2. PMID 9683412.
- ^ "Official SI Unit definitions". Diarsipkan dari versi asli tanggal 14 Oktober 2007. Diakses tanggal 20 Agustus 2022.
- ^ Bowman, S. (1990). Interpreting the past: Radiocarbon dating. British Museum Press. ISBN 978-0-7141-2047-8.
- ^ Brown, Tom (1 Maret 2006). "Carbon Goes Full Circle in the Amazon". Lawrence Livermore National Laboratory. Diarsipkan dari versi asli tanggal 22 September 2008. Diakses tanggal 20 Agustus 2022.
- ^ Libby, W. F. (1952). Radiocarbon dating. Chicago University Press and references therein.
- ^ Westgren, A. (1960). "The Nobel Prize in Chemistry 1960". Nobel Foundation. Diarsipkan dari versi asli tanggal 25 Oktober 2007. Diakses tanggal 20 Agustus 2022.
- ^ "Use query for carbon-8". barwinski.net. Diarsipkan dari versi asli tanggal 7 Februari 2005. Diakses tanggal 20 Agustus 2022.
- ^ Watson, A. (1999). "Beaming Into the Dark Corners of the Nuclear Kitchen". Science. 286 (5437): 28–31. doi:10.1126/science.286.5437.28.
- ^ Audi, Georges; Bersillon, Olivier; Blachot, Jean; Wapstra, Aaldert Hendrik (1997). "The NUBASE evaluation of nuclear and decay properties" (PDF). Nuclear Physics A. 624 (1): 1–124. Bibcode:1997NuPhA.624....1A. doi:10.1016/S0375-9474(97)00482-X. Diarsipkan dari versi asli (PDF) tanggal 23 September 2008.
- ^ Ostlie, Dale A.; Carroll, Bradley W. (2007). An Introduction to Modern Stellar Astrophysics. San Francisco (CA): Addison Wesley. ISBN 978-0-8053-0348-3.
- ^ Whittet, Douglas C. B. (2003). Dust in the Galactic Environment. CRC Press. hlm. 45–46. ISBN 978-0-7503-0624-9.
- ^ Pikelʹner, Solomon Borisovich (1977). Star Formation. Springer. hlm. 38. ISBN 978-90-277-0796-3. Diarsipkan dari versi asli tanggal 23 November 2012. Diakses tanggal 20 Agustus 2022.
- ^ Mannion, hlm. 51–54.
- ^ Mannion, hlm. 84–88.
- ^ Falkowski, P.; Scholes, R. J.; Boyle, E.; Canadell, J.; Canfield, D.; Elser, J.; Gruber, N.; Hibbard, K.; et al. (2000). "The Global Carbon Cycle: A Test of Our Knowledge of Earth as a System". Science. 290 (5490): 291–296. Bibcode:2000Sci...290..291F. doi:10.1126/science.290.5490.291. PMID 11030643.
- ^ Smith, T. M.; Cramer, W. P.; Dixon, R. K.; Leemans, R.; Neilson, R. P.; Solomon, A. M. (1993). "The global terrestrial carbon cycle". Water, Air, & Soil Pollution. 70 (1–4): 19–37. Bibcode:1993WASP...70...19S. doi:10.1007/BF01104986.
- ^ Burrows, A.; Holman, J.; Parsons, A.; Pilling, G.; Price, G. (2017). Chemistry3: Introducing Inorganic, Organic and Physical Chemistry. Oxford University Press. hlm. 70. ISBN 978-0-19-873380-5. Diarsipkan dari versi asli tanggal 22 November 2017. Diakses tanggal 20 Agustus 2022.
- ^ Mannion hlm. 27–51
- ^ Mannion hlm. 84–91
- ^ Levine, Joel S.; Augustsson, Tommy R.; Natarajan, Murali (1982). "The prebiological paleoatmosphere: stability and composition". Origins of Life and Evolution of Biospheres. 12 (3): 245–259. Bibcode:1982OrLi...12..245L. doi:10.1007/BF00926894. PMID 7162799.
- ^ Loerting, T.; et al. (2001). "On the Surprising Kinetic Stability of Carbonic Acid". Angew. Chem. Int. Ed. 39 (5): 891–895. doi:10.1002/(SICI)1521-3773(20000303)39:5<891::AID-ANIE891>3.0.CO;2-E. PMID 10760883.
- ^ Haldane J. (1895). "The action of carbonic oxide on man". Journal of Physiology. 18 (5–6): 430–462. doi:10.1113/jphysiol.1895.sp000578. PMC 1514663
 . PMID 16992272.
. PMID 16992272.
- ^ Gorman, D.; Drewry, A.; Huang, Y. L.; Sames, C. (2003). "The clinical toxicology of carbon monoxide". Toxicology. 187 (1): 25–38. doi:10.1016/S0300-483X(03)00005-2. PMID 12679050.
- ^ "Compounds of carbon: carbon suboxide". Diarsipkan dari versi asli tanggal 7 Desember 2007. Diakses tanggal 21 Agustus 2022.
- ^ Bayes, K. (1961). "Photolysis of Carbon Suboxide". Journal of the American Chemical Society. 83 (17): 3712–3713. doi:10.1021/ja01478a033.
- ^ Anderson D. J.; Rosenfeld, R. N. (1991). "Photodissociation of Carbon Suboxide". Journal of Chemical Physics. 94 (12): 7852–7867. Bibcode:1991JChPh..94.7857A. doi:10.1063/1.460121.
- ^ Sabin, J. R.; Kim, H. (1971). "A theoretical study of the structure and properties of carbon trioxide". Chemical Physics Letters. 11 (5): 593–597. Bibcode:1971CPL....11..593S. doi:10.1016/0009-2614(71)87010-0.
- ^ Moll N. G.; Clutter D. R.; Thompson W. E. (1966). "Carbon Trioxide: Its Production, Infrared Spectrum, and Structure Studied in a Matrix of Solid CO2". Journal of Chemical Physics. 45 (12): 4469–4481. Bibcode:1966JChPh..45.4469M. doi:10.1063/1.1727526.
- ^ a b Fatiadi, Alexander J.; Isbell, Horace S.; Sager, William F. (1963). "Cyclic Polyhydroxy Ketones. I. Oxidation Products of Hexahydroxybenzene (Benzenehexol)" (PDF). Journal of Research of the National Bureau of Standards Section A. 67A (2): 153–162. doi:10.6028/jres.067A.015. PMC 6640573
 . PMID 31580622. Diarsipkan dari versi asli (PDF) tanggal 25 Maret 2009. Diakses tanggal 21 Agustus 2022.
. PMID 31580622. Diarsipkan dari versi asli (PDF) tanggal 25 Maret 2009. Diakses tanggal 21 Agustus 2022.
- ^ Pauling, L. (1960). The Nature of the Chemical Bond
 (edisi ke-3). Ithaca, NY: Cornell University Press. hlm. 93. ISBN 978-0-8014-0333-0.
(edisi ke-3). Ithaca, NY: Cornell University Press. hlm. 93. ISBN 978-0-8014-0333-0.
- ^ Greenwood and Earnshaw, hlm. 297–301
- ^ Scherbaum, Franz; et al. (1988). ""Aurophilicity" as a consequence of Relativistic Effects: The Hexakis(triphenylphosphaneaurio)methane Dication [(Ph3PAu)6C]2+". Angew. Chem. Int. Ed. Engl. 27 (11): 1544–1546. doi:10.1002/anie.198815441.
- ^ Ritter, Stephen K. "Six bonds to carbon: Confirmed". Chemical & Engineering News. Diarsipkan dari versi asli tanggal 9 Januari 2017.
- ^ Yamashita, Makoto; Yamamoto, Yohsuke; Akiba, Kin-ya; Hashizume, Daisuke; Iwasaki, Fujiko; Takagi, Nozomi; Nagase, Shigeru (2005-03-01). "Syntheses and Structures of Hypervalent Pentacoordinate Carbon and Boron Compounds Bearing an Anthracene Skeleton − Elucidation of Hypervalent Interaction Based on X-ray Analysis and DFT Calculation". Journal of the American Chemical Society. 127 (12): 4354–4371. doi:10.1021/ja0438011. ISSN 0002-7863. PMID 15783218.
- ^ Shorter Oxford English Dictionary, Oxford University Press
- ^ "Chinese made first use of diamond". BBC News. 17 Mei 2005. Diarsipkan dari versi asli tanggal 20 Maret 2007. Diakses tanggal 21 Agustus 2022.
- ^ van der Krogt, Peter. "Carbonium/Carbon at Elementymology & Elements Multidict". Diarsipkan dari versi asli tanggal 23 Januari 2010. Diakses tanggal 21 Agustus 2022.
- ^ Ferchault de Réaumur, R.-A. (1722). L'art de convertir le fer forgé en acier, et l'art d'adoucir le fer fondu, ou de faire des ouvrages de fer fondu aussi finis que le fer forgé (terjemahan bahasa Inggris dari tahun 1956). Paris, Chicago.
- ^ "Carbon". Canada Connects. Diarsipkan dari versi asli tanggal 27 Oktober 2010. Diakses tanggal 21 Agustus 2022.
- ^ a b Senese, Fred (9 September 2000). "Who discovered carbon?". Frostburg State University. Diarsipkan dari versi asli tanggal 7 Desember 2007. Diakses tanggal 21 Agustus 2022.
- ^ Giolitti, Federico (1914). The Cementation of Iron and Steel. McGraw-Hill Book Company, inc.
- ^ Kroto, H. W.; Heath, J. R.; O'Brien, S. C.; Curl, R. F.; Smalley, R. E. (1985). "C60: Buckminsterfullerene". Nature. 318 (6042): 162–163. Bibcode:1985Natur.318..162K. doi:10.1038/318162a0.
- ^ "The Nobel Prize in Chemistry 1996 "for their discovery of fullerenes"". Diarsipkan dari versi asli tanggal 11 Oktober 2007. Diakses tanggal 21 Agustus 2022.
- ^ a b c USGS Minerals Yearbook: Graphite, 2009 Diarsipkan 16 September 2008 di Wayback Machine. dan Graphite: Mineral Commodity Summaries 2011
- ^ Harlow, G. E. (1998). The nature of diamonds. Cambridge University Press. hlm. 223. ISBN 978-0-521-62935-5.
- ^ Catelle, W. R. (1911). The Diamond. John Lane Company. hlm. 159. diskusi mengenai intan aluvial di India dan di tempat lain serta penemuan paling awal
- ^ Ball, V. (1881). Diamonds, Gold and Coal of India. London, Truebner & Co. Ball adalah seorang Geologist di layanan Inggris. Bab I, Halaman 1
- ^ Hershey, J. W. (1940). The Book Of Diamonds: Their Curious Lore, Properties, Tests And Synthetic Manufacture. Kessinger Pub Co. hlm. 28. ISBN 978-1-4179-7715-4.
- ^ Janse, A. J. A. (2007). "Global Rough Diamond Production Since 1870". Gems and Gemology. XLIII (Summer 2007): 98–119. doi:10.5741/GEMS.43.2.98.
- ^ Marshall, Stephen; Shore, Josh (22 Oktober 2004). "The Diamond Life". Guerrilla News Network. Diarsipkan dari versi asli tanggal 9 Juni 2008. Diakses tanggal 21 Agustus 2022.
- ^ Zimnisky, Paul (21 Mei 2018). "Global Diamond Supply Expected to Decrease 3.4% to 147M Carats in 2018". Kitco.com. Diakses tanggal 21 Agustus 2022.
- ^ Lorenz, V. (2007). "Argyle in Western Australia: The world's richest diamantiferous pipe; its past and future". Gemmologie, Zeitschrift der Deutschen Gemmologischen Gesellschaft. 56 (1/2): 35–40.
- ^ Mannion hlm. 25–26
- ^ "Microscopic diamond found in Montana". The Montana Standard. 17 Oktober 2004. Diarsipkan dari versi asli tanggal 21 Januari 2005. Diakses tanggal 21 Agustus 2022.
- ^ Cooke, Sarah (19 Oktober 2004). "Microscopic Diamond Found in Montana". Livescience.com. Diarsipkan dari versi asli tanggal 5 Juli 2008. Diakses tanggal 21 Agustus 2022.
- ^ "Delta News / Press Releases / Publications". Deltamine.com. Diarsipkan dari versi asli tanggal 26 Mei 2008. Diakses tanggal 21 Agustus 2022.
- ^ Cantwell, W. J.; Morton, J. (1991). "The impact resistance of composite materials – a review". Composites. 22 (5): 347–62. doi:10.1016/0010-4361(91)90549-V.
- ^ Holtzapffel, Ch. (1856). Turning And Mechanical Manipulation. Charles Holtzapffel. Internet Archive Diarsipkan 26 Maret 2016 di Wayback Machine.
- ^ "Industrial Diamonds Statistics and Information". Survei Geologi Amerika Serikat. Diarsipkan dari versi asli tanggal 6 Mei 2009. Diakses tanggal 21 Agustus 2022.
- ^ Coelho, R. T.; Yamada, S.; Aspinwall, D. K.; Wise, M. L. H. (1995). "The application of polycrystalline diamond (PCD) tool materials when drilling and reaming aluminum-based alloys including MMC". International Journal of Machine Tools and Manufacture. 35 (5): 761–774. doi:10.1016/0890-6955(95)93044-7.
- ^ Harris, D. C. (1999). Materials for infrared windows and domes: properties and performance. SPIE Press. hlm. 303–334. ISBN 978-0-8194-3482-1.
- ^ Nusinovich, G. S. (2004). Introduction to the physics of gyrotrons. JHU Press. hlm. 229. ISBN 978-0-8018-7921-0.
- ^ Sakamoto, M.; Endriz, J. G.; Scifres, D. R. (1992). "120 W CW output power from monolithic AlGaAs (800 nm) laser diode array mounted on diamond heatsink". Electronics Letters. 28 (2): 197–199. Bibcode:1992ElL....28..197S. doi:10.1049/el:19920123.
- ^ Dorfer, Leopold; Moser, M.; Spindler, K.; Bahr, F.; Egarter-Vigl, E.; Dohr, G. (1998). "5200-year old acupuncture in Central Europe?". Science. 282 (5387): 242–243. Bibcode:1998Sci...282..239D. doi:10.1126/science.282.5387.239f. PMID 9841386.
- ^ Donaldson, K.; Stone, V.; Clouter, A.; Renwick, L.; MacNee, W. (2001). "Ultrafine particles". Occupational and Environmental Medicine. 58 (3): 211–216. doi:10.1136/oem.58.3.211. PMC 1740105
 . PMID 11171936.
. PMID 11171936.
- ^ Carbon Nanoparticles Toxic To Adult Fruit Flies But Benign To Young Diarsipkan 2 November 2011 di Wayback Machine. ScienceDaily (17 Agustus 2009)
- ^ "Press Release – Titanic Disaster: New Theory Fingers Coal Fire". www.geosociety.org. Diarsipkan dari versi asli tanggal 14 April 2016. Diakses tanggal 21 Agustus 2022.
- ^ McSherry, Patrick. "Coal bunker Fire". www.spanamwar.com. Diarsipkan dari versi asli tanggal 23 Maret 2016. Diakses tanggal 21 Agustus 2022.
Bibliografi[sunting | sunting sumber]
- Greenwood, Norman N.; Earnshaw, A. (1997), Chemistry of the Elements (edisi ke-2), Oxford: Butterworth-Heinemann, ISBN 0-7506-3365-4
- Mannion, A. M. (12 Januari 2006). Carbon and Its Domestication. Springer. hlm. 1–319. ISBN 978-1-4020-3956-0.
Pranala luar[sunting | sunting sumber]
- (Inggris) Carbon di In Our Time di BBC
- (Inggris) Carbon di The Periodic Table of Videos (Universitas Nottingham)
- (Inggris) Karbon di Britannica
- (Inggris) Halaman Karbon yang luas di asu.edu
- (Inggris) Penggunaan karbon secara elektrokimia
- (Inggris) Carbon—Super Stuff. Animasi dengan suara dan model 3D interaktif.
| (besar) | |||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | ||||||||||||||||
| 1 | H | He | |||||||||||||||||||||||||||||||
| 2 | Li | Be | B | C | N | O | F | Ne | |||||||||||||||||||||||||
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar | |||||||||||||||||||||||||
| 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | |||||||||||||||
| 5 | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | |||||||||||||||
| 6 | Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | |
| 7 | Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | |
|
| |||||||||||||||||||||||||||||||||



