Unsur kimia
 | |
  | |
  | |
  | |
| Atas: tabel periodik unsur-unsur kimia. Bawah: Contoh unsur kimia tertentu. Dari kiri ke kanan: hidrogen, barium, tembaga, uranium, bromin, dan helium. |
Unsur kimia bisa berarti dua hal. Kesatu, unsur sama artinya dengan atom (misal mengatakan 'unsur oksigen' sama dengan mengatakan 'atom oksigen'). Kedua, unsur berarti zat yaitu kumpulan sangat banyak atom hingga sampai pada tingkat yang bisa kita rasakan, bisa dilihat, dicium, dan berdampak pada tubuh (makhluk hidup, benda padat, cair, dan gas). Unsur jika lebih dirinci termasuk sebagai zat murni bersama dengan senyawa. 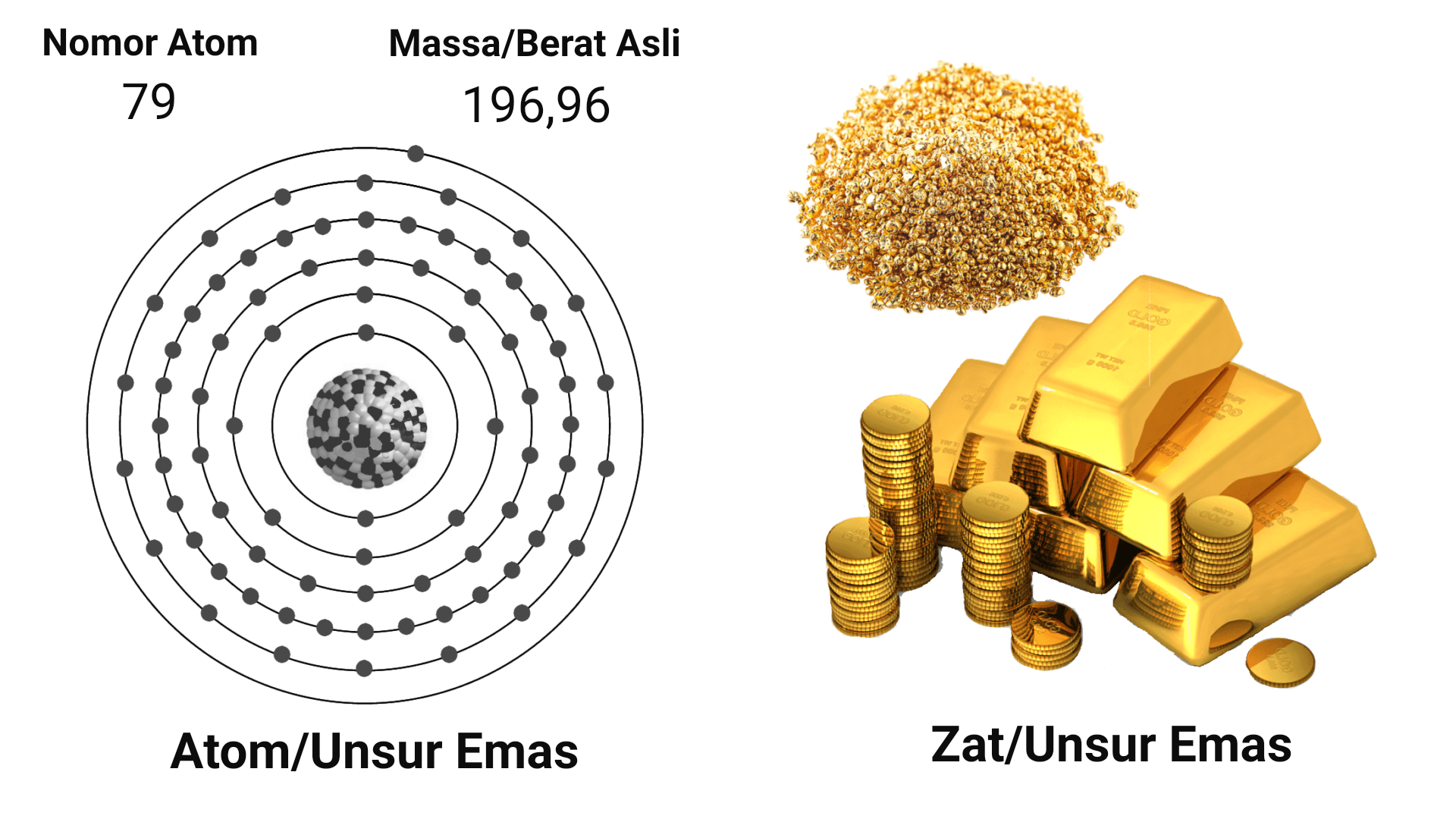
perbedaan unsur dalam artian atom dan unsur dalam artian zat
Unsur (dalam hal ini atom) mempunyai jumlah proton yang sama dalam inti atomnya (yaitu nomor atom, atau Z yang sama).[1] Sebanyak 118 unsur telah diketahui, yang mana 94 di antaranya ada secara alami di bumi. Sedangkan 24 sisanya, merupakan unsur buatan. Terdapat 80 unsur yang memiliki sekurang-kurangnya satu isotop stabil dan 38 unsur yang merupakan radionuklida yang seiring berjalannya waktu meluruh menjadi unsur lain. Besi adalah unsur penyusun bumi paling melimpah (berdasarkan massa), sementara di kerak bumi oksigen adalah yang paling melimpah.[2]
Unsur kimia menyusun materi biasa di jagat raya. Namun, observasi astronomi menyarankan bahwa materi biasa yang teramati hanya menyusun 4% dari materi di alam semesta: sisanya adalah materi gelap (73%); komposisinya tidak diketahui, tetapi tidak tersusun dari unsur kimia.[3] Energi misterius ini kemungkinan mempercepat inflasi Alam semesta.
Dua unsur yang paling ringan, hidrogen dan helium, sebagian besar terbentuk dalam Ledakan Dahsyat dan merupakan unsur paling umum di jagat raya. Tiga unsur berikutnya (litium, berilium, dan boron) sebagian besar terbentuk melalui spalasi sinar kosmis, dan oleh sebab itu lebih jarang daripada unsur-unsur yang lebih berat. Pembentukan unsur dengan proton antara 6 sampai 26 terjadi dan terus berlanjut dalam bintang-bintang deret utama melalui nukleosintesis bintang. Kelimpahan oksigen, silikon, dan besi yang tinggi di Bumi mencerminkan produksinya yang banyak di bintang-bintang tersebut. Unsur-unsur dengan proton lebih dari 26 terbentuk melalui nukleosintesis supernova dalam supernova, yang, ketika mereka meledak, memercikkan unsur-unsur ini sebagai sisa-sisa supernova jauh ke angkasa, yang menyatu dengan planet ketika mereka terbentuk.[4]
Istilah "unsur" (atau "elemen") digunakan untuk atom-atom dengan jumlah proton tertentu (tanpa menghiraukan apakah mereka terionisasi atau berikatan kimia, misalnya hidrogen dalam air) maupun sebagai zat kimia murni yang mengandung unsur tunggal (misalnya gas hidrogen).[1] Untuk makna yang kedua, telah diusulkan juga istilah "zat elementer" dan "zat sederhana", tetapi tidak mendapat penerimaan yang luas dalam literatur kimia Inggris, sementara dalam beberapa bahasa lainnya kesetaraannya banyak digunakan (misalnya Prancis: corps simple, bahasa Rusia: простое вещество). Sebuah unsur tunggal dapat membentuk banyak zat yang berbeda strukturnya; mereka disebut alotrop unsur.Ketika unsur yang berbeda bergabung secara kimia, dengan atom-atom yang terikat melalui ikatan kimia, mereka membentuk senyawa kimia. Hanya sedikit unsur yang ditemukan tak berikatan sebagai mineral murni. Unsur alami semacam ini di antaranya adalah tembaga, perak, emas, karbon (sebagai batu bara, grafit, atau intan), dan belerang. Semua unsur, kecuali yang sangat inert seperti gas mulia dan logam mulia, biasanya ditemukan di bumi dalam bentuk gabungan kimianya, sebagai senyawa kimia. Sementara sekitar 32 unsur kimia yang ada di bumi dalam bentuk alami tak tergabung, sebagian besar berada sebagai campuran. Misalnya, udara atmosfer campuran utamanya adalah nitrogen, oksigen, dan argon, sementara unsur padat alami terjadi dalam logam paduan, seperti pada besi dan nikel.
Sejarah penemuan dan penggunaan unsur dimulai sejak masyarakat manusia primitif yang menemukan unsur-unsur alami seperti karbon, belerang, tembaga dan emas. Peradaban selanjutnya mengekstraksi unsur tembaga, timah, timbal dan besi dari bijihnya melalui peleburan, menggunakan batu bara. Alkimiawan dan kimiawan secara berurutan mengidentifikasi lebih banyak lagi; seluruh unsur yang terbentuk secara alami telah diketahui pada tahun 1950.Sifat unsur kimia dirangkum dalam tabel periodik, yang menyusun unsur-unsur menurut kenaikan nomor atom dalam baris ("periode") yang merupakan pengulangan ("secara periodik") sifat-sifat kimia dan fisika kolom-kolomnya ("golongan"). Selain unsur radioaktif tak stabil dengan waktu paruh singkat, seluruh unsur tersedia secara industri, sebagian besar berketakmurnian[Cat 1] rendah.
Deskripsi[sunting | sunting sumber]
Unsur adalah zat bagian terkecil suatu zat.Unsur kimia paling ringan adalah hidrogen dan helium, keduanya tercipta melalui nukleosintesis Big Bang selama 20 menit pertama alam semesta,[5] dengan rasio sekitar 3:1 berdasarkan massa (atau 12:1 berdasarkan nomor atom),[6][7] bersama dengan dua unsur renik berikutnya, litium dan berilium. Hampir semua unsur lain yang dijumpai di alam terbentuk melalui beragam metode nukleosintesis alami.[8] Sejumlah kecil atom secara alami diproduksi di bumi melalui reaksi nukleogenik, atau dalam proses kosmogenik, seperti spalasi sinar kosmis. Atom-atom baru juga diproduksi secara alami di bumi sebagai isotop luruhan radiogenik dari proses peluruhan radioaktif seperti peluruhan alfa, peluruhan beta, fisi spontan, peluruhan gugus, dan moda peluruhan yang lebih jarang lainnya.
Dari 94 unsur yang terbentuk secara alami, unsur dengan nomor atom 1 hingga 82 memiliki sekurang-kurangnya satu isotop stabil (kecuali teknesium, unsur 43, dan prometium, unsur 61, yang tidak memiliki isotop stabil). Isotop yang dianggap stabil adalah mereka yang tidak (atau belum) teramati mengalami peluruhan radioaktif. Unsur dengan nomor atom 83 hingga 94 adalah tidak stabil dari sudut pandang peluruhan radioaktif seluruh isotop yang dapat dideteksi. Beberapa unsur ini, terutama bismut (nomor atom 83), torium (nomor atom 90), dan uranium (nomor atom 92), memiliki satu atau lebih isotop dengan waktu paruh yang cukup panjang untuk bertahan sebagai sisa-sisa ledakan nukleosintesis stelar yang menghasilkan logam berat sebelum pembentukan Tata Surya. Selama lebih dari 1,9×1019 tahun, lebih dari satu miliar kali lebih lama daripada perkiraan umur alam semesta saat ini, bismut-209 (nomor atom 83) memiliki waktu paruh peluruhan alfa terpanjang di antara unsur yang terjadi secara alami, dan hampir selalu dianggap setara dengan 80 unsur stabil.[9][10] Unsur yang paling berat (yaitu yang di atas plutonium, unsur 94), mengalami peluruhan radioaktif dengan waktu paruh yang sangat singkat dan tidak ditemukan di alam sehingga harus disintesis.
Per tahun 2010, terdapat 118 unsur yang diketahui (dalam konteks ini, "diketahui" berarti telah diteliti dengan cukup baik, meskipun hanya dari sedikit produk peluruhannya, untuk memastikan berbeda dari unsur lain).[11][12] Dari 118 unsur ini, 94 terbentuk secara alami di bumi. Enam di antaranya terbentuk dalam jumlah yang sangat renik: teknesium, nomor atom 43; prometium, nomor 61; astatin, nomor 85; fransium, nomor 87; neptunium, nomor 93; dan plutonium, nomor 94. Sembilan puluh empat unsur ini telah terdeteksi melimpah di alam semesta, dalam spektrum bintang dan juga supernova, di mana terjadi pembentukan unsur radioaktif berumur pendek. Sembilan puluh empat unsur pertama telah dideteksi langsung di bumi sebagai nuklida primordial yang hadir sejak pembentukan tata surya, atau sebagai fisi alami atau transmutasi produk uranium dan torium.
Sisanya, 24 unsur yang lebih berat, yang tidak ditemukan saat ini baik di bumi maupun pada spektra astronomis, telah diproduksi secara artifisial: seluruhnya bersifat radioaktif, dengan waktu paruh yang sangat singkat. Jika ada atom-atom unsur ini yang terdapat pada pembentukan bumi, dapat dipastikan telah meluruh sempurna, dan jika terdapat pada nova (bintang baru), pastinya berada dalam jumlah yang sangat kecil untuk diketahui. Teknesium adalah non-alami yang disintesis pertama kali, pada tahun 1937, meskipun sekelumit teknesium telah dijumpai di alam (dan juga unsurnya telah ditemui secara alami pada tahun 1925).[13] Pola produksi artifisial dan pengungkapan alami di kemudian hari telah berulang dengan unsur radioaktif alami yang langka lainnya.[14]
Dafar unsur tersedia berdasarkan nama, nomor atom, massa jenis, titik lebur, titik didih, dan berdasarkan simbol, serta berdasarkan energi ionisasi unsur kimia. Nuklida unsur stabil dan radioaktif juga tersedia sebagai daftar nuklida, yang diurutkan berdasarkan waktu paruh untuk yang tidak stabil. Satu yang paling nyaman, dan tentunya penyajian unsur paling tradisional adalah dalam bentuk tabel periodik, yang mengelompokkan unsur-unsur dengan kemiripan sifat kimia (dan biasanya juga memiliki struktur elektron yang mirip).
Nomor atom[sunting | sunting sumber]
Nomor atom suatu unsur sama dengan jumlah proton dalam masing-masing atom, dan mendefinisikan unsur kimia.[15] Sebagai contoh, seluruh atom karbon mengandung 6 proton dalam inti atomnya; sehingga nomor atom karbon adalah 6.[16] Atom karbon dapat memiliki jumlah neutron yang berbeda; atom dari unsur yang sama tetapi memiliki jumlah netron yang berbeda dikenal sebagai isotop.[17]
Jumlah proton dalam inti atom juga menentukan muatan listrik, yang pada gilirannya menentukan jumlah elektron atom tersebut dalam kondisi tak terionisasi. Elektron menempati orbital atom yang menentukan beragam sifat kimia atom. Jumlah neutron dalam inti atom biasanya berpengaruh sangat kecil pada sifat unsur kimia (kecuali dalam kasus hidrogen dan deuterium). Oleh karena itu, seluruh isotop karbon memiliki sifat kimia yang hampir identik karena kesemuanya memiliki enam proton dan enam elektron, meskipun atom karbon dapat mempunyai, misalnya, 6 atau 8 neutron. Inilah dasar pemikiran penentuan karakteristik unsur kimia menggunakan nomor atom, dan bukannya nomor massa atau massa atom.
Lambang nomor atom adalah Z.
Isotop[sunting | sunting sumber]
Isotop adalah atom-atom unsur yang sama (yaitu, dengan jumlah proton yang sama dalam inti atomnya), tetapi memiliki jumlah neutron yang berbeda. Oleh karena itu, terdapat, misalnya, tiga isotop utama karbon. Seluruh atom karbon memiliki 6 proton di dalam intinya, tetapi mereka dapat memiliki 6, 7, atau 8 neutron. Sehingga, nomor massanya masing-masing adalah 12, 13, dan 14. Ketiga isotop karbon tersebut dikenal sebagai karbon-12, karbon-13, dan karbon-14, sering kali disingkat sebagai 12C, 13C, 14C. Karbon dalam kehidupan sehari-hari dan dalam ilmu kimia adalah campuran dari 12C (sekitar 98,8%), 13C (sekitar 1,1%) dan sekitar 1 atom per triliun 14C.
Sebagian besar unsur alami (66 dari 94) memiliki lebih dari satu isotop stabil. Selain isotop hidrogen (yang masing-masing memiliki massa relatif sangat jauh berbeda—cukup untuk menyebabkan efek kimia), isotop-isotop unsur terdaftar secara kimia hampir tidak dapat dibedakan.
Seluruh unsur memiliki isotop yang bersifat radioaktif (radioisotop), meskipun tidak semua radioisotop ini terjadi secara alami. Radioisotop umumnya meluruh menjadi unsur lain dengan memancarkan partikel alfa atau beta. Jika suatu unsur memiliki isotop yang tidak bersifat radioaktif, ini disebut sebagai isotop "stabil". Seluruh isotop stabil yang dikenal terjadi secara alami (lihat isotop primordial). Kebanyakan radioisotop yang tidak dijumpai di alam telah dijelaskan setelah dibuat secara artifisial. Unsur-unsur tertentu tidak memiliki isotop stabil dan hanya terdiri dari isotop radioaktif: secara spesifik, unsur tanpa isotop stabil adalah teknesium (nomor atom 43), prometium (nomor 61), dan seluruh unsur dengan nomor atom lebih dari 82.
Dari 80 unsur dengan sekurang-kurangnya satu isotop stabil, 26 di antaranya hanya memiliki sebuah isotop stabil. Rata-rata jumlah isotop stabil untuk 80 unsur stabil adalah 3,1 isotop stabil per unsur. Jumlah isotop stabil terbanyak yang terjadi untuk unsur tunggal adalah 10 isotop (timah, nomor atom 50).
Massa isotop dan massa atom[sunting | sunting sumber]
Nomor massa unsur, A merupakan jumlah dari proton yang bermuatan positif dan neutron yang bermuatan netral / nukleon (proton dan neutron). perbedaan Isotop dalam unsur dibedakan berdasarkan nomor massanya, yang secara konvensional ditulis sebagai superskrip di sebelah kiri lambang atom (misalnya 238U). Nomor massa selalu bilangan bulat dan memiliki satuan "nukleon". Sebagai contoh, magnesium-24 (24 adalah nomor massa) adalah sebuah atom dengan 24 nukleon (12 proton dan 12 neutron).
Sementara nomor massa hanya berupa pencacahan jumlah neutron dan proton, sehingga menghasilkan bilangan bulat, nomor massa suatu atom berupa bilangan riil yang menyatakan massa isotop (atau "nuklida") unsur tertentu, dinyatakan dalam satuan massa atom (lambang: u). Secara umum, nomor massa nuklida tertentu memiliki nilai yang sedikit berbeda dari massa atomnya, karena
- massa masing-masing proton dan neutron tidak tepat 1 u;
- elektron hanya sedikit kontribusinya terhadap massa atom ketika jumlah neutron melebihi jumlah proton, dan (akhirnya)
- energi ikatan nuklir.
Sebagai contoh, massa atom klorin-35 hingga lima angka bermakna adalah 34,969 u dan klorin-37 adalah 36,966 u. Namun, massa atom dalam u untuk masing-masing isotop sangat mendekati nomor massa sederhananya (selalu dalam rentang 1%). Satu-satunya isotop yang memiliki massa atom tepat bilangan asli adalah 12C yang secara definitif memiliki massa tepa 12, karena u didefinisikan sebagai 1⁄12 dari massa atom karbon-12 alami bebas dalam keadaan dasar.
Berat atom standar (umum disebut sebagai "berat atom") suatu unsur adalah rata-rata massa atom seluruh isotop unsur kimia yang ditemukan di lingkungan tertentu, tertimbang sesuai kelimpahan isotopnya, relatif terhadap satuan massa atom. Angka ini dapat berupa fraksi yang tidak mendekati bilangan bulat. Misalnya, massa atom relatif klorin adalah 35,453 u, yang sangat jauh berbeda dari bilangan bulat karena merupakan rata-rata dari 76% klorin-35 dan 24% klorin-37. Ketika nilai massa atom relatif berbeda lebih dari 1% dari bilangan bulat, akibat dirata-ratakan, hal itu menunjukkan bahwa keberadaannya di alam diwakili oleh lebih dari satu isotop dalam jumlah yang banyak.
Kemurnian kimia dan kemurnian isotopis[sunting | sunting sumber]
Kimiawan dan ilmuwan nuklir memiliki definisi yang berbeda terkait unsur murni. Dalam kimia, unsur murni berarti suatu zat yang seluruh (atau hampir seluruh) atomnya memiliki nomor atom atau jumlah proton, yang sama. Sementara ilmuwan nuklir mendefinisikan unsur murni sebagai sesuatu yang mengandung hanya satu isotop stabil.[18]
Sebagai contoh, kawat tembaga secara kimia berkemurnian 99,99% jika 99,99% nya adalah atom tembaga, dengan masing-masing 29 proton. Namun ia tidak murni secara isotop karena tembaga biasa mengandung dua isotop stabil, 69% 63Cu dan 31% 65Cu, dengan jumlah proton yang berbeda. Namun, batangan emas murni dinyatakan murni secara kimia maupun isotop karena emas biasa hanya mengandung satu isotop, 197Au.
Alotrop[sunting | sunting sumber]
Atom unsur berkemurnian kimia dapat berikatan kimia satu dengan lainnya melalui lebih dari satu cara, memungkinkan unsur murni terdapat dalam banyak struktur kimia (penataan ulang spasial atom), yang dikenal sebagai alotrop, yang memiliki sifat berbeda. Sebagai contoh, karbon dapat dijumpai sebagai intan, yang memiliki struktur tetrahedral di sekeliling masing-masing atom karbon; grafit, yang memiliki lapisan atom karbon dengan struktur heksagonal yang ditumpuk; grafena, yang merupakan lapisan tunggal grafit yang sangat kuat; fulerena, yang memiliki bentuk hampir bulat, dan tabung nano karbon, yang berbentuk tabung dengan struktur heksagonal (bahkan inipun berbeda satu dengan lainnya dalam hal sifat listrik). Kemampuan suatu unsur untuk berada dalam lebih dari satu bentuk struktur dikenal sebagai 'alotropi'.
Keadaan standar, dikenal juga sebagai keadaan rujukan, suatu unsur didefinisikan sebagai keadaan paling stabilnya secara termodinamika pada tekanan 1 bar dan temperatur tertentu (biasanya pada 298,15 K). Dalam termokimia, suatu unsur didefinisikan memiliki entalpi pembentukan nol dalam keadaan dasarnya. Sebagai contoh, keadaan standar karbon adalah grafit, karena struktur grafit lebih stabil daripada alotrop lainnya.
Sifat-sifat[sunting | sunting sumber]
Beberapa kategori dapat diterapkan secara luas terhadap unsur, termasuk memperhatikan sifat fisik dan kimia mereka secara umum, keadaan materi dalam kondisi yang banyak dijumpai, titik lebur dan didihnya, massa jenisnya, struktur kristalnya sebagai padatan, dan asal-usulnya.
Sifat-sifat umum[sunting | sunting sumber]
Beberapa istilah umum digunakan untuk menandai sifat fisik dan kimia umum unsur-unsur kimia. Pembeda pertama adalah antara logam, yang mudah menghantarkan listrik, nonlogam, yang tidak menghantarkan listrik, dan sekelompok kecil (metaloid), yang memiliki sifat di antara keduanya dan sering berperilaku sebagai semikonduktor.
Klasifikasi yang lebih detail sering ditunjukkan melalui penyajian warna dalam tabel periodik. Sistem ini membatasi istilah "logam" dan "nonlogam" menjadi hanya logam dan nonlogam tertentu dari sedemikian banyaknya logam dan nonlogam. Versi klasifikasi tabel periodik yang digunakan di sini meliputi: aktinida, logam alkali, logam alkali tanah, halogen, lantanida, logam transisi, logam pasca-transisi, metaloid, nonlogam reaktif, dan gas mulia. Pada sistem ini, logam alkali, logam alkali tanah, dan logam transisi, serta lantanida dan aktinida, adalah golongan khusus logam dilihat dari sudut pandang yang lebih luas. Sama halnya, nonlogam reaktif dan gas mulia adalah nonlogam jika dilihat dari perspektif yang lebih luas. Dalam beberapa penyajian, halogen tidak dibedakan, dengan astatin diidentifikasi sebagai metaloid dan lainnya diidentifikasi sebagai nonlogam.
Keadaan materi[sunting | sunting sumber]
Hal mendasar lainnya yang umum digunakan untuk membedakan unsur kimia adalah wujud materi (fase) nya, yaitu padat, cair, atau gas, pada temperatur dan tekanan standar (STP). Sebagian besar unsur berwujud padat pada temperatur konvensional dan tekanan atmosfer, sementara beberapa berwujud gas. Hanya bromin dan raksa yang berwujud cair pada 0 °C (32 °F) dan tekanan atmosfer normal; sesium dan galium berwujud padat pada suhu tersebut, tetapi meleleh pada suhu, berturut-turut, 284 °C (543 °F) dan 298 °C (568 °F).
Titik lebur dan titik didih[sunting | sunting sumber]
Titik lebur dan titik didih, biasanya dinyatakan dalam derajat Celsius pada tekanan satu atmosfer, umumnya digunakan untuk mendefinisikan karakter berbagai unsur. Karakter ini untuk sebagian besar unsur telah diketahui, namun, untuk beberapa unsur radioaktif yang tersedia dalam jumlah sangat kecil belum diketahui. Helium tetap berada dalam wujud cair meskipun pada keadaan nol mutlak pada tekanan atmosfer, sehingga He hanya memiliki titik didih, dan tidak memiliki titik lebur pada penyajian konvensional.
Massa jenis[sunting | sunting sumber]
Massa jenis pada temperatur dan tekanan standar (STP) tertentu sering kali digunakan dalam menentukan karakter unsur. Massa jenis sering dinyatakan dalam gram per sentimeter kubik (g/cm3). Beberapa gas yang pada temperatur pengukuran berwujud gas, massa jenisnya biasanya dinyatakan untuk wujud gasnya; ketika dicairkan atau dipadatkan, unsur gas memiliki massa jenis sama dengan unsur lainnya.
Ketika suatu unsur memiliki alotrop dengan massa jenis yang berbeda, salah satu alotrop yang mewakili biasanya dipilih dalam penyajian kesimpulan, sementara massa jenis untuk masing-masing alotrop dapat dinyatakan di bagian detailnya. Sebagai contoh, tiga alotrop karbon yang terkenal (karbon amorf, grafit, dan intan) memiliki massa jenis masing-masing 1,8–2,1; 2,267; dan 3,515 g/cm3.
Struktur kristal[sunting | sunting sumber]
Unsur-unsur yang diteliti hingga saat ini sebagai sampel padat memiliki delapan jenis struktur kristal: kubik, kubik pusat badan, kubik pusat muka, heksagonal, monoklinis, ortorombis, rombohedral, dan tetragonal. Untuk beberapa unsur transuranium sintetis, sampel yang tersedia sangat sedikit untuk dapat menentukan struktur kristalnya.
Keterjadian dan asalnya di bumi[sunting | sunting sumber]
Unsur kimia dapat juga dikategorikan berdasarkan asal-usulnya di bumi. Sembilan puluh empat unsur pertama terjadi secara alami, sementara unsur dengan nomor atom lebih 94 hanya diproduksi secara artifisial sebagai produk sintetis melalui reaksi nuklir buatan.
Dari 94 unsur yang terjadi secara alami, 83 dianggap sebagai primordial dan bersifat stabil atau radioaktif lemah. Sisanya, 11 unsur yang terjadi secara alami, memiliki waktu paruh yang terlalu singkat untuk berada di awal Tata Surya, dan oleh karena itu dianggap sebagai unsur fana. Dari 11 unsur fana tersebut, 5 unsur (polonium, radon, radium, aktinium, dan protaktinium) umumnya merupakan produk peluruhan dari torium dan uranium. Enam unsur fana yang tersisa (teknesium, prometium, astatin, fransium, neptunium, dan plutonium) memiliki keterjadian yang sangat langka, sebagai produk moda peluruhan atau proses reaksi nuklir langka yang melibatkan uranium atau unsur-unsur berat.
Seluruh unsur dengan nomor atom 1 hingga 40 adalah stabil, sementara yang bernomor atom 41 hingga 82 (kecuali teknesium dan prometium) adalah metastabil. Waktu paruh "radionuklida teoritis" metastabil ini sangat panjang (sekurang-kurangnya 100 juta kali lebih panjang daripada perkiraan usia alam semesta) sehingga peluruhan radioaktifnya belum dapat dideteksi melalui eksperimen. Unsur dengan nomor atom 83 hingga 94 bersifat metastabil dari sudut pandang bahwa peluruhan radioaktifnya dapat dideteksi. Tiga dari unsur ini, bismut (unsur 83), torium (90), dan uranium (92) memiliki satu atau lebih isotop dengan waktu paruh yang cukup panjang untuk bertahan sebagai sisa-sisa ledakan nukleosintesis stelar yang menghasilkan unsur berat sebelum pembentukan tata surya kita. Sebagai contoh, pada lebih dari 1,9×1019 tahun, lebih dari satu miliar kali lebih lama daripada perkiraan alam semesta. Bismut-209 memiliki waktu paruh peluruhan alfa terpanjang dari unsur alami lainnya.[9][10] Sebanyak 24 unsur yang sangat berat (yaitu unsur setelah plutonium, unsur 94) mengalami peluruhan radioaktif dengan waktu paruh singkat dan tidak dapat menghasilkan produk peluruhan berupa unsur berumur panjang. Oleh sebab itu mereka sama sekali tidak terjadi secara alami.
Tabel periodik[sunting | sunting sumber]
| Golongan | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Logam alkali | Logam alkali tanah | Pniktogen | Kalkogen | Halogen | Gas Mulia | |||||||||||||||||||||||||
| Periode |
||||||||||||||||||||||||||||||
| 2 | ||||||||||||||||||||||||||||||
| 3 | ||||||||||||||||||||||||||||||
| 4 | ||||||||||||||||||||||||||||||
| 5 | ||||||||||||||||||||||||||||||
| 6 | ||||||||||||||||||||||||||||||
| 7 | ||||||||||||||||||||||||||||||
|
| ||||||||||||||||||||||||||||||
Sifat unsur kimia sering kali dirangkum menggunakan tabel periodik, yang mengatur secara elegan unsur-unsur berdasarkan kenaikan nomor atom menjadi baris ("periode") yang mendasari perulangan sifat kimia dan fisik kolom ("golongan") secara periodik. Tabel standar saat ini berisi 118 unsur yang telah dikonfirmasi per 10 April 2010.
Meskipun terdapat penyajian sebelum tabel periodik, penemuannya umumnya dikreditkan kepada kimiawan Rusia Dmitri Mendeleev pada tahun 1869, yang dengan tabelnya memberikan ilustrasi tentang tren keberulangan sifat-sifat unsur kimia. Tata letak tabel telah disesuaikan dan diperluas seiring berjalannya waktu karena penemuan unsur-unsur baru dan pengembangan model-model teoritis baru untuk menjelaskan perilaku kimia.
Tabel periodik saat ini digunakan dimanapun di lingkungan disiplin ilmu kimia, karena mampu menyediakan kerangka kerja yang sangat berguna untuk mengelompokkan, melakukan sistematika dan membandingkan seluruh bentuk perilaku kimia yang berbeda. Tabel tersebut juga banyak memiliki aplikasi dalam bidang fisika, geologi, biologi, ilmu bahan, teknik, pertanian, kedokteran, ilmu gizi, kesehatan lingkungan, dan astronomi. Prinsipnya secara khusus sangat penting dalam bidang teknik kimia.
Tata nama dan simbol[sunting | sunting sumber]
Beragam unsur kimia secara formal diidentifikasi berdasarkan nomor atom uniknya, berdasarkan nama yang telah disepakati, dan berdasarkan simbol atau lambangnya.
Nomor atom[sunting | sunting sumber]
Unsur kimia yang telah dikenal memiliki nomor atom dari 1 hingga 118, yang secara konvensional disajikan dalam angka Arab. Oleh karena unsur-unsur tersebut dapat diurutkan sesuai nomor atomnya, biasanya dari paling rendah ke paling tinggi (sebagai tabel periodik), sekelompok unsur kadang-kadang disebutkan dengan notasi semacam "hingga", "setelah", atau "dari ... hingga", seperti "hingga besi", "setelah uranium", atau "dari lantanum hingga lutesium". Istilah "ringan" dan "berat" kadang-kadang juga digunakan secara informal untuk mengindikasikan nomor atom relatif (bukan massa jenis), seperti dalam "lebih ringan daripada karbon" atau "lebih berat daripada timbal", meskipun secara teknis pertambahan berat atau massa atom unsur tersebut (berat atom atau massa atom) tidak selalu berbanding lurus dengan nomor atomnya.
Nama unsur kimia[sunting | sunting sumber]
Penamaan berbagai zat yang sekarang dikenal sebagai unsur mendahului teori atom, karena nama diberikan secara lokal oleh berbagai budaya untuk berbagai mineral, logam, senyawa, paduan, campuran, dan bahan lainnya, meskipun pada saat itu tidak diketahui bahan kimia tersebut adalah unsur atau senyawa. Oleh karena mereka diidentifikasi sebagai unsur, nama-nama yang ada untuk unsur yang telah dikenal sejak zaman kuno (misalnya, emas, raksa, besi) disimpan di sebagian besar negara. Perbedaan-perbedaan nasional muncul terkait nama-nama unsur, baik untuk kenyamanan, kesenangan linguistik, atau nasionalisme. Beberapa contoh ilustratif: Penutur bahasa Jerman menggunakan "Wasserstoff" (zat air) untuk "hidrogen", "Sauerstoff" (zat asam) untuk "oksigen" dan "Stickstoff" (zat pencekik) untuk "nitrogen", sementara bahasa Inggris dan beberapa bahasa roman menggunakan "sodium" untuk "natrium" dan "potassium" untuk "kalium", dan orang Prancis, Italia, Yunani, Portugis, dan Polandia lebih suka "azote / azot / azoto" (dari akar yang berarti "tak hidup") untuk "nitrogen".
Untuk tujuan komunikasi dan perdagangan internasional, nama resmi unsur kimia, baik yang kuno maupun yang baru-baru ini diakui, diputuskan oleh International Union of Pure and Applied Chemistry (IUPAC), yang telah memutuskan semacam bahasa Inggris internasional, dengan menggunakan nama bahasa Inggris tradisional bahkan ketika simbol kimia suatu unsur didasarkan pada kata Latin atau kata tradisional lainnya, misalnya mengadopsi "gold" daripada "aurum" sebagai nama untuk unsur ke-79 (Au). IUPAC lebih memilih ejaan British "aluminium" dan "caesium" daripada ejaan AS "aluminum" dan "cesium", serta "sulfur" AS daripada "sulphur" British. Namun, unsur yang praktis untuk dijual dalam jumlah besar di banyak negara sering masih memiliki nama nasional yang digunakan secara lokal, dan negara-negara yang bahasa nasionalnya tidak menggunakan huruf Latin cenderung menggunakan nama unsur IUPAC.
Menurut IUPAC, unsur kimia bukanlah nama diri dalam bahasa Inggris; konsekuensinya, nama lengkap dari suatu unsur tidak dikapitalisasi dalam bahasa Inggris, meskipun berasal dari nama diri, seperti dalam californium dan einsteinium.[Cat 2] Nama isotop unsur-unsur kimia juga tidak disapitalisasi jika dituliskan, misalnya, karbon-12 atau uranium-235. Simbol unsur kimia (seperti Cf untuk californium dan Es untuk einsteinium), selalu dikapitalisasi (lihat di bawah).
Pada paruh kedua abad ke-20, laboratorium fisika mampu menghasilkan inti atom unsur kimia dengan waktu paruh yang terlalu pendek untuk jumlah yang cukup besar untuk disebut ada. Unsur-unsur ini juga dinamai oleh IUPAC, yang umumnya mengadopsi nama yang dipilih oleh penemu. Praktek ini dapat mengarah pada pertanyaan kontroversial dari kelompok riset yang benar-benar menemukan unsur kimia, sebuah pertanyaan yang tertunda cukup lama untuk unsur-unsur dengan nomor atom 104 dan selanjutnya. (Lihat kontroversi penamaan unsur kimia).
Bibit kontroversi tersebut melibatkan penamaan nasionalistik unsur-unsur kimia pada akhir abad ke-19. Misalnya, lutesium dinamai dalam referensi sebagai Paris, Prancis. Orang Jerman, yang enggan melepaskan hak penamaan ke Prancis, sering menyebutnya cassiopeium. Demikian pula, niobium yang ditemukan oleh penemu Inggris awalnya dinamakan columbium, mengacu pada Dunia Baru. Ini digunakan secara luas oleh publikasi Amerika sebelum standardisasi internasional (tahun 1950).
Simbol kimia[sunting | sunting sumber]
Unsur kimia spesifik[sunting | sunting sumber]
Sebelum kimia menjadi ilmu, alkimiawan telah merancang simbol misterius untuk baik logam maupun senyawa umum. Namun ini digunakan sebagai singkatan dalam diagram atau prosedur; tidak ada konsep penggabungan atom untuk membentuk molekul. Seiring kemajuan dalam teori materi atom, John Dalton menemukan simbolnya sendiri yang lebih sederhana, berdasarkan lingkaran, untuk menggambarkan molekul.
Sistem notasi kimia saat ini diciptakan oleh Berzelius. Dalam sistem tipografi ini, simbol kimia bukanlah singkatan belaka—meskipun masing-masing terdiri dari huruf-huruf alfabet Latin. Mereka dimaksudkan sebagai simbol universal untuk semua bahasa dan alfabet.
Simbol-simbol ini pada mulanya dimaksudkan untuk menjadi sepenuhnya universal. Oleh karena bahasa Latin adalah bahasa umum ilmu pada waktu itu, maka simbolnya merupakan singkatan berdasarkan nama-nama logam dalam bahasa Latin. Cu diambil dari Cuprum, Fe dari Ferrum, Ag dari Argentum, dan sebagainya. Simbol tidak diikuti oleh suatu titik seperti halnya singkatan. Unsur kimia berikutnya juga diberi simbol kimia yang unik, berdasarkan nama unsur, tetapi tidak harus dalam bahasa Inggris. Misalnya, besi memiliki simbol kimia "Fe" sesuai nama Latinnya ferrum. Hal yang sama berlaku juga untuk "Hg" (hydrargyrum) untuk raksa, "Sn" (stannum) untuk timah, "Au" (aurum) untuk emas, "Ag" (argentum) untuk perak, "Pb" (plumbum) untuk timbal, "Cu" (cuprum) untuk tembaga, dan "Sb" (stibium) untuk antimon.
Simbol kimia dipahami secara internasional ketika nama unsur mungkin memerlukan penerjemahan. Ada perbedaan di masa lalu. Misalnya, Jerman dan Belanda di masa lalu menggunakan "J" (untuk nama alternatif Jod) untuk iodium, tetapi sekarang menggunakan "I" dan "Iod". Indonesia juga pernah mengikuti Jerman dan Belanda, menggunakan "J" dan "Jodium". Pada awal Ejaan Yang Disempurnakan (EYD), namanya menjadi "Yodium", tetapi simbolnya masih menggunakan "J", karena "Y" telah digunakan untuk itrium.
Huruf pertama dari simbol kimia selalu ditulis menggunakan huruf kapital, seperti pada contoh sebelumnya, dan huruf berikutnya, jika ada, selalu huruf kecil. Jadi, simbol untuk californium dan einsteinium adalah Cf dan Es.
Simbol kimia umum[sunting | sunting sumber]
Terdapat juga simbol dalam persamaan kimia untuk kelompok unsur kimia, misalnya dalam rumus perbandingan. Ini sering merupakan huruf kapital tunggal, dan huruf-huruf tersebut dicadangkan dan tidak digunakan untuk nama unsur tertentu. Misalnya, "X" menunjukkan kelompok variabel (biasanya halogen) dalam kelas senyawa, sedangkan "R" adalah radikal, yang berarti struktur senyawa seperti rantai hidrokarbon. Huruf "Q" dicadangkan untuk "panas" dalam reaksi kimia. "Y" juga sering digunakan sebagai simbol kimia umum, meskipun itu juga merupakan simbol dari itrium. "Z" juga sering digunakan sebagai kelompok variabel umum. "E" digunakan dalam kimia organik untuk menunjukkan gugus penarik elektron atau elektrofil; serupa dengan "Nu" yang menunjukkan nukleofil. "L" digunakan untuk mewakili ligan umum dalam kimia anorganik dan organologam. "M" juga sering digunakan sebagai pengganti logam umum.
Setidaknya ada dua tambahan, simbol kimia generik dua huruf yang juga digunakan secara informal, "Ln" untuk setiap unsur lantanida dan "An" untuk setiap unsur aktinida. "Rg" sebelumnya digunakan untuk unsur gas langka, tetapi kelompok gas langka sekarang telah berganti nama gas mulia dan simbol "Rg" kini telah digunakan untuk unsur roentgenium.
Simbol isotop[sunting | sunting sumber]
Isotop dibedakan menurut nomor massa atom (total proton dan neutron) untuk isotop tertentu dari suatu unsur, kemudian nomor tersebut dikombinasikan dengan simbol unsur yang bersangkutan. IUPAC lebih memilih agar simbol isotop ditulis dalam notasi superskrip demi kepraktisan, misalnya 12C dan 235U. Namun, digunakan juga notasi lain, seperti karbon-12 dan uranium-235, atau C-12 dan U-235.
Sebagai kasus khusus, tiga isotop alami unsur hidrogen sering ditetapkan sebagai H untuk 1H (protium), D untuk 2H (deuterium), dan T untuk 3H (tritium). Konvensi ini lebih mudah digunakan dalam persamaan kimia, menggantikan kebutuhan untuk menuliskan nomor massa untuk setiap atom. Misalnya, rumus untuk air berat ditulis D2O, bukan 2H2O.
Asal-usul unsur[sunting | sunting sumber]

Hanya sekitar 4% dari total massa alam semesta yang terbuat dari atom atau ion, dan hanya itu pula yang diwakili oleh unsur-unsur kimia. Fraksi ini sekitar 15% dari total materi, dengan sisa materi (85%) adalah materi gelap. Sifat materi gelap tidak diketahui, tetapi tidak terdiri dari atom-atom unsur kimia karena tidak mengandung proton, neutron, atau elektron. (Bagian non-materi yang tersisa dari massa alam semesta tersusun atas energi gelap yang lebih misterius).
Ke-94 unsur kimia yang terbentuk secara alami dianggap telah diproduksi oleh setidaknya empat proses kosmik. Sebagian besar hidrogen, helium, dan sejumlah kecil litium di alam semesta diproduksi secara primordial dalam beberapa menit pertama Dentuman Besar. Tiga proses selanjutnya yang terjadi berulang-ulang diduga telah menghasilkan unsur-unsur lainnya. Nukleosintesis stelar, proses yang sedang berlangsung di dalam bintang, menghasilkan semua unsur dalam rentang nomor atom karbon hingga besi, tetapi sedikit litium, berilium, atau boron. Unsur-unsur dengan nomor atom yang lebih berat daripada besi, seperti uranium dan plutonium, diproduksi oleh nukleosintesis eksplosif dalam supernova dan peristiwa ledakan kosmik lainnya. Spalasi (fragmentasi) sinar kosmik karbon, nitrogen, dan oksigen penting untuk produksi litium, berilium dan boron.
Selama fase awal Dentuman Besar, nukleosintesis inti hidrogen menghasilkan hidrogen-1 (protium, 1H) dan helium-4 (4He), serta sejumlah kecil deuterium (2H) dan (pada urutan 10−10) litium dan berilium dalam jumlah amat sangat kecil. Bahkan jumlah boron yang jauh lebih kecil mungkin telah dihasilkan dalam Dentuman Besar, karena telah teramati di beberapa bintang yang sangat tua, sementara karbon tidak.[19] Secara umum disepakati bahwa tidak ada unsur yang lebih berat daripada boron yang diproduksi di Big Bang. Akibatnya, kelimpahan primordial atom (atau ion) terdiri dari sekitar 75% 1H, 25% 4He, dan 0,01% deuterium, dengan hanya sekelumit litium, berilium, dan mungkin boron.[20] Pengayaan galaksi halo selanjutnya terjadi karena nukleosintesis bintang dan nukleosintesis supernova.[21] Namun, kelimpahan unsur dalam ruang antargalaksi masih bisa sangat mirip dengan kondisi primordial, kecuali telah diperkaya dengan beberapa cara.

Di Bumi (dan di tempat lain), berbagai unsur dalam jumlah renik terus diproduksi dari unsur-unsur lain sebagai produk dari proses transmutasi nuklir. Ini termasuk beberapa yang dihasilkan oleh sinar kosmik atau reaksi nuklir lainnya (lihat nuklida kosmogenik dan nukleogenik), dan yang lain diproduksi sebagai produk peluruhan nuklida primordial berumur panjang.[22] Sebagai contoh, sekelumit (tetapi terdeteksi) karbon-14 (14C) terus diproduksi di atmosfer oleh sinar kosmik yang menerpa atom nitrogen, dan argon-40 (40Ar) terus diproduksi melalui peluruhan kalium-40 (40K) yang terjadi secara primordial tetapi tidak stabil. Selain itu, tiga aktinida yang terjadi secara primordial tetapi bersifat radioaktif, torium, uranium, dan plutonium, meluruh melalui serangkaian unsur radioaktif yang diproduksi berulang tetapi tidak stabil seperti radium dan radon, yang secara sementara hadir dalam sampel logam-logam ini atau bijih atau senyawanya. Tiga unsur radioaktif lainnya, teknesium, prometium, dan neptunium, hanya terjadi secara insidental dalam bahan alami, yang diproduksi sebagai atom-atom individual melalui fisi nuklir dari inti berbagai unsur berat atau dalam proses nuklir langka lainnya.
Teknologi manusia telah menghasilkan berbagai unsur tambahan di luar 94 pertama ini, sekarang telah dikenal nomor atom hingga 118.
Kelimpahan[sunting | sunting sumber]
Grafik berikut (catatan skala log) menunjukkan kelimpahan unsur dalam Tata Surya kita. Tabel ini menunjukkan dua belas unsur paling umum di galaksi kita (diestimasi secara spektroskopi), diukur dalam bagian per juta, berdasarkan massa.[23] Galaksi-galaksi terdekat yang telah berevolusi sepanjang garis yang sama memiliki pengayaan unsur-unsur yang lebih berat daripada hidrogen dan helium. Galaksi yang lebih jauh dilihat saat mereka muncul di masa lalu, sehingga kelimpahan unsur mereka tampak lebih mendekati campuran primordial. Bagaimanapun, karena hukum dan proses fisik berlaku umum di seluruh alam semesta teramati, ilmuwan berharap bahwa galaksi-galaksi ini berevolusi menjadi unsur-unsur dalam kelimpahan yang sama.
Kelimpahan unsur di Tata Surya sesuai dengan asal mereka dari nukleosintesis dalam Dentuman Besar dan sejumlah bintang supernova progenitor. Hidrogen dan helium yang sangat melimpah adalah produk Dentuman Besar, tetapi tiga unsur berikutnya jarang terjadi karena mereka memiliki sedikit waktu untuk terbentuk dalam Dentuman Besar dan tidak dibuat di dalam bintang (namun, mereka terbentuk dalam jumlah kecil melalui pemecahan unsur yang lebih berat dalam debu antar bintang, sebagai akibat dari tumbukan oleh sinar kosmik). Dimulai dengan karbon, unsur-unsur diproduksi di bintang melalui penumpukan dari partikel alfa (inti helium), menghasilkan kelimpahan unsur-unsur dengan jumlah atomik yang lebih banyak secara bergantian (ini juga lebih stabil). Secara umum, unsur-unsur tersebut hingga besi dibuat dalam bintang besar yang berproses menjadi supernova. Besi-56 sangat umum, karena merupakan unsur paling stabil yang dapat dengan mudah dibuat dari partikel alfa (produk peluruhan nikel-56 radioaktif, yang pada akhirnya terbuat dari 14 inti helium). Unsur yang lebih berat daripada besi terbuat dari proses penyerap energi di bintang besar, dan kelimpahannya di alam semesta (dan di Bumi) umumnya menurun seiring kenaikan nomor atomnya.

| Unsur kimia di galaksi kita | Bagian per juta berdasarkan massa |
|---|---|
| Hidrogen | 739.000 |
| Helium | 240.000 |
| Oksigen | 10.400 |
| Karbon | 4.600 |
| Neon | 1.340 |
| Besi | 1.090 |
| Nitrogen | 960 |
| Silikon | 650 |
| Magnesium | 580 |
| Belerang | 440 |
| Kalium | 210 |
| Nikel | 100 |
| H | He | |||||||||||||||||
| Li | Be | B | C | N | O | F | Ne | |||||||||||
| Na | Mg | Al | Si | P | S | Cl | Ar | |||||||||||
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | |
| Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | |
| Cs | Ba | La | * | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn |
| Fr | Ra | Ac | ** | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og |
| * | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | ||||
| ** | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | ||||
Empat unsur dasar organik
|
Unsur kuantitas
|
Unsur renik esensial
|
Dianggap berfungsi dari kekurangan efek atau penanganan metabolik aktif, namun tidak ada fungsi biokimia yang jelas teridentifikasi pada manusia
|
Terbatasnya bukti tidak langsung untuk mengetahui jejak manfaat atau aksi biologis pada mamalia
|
Tidak ada bukti aksi biologis pada mamalia, namun esensial untuk beberapa organisme yang lebih rendah.
(Dalam kasus lantanum, definisi nutrisi esensial sebagai sangat diperlukan dan tak tergantikan tidak sepenuhnya berlaku karena kemiripan lantanida yang ekstrem. Jadi Ce, Pr, dan Nd dapat menggantikan La tanpa efek buruk bagi organisme yang menggunakan La. Sedangkan Sm, Eu, dan Gd yang lebih kecil juga dapat menggantikan dengan baik namun menyebabkan pertumbuhan lebih lambat.) |
Sejarah[sunting | sunting sumber]

Definisi yang berkembang[sunting | sunting sumber]
Konsep "unsur" sebagai zat yang tak dapat dibagi lagi telah berkembang melalui tiga fase utama sejarah: Definisi klasik (seperti yang dimiliki orang-orang Yunani kuno), definisi kimia, dan definisi atom.
Definisi klasik[sunting | sunting sumber]
Filosofi kuno mengemukakan seperangkat unsur klasik untuk menjelaskan pola yang diamati di alam. Unsur-unsur ini awalnya disebut tanah, air, udara dan api, bukan unsur-unsur kimia seperti dalam ilmu modern.
Istilah 'unsur' (stoicheia) pertama kali digunakan oleh filsuf Yunani Plato di sekitar tahun 360 SM dalam dialognya Timaios, yang mencakup diskusi tentang komposisi badan anorganik dan organik dan merupakan risalah spekulatif kimia. Plato percaya bahwa unsur-unsur yang diperkenalkan satu abad sebelumnya oleh Empedokles terdiri dari bentuk-bentuk kecil polihedron: tetrahedron (api), oktahedron (udara), ikosahedron (air), dan kubus (tanah).[24][25]
Aristoteles, c. 350 SM, juga menggunakan istilah stoicheia dan menambahkan unsur kelima yang disebut eter, yang membentuk langit. Aristoteles mendefinisikan unsur sebagai:
Unsur–sesuatu hasil penguraian sesuatu yang lain, tetapi ia sendiri tidak dapat dipecah lagi menjadi yang lainnya.[26]
Definisi kimia[sunting | sunting sumber]
Pada 1661, Robert Boyle mengusulkan teorinya tentang korpuskularisme yang lebih menyukai analisis materi sebagaimana didasari oleh unit materi yang tak dapat direduksi (atom) dan, memilih untuk sependapat dengan pandangan Aristoteles tentang empat unsur atau pandangan Paracelsus tentang tiga unsur fundamental, membiarkan pertanyaan tentang jumlah unsur tetap terbuka.[27] Daftar modern unsur-unsur kimia yang pertama disajikan oleh Antoine Lavoisier pada tahun 1789 melalui bukunya Traité Élémentaire de Chimie, yang mengandung tiga puluh tiga unsur, termasuk cahaya dan kalori.[28] Pada tahun 1818, Jöns Jakob Berzelius telah menentukan bobot atom untuk empat puluh lima dari empat puluh sembilan unsur yang diterima kemudian. Dmitri Mendeleev memiliki enam puluh enam unsur dalam tabel periodiknya pada 1869.
Dari Boyle hingga awal abad ke-20, unsur didefinisikan sebagai zat murni yang tidak dapat diuraikan menjadi zat yang lebih sederhana.[27] Dengan kata lain, unsur kimia tidak dapat diubah menjadi unsur kimia lainnya melalui proses kimia. Unsur-unsur selama waktu ini umumnya dibedakan oleh bobot atom mereka, sifat yang terukur dengan akurasi yang mencukupi dengan teknik analisis yang tersedia.

Definisi atom[sunting | sunting sumber]

Pada tahun 1913 fisikawan Inggris Henry Moseley menemukan bahwa muatan nuklir adalah basis fisika untuk nomor atom, lebih lanjut disempurnakan ketika sifat proton dan neutron diungkap, akhirnya mengarah pada definisi saat ini yaitu unsur berdasarkan nomor atom (jumlah proton per inti atom). Penggunaan nomor atom, bukan berat atom, untuk membedakan unsur memiliki nilai prediktif yang lebih besar (karena angka-angka ini adalah bilangan bulat), dan juga menyelesaikan beberapa ambiguitas dalam pandangan berbasis kimia karena berbagai sifat isotop dan alotrop dalam unsur yang sama. Saat ini, IUPAC mendefinisikan unsur dinyatakan ada jika memiliki isotop dengan umur lebih lama dari 10−14 detik yang dibutuhkan inti untuk membentuk awan elektron.[29]
Pada 1914, diketahui tujuh puluh dua unsur, semua terjadi secara alami.[30] Unsur-unsur alami yang tersisa ditemukan atau diisolasi dalam dekade-dekade berikutnya, dan berbagai unsur tambahan juga telah diproduksi secara sintetis, yang sebagian besar diprakarsai oleh Glenn T. Seaborg. Pada tahun 1955, unsur 101 ditemukan dan diberi nama mendelevium untuk menghormati D.I. Mendeleev, tokoh pertama mengatur unsur secara berkala. Baru-baru ini, sintesis unsur 118 (diberi nama oganeson) dilaporkan pada Oktober 2006, dan sintesis unsur 117 (tenesin) dilaporkan pada bulan April 2010.[31]
Penemuan dan pengakuan berbagai unsur[sunting | sunting sumber]
Sepuluh bahan yang akrab dengan berbagai budaya prasejarah yang sekarang dikenal sebagai unsur kimia adalah: Karbon, tembaga, emas, besi, timbal, raksa, perak, belerang, timah, dan seng. Tiga bahan lain yang sekarang diterima sebagai unsur adalah arsenik, antimon, dan bismut, yang diakui sebagai zat berbeda sebelum tahun 1500. Fosforus, kobalt, dan platina diisolasi sebelum tahun 1750.
Sebagian besar unsur kimia alami berikutnya diidentifikasi dan dikarakterisasi pada tahun 1900, termasuk:
- bahan-bahan industri yang sekarang dikenal seperti aluminium, silikon, nikel, kromium, magnesium, dan wolfram,
- logam reaktif seperti litium, natrium, kalium, dan kalsium,
- halogen fluor, klor, bromin, dan iodin,
- gas seperti hidrogen, oksigen, nitrogen, helium, argon, dan neon,
- sebagian besar unsur tanah jarang, termasuk serium, lantanum, gadolinium, dan neodimium, dan
- unsur-unsur radioaktif yang lebih umum, termasuk uranium, torium, radium, dan radon
Unsur yang diisolasi atau diproduksi sejak tahun 1900 meliputi:
- tiga unsur alam stabil yang belum terungkap terjadi secara tetap: hafnium, lutesium, dan renium,
- plutonium, yang pertama kali diproduksi secara sintetis pada tahun 1940 oleh Glenn T. Seaborg, tetapi sekarang juga diketahui dari beberapa kejadian alam yang berlangsung lama,
- tiga unsur alami yang terjadi secara kebetulan (neptunium, prometium, dan teknesium), yang semuanya pertama kali diproduksi secara sintetik tetapi kemudian ditemukan dalam jumlah kecil dalam sampel geologi tertentu
- tiga produk peluruhan yang langka dari uranium atau torium, (astatin, fransium, dan protaktinium), dan
- berbagai unsur transuranium sintetis, dimulai dengan amerisium dan kurium.
Unsur yang baru ditemukan[sunting | sunting sumber]
Unsur transuranium (unsur dengan nomor atom lebih besar dari 92) yang pertama ditemukan adalah neptunium pada tahun 1940. Sejak 1999 klaim untuk penemuan unsur-unsur baru telah dipertimbangkan oleh IUPAC/IUPAP Joint Working Party. Sejak Januari 2016, seluruh 118 unsur telah dikonfirmasi sebagai ditemukan oleh IUPAC. Penemuan unsur 112 diakui pada tahun 2009, dan diusulkan untuk dinamakan kopernisium dengan simbol atom Cn.[32] Nama dan simbol tersebut secara resmi didukung oleh IUPAC pada 19 Februari 2010.[33] Unsur terberat yang diyakini telah disintesis hingga saat ini adalah unsur 118, oganeson, pada 9 Oktober 2006, oleh Flerov Laboratory of Nuclear Reactions di Dubna, Rusia.[12][34] Tenesin, unsur 117 adalah unsur terbaru yang diklaim ditemukan, pada tahun 2009.[35] Pada 28 November 2016, para ilmuwan di IUPAC secara resmi mengakui nama-nama untuk empat unsur kimia terbaru, dengan nomor atom 113, 115, 117, dan 118.[36][37]
Daftar 118 unsur kimia yang telah diketahui[sunting | sunting sumber]
Berikut adalah tabel yang memuat 118 unsur kimia yang telah diketahui.
- Nomor atom, nama, dan lambang semuanya berfungsi secara independen sebagai identitas unik.
- Nama adalah yang diterima oleh IUPAC; nama sementara untuk unsur-unsur yang baru diproduksi dan belum diberi nama secara resmi ditulis dalam tanda kurung.
- Golongan dan periode mengacu pada posisi unsur dalam tabel periodik. Nomor golongan di sini menunjukkan penomoran yang saat ini diterima; untuk penomoran alternatif yang lebih lama, lihat Golongan tabel periodik.
- Massa adalah massa atom dalam satuan g/mol.
| Logam alkali | Alkali tanah | Lantanida | Aktinida | Logam transisi |
| Logam | Metaloid | Nonlogam | Halogen | Gas mulia |
| No. Atom |
Nama | Lambang | Periode, Golongan |
Massa (g/Mol) |
Massa jenis (g/cm³) pada 20°C |
Titik lebur (°C) |
Titik didih (°C) |
Tahun penemuan |
Penemu |
|---|---|---|---|---|---|---|---|---|---|
| 1 | Hidrogen | H | 1; 1 | 1,00794(7)2 3 4 | 0,084 g/l | −259,1 | −252,9 | 1766 | Cavendish |
| 2 | Helium | He | 1; 18 | 4,002602(2)2 4 | 0,17 g/l | −272,2 | −268,9 | 1895 | Ramsay dan Cleve |
| 3 | Litium | Li | 2; 1 | 6,941(2)2 3 4 5 | 0,53 | 180,5 | 1317 | 1817 | Arfwedson |
| 4 | Berilium | Be | 2; 2 | 9,012182(3) | 1,85 | 1278 | 2970 | 1797 | Vauquelin |
| 5 | Boron | B | 2; 13 | 10,811(7)2 3 4 | 2,46 | 2300 | 2550 | 1808 | Davy dan Gay-Lussac |
| 6 | Karbon | C | 2; 14 | 12,0107(8)2 4 | 3,51 | 3550 | 4827 | 3750 SM | orang Mesir Kuno dan orang Sumeria |
| 7 | Nitrogen | N | 2; 15 | 14,0067(2)2 4 | 1,17 g/l | −209,9 | −195,8 | 1772 | Rutherford |
| 8 | Oksigen | O | 2; 16 | 15,9994(3)2 4 | 1,33 g/l | −218,4 | −182,9 | 1774 | Priestly dan Scheele |
| 9 | Fluorin | F | 2; 17 | 18,9984032(5) | 1,58 g/l | −219,6 | −188,1 | 1886 | Moissan |
| 10 | Neon | Ne | 2; 18 | 20,1797(6)2 3 | 0,84 g/l | −248,7 | −246,1 | 1898 | Ramsay dan Travers |
| 11 | Natrium | Na | 3; 1 | 22,98976928(2) | 0,97 | 97,8 | 892 | 1807 | Davy |
| 12 | Magnesium | Mg | 3; 2 | 24,3050(6) | 1,74 | 648,8 | 1107 | 1755 | Black |
| 13 | Alumunium | Al | 3; 13 | 26,9815386(8) | 2,70 | 660,5 | 2467 | 1825 | Ørsted |
| 14 | Silikon | Si | 3; 14 | 28,0855(3)4 | 2,33 | 1410 | 2355 | 1824 | Berzelius |
| 15 | Fosforus | P | 3; 15 | 30,973762(2) | 1,82 | 44 (P4) | 280 (P4) | 1669 | Brand |
| 16 | Belerang | S | 3; 16 | 32,065(5)2 4 | 2,06 | 113 | 444,7 | sebelum 2000 SM | orang Tionghoa |
| 17 | Klorin | Cl | 3; 17 | 35,453(2)2 3 4 | 2,95 g/l | −34,6 | −101 | 1774 | Scheele |
| 18 | Argon | Ar | 3; 18 | 39,948(1)2 4 | 1,66 g/l | −189,4 | −185,9 | 1894 | Ramsay dan Rayleigh |
| 19 | Kalium | K | 4; 1 | 39,0983(1) | 0,86 | 63,7 | 774 | 1807 | Davy |
| 20 | Kalsium | Ca | 4; 2 | 40,078(4)2 | 1,54 | 839 | 1487 | 1808 | Davy |
| 21 | Skandium | Sc | 4; 3 | 44,955912(6) | 2,99 | 1539 | 2832 | 1879 | Nilson |
| 22 | Titanium | Ti | 4; 4 | 47,867(1) | 4,51 | 1660 | 3260 | 1791 | Gregor dan Klaproth |
| 23 | Vanadium | V | 4; 5 | 50,9415(1) | 6,09 | 1890 | 3380 | 1801 | del Río |
| 24 | Kromium | Cr | 4; 6 | 51,9961(6) | 7,14 | 1857 | 2482 | 1797 | Vauquelin |
| 25 | Mangan | Mn | 4; 7 | 54,938045(5) | 7,44 | 1244 | 2097 | 1774 | Gahn |
| 26 | Besi | Fe | 4; 8 | 55,845(2) | 7,87 | 1535 | 2750 | sebelum 5000 SM | tak diketahui |
| 27 | Kobalt | Co | 4; 9 | 58,933195(5) | 8,89 | 1495 | 2870 | 1735 | Brandt |
| 28 | Nikel | Ni | 4; 10 | 58,6934(2) | 8,91 | 1453 | 2732 | 1751 | Cronstedt |
| 29 | Tembaga | Cu | 4; 11 | 63,546(3)4 | 8,92 | 1083,5 | 2595 | 9000 SM | orang Timur Tengah |
| 30 | Seng | Zn | 4; 12 | 65,409(4) | 7,14 | 419,6 | 907 | sebelum 1000 SM | ahli metalurgi India |
| 31 | Galium | Ga | 4; 13 | 69,723(1) | 5,91 | 29,8 | 2403 | 1875 | Lecoq de Boisbaudran |
| 32 | Germanium | Ge | 4; 14 | 72,64(1) | 5,32 | 937,4 | 2830 | 1886 | Winkler |
| 33 | Arsen | As | 4; 15 | 74,92160(2) | 5,72 | 615 | 615 (subl.) |
sebelum 815 M | alkemis Arab |
| 34 | Selenium | Se | 4; 16 | 78,96(3)4 | 4,82 | 217 | 685 | 1817 | Berzelius |
| 35 | Bromin | Br | 4; 17 | 79,904(1) | 3,14 | −7,3 | 58,8 | 1826 | Balard |
| 36 | Kripton | Kr | 4; 18 | 83,798(2)2 3 | 3,48 g/l | −156,6 | −152,3 | 1898 | Ramsay dan Travers |
| 37 | Rubidium | Rb | 5; 1 | 85,4678(3)2 | 1,53 | 39 | 688 | 1861 | Bunsen dan Kirchhoff |
| 38 | Stronsium | Sr | 5; 2 | 87,62(1)2 4 | 2,63 | 769 | 1384 | 1790 | Crawford |
| 39 | Itrium | Y | 5; 3 | 88,90585(2) | 4,47 | 1523 | 3337 | 1794 | Gadolin |
| 40 | Zirkonium | Zr | 5; 4 | 91,224(2)2 | 6,51 | 1852 | 4377 | 1789 | Klaproth |
| 41 | Niobium | Nb | 5; 5 | 92,906 38(2) | 8,58 | 2468 | 4927 | 1801 | Hatchett |
| 42 | Molibdenum | Mo | 5; 6 | 95,94(2)2 | 10,28 | 2617 | 5560 | 1778 | Scheele |
| 43 | Teknesium | Tc | 5; 7 | [98,9063]1 | 11,49 | 2172 | 5030 | 1937 | Perrier dan Segrè |
| 44 | Rutenium | Ru | 5; 8 | 101,07(2)2 | 12,45 | 2310 | 3900 | 1844 | Klaus |
| 45 | Rodium | Rh | 5; 9 | 102,90550(2) | 12,41 | 1966 | 3727 | 1803 | Wollaston |
| 46 | Paladium | Pd | 5; 10 | 106,42(1)2 | 12,02 | 1552 | 3140 | 1803 | Wollaston |
| 47 | Perak | Ag | 5; 11 | 107,8682(2)2 | 10,49 | 961,9 | 2212 | sebelum 5000 SM | tak diketahui |
| 48 | Kadmium | Cd | 5; 12 | 112,411(8)2 | 8,64 | 321 | 765 | 1817 | Strohmeyer dan Hermann |
| 49 | Indium | In | 5; 13 | 114,818(3) | 7,31 | 156,2 | 2080 | 1863 | Reich dan Richter |
| 50 | Timah | Sn | 5; 14 | 118,710(7)2 | 7,29 | 232 | 2270 | protosejarah, sekitar abad ke-35 SM | tak diketahui |
| 51 | Antimon | Sb | 5; 15 | 121,760(1)2 | 6,69 | 630,7 | 1750 | sebelum 815 M | alkemis Arab |
| 52 | Telurium | Te | 5; 16 | 127,60(3)2 | 6,25 | 449,6 | 990 | 1782 | von Reichenstein |
| 53 | Iodin | I | 5; 17 | 126,90447(3) | 4,94 | 113,5 | 184,4 | 1811 | Courtois |
| 54 | Xenon | Xe | 5; 18 | 131,293(6)2 3 | 4,49 g/l | −111,9 | −107 | 1898 | Ramsay dan Travers |
| 55 | Sesium | Cs | 6; 1 | 132,9054519(2) | 1,90 | 28,4 | 690 | 1860 | Kirchhoff dan Bunsen |
| 56 | Barium | Ba | 6; 2 | 137,327(7) | 3,65 | 725 | 1640 | 1808 | Davy |
| 57 | Lantanum | La | 6 | 138,90547(7)2 | 6,16 | 920 | 3454 | 1839 | Mosander |
| 58 | Serium | Ce | 6 | 140,116(1)2 | 6,77 | 798 | 3257 | 1803 | von Hisinger dan Berzelius |
| 59 | Praseodimium | Pr | 6 | 140,90765(2) | 6,48 | 931 | 3212 | 1895 | von Welsbach |
| 60 | Neodimium | Nd | 6 | 144,242(3)2 | 7,00 | 1010 | 3127 | 1895 | von Welsbach |
| 61 | Prometium | Pm | 6 | [146,9151]1 | 7,22 | 1080 | 2730 | 1945 | Marinsky dan Glendenin |
| 62 | Samarium | Sm | 6 | 150,36(2)2 | 7,54 | 1072 | 1778 | 1879 | Lecoq de Boisbaudran |
| 63 | Europium | Eu | 6 | 151,964(1)2 | 5,25 | 822 | 1597 | 1901 | Demarçay |
| 64 | Gadolinium | Gd | 6 | 157,25(3)2 | 7,89 | 1311 | 3233 | 1880 | de Marignac |
| 65 | Terbium | Tb | 6 | 158,92535(2) | 8,25 | 1360 | 3041 | 1843 | Mosander |
| 66 | Disprosium | Dy | 6 | 162,500(1)2 | 8,56 | 1409 | 2335 | 1886 | Lecoq de Boisbaudran |
| 67 | Holmium | Ho | 6 | 164,93032(2) | 8,78 | 1470 | 2720 | 1878 | Soret |
| 68 | Erbium | Er | 6 | 167,259(3)2 | 9,05 | 1522 | 2510 | 1842 | Mosander |
| 69 | Tulium | Tm | 6 | 168,93421(2) | 9,32 | 1545 | 1727 | 1879 | Cleve |
| 70 | Iterbium | Yb | 6 | 173,04(3)2 | 6,97 | 824 | 1193 | 1878 | de Marignac |
| 71 | Lutesium | Lu | 6; 3 | 174,967(1)2 | 9,84 | 1656 | 3315 | 1907 | Urbain |
| 72 | Hafnium | Hf | 6; 4 | 178,49(2) | 13,31 | 2150 | 5400 | 1923 | Coster dan de Hevesy |
| 73 | Tantalum | Ta | 6; 5 | 180,9479(1) | 16,68 | 2996 | 5425 | 1802 | Ekeberg |
| 74 | Wolfram | W | 6; 6 | 183,84(1) | 19,26 | 3407 | 5927 | 1783 | Elhuyar |
| 75 | Renium | Re | 6; 7 | 186,207(1) | 21,03 | 3180 | 5627 | 1925 | Noddack; Tacke dan Berg |
| 76 | Osmium | Os | 6; 8 | 190,23(3)2 | 22,61 | 3045 | 5027 | 1803 | Tennant |
| 77 | Iridium | Ir | 6; 9 | 192,217(3) | 22,65 | 2410 | 4130 | 1803 | Tennant |
| 78 | Platina | Pt | 6; 10 | 195,084(9) | 21,45 | 1772 | 3827 | 1557 | Scaliger |
| 79 | Emas | Au | 6; 11 | 196,966569(4) | 19,32 | 1064,4 | 2940 | sebelum 6000 SM | orang Timur Tengah |
| 80 | Raksa | Hg | 6; 12 | 200,59(2) | 13,55 | −38,9 | 356,6 | sebelum 1500 SM | orang Mesir Kuno |
| 81 | Talium | Tl | 6; 13 | 204,3833(2) | 11,85 | 303,6 | 1457 | 1861 | Crookes |
| 82 | Timbal | Pb | 6; 14 | 207,2(1)2 4 | 11,34 | 327,5 | 1740 | 7000 SM | orang Timur Tengah |
| 83 | Bismut | Bi | 6; 15 | 208,98040(1) | 9,80 | 271,4 | 1560 | sebelum 1000 SM | alkemis Arab |
| 84 | Polonium | Po | 6; 16 | [208,9824]1 | 9,20 | 254 | 962 | 1898 | Marie dan Pierre Curie |
| 85 | Astatin | At | 6; 17 | [209,9871]1 | 1940 | Corson dan MacKenzie | |||
| 86 | Radon | Rn | 6; 18 | [222,0176]1 | 9,23 g/l | −71 | −61,8 | 1900 | Dorn |
| 87 | Fransium | Fr | 7; 1 | [223,0197]1 | 27 | 677 | 1939 | Perey | |
| 88 | Radium | Ra | 7; 2 | [226,0254]1 | 5,50 | 700 | 1140 | 1898 | Marie dan Pierre Curie |
| 89 | Aktinium | Ac | 7 | [227,0278]1 | 10,07 | 1047 | 3197 | 1899 | Debierne |
| 90 | Torium | Th | 7 | 232,03806(2)1 2 | 11,72 | 1750 | 4787 | 1829 | Berzelius |
| 91 | Protaktinium | Pa | 7 | 231,03588(2)1 | 15,37 | 1554 | 4030 | 1917 | Soddy; Cranston dan Hahn |
| 92 | Uranium | U | 7 | 238,02891(3)1 2 3 | 18,97 | 1132,4 | 3818 | 1789 | Klaproth |
| 93 | Neptunium | Np | 7 | [237,0482]1 | 20,48 | 640 | 3902 | 1940 | McMillan dan Abelson |
| 94 | Plutonium | Pu | 7 | [244,0642]1 | 19,74 | 641 | 3327 | 1940 | Seaborg |
| 95 | Amerisium | Am | 7 | [243,0614]1 | 13,67 | 994 | 2607 | 1944 | Seaborg |
| 96 | Kurium | Cm | 7 | [247,0703]1 | 13,51 | 1340 | 1944 | Seaborg | |
| 97 | Berkelium | Bk | 7 | [247,0703]1 | 13,25 | 986 | 1949 | Seaborg | |
| 98 | Kalifornium | Cf | 7 | [251,0796]1 | 15,1 | 900 | 1950 | Seaborg | |
| 99 | Einsteinium | Es | 7 | [252,0829]1 | 860 | 1952 | Seaborg | ||
| 100 | Fermium | Fm | 7 | [257,0951]1 | 1952 | Seaborg | |||
| 101 | Mendelevium | Md | 7 | [258,0986]1 | 1955 | Seaborg | |||
| 102 | Nobelium | No | 7 | [259,1009]1 | 1958 | Seaborg | |||
| 103 | Lawrensium | Lr | 7; 3 | [260,1053]1 | 1961 | Ghiorso | |||
| 104 | Ruterfordium | Rf | 7; 4 | [261,1087]1 | 1964/69 | Flyorov | |||
| 105 | Dubnium | Db | 7; 5 | [262,1138]1 | 1967/70 | Flyorov | |||
| 106 | Seaborgium | Sg | 7; 6 | [263,1182]1 | 1974 | Flyorov | |||
| 107 | Bohrium | Bh | 7; 7 | [262,1229]1 | 1976 | Oganessian | |||
| 108 | Hasium | Hs | 7; 8 | [265]1 | 1984 | GSI (*) | |||
| 109 | Meitnerium | Mt | 7; 9 | [266]1 | 1982 | GSI | |||
| 110 | Darmstadtium | Ds | 7; 10 | [269]1 | 1994 | GSI | |||
| 111 | Roentgenium | Rg | 7; 11 | [272]1 | 1994 | GSI | |||
| 112 | Kopernisium | Cn | 7; 12 | [285]1 | 1996 | GSI | |||
| 113 | Nihonium | Nh | 7; 13 | [286]1 | 2004 | RIKEN; JINR (*); LLNL (*) | |||
| 114 | Flerovium | Fl | 7; 14 | [289]1 | 1998 | JINR | |||
| 115 | Moskovium | Mc | 7; 15 | [289]1 | 2003 | JINR; LLNL | |||
| 116 | Livermorium | Lv | 7; 16 | [293]1 | 2000 | LBNL (*) | |||
| 117 | Tenesin | Ts | 7; 17 | [294]1 | 2009 | JINR; LLNL | |||
| 118 | Oganeson | Og | 7; 18 | [294]1 | 2002 | JINR; LLNL |
| Logam alkali | Alkali tanah | Lantanida | Aktinida | Logam transisi |
| Logam | Metaloid | Nonlogam | Halogen | Gas mulia |
Lihat juga[sunting | sunting sumber]
- Basis data kimia
- Penemuan unsur kimia
- Pengumpulan unsur kimia
- Unsur fiksi
- Klasifikasi Goldschmidt
- Pulau stabilitas
- Nomor atom
- Lambang unsur
- Daftar unsur kimia menurut nama
- Daftar unsur kimia menurut nomor atom
- Daftar nuklida
- Daftar massa jenis unsur kimia
- Sistem periodik molekul kecil
- Harga unsur kimia dan senyawanya
- Nama unsur sistematik
- Tabel nuklida
- The Mystery of Matter: Search for the Elements (PBS film)
- Atomas, permainan tentang penggabungan atom
Referensi[sunting | sunting sumber]
- ^ a b IUPAC (ed.). "chemical element". International Union of Pure and Applied Chemistry. doi:10.1351/goldbook.C01022.
- ^ Los Alamos National Laboratory (2011). "Periodic Table of Elements: Oxygen". Los Alamos, New Mexico: Los Alamos National Security, LLC. Diakses tanggal 7 May 2011.
- ^ Oerter, Robert (2006). The Theory of Almost Everything: The Standard Model, the Unsung Triumph of Modern Physics. Penguin. hlm. 223. ISBN 978-0-452-28786-0.
- ^ E. M. Burbidge; G. R. Burbidge; W. A. Fowler; F. Hoyle (1957). "Synthesis of the Elements in Stars". Reviews of Modern Physics. 29 (4): 547–650. Bibcode:1957RvMP...29..547B. doi:10.1103/RevModPhys.29.547.
- ^ See the timeline on p.10 in Oganessian, Yu. Ts.; Utyonkov, V.; Lobanov, Yu.; Abdullin, F.; Polyakov, A.; Sagaidak, R.; Shirokovsky, I.; Tsyganov, Yu.; et al. (2006). "Evidence for Dark Matter" (PDF). Physical Review C. 74 (4): 044602. Bibcode:2006PhRvC..74d4602O. doi:10.1103/PhysRevC.74.044602. Diarsipkan dari versi asli (PDF) tanggal 2021-02-13. Diakses tanggal 2018-10-02.
- ^ lbl.gov (2005). "The Universe Adventure Hydrogen and Helium". Lawrence Berkeley National Laboratory U.S. Department of Energy. Diarsipkan dari versi asli tanggal 21 September 2013.
- ^ astro.soton.ac.uk (3 January 2001). "Formation of the light elements". University of Southampton. Diarsipkan dari versi asli tanggal 21 September 2013.
- ^ foothill.edu (18 October 2006). "How Stars Make Energy and New Elements" (PDF). Foothill College.
- ^ a b Dumé, B. (23 April 2003). "Bismuth breaks half-life record for alpha decay". Physicsworld.com. Bristol, England: Institute of Physics. Diakses tanggal 14 July 2015.
- ^ a b de Marcillac, P.; Coron, N.; Dambier, G.; Leblanc, J.; Moalic, J-P (2003). "Experimental detection of alpha-particles from the radioactive decay of natural bismuth". Nature. 422 (6934): 876–8. Bibcode:2003Natur.422..876D. doi:10.1038/nature01541. PMID 12712201.
- ^ Sanderson, K. (17 October 2006). "Heaviest element made–again". News@nature. Nature News. doi:10.1038/news061016-4.
- ^ a b Schewe, P.; Stein, B. (17 October 2000). "Elements 116 and 118 Are Discovered". Physics News Update. American Institute of Physics. Diarsipkan dari versi asli tanggal 1 January 2012. Diakses tanggal 19 October 2006.
- ^ United States Environmental Protection Agency. "Technetium-99". epa.gov. Diakses tanggal 26 February 2013.
- ^ Harvard–Smithsonian Center for Astrophysics. "ORIGIN OF HEAVY ELEMENTS". cfa.harvard.edu. Diakses tanggal 26 February 2013.
- ^ "ATOMIC NUMBER AND MASS NUMBERS". ndt-ed.org. Diarsipkan dari versi asli tanggal 2014-02-12. Diakses tanggal 17 February 2013.
- ^ periodic.lanl.gov. "PERIODIC TABLE OF ELEMENTS: LANL Carbon". Los Alamos National Laboratory.
- ^ Katsuya Yamada. "Atomic mass, isotopes, and mass number" (PDF). Los Angeles Pierce College. Diarsipkan dari versi asli (PDF) tanggal 11 January 2014.
- ^ "Pure element". European Nuclear Society. Diarsipkan dari versi asli tanggal 2017-06-13. Diakses tanggal 2018-10-02.
- ^ Wilford, J. N. (14 January 1992). "Hubble Observations Bring Some Surprises". The New York Times.
- ^ Wright, E. L. (12 September 2004). "Big Bang Nucleosynthesis". UCLA, Division of Astronomy. Diakses tanggal 22 February 2007.
- ^ Wallerstein, George; Iben, Icko; Parker, Peter; Boesgaard, Ann; Hale, Gerald; Champagne, Arthur; Barnes, Charles; Käppeler, Franz; et al. (1999). "Synthesis of the elements in stars: forty years of progress" (PDF). Reviews of Modern Physics. 69 (4): 995–1084. Bibcode:1997RvMP...69..995W. doi:10.1103/RevModPhys.69.995. Diarsipkan dari versi asli (PDF) tanggal 28 September 2006.
- ^ Earnshaw, A.; Greenwood, N. (1997). Chemistry of the Elements (edisi ke-2nd). Butterworth-Heinemann.
- ^ Croswell, K. (1996). Alchemy of the Heavens. Anchor. ISBN 0-385-47214-5.
- ^ Plato (2008) [c. 360 BC]. Timaeus. Forgotten Books. hlm. 45. ISBN 978-1-60620-018-6.
- ^ Hillar, M. (2004). "The Problem of the Soul in Aristotle's De anima". NASA/WMAP. Diarsipkan dari versi asli tanggal 9 September 2006. Diakses tanggal 10 August 2006.
- ^ Partington, J. R. (1937). A Short History of Chemistry. New York: Dover Publications. ISBN 0-486-65977-1.
- ^ a b Boyle, R. (1661). The Sceptical Chymist. London. ISBN 0-922802-90-4.
- ^ Lavoisier, A. L. (1790). Elements of chemistry translated by Robert Kerr. Edinburgh. hlm. 175–6. ISBN 978-0-415-17914-0.
- ^ Transactinide-2. www.kernchemie.de
- ^ Carey, G. W. (1914). The Chemistry of Human Life. Los Angeles. ISBN 0-7661-2840-7.
- ^ Glanz, J. (6 April 2010). "Scientists Discover Heavy New Element". The New York Times.
- ^ "IUPAC Announces Start of the Name Approval Process for the Element of Atomic Number 112" (PDF). IUPAC. 20 July 2009. Diakses tanggal 27 August 2009.
- ^ "IUPAC (International Union of Pure and Applied Chemistry): Element 112 is Named Copernicium". IUPAC. 20 February 2010. Diarsipkan dari versi asli tanggal 24 February 2010.
- ^ Oganessian, Yu. Ts.; Utyonkov, V.; Lobanov, Yu.; Abdullin, F.; Polyakov, A.; Sagaidak, R.; Shirokovsky, I.; Tsyganov, Yu.; et al. (2006). "Evidence for Dark Matter" (PDF). Physical Review C. 74 (4): 044602. Bibcode:2006PhRvC..74d4602O. doi:10.1103/PhysRevC.74.044602. Diarsipkan dari versi asli (PDF) tanggal 2021-02-13. Diakses tanggal 2018-10-02.
- ^ Greiner, W. "Recommendations" (PDF). 31st meeting, PAC for Nuclear Physics. Joint Institute for Nuclear Research. Diarsipkan dari versi asli (PDF) tanggal 14 April 2010.
- ^ Staff (30 November 2016). "IUPAC Announces the Names of the Elements 113, 115, 117, and 118". IUPAC. Diakses tanggal 1 December 2016.
- ^ St. Fleur, Nicholas (1 December 2016). "Four New Names Officially Added to the Periodic Table of Elements". The New York Times. Diakses tanggal 1 December 2016.
Catatan[sunting | sunting sumber]
- ^ Ketakmurnian (Inggris: Impurity)
- ^ Karena tidak dianggap sebagai nama diri, maka bisa diterjemahkan ke Bahasa Indonesia sesuai kaidah EYD yang berlaku. Misalnya, californium diterjemahkan menjadi kalifornium, rutherfordium menjadi ruterfodium, dll. Untuk lebih jelasnya, dapat dilihat di Glosarium Pusat Bahasa Republik Indonesia
Bacaan lain[sunting | sunting sumber]
- Ball, P. (2004). The Elements: A Very Short Introduction. Oxford University Press. ISBN 0-19-284099-1.
- Emsley, J. (2003). Nature's Building Blocks: An A-Z Guide to the Elements. Oxford University Press. ISBN 0-19-850340-7.
- Gray, T. (2009). The Elements: A Visual Exploration of Every Known Atom in the Universe. Black Dog & Leventhal Publishers Inc. ISBN 1-57912-814-9.
- Scerri, E. R. (2007). The Periodic Table, Its Story and Its Significance. Oxford University Press.
- Strathern, P. (2000). Mendeleyev's Dream: The Quest for the Elements. Hamish Hamilton Ltd. ISBN 0-241-14065-X.
- Kean, Sam (2011). The Disappearing Spoon: And Other True Tales of Madness, Love, and the History of the World from the Periodic Table of the Elements. Back Bay Books.
- Compiled by A. D. McNaught and A. Wilkinson. (1997). Blackwell Scientific Publications, Oxford, ed. Compendium of Chemical Terminology, 2nd ed. (the "Gold Book"). doi:10.1351/goldbook. ISBN 0-9678550-9-8.
- XML on-line corrected version: created by M. Nic, J. Jirat, B. Kosata; updates compiled by A. Jenkins.
Pranala luar[sunting | sunting sumber]
- Videos for each element by the University of Nottingham
- "Chemical Elements", In Our Time, BBC Radio 4 discussion with Paul Strathern, Mary Archer and John Murrell (May 25, 2000).
