Kromium
| Kromium | |||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 Kristal dan kubus kromium 1 cm3 | |||||||||||||||||||||||||||||||||
Garis spektrum kromium | |||||||||||||||||||||||||||||||||
| Sifat umum | |||||||||||||||||||||||||||||||||
| Nama, lambang | kromium, Cr | ||||||||||||||||||||||||||||||||
| Pengucapan | /kromium/[1] | ||||||||||||||||||||||||||||||||
| Penampilan | metalik keperakan | ||||||||||||||||||||||||||||||||
| Kromium dalam tabel periodik | |||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||
| Nomor atom (Z) | 24 | ||||||||||||||||||||||||||||||||
| Golongan | golongan 6 | ||||||||||||||||||||||||||||||||
| Periode | periode 4 | ||||||||||||||||||||||||||||||||
| Blok | blok-d | ||||||||||||||||||||||||||||||||
| Kategori unsur | logam transisi | ||||||||||||||||||||||||||||||||
| Berat atom standar (Ar) |
| ||||||||||||||||||||||||||||||||
| Konfigurasi elektron | [Ar] 4s13d5 | ||||||||||||||||||||||||||||||||
| Elektron per kelopak | 2, 8, 13, 1 | ||||||||||||||||||||||||||||||||
| Sifat fisik | |||||||||||||||||||||||||||||||||
| Fase pada STS (0 °C dan 101,325 kPa) | padat | ||||||||||||||||||||||||||||||||
| Titik lebur | 2180 K (1907 °C, 3465 °F) | ||||||||||||||||||||||||||||||||
| Titik didih | 2944 K (2671 °C, 4840 °F) | ||||||||||||||||||||||||||||||||
| Kepadatan mendekati s.k. | 7,15 g/cm3 | ||||||||||||||||||||||||||||||||
| saat cair, pada t.l. | 6,3 g/cm3 | ||||||||||||||||||||||||||||||||
| Kalor peleburan | 21,0 kJ/mol | ||||||||||||||||||||||||||||||||
| Kalor penguapan | 347 kJ/mol | ||||||||||||||||||||||||||||||||
| Kapasitas kalor molar | 23,35 J/(mol·K) | ||||||||||||||||||||||||||||||||
Tekanan uap
| |||||||||||||||||||||||||||||||||
| Sifat atom | |||||||||||||||||||||||||||||||||
| Bilangan oksidasi | −4, −2, −1, 0, +1, +2, +3, +4, +5, +6 (tergantung pada bilangan oksidasinya, oksida asam, basa, atau amfoter) | ||||||||||||||||||||||||||||||||
| Elektronegativitas | Skala Pauling: 1,66 | ||||||||||||||||||||||||||||||||
| Energi ionisasi | ke-1: 652,9 kJ/mol ke-2: 1590,6 kJ/mol ke-3: 2987 kJ/mol (artikel) | ||||||||||||||||||||||||||||||||
| Jari-jari atom | empiris: 128 pm | ||||||||||||||||||||||||||||||||
| Jari-jari kovalen | 139±5 pm | ||||||||||||||||||||||||||||||||
| Lain-lain | |||||||||||||||||||||||||||||||||
| Kelimpahan alami | primordial | ||||||||||||||||||||||||||||||||
| Struktur kristal | kubus berpusat badan (bcc) | ||||||||||||||||||||||||||||||||
| Kecepatan suara batang ringan | 5940 m/s (suhu 20 °C) | ||||||||||||||||||||||||||||||||
| Ekspansi kalor | 4,9 µm/(m·K) (suhu 25 °C) | ||||||||||||||||||||||||||||||||
| Konduktivitas termal | 93,9 W/(m·K) | ||||||||||||||||||||||||||||||||
| Resistivitas listrik | 125 n Ω·m (suhu 20 °C) | ||||||||||||||||||||||||||||||||
| Arah magnet | antiferomagnetik (agak: SDW)[2] | ||||||||||||||||||||||||||||||||
| Suseptibilitas magnetik molar | +280,0×10−6 cm3/mol (273 K)[3] | ||||||||||||||||||||||||||||||||
| Modulus Young | 279 GPa | ||||||||||||||||||||||||||||||||
| Modulus Shear | 115 GPa | ||||||||||||||||||||||||||||||||
| Modulus curah | 160 GPa | ||||||||||||||||||||||||||||||||
| Rasio Poisson | 0,21 | ||||||||||||||||||||||||||||||||
| Skala Mohs | 8,5 | ||||||||||||||||||||||||||||||||
| Skala Vickers | 1060 MPa | ||||||||||||||||||||||||||||||||
| Skala Brinell | 687–6500 MPa | ||||||||||||||||||||||||||||||||
| Nomor CAS | 7440-47-3 | ||||||||||||||||||||||||||||||||
| Sejarah | |||||||||||||||||||||||||||||||||
| Penemuan dan isolasi pertama | Louis N. Vauquelin (1794, 1797) | ||||||||||||||||||||||||||||||||
| Isotop kromium yang utama | |||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||
Kromium adalah suatu unsur kimia dalam tabel periodik yang memiliki lambang Cr dan nomor atom 24. Ia adalah unsur pertama dalam golongan 6. Ia adalah logam berwarna abu-abu seperti baja, berkilau, keras dan rapuh[4] yang memerlukan pemolesan tinggi, tahan pengusaman, dan memiliki titik lebur tinggi. Nama unsur ini diturunkan dari bahasa Yunani χρῶμα, chrōma, yang berarti warna,[5] karena banyak senyawa kromium sangat berwarna.
Paduan ferokromium diproduksi secara komersial dari kromit dengan cara silikotermal atau reaksi aluminotermal dan logam kromium melalui proses pemanggangan dan pelindian yang diikuti dengan reduksi menggunakan karbon dan kemudian aluminium. Logam kromium bernilai tinggi karena ketahanannya yang tinggi terhadap korosi dan kekerasannya. Pengembangan utamanya adalah pengungkapan bahwa baja dapat dibuat sangat tahan korosi dan pengusaman dengan penambahan kromium logam untuk membentuk baja nirkarat. Baja nirkarat dan pelapisan krom (elektroplating dengan kromium) secara gabungan adalah 85% dari penggunaan komersial.
Ion kromium trivalen (Cr(III)) dalam jumlah renik adalah nutrisi esensial pada manusia untuk metabolisme insulin, gula dan lipida, meskipun persoalan ini masih diperdebatkan.[6]
Sementara logam kromium dan ion Cr(III) dianggap tidak beracun, kromium heksavalen (Cr(VI)) bersifat toksik dan karsinogenik. Situs produksi kromium yang sudah tidak terpakai sering memerlukan pembersihan lingkungan.
Karakteristik[sunting | sunting sumber]
Fisika[sunting | sunting sumber]
Kromium mengagumkan untuk sifat magnetiknya: ia adalah satu-satunya unsur padat yang menunjukkan tingkat antiferomagnetik pada suhu ruang (dan di bawahnya). Di atas 38 °C, ia berubah menjadi paramagnetik.[2]
Pasivasi[sunting | sunting sumber]
Logam kromium yang dibiarkan di udara terbuka mengalami pasivasi oleh oksidasi, dengan membentuk lapisan permukaan tipis yang protektif. Lapisan ini adalah suatu struktur spinel dengan ketebalan hanya beberapa molekul. Ia sangat padat, dan mencegah difusi oksigen ke dalam logam di bawahnya. Ini berbeda dari oksida yang terbentuk pada permukaan besi dan baja karbon, yang mana oksigen elemental terus bermigrasi, mencapai logam di bawahnya yang menyebabkan perkaratan berkelanjutan.[7] Pasivasi dapat ditingkatkan dengan kontak singkat dengan asam oksidator seperti asam nitrat. Kromium terpasivasi stabil terhadap asam. Pasivasi dapat dihilangkan dengan reduktor kuat yang menghancurkan lapisan oksida pelindung pada logam. Logam kromium yang telah diberi perlakuan ini mudah larut dalam asam lemah.[8]
Kromium, tidak seperti logam sejenis seperti besi dan nikel, tidak terpengaruh oleh perapuhan hidrogen. Namun ia terpengaruh oleh perapuhan nitrogen, bereaksi dengan nitrogen dari air dan membentuk nitrida yang rapuh pada suhu tinggi yang merupakan bagian dari karya logam.[9]
Keterjadian[sunting | sunting sumber]


Kromium adalah unsur paling melimpah ke-22 di kerak bumi dengan konsentrasi rata-rata 100 ppm.[10] Senyawa kromium ditemukan di lingkungan dari erosi batuan yang mengandung kromium, dan dapat disebarluaskan oleh letusan gunung berapi. Latar belakang khas konsentrasi kromium di media lingkungan adalah: atmosfer <10 ngˑm−3; tanah <500 mgˑkg−1; vegetasi <0,5 mgˑkg−1; air tawar <10 ugˑL−1; air laut <1 ugˑL−1; sedimen <80 mgˑkg−1.[11]
Kromium ditambang sebagai bijih kromit (FeCr).[12] Sekitar dua per lima bijih dan konsentrat kromit di dunia diproduksi di Afrika Selatan, sementara Kazakhstan, India, Rusia, dan Turki juga merupakan produsen substansial. Deposit kromit yang belum dimanfaatkan berlimpah, namun secara geografis terkonsentrasi di Kazakhstan dan Afrika bagian selatan.[13]
Deposit kromium asli ada, meskipun jarang.[14][15] Pipa Udachnaya di Rusia menghasilkan sampel logam alami. Tambang ini adalah pipa kimberlit, kaya akan intan, dan lingkungan reduktor membantu menghasilkan baik unsur kromium maupun intan.[16]
Hubungan antara Cr(III) dan Cr(VI) sangat bergantung pada pH dan sifat oksidatif lokasinya. Di banyak tempat, Cr(III) adalah spesies dominan,[17] tetapi di beberapa daerah, air tanah dapat mengandung sampai dengan 39 µg/Liter dari total kromium, dengan 30 µg/Liter adalah Cr(VI).[18]
Isotop[sunting | sunting sumber]
Kromium alami tersusun atas tiga isotop stabil; 52Cr, 53Cr dan 54Cr, dengan 52Cr adalah yang paling melimpah (kelimpahan alami 83,789%). Sebanyak 19 radioisotop telah dikarakterisasi, dengan yang paling stabil adalah 50Cr dengan waktu paruh (lebih dari) 1,8×1017 tahun, dan 51Cr dengan waktu paruh 27,7 hari. Seluruh isotop radioaktif sisanya mempunyai waktu paruh kurang dari 24 jam dan mayoritas kurang dari 1 menit. Unsur ini juga memiliki 2 isotop meta stabil.[19]
53Cr adalah produk peluruhan radiogenik dari 53Mn (waktu paruh = 3,74 juta tahun),[20] dan isotop kromium biasanya terkolokasi (dan bergabung) dengan isotop mangan. Keadaan ini berguna dalam geologi isotop. Rasio isotop mangan-kromium memperkuat bukti dari 26Al dan 107Pd tentang asal usul sistem tata surya. Variasi dalam rasio 53Cr/52Cr dan Mn/Cr dari beberapa meteorit menandakan rasio awal 53Mn/55Mn yang mengarah pada komposisi isotopik Mn-Cr seharusnya merupakan hasil peluruhan in situ 53Mn dalam badan planet yang berbeda. Sehingga, 53Cr memberi bukti tambahan bahwa proses nukleosintesis terjadi segera sebelum peleburan sistem tata surya.[21]
Isotop kromium berada dalam kisaran massa atom dari 43 u (43Cr) hingga 67 u (67Cr). Moda peluruhan utama sebelum isotop stabil palling melimpah, 52Cr, adalah tangkapan elektron, sedangkan moda utama setelahnya adalah peluruhan beta.[19] 53Cr telah diajukan sebagai proksi untuk konsentrasi oksigen atmosfer.[22]
Senyawa[sunting | sunting sumber]
| Tingkat oksidasi[catatan 1][23] | |
|---|---|
| −2 | Na2[Cr(CO)5] |
| −1 | Na2[Cr2(CO)10] |
| 0 | Cr(C6H6)2 |
| +1 | K3[Cr(CN)5NO] |
| +2 | CrCl2 |
| +3 | CrCl3 |
| +4 | K2CrF6 |
| +5 | K3CrO8 |
| +6 | K2CrO4 |
Kromium adalah logam transisi anggota golongan 6. Kromium(0) mempunyai konfigurasi elektron [Ar]3d54s1, karena energi yang lebih rendah dari konfigurasi spin tinggi. Kromium menunjukkan rentang tingkat oksidasi yang lebar, dengan +3 adalah yang paling stabil; keadaan +3 dan +6 adalah yang paling umum dalam senyawa kromium, sementara +1, +4, dan +5 jarang.[23]
Berikut adalah diagram Pourbaix untuk kromium dalam air murni, asam perklorat atau natrium hidroksida:[17][24]
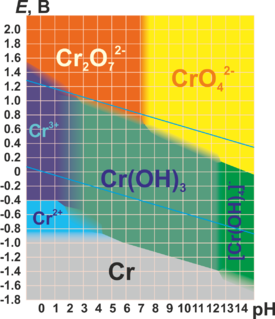
Kromium(III)[sunting | sunting sumber]


Terdapat panyak senyawa kromium(III) yang diketahui. Kromium(III) dapat diperoleh dengan melarutkan unsur kromium dalam asam seperti asam klorida atau asam sulfat. Ion Cr memiliki jari-jari 63 pm, hampir sama dengan Al (jari-jari 50 pm), dan mereka dapat saling menggantikan dalam beberapa senyawa seperti dalam krom alum dan alum. Jika sejumlah renik Cr menggantikan Al dalam korundum (aluminium oksida, Al, terbentuklah safir pink atau rubi, tergantung kandungan kromiumnya.
Ion kromium(III) cenderung membentuk kompleks oktahedral. Warna kompleks ini ditentukan oleh ligan yang menempel pada pusat Cr. Kromium(III) klorida hidrat yang tersedia di pasaran adalah kompleks [CrCl''"; yang berwarna hijau tua. Senyawa kerabat dekatnya memiliki warna yang berbeda: [CrCl(H''"; hijau pucat dan [Cr(H''"; ungu. Jika kromium(III) klorida bebas air yang berwarna hijau dilarutkan dalam air, larutan hijau berubah menjadi ungu setelah beberapa saat karena klorida dalam lingkungan koordinasi bagian dalam digantikan oleh air. Reaksi semacam ini juga teramati dengan larutan krom alum dan garam kromium(III) yang dapat larut dalam air lainnya.
Kromium(III) hidroksida (Cr(OH)) bersifat amfoter, melarutkannya dalam larutan asam membentuk [Cr(H''"; dan dalam larutan basa membentuk [Cr(OH)''";. Senyawa ini didehidrasi dengan pemanasan membentuk kromium(III) oksida (Cr) yang berwarna hijau, suatu oksida stabil dengan struktur kristal yang identik seperti yang terdapat pada korundum.[8]
Kromium(VI)[sunting | sunting sumber]

Kromium(VI) adalah oksidator kuat pada pH rendah atau netral. Anion terpenting adalah anion kromat (CrO) dan anion dikromat (Cr), yang berada dalam kesetimbangan:
Halida kromium(VI) juga diketahui dan termasuk heksafluorida CrF dan kromil klorida (CrO).[8]
Natrium kromat diproduksi dalam skala industri melalui pemanggangan oksidatif bijih kromit dengan kalsium atau natrium karbonat. Oleh karena itu, spesies dominan, berdasarkan hukum aksi massa, ditentukan oleh pH larutan. Perubahan dalam kesetimbangan tampak berdasarkan perubahan warna dari kuning (kromat) menjadi jingga (dikromat), seperti ketika asam ditambahkan ke dalam larutan netral kalium kromat. Pada pH yang lebih rendah lagi, dimungkinkan kondensasi lebih lanjut menjadi oksianion kromium yang lebih kompleks.
Baik anion kromat dan dikromat adalah oksidator kuat pada pH rendah:[8]

Namun, sifat oksidator mereka melemah pada pH tinggi:[8]
Senyawa kromium(VI) dalam larutan dapat dideteksi dengan menambahkan larutan asam hidrogen peroksida. Terbentuk kromium(VI) peroksida (CrO) berwarna biru tua yang tidak stabil, yang dapat distabilkan sebagai aduk eter CrO5·OR2.[8]
Asam kromat mempunyai rumus hipotetis H. Penjelasan ini masih sumir, meskipun banyak kromat dan dikromat yang diketahui telah didefinisikan dengan baik. Kromium(VI) oksida CrO yang berwarna merah tua, anhidrida asam dari asam kromat, dipasarkan dalam skala industri sebagai "asam kromat".[8] Ia dapat dibuat dengan mencampur asam sulfat dengan dikromat, dan merupakan suatu oksidator kuat.
Kromium(V) dan kromium(IV)[sunting | sunting sumber]
Keadaan oksidasi +5 hanya terdapat dalam beberapa senyawa tetapi merupakan zat antara dalam banyak reaksi yang melibatkan oksidasi dengan kromat. Satu-satunya senyawa biner adalah kromium(V) fluorida yang mudah menguap (CrF5). Padatan merah ini memiliki titik leleh 30 °C dan titik didih 117 °C. Ini dapat disiapkan dengan memberi perlakuan logam kromium dengan fluor pada suhu 400 °C dan tekanan 200 bar. Peroksokromat(V) adalah contoh lain dari keadaan oksidasi +5. Kalium peroksokromat (K) dibuat dengan mereaksikan kalium kromat dengan hidrogen peroksida pada suhu rendah. Senyawa merah coklat ini stabil pada suhu kamar namun terurai secara spontan pada 150–170 °C.[25]
Senyawa kromium(IV) (dengan tingkat oksidasi +4) sedikit lebih umum daripada kromium(V). Tetrahalidanya, CrF4, CrCl4, dan CrBr4, dapat diproduksi dengan memberi perlakukan trihalidanya (CrX3) dengan halogen yang sesuai pada suhu tinggi. Senyawa-senyawa tersebut rentan terhadap reaksi disproporsionasi dan tidak stabil dalam air.
Kromium(II)[sunting | sunting sumber]
Banyak senyawa kromium(II) yang diketahui, termasuk kromium(II) klorida, CrCl, yang stabil dalam air, dan dapat dibuat melalui reduksi kromium(III) klorida dengan seng. Larutan biru terang yang dihasilkan hanya stabil pada pH netral.[8] Banyak karboksilat kromo (nama trivial untuk ion kromium(II)) yang diketahui, terutama kromo asetat (Cr) yang berwarna merah dan memiliki ikatan kuadrupel.
Kromium(I)[sunting | sunting sumber]
Sebagian besar senyawa Cr(I) diperoleh melalui oksidasi kompleks Cr(0) oktahedral yang kaya elektron. Kompleks Cr(I) lainnya mengandung ligan siklopentadienil. Sesuai verifikasi menggunakan difraksi sinar-X, ikatan kuintupel Cr-Cr (panjang 183,51(4) pm) telah pula dideskripsikan.[26] Ligan monodentat yang sangat besar menstabilkan senyawa ini dengan melindungi ikatan kuintupel dari reaksi lebih lanjut.

Kromium(0)[sunting | sunting sumber]
Banyak senyawa kromium(0) yang diketahui. Sebagian besar adalah turunan kromium heksakarbonil atau bis(benzena)kromium.
Sejarah[sunting | sunting sumber]
Kromium ditemukan sebagai unsur setelah ia menarik perhatian dunia Barat dengan kristal mineral merahnya, krokoit (timbal(II) kromat), yang ditemukan pada tahun 1761 dan awalnya digunakan sebagai pigmen. Hampir semua kromium yang diekstraksi secara komersial berasal dari sumber tunggal, bijih kromit, yang merupakan besi kromium oksida (FeCr}). Kromit sekarang merupakan sumber utama kromium untuk pigmen.
Senjata yang ditemukan dalam lubang penguburan berasal dari Pasukan Terakota Dinasti Qin abad ke-3 SM di dekat Xi'an, China telah dianalisis oleh para arkeolog. Meskipun terkubur lebih dari 2.000 tahun, ujung perunggu kuno dari baut busur silang dan pedang yang ditemukan pada situs tersebut menunjukkan hanya sedikit korosi, mungkin karena perunggu sengaja disalut lapisan tipis kromium oksida.[27] Namun, lapisan oksida bukan logam kromium atau lapisan krom seperti yang kita ketahui saat ini.
Mineral kromium sebagai pigmen menarik perhatian dunia Barat pada abad ke-18. Pada 26 Juli 1761, Johann Gottlob Lehmann menemukan mineral merah-jingga dalam tambang Beryozovskoye di Pegunungan Ural yang ia namakan timbal merah Siberia. Meskipun disalahtafsirkan sebagai senyawa timbal dengan komponen selenium dan besi, mineral ini sebetulnya adalah krokoit (timbal kromat) dengan rumus PbCrO. [28]
Pada tahun 1770, Peter Simon Pallas mengunjungi situs yang sama seperti yang dikunjungi oleh Lehmann dan meemukan mineral timbal merah yang memiliki manfaat sebagai pigmen dalam cat. Penggunaan timbal merah Siberia sebagai pigmen cat kemudian berkembang pesat. Pigmen kuning cerah yang dibuat dari krokoit juga menjadi populer.[28]

Pada tahun 1797, Louis Nicolas Vauquelin menerima sampel bijih krokoit. Ia membuat kromium trioksida (CrO) dengan mencampur krokoit dengan asam klorida. Pada tahun 1798, Vauquelin menemukan bahwa ia dapat mengisolasi logam kromium dengan memanaskan oksidanya dalam oven batubara, sehingga ia dianugerahi sebagai penemu kromium.[29] Vauquelin juga mampu mendeteksi jejak kromium dalam batu permata berharga, seperti rubi atau zamrud.[28][30]
Selama tahun 1880an, kromium digunakan terutama sebagai komponen cat dan dalam garam penyamakan kulit. Pada mulanya, krokoit dari Rusia adalah sumber utama, tetapi pada tahun 1827, deposit kromit yang lebih besar ditemukan di dekat Baltimore, Amerika Serikat. Hal ini membuat Amerika Serikat sebagai produsen terbesar produk kromium sampai 1848 ketika deposit besar kromit ditemukan di dekat Bursa, Turki.[12]
Kromium juga dikenal karena kilaunya ketika dipoles. Ia digunakan sebagai penyalut untuk melindungi dan mempercantik bagian-bagian mobil, perlengkapan perpipaan, bagian-bagian furnitur, dan banyak barang lainnya, biasanya melalui aplikasi penyepuhan elektrik. Awal kromium digunakan untuk penyepuhan elektrik terjadi pada tahun 1848, tetapi penggunaan ini menjadi semakin meluas dengan perkembangan proses yang telah ditingkatkan pada tahun 1924.[31]
Produksi[sunting | sunting sumber]



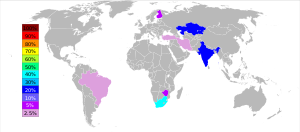
Sekitar 28,8 juta metrik ton (MT) bijih kromit yang dipasarkan diproduksi pada tahun 2013, dan yang diubah menjadi ferokromium sebanyak 7,5 MT.[33] Menurut John F. Papp, yang menulis untuk USGS:
Ferokromium adalah ujung akhir penggunaan bijih kromit, [dan] baja nirkarat adalah ujung akhir penggunaan ferokromium.[33]
Produser terbesar bijih kromium pada tahun 201 adalah Afrika Selatan (48%), Kazakhstan (13%), Turki (11%), India (10%) dengan beberapa negara lainnya yang memproduksi sekitar 18% dari produksi dunia.[33]
Dua produk utama pengolahan bijih kromium adalah ferokromium dan logam kromium. Untuk produk-produk tersebut, proses peleburan bijih tersebut sangat berbeda. Untuk produksi ferokromium, bijih kromit (FeCr) direduksi dalam skala besar dalam tungku busur listrik atau peleburan yang lebih kecil dengan baik aluminium maupun silikon dalam suatu reaksi aluminotermik.[34]
Untuk produksi kromium murni, besi harus dipisahkan dari kromium dalam dua tahap proses pemanggangan dan pelindian (leaching). Bijih kromit dipanaskan dengan campuran kalsium karbonat dan natrium karbonat dengan adanya udara. Kromium dioksidasi menjadi bentuk heksavalennya, sementara besi membentuk Fe yang stabil. Pelindian selanjutnya pada suhu yang lebih tinggi melarutkan kromat dan meninggalkan oksida besi yang tidak larut. Kromat diubah menjadi dikromat menggunakan asam sulfat.[34]
Dikromat dikonversi menjadi kromium(III) oksida melalui reduksi dengan karbon dan kemudian direduksi dalam suatu reaksi aluminotermik menjadi kromium.[34]
Aplikasi[sunting | sunting sumber]
Paduan logam mencakup 85% dari total penggunaan kromium. Sisanya digunakan dalam industri bahan kimia, refraktori, dan pabrik peleburan logam (Inggris: foundry).
Metalurgi[sunting | sunting sumber]

Efek penguatan dari pembentukan karbida logam stabil pada batas butir dan kenaikan daya tahan korosi membuat kromium menjadi bahan paduan yang penting untuk baja. Peralatan baja kecepatan tinggi mengandung antara 3 dan 5% kromium. Baja nirkarat, paduan logam tahan korosi utama, terbentuk ketika kromium ditambahkan pada besi dalam konsentrasi cukup, biasanya di atas 11%. Untuk pembentukannya, ferokromium ditambahkan ke besi cair. Selain itu, paduan berbasis nikel meningkatkan kekuatan karena pembentukan partikel karbida logam yang diskrit dan stabil pada batas butir. Misalnya, Inconel 718 mengandung kromium 18,6%. Mereka digunakan dalam mesin jet dan turbin gas sebagai pengganti bahan struktural umum, karena sifat suhu tinggi yang sangat baik dari nikel superaloy ini.[35]
Kekerasan yang relatif tinggi dan ketahanan korosi dari kromium murni membuatnya menjadi penyalut permukaan yang baik, saat ini masih merupakan salutan logam yang paling "populer" dengan daya tahan kombinasi yang tak tertandingi. Lapisan tipis kromium diendapkan pada permukaan logam yang telah diolah dengan teknik penyepuhan elektrik. Ada dua metode pengendapan: Tipis, ketebalan di bawah 1 μm, lapisan diendapkan oleh penyepuhan krom, dan digunakan untuk permukaan dekoratif. Jika dibutuhkan permukaan tahan aus maka lapisan kromium yang lebih tebal diendapkan. Kedua metode tersebut biasanya menggunakan larutan asam kromat atau dikromat. Untuk mencegah perubahan konsumsi energi pada keadaan oksidasi, penggunaan kromium(III) sulfat sedang dikembangkan, namun untuk sebagian besar aplikasi, digunakan proses yang telah mapan.[31]
Dalam proses salutan konversi kromat, sifat oksidatif kuat dari kromat digunakan untuk mendepositkan lapisan oksida pelindung pada logam seperti aluminium, seng dan kadmium. Pasivasi dan sifat penyembuhan diri oleh kromat yang tersimpan dalam salutan konversi kromat, yang dapat bermigrasi ke kerusakan lokal, merupakan keuntungan dari metode pelapisan ini.[36] Sedang dikembangkan metode penyalutan alternatif, karena peraturan lingkungan dan kesehatan pada kromat.[37]
Penganodaan asam kromat (penganodaan Type I) aluminium adalah proses elektrokimia lainnya, yang tidak menyebabkan deposisi kromium, tetapi menggunakan asam kromat sebagai elektrolit dalam larutan. Selama penganodaan, lapisan oksida terbentuk pada permukaan aluminium. Penggunaan asam kromat, dan bukannya asam sulfat seperti biasanya, menyebabkan sedikit perbedaan pada lapisan oksida ini.[38]
Toksisitas tinggi dari senyawa Cr(VI), yang digunakan dalam proses penyepuhan elektrik, dan penguatan regulasi keamanan dan keselamatan perlu dicari pengganti untuk kromium atau setidaknya mengubahnya ke senyawa kromium(III) yang kurang toksik.[31]
Pewarna dan pigmen[sunting | sunting sumber]

Mineral krokoit (timbal kromat PbCrO) digunakan sebagai pigmen kuning segera setelah penemuannya. Setelah metode sintesis tersedia sejak melimpahnya kromit, kuning krom, bersama dengan kuning kadmium, menjadi salah satu pigmen kuning yang paling banyak digunakan. Pigmen tidak mengalamai fotodegradasi, tetapi cenderung menggelap karena pembentukan kromium(III) oksida. Ia memiliki warna yang kuat, dan digunakan untuk bus sekolah di AS dan untuk layanan pos (misalnya Deutsche Post) di Eropa. Penggunaan kuning krom ditolak dengan alasan lingkungan dan keselamatan dan digantikan oleh pigmen organik atau alternatif yang bebas dari timbal dan kromium. Pigmen lain berbasis kromium adalah, misalnya, pigmen merah cerah merah krom, yang merupakan timbal kromat basa (PbCrO). Pigmen kromat yang sangat penting, yang pernah digunakan luas dalam formulasi cat dasar logam, adalah seng kromat, sekarang digantikan oleh seng fosfat. Sebuah cat dasar diformulasikan untuk menggantikan praktik berbahaya dari perawatan badan pesawat aluminium dengan larutan asam fosfat. Teknik ini menggunakan seng tetroksikromat yang terdispersi dalma larutan polivinil butiral. Suatu larutan 8% asam fosfat dalam larutan ditambahkan segera sebelum aplikasi. Ditemukan bahwa alkohol yang mudah teroksidasi adalah bahan ramuan penting. Suatu lapisan tipis sekitar 10–15 µm diaplikasikan, yang berubah dari kuning menjadi hijau tua ketika sudah pulih. Tetap masih ada pertanyaan terkait mekanisme yang benar. Hijau krom adalah campuran biru Prusia dan kuning krom, sementara hijau krom oksida adalah kromium(III) oksida.[40]
Oksida kromium juga digunakan sebagai pewarna hijau dalam pembuatan kaca dan sebagai glasir pada keramik.[41] Kromium oksida hijau sangat ringan dan seperti digunakan pada penyalut selongsong. Ia juga merupakan ingredien utama dalam cat reflektor inframerah, yang digunakan oleh pasukan bersenjata, untuk mencat kendaraan, untuk memberikan reflektansi IR yang serupa dengan daun hijau.[42]
Rubi sintetis dan laser pertama[sunting | sunting sumber]
Rubi alami adalah kristal korundum (aluminium oksida) yang berwarna merah (jenis paling langka) karena adanya ion kromium(III) (permata korundum berwarna lain disebut safir). Rubi buatan berwarna merah dapat juga diperoleh melalui doping kromium(III) ke dalam kristal korundum buatan, sehingga membaut kromium suatu syarat untuk pembuatan rubi sintetis.[43] Kristal rubi sintetis semacam ini adalah dasar untuk laser pertama, diproduksi tahun 1960, yang bergantung pada emisi terstimulasi cahaya dari atom kromium dalam kristal tersebut.
Pengawet kayu[sunting | sunting sumber]
Garam kromium(VI) digunakan untuk pengawet kayu karena toksisitasnya. Sebagai contoh, tembaga arsenat terkromasi (chromated copper arsenate, CCA) digunakan dalam pengolahan kayu untuk melindungi kayu dari pelapukan jamur, serangga yang menyerang kayu, termasuk rayap, dan penggerek laut.[44] Formulasinya mengandung kromium berbasis oksida CrO3 antara 35,3% dan 65,5%. Di Amerika Serikat, 65.300 metrik ton larutan CCA digunakan pada tahun 1996.[44]
Penyamakan[sunting | sunting sumber]
Garam kromium(III), terutama alum krom dan kromium(III) sulfat, digunakan dalam penyamakan kulit. Kromium(III) menstabilkan kulit dengan mengikat silang serat kolagen.[45] Kulit yang disamak dengan kromium mengandung antara 4 dan 5% kromium, yang berikatan kuat dengan protein.[12] Meskipun bentuk kromium yang digunakan untuk menyamak bukanlah varietas heksavalen yang toksik, tetap ada minat dalam mengelola kromium dalam industri penyamakan seperti perolehan kembali dan penggunaan ulang, daur ulang langsung/tak langsung,[46] menggunakan sedikit kromium atau penyamakan "nirkrom" dilakukan untuk pengelolaan kromium yang lebih baik dalam penyamakan.
Bahan refraktori[sunting | sunting sumber]
Ketahanan terhadap panas yang tinggi dan tingginya titik lebur menjadikan kromit dan kromium(III) oksida suatu bahan untuk aplikasi refraktori suhu tinggi, seperti tanur tinggi, tanur semen, cetakan untuk membakar batu bata dan pasir peleburan untuk pengecoran logam. Pada aplikasi ini, bahan refraktori dibuat dari campuran kromit dan magnesit. Penggunaannya menurun karena regulasi lingkungan tentang kemungkinan pembentukan kromium(VI).[34]
Katalis[sunting | sunting sumber]
Beberapa senyawa kromium digunakan sebagai katalis untuk pengolahan hidrokarbon. Contohnya, katlis Phillips, dibuat dari oksida kromium, digunakan untuk produksi sekitar setengah polietilena dunia.[47] Oksida campuran Fe-Cr digunakan sebagai katalis suhu tinggu untuk reaksi pergeseran gas air.[48][49] Tembaga kromit adalah katalis hidrogenasi yang berguna.[50]
Kegunaan lain[sunting | sunting sumber]
- Kromium(IV) oksida (CrO2) adalah senyawa magnetik. Bentuk idealnya anisotropi, yang memberikan koersivitas tinggi dan sisa magnetisasi, membuatnya sebagai senyawa superior terhadap γ-Fe. Kromium(IV) oksida digunakan untuk pabrikasi pita magnetik yang digunakan dalam pita audio kinerja tinggi dan kaset audio.[51] Kromat dapat mencegah korosi baja pada kondisi basah, dan oleh karena itu kromat ditambahkan pada lumpur pengeboran.[52]
- Kromium(III) oksida (Cr) adalah logam poles yang dikenal sebagai rona hijau.[53]
- Asam kromat adalah oksidator kuat dan senyawa yang berguna untuk membersihkan peralatan gelas laboratorium dari senyawa organik renik apapun. Ia disiapkan dengan melarutkan kalium dikromat dalam asam sulfat pekat, yang kemudian digunakan untuk membilas peralatan. Natrium dikromat kadang-kadang digunakan karena kelarutannya yang lebih tinggi (masing-masing 50 g/L vs 200 g/L). Penggunaan larutan pembersih dikromat sekarang sudah dihapus karena toksisitasnya yang tinggi dan masalah lingkungan. Larutan pembersih modern sangat efektif dan bebas kromium.
- Kalium dikromat adalah pereaksi kimia, yang digunakan untuk titrasi.
- Alum krom adalah kromium(III) kalium sulfat dan digunakan sebagai mordan (yaitu zat fiksasi) untuk pewarna kain dan penyamakan.
Peran biologis[sunting | sunting sumber]
Dalam bentuk kromium trivalen, Cr(III), atau Cr3+, kromium diidentifikasi sebagai nutrisi esensial pada akhir tahun 1950an dan kemudian diterima sebagai unsur renik untuk perannya dalam aksi insulin, hormon penting untuk metabolisme dan penyimpanan karbohidrat, lemak dan protein.[6][54] Namun, mekanisme tepatnya dalam tubuh belum sepenuhnya didefinisikan, meninggalkan pertanyaan apakah kromium penting untuk kesehatan manusia.[6][55][56][57]
Kromium trivalen terdapat dalam jumlah renik pada makanan, minuman anggur dan air.[6][58] Sebaliknya, kromium heksavalen (Cr(VI) atau Cr6+ sangat beracun dan merupakan mutagen jika terhirup.[59] Menghirup kromium(VI) dalam air telah dikaitkan dengan tumor lambung, dan juga dapat menyebabkan alergi dermatitis kontak (allergic contact dermatitis, ACD).[60]
Defisiensi kromium, yang melibatkan kekurangan Cr(III) di dalam tubuh, atau mungkin beberapa kompleknya, seperti faktor toleransi glukosa masih kontroversial.[6] Beberapa penelitian menunjukkan bahwa kromium(III) bentuk aktif biologis dalam oligopeptida disebut zat pengikat kromium berat molekul rendah (low-molecular-weight chromium-binding substance, LMWCr), yang mungkin berperan dalam jalur pensinyalan insulin.[61]
Meskipun mekanisme kromium dalam peran biologis tidak jelas, suplemen diet kromium meliputi kromium(III) pikolinat, kromium(III) polinikotinat, dan zat terkait.[6] Manfaat suplemen-suplemen tersebut belum terbukti.[6][62]
Di Amerika Serikat, panduan diet untuk asupan kromium harian pada 2001 cukup rendah, mulai 50-200 µg untuk dewasa hingga 35 µg (pria dewasa) dan 25 µg (wanita dewasa).[6][63] Pada tahun 2014, Otoritas Keamanan Pangan Eropa (European Food Safety Authority) menerbitkan laporan yang menyatakan bahwa asupan kromium(III) tidak memiliki manfaat pada kesehatan manusia, sehingga Panel menghilangkan kromium dari daftar unsur nutrisi dan esensial.[61][55]
Kandungan kromium dalam makanan umumnya rendah (1-13 mikrogram per porsi).[6][64] Kandungan kromium makanan sangat bervariasi karena perbedaan kandungan mineral tanah, musim tanam, kultivar tanaman, dan kontaminasi selama pemrosesan.[64] Sebagai tambahan, sejumlah besar kromium (dan nikel) larut ke dalam makanan yang dimasak dengan stainless steel.[65][66]
Angka kebutuhan gizi[sunting | sunting sumber]
Badan Makanan dan Gizi dari Lembaga Kedokteran AS memperbarui Estimasi Kebutuhan Rata-rata (Estimated Average Requirements, EARs) dan Angka Kebutuhan Gizi (AKG) pada tahun 2001. Untuk kromium, tidak ada informasi yang memadai untuk menentukan EAR dan AKG, sehingga perlu dipaparkan sebagai perkiraan untuk Kecukupan Asupan (Adequate Intake, AI). AI saat ini untuk kromium untuk wanita berusia 14-50 tahun adalah 25 μg/hari dan 20 μg/hari untuk di atas 50 tahun. AI untuk wanita hamil adalah 30 μg/hari. AKG untuk ibu menyusui adalah 45 μg/hari. Untuk pria berusia 14-50 tahun adalah 35 μg/hari dan 30 μg/hari untuk pria di atas 50 tahun. Untuk bayi dan anak-anak berusia 1-13 tahun AI meningkat sesuai umur dari 0,2 sampai 25 μg/hari. Demi keamanan, Badan Makanan dan Gizi juga menentukan Batas Atas Asupan yang dapat ditoleransi (dikenal sebagai UL) untuk vitamin dan mineral jika terdapat bukti-bukti yang mencukupi. Dalam kasus kromium, belum ada informasi yang mencukupi dan oleh karenanya tidak ada UL. Secara kolektif, EAR, AKG, AI dan UL dirujuk sebagai Angka Kebutuhan Gizi.[67] Otoritas Keamanan Pangan Eropa meninjau pertanyaan terkait keamanan pangan yang sama dan tidak menetapkan UL.[68] Organisasi Kesehatan Dunia (WHO) menetapkan UL tentatif pada 250 μg/hari. Di Amerika Serikat banyak perusahaan suplemen makanan menawarkan produk kromium 200 sampai 800 μg/hari. Produk multivitamin/mineral cenderung mengandung 120 μg kromium per tablet karena sampai saat ini itulah 100% nilai harian (lihat di bawah).
Untuk suplemen makanan A.S., jumlah per porsi disajikan sebagai persentase Nilai Harian (%DV). Untuk tujuan pelabelan kromium, 100% dari Nilai Harian adalah 120 μg, namun pada Mei 2016 telah direvisi menjadi 35 μg. Perusahaan makanan dan suplemen memiliki tenggat sampai 28 Juli 2018 untuk mematuhi perubahan tersebut.
Tindakan pencegahan[sunting | sunting sumber]
Senyawa kromium(III) dan logam kromium yang tidak larut dianggap tidak membahayakan kesehatan, sementara toksisitas dan sifat karsinogenik kromium(VI) telah lama diketahui.[69] Kromium(III) memasuki sel hanya dalam jumlah terbatas, kerana mekanisme transport spesifik. Beberapa studi in vitro menandakan bahwa tingginya konsentrasi kromium(III) dalam sel dapat menyebabkan kerusakan DNA.[70] Toksisitas oral akut berkisar antara 1,5 dan 3,3 mg/kg.[71] Tinjauan tahun 2008 menyarankan bahwa asupan moderat kromium(III) melalui suplemen makanan tidak memicu risiko keracunan genetik.[70] Administrasi Keselamatan dan Kesehatan Kerja (OSHA) di AS telah menetapkan batas paparan yang diizinkan (permissible eposure limit, PEL) di tempat kerja sebagai rata-rata tertimbang waktu (time-weighted average, TWA) sebesar 1 mg/m3. National Institute for Occupational Safety and Health (NIOSH) telah menetapkan batas paparan yang direkomendasikan (recommended exposure limit, REL) sebesar 0,5 mg/m3, rata-rata tertimbang waktu. Nilai IDLH (immediately dangerous to life and health) adalah 250 mg/m3.[72]Senyawa kromium(III) dan logam kromium yang tidak larut dianggap tidak membahayakan kesehatan, sementara toksisitas dan sifat karsinogenik kromium(VI) telah lama diketahui.[69] Kromium(III) memasuki sel hanya dalam jumlah terbatas, kerana mekanisme transport spesifik. Beberapa studi in vitro menandakan bahwa tingginya konsentrasi kromium(III) dalam sel dapat menyebabkan kerusakan DNA.[70] Toksisitas oral akut berkisar antara 1,5 dan 3,3 mg/kg.[71] Tinjauan tahun 2008 menyarankan bahwa asupan moderat kromium(III) melalui suplemen makanan tidak memicu risiko keracunan genetik.[70] Administrasi Keselamatan dan Kesehatan Kerja (OSHA) di AS telah menetapkan batas paparan yang diizinkan (permissible eposure limit, PEL) di tempat kerja sebagai rata-rata tertimbang waktu (time-weighted average, TWA) sebesar 1 mg/m3. National Institute for Occupational Safety and Health (NIOSH) telah menetapkan batas paparan yang direkomendasikan (recommended exposure limit, REL) sebesar 0,5 mg/m3, rata-rata tertimbang waktu. Nilai IDLH (immediately dangerous to life and health) adalah 250 mg/m3.[73]
Cr(VI)[sunting | sunting sumber]
Toksisitas oral akut untuk kromium(VI) berkisar antara 50 dan 150 µg/kg.[71] Di dalam tubuh, kromium(VI) direduksi melalui beberapa mekanisme menjadi kromium(III) yang sudah ada dalam darah sebelum memasuki sel. Kromium(III) diekskresikan dari dalam tubuh, sementara ion kromat ditransfer ke dalam sel melalui mekanisme transport, bersamaan dengan masuknya ion sulfat dan fosfat ke dalam sel. Toksisitas akut kromium(VI) karena sifat oksidator kuatnya. Setelah memasuki aliran darah, ia akan menghancurkan ginjal, liver dan sel darah melalui reaksi oksidasi. Hasilnya adalah hemolisis, kegagalan ginjal dan liver. Dialisis agresif dapat dijadikan pengobatannya.[74]
Karsinogenitas debu kromat telah diketahui sejak lama, dan pada tahun 1890 publikasi pertama menjelaskan peningkatan risiko kanker pada pekerja perusahaan pewarna kromat.[75][76] Tiga mekanisme diusulkan untuk menjelaskan genotoksisitas kromium(VI). Mekanisme pertama mencakup radikal hidroksil yang sangat reaktif dan radikal reaktif lainnya yang merupakan produk sampingan reduksi kromium(VI) ke kromium(III). Proses kedua menckup pengikatan langsung senyawa kromium(V), yang dihasilkan melalui reduksi dalam sel, dan kromium(IV) pada DNA. Mekanisme terakhir terkait genotoksisitas dengan ikatan DNA dengan produk akhir reduksi kromium(III).[77][78]
Garam kromium (kromat) juga penyebab reaksi alergi pada beberapa orang. Kromat sering digunakan untuk manufaktur, antara lain, produk kulit, cat, semen, mortar dan anti korosi. Kontak dengan produk yang mengandung kromat dapat menyebabkan alergi dermatitis kontak dan dermatitis iritasi. yang menghasilkan koreng pada kulit, kadang-kadang disebut sebagai "koreng krom". Kondisi ini sering dijumpai pada pekerja yang telah terpapar larutan kromat kuat pada penyepuhan elektrik, penyamakan, dan pabrik yang menghasilkan krom.[79][80]
Masalah lingkungan[sunting | sunting sumber]
Senyawa kromium sering ditemukan di dalam tanah dan air tanah pada situs industri yang sudah tak terpakai, karena senyawa kromium pernah digunakan dalam senyawa pewarna, cat, dan penyamak kulit. Saat ini, diperlukan pembersihan dan remediasi lingkungan. Cat dasar yang mengandung kromium heksavalen masih banyak digunakan untuk aplikasi finishing pesawat terbang dan mobil.[81]
Pada tahun 2010, Kelompok Kerja Lingkungan mempelajari air minum di 35 kota Amerika dalam rangka studi nasional pertama. Studi tersebut menemukan kromium heksavalen dalam air keran di 31 kota yang disampel, dengan Norman, Oklahoma menempati urutan teratas; 25 kota memiliki tingkat yang melebihi batas yang diusulkan oleh California.[82] Konsentrasi Cr(VI) dalam pasokan air minum kota AS, dilaporkan oleh EWG, tidak mengindikasikan adanya polusi industri.[83] Faktor ini tidak menjadi perhatian laporan EWG.
Catatan[sunting | sunting sumber]
- ^ Tingkat oksidasi kromium paling umum ditebalkan. Kolom sebelah kanan mencantumkan contoh senyawa untuk masing-masing tingkat oksidasi.
Referensi[sunting | sunting sumber]
- ^ (Indonesia) "Kromium". KBBI Daring. Diakses tanggal 17 Juli 2022.
- ^ a b Fawcett, Eric (1988). "Spin-density-wave antiferromagnetism in chromium". Reviews of Modern Physics. 60: 209. Bibcode:1988RvMP...60..209F. doi:10.1103/RevModPhys.60.209.
- ^ Weast, Robert (1984). CRC, Handbook of Chemistry and Physics. Boca Raton, Florida: Chemical Rubber Company Publishing. hlm. E110. ISBN 0-8493-0464-4.
- ^ Brandes, E. A.; Greenaway, H. T.; Stone, H. E. N. (1956). "Ductility in Chromium". Nature. 178 (587): 587. Bibcode:1956Natur.178..587B. doi:10.1038/178587a0.
- ^ χρῶμα, Henry George Liddell, Robert Scott, A Greek-English Lexicon, on Perseus
- ^ a b c d e f g h i "Chromium". Office of Dietary Supplements, US National Institutes of Health. 2016. Diakses tanggal 26 June 2016.
- ^ Wallwork, G. R. (1976). "The oxidation of alloys". Reports on the Progress Physics. 39 (5): 401–485. Bibcode:1976RPPh...39..401W. doi:10.1088/0034-4885/39/5/001.
- ^ a b c d e f g h Holleman, Arnold F.; Wiberg, Egon; Wiberg, Nils (1985). "Chromium". Lehrbuch der Anorganischen Chemie (dalam bahasa German) (edisi ke-91–100). Walter de Gruyter. hlm. 1081–1095. ISBN 3-11-007511-3.
- ^ National Research Council (U.S.). Committee on Coatings (1970). High-temperature oxidation-resistant coatings: coatings for protection from oxidation of superalloys, refractory metals, and graphite. National Academy of Sciences. ISBN 0-309-01769-6.
- ^ Emsley, John (2001). "Chromium". Nature's Building Blocks: An A-Z Guide to the Elements. Oxford, England, UK: Oxford University Press. hlm. 495–498. ISBN 0-19-850340-7.
- ^ Rieuwerts, J. (2015), The Elements of Environmental Pollution, Abingdon and New York: Routledge
- ^ a b c National Research Council (U.S.). Committee on Biologic Effects of Atmospheric Pollutants (1974). Chromium. National Academy of Sciences. hlm. 155. ISBN 978-0-309-02217-0.
- ^ Papp, John F. "Commodity Summary 2009: Chromium" (PDF). United States Geological Survey. Diakses tanggal 2009-03-17.
- ^ Fleischer, Michael (1982). "New Mineral Names" (PDF). American Mineralogist. 67: 854–860.
- ^ "Chromium (with location data)", Mindat
- ^ "Chromium from Udachnaya-Vostochnaya pipe, Daldyn, Daldyn-Alakit kimberlite field, Saha Republic (Sakha Republic; Yakutia), Eastern-Siberian Region, Russia", Mindat
- ^ a b Kotaś, J.; Stasicka, Z. (2000). "Chromium occurrence in the environment and methods of its speciation". Environmental Pollution. 107 (3): 263–283. doi:10.1016/S0269-7491(99)00168-2. PMID 15092973.
- ^ Gonzalez, A. R.; Ndung'u, K.; Flegal, A. R. (2005). "Natural Occurrence of Hexavalent Chromium in the Aromas Red Sands Aquifer, California". Environmental Science and Technology. 39 (15): 5505–5511. Bibcode:2005EnST...39.5505G. doi:10.1021/es048835n. PMID 16124280.
- ^ a b Georges, Audi; Bersillon, O.; Blachot, J.; Wapstra, A. H. (2003). "The NUBASE Evaluation of Nuclear and Decay Properties". Nuclear Physics A. Atomic Mass Data Center. 729: 3–128. Bibcode:2003NuPhA.729....3A. doi:10.1016/j.nuclphysa.2003.11.001.
- ^ 53Mn Diarsipkan 2017-07-12 di Wayback Machine.. Chart of Nuclides. nndc.bnl.gov
- ^ Birck, J. L.; Rotaru, M.; Allegre, C. (1999). "53Mn-53Cr evolution of the early solar system". Geochimica et Cosmochimica Acta. 63 (23–24): 4111–4117. Bibcode:1999GeCoA..63.4111B. doi:10.1016/S0016-7037(99)00312-9.
- ^ Frei, Robert; Gaucher, Claudio; Poulton, Simon W.; Canfield, Don E. (2009). "Fluctuations in Precambrian atmospheric oxygenation recorded by chromium isotopes". Nature. 461 (7261): 250–253. Bibcode:2009Natur.461..250F. doi:10.1038/nature08266. PMID 19741707.
- ^ a b Greenwood, Norman N.; Earnshaw, A. (1997), Chemistry of the Elements (edisi ke-2), Oxford: Butterworth-Heinemann, ISBN 0-7506-3365-4
- ^ Puigdomenech, Ignasi Hydra/Medusa Chemical Equilibrium Database and Plotting Software Diarsipkan 5 June 2013 di Wayback Machine. (2004) KTH Royal Institute of Technology
- ^ Haxhillazi, Gentiana (2003). "Preparation, Structure and Vibrational Spectroscopy of Tetraperoxo Complexes of CrV+, VV+, NbV+ and TaV+". PhD thesis, University of Siegen.
- ^ Nguyen, T.; et al. (2005). "Synthesis of a Stable Compound with Fivefold Bonding Between Two Chromium(I) Centers". Science. 310 (5749): 844–847. Bibcode:2005Sci...310..844N. doi:10.1126/science.1116789. PMID 16179432.
- ^ Cotterell, Maurice (2004), The Terracotta Warriors: The Secret Codes of the Emperor's Army, Rochester: Bear and Company, ISBN 1-59143-033-X
- ^ a b c Guertin, Jacques; Jacobs, James Alan & Avakian, Cynthia P. (2005). Chromium (VI) Handbook. CRC Press. hlm. 7–11. ISBN 978-1-56670-608-7.
- ^ Vauquelin, Louis Nicolas (1798). "Memoir on a New Metallic Acid which exists in the Red Lead of Sibiria". Journal of Natural Philosophy, Chemistry, and the Art. 3: 146.
- ^ van der Krogt, Peter. "Chromium". Diakses tanggal 2008-08-24.
- ^ a b c Dennis, J. K.; Such, T. E. (1993). "History of Chromium Plating". Nickel and Chromium Plating. Woodhead Publishing. hlm. 9–12. ISBN 978-1-85573-081-6.
- ^ Papp, John F. "Mineral Yearbook 2002: Chromium" (PDF). United States Geological Survey. Diakses tanggal 2009-02-16.
- ^ a b c Papp, John F. "Mineral Yearbook 2015: Chromium" (PDF). United States Geological Survey. Diakses tanggal 2015-06-03.
- ^ a b c d Papp, John F. & Lipin, Bruce R. (2006). "Chromite". Industrial Minerals & Rocks: Commodities, Markets, and Uses (edisi ke-7th). SME. ISBN 978-0-87335-233-8.
- ^ Bhadeshia, H. K. D. H. "Nickel-Based Superalloys". University of Cambridge. Diarsipkan dari versi asli tanggal 2006-08-25. Diakses tanggal 2009-02-17.
- ^ Edwards, Joseph (1997). Coating and Surface Treatment Systems for Metals. Finishing Publications Ltd. and ASMy International. hlm. 66–71. ISBN 0-904477-16-9.
- ^ Zhao, J.; Xia, L.; Sehgal, A.; Lu, D.; McCreery, R. L.; Frankel, G. S. (2001). "Effects of chromate and chromate conversion coatings on corrosion of aluminum alloy 2024-T3". Surface and Coatings Technology. 140 (1): 51–57. doi:10.1016/S0257-8972(01)01003-9. Diarsipkan dari versi asli tanggal 20 July 2011.
- ^ Sprague, J. A.; Smidt, F. A. (1994). ASM Handbook: Surface Engineering. ASM International. ISBN 978-0-87170-384-2. Diakses tanggal 2009-02-17.
- ^ Worobec, Mary Devine; Hogue, Cheryl (1992). Toxic Substances Controls Guide: Federal Regulation of Chemicals in the Environment. Washington, D.C.: BNA Books. hlm. 13. ISBN 978-0-87179-752-0.
- ^ Gettens, Rutherford John (1966). "Chrome yellow". Painting Materials: A Short Encyclopaedia. Courier Dover Publications. hlm. 105–106. ISBN 978-0-486-21597-6.
- ^ Gerd Anger; et al. (2005), "Chromium Compounds", Ullmann's Encyclopedia of Industrial Chemistry, Weinheim: Wiley-VCH, doi:10.1002/14356007.a07_067
- ^ Marrion, Alastair (2004). The chemistry and physics of coatings. Royal Society of Chemistry. hlm. 287–. ISBN 978-0-85404-604-1.
- ^ Moss, S. C.; Newnham, R. E. (1964). "The chromium position in ruby" (PDF). Zeitschrift für Kristallographie. 120 (4–5): 359–363. Bibcode:1964ZK....120..359M. doi:10.1524/zkri.1964.120.4-5.359.
- ^ a b Hingston, J.; et al. (2001). "Leaching of chromated copper arsenate wood preservatives: a review". Environmental Pollution. 111 (1): 53–66. doi:10.1016/S0269-7491(00)00030-0. PMID 11202715.
- ^ Brown, E. M. (1997). "A Conformational Study of Collagen as Affected by Tanning Procedures". Journal of the American Leather Chemists Association. 92: 225–233.
- ^ Sreeram, K.; Ramasami, T. (2003). "Sustaining tanning process through conservation, recovery and better utilization of chromium". Resources, Conservation and Recycling. 38 (3): 185–212. doi:10.1016/S0921-3449(02)00151-9.
- ^ Weckhuysen, Bert M.; Schoonheydt, Robert A. (1999). "Olefin polymerization over supported chromium oxide catalysts". Catalysis Today. 51 (2): 215–221. doi:10.1016/S0920-5861(99)00046-2.
- ^ Twigg, M. V. E. (1989). "The Water-Gas Shift Reaction". Catalyst Handbook. ISBN 978-0-7234-0857-4.
- ^ Rhodes, C.; Hutchings, G. J.; Ward, A. M. (1995). "Water-gas shift reaction: Finding the mechanistic boundary". Catalysis Today. 23: 43–58. doi:10.1016/0920-5861(94)00135-O.
- ^ Lazier, W.A.; Arnold, H.R. (1939). "Copper Chromite Catalyst". Org. Synth. 19: 31; Coll. Vol. 2: 142.
- ^ Mallinson, John C. (1993). "Chromium Dioxide". The foundations of magnetic recording. Academic Press. ISBN 978-0-12-466626-9.
- ^ Garverick, Linda (1994). Corrosion in the Petrochemical Industry. ASM International. ISBN 978-0-87170-505-1.
- ^ Baral, Anil; Engelken, Robert D. (2002). "Chromium-based regulations and greening in metal finishing industries in the USA". Environmental Science & Policy. 5 (2): 121–133. doi:10.1016/S1462-9011(02)00028-X.
- ^ Anderson, R. A. (1997). "Chromium as an Essential Nutrient for Humans". Regulatory Toxicology and Pharmacology. 26 (1 Pt 2): S35–S41. doi:10.1006/rtph.1997.1136. PMID 9380836.
- ^ a b European Food Safety Authority (2014). "Scientific Opinion on Dietary Reference Values for chromium". EFSA Journal. 12 (10): 3845. doi:10.2903/j.efsa.2014.3845.
- ^ Vincent, John B. (2013). "Chapter 6. Chromium: Is It Essential, Pharmacologically Relevant, or Toxic?". Dalam Astrid Sigel; Helmut Sigel; Roland K. O. Sigel. Interrelations between Essential Metal Ions and Human Diseases. Metal Ions in Life Sciences. 13. Springer. hlm. 171–198. doi:10.1007/978-94-007-7500-8_6.
- ^ Bona, Kristin R.; Love, Sharifa; Rhodes, Nicholas R.; McAdory, Deana; Sinha, Sarmistha Halder; Kern, Naomi; Kent, Julia; Strickland, Jessyln; Wilson, Austin; Beaird, Janis; Ramage, James; Rasco, Jane F.; Vincent, John B. (2011). "Chromium is not an essential trace element for mammals: Effects of a "low-chromium" diet". JBIC Journal of Biological Inorganic Chemistry. 16 (3): 381–90. doi:10.1007/s00775-010-0734-y. PMID 21086001.
- ^ Mertz, Walter (1 April 1993). "Chromium in Human Nutrition: A Review". Journal of Nutrition. 123 (4): 626–33. PMID 8463863.
- ^ Wise, Sandra S.; Wise, J. P., Sr (2012). "Chromium and genomic stability". Mutation Research/Fundamental and Molecular Mechanisms of Mutagenesis. 733 (1–2): 78–82. doi:10.1016/j.mrfmmm.2011.12.002. PMC 4138963
 . PMID 22192535.
. PMID 22192535.
- ^ "ToxFAQs: Chromium". Agency for Toxic Substances & Disease Registry, Centers for Disease Control and Prevention. February 2001. Diarsipkan dari versi asli tanggal 2014-07-08. Diakses tanggal 2007-10-02.
- ^ a b Vincent, J. B. (17 January 2015). "Is the Pharmacological Mode of Action of Chromium(III) as a Second Messenger?". Biological trace element research. 166 (1): 7–12. doi:10.1007/s12011-015-0231-9. PMID 25595680.
- ^ Vincent, John B. (2010). "Chromium: Celebrating 50 years as an essential element?". Dalton Transactions. 39 (16): 3787–94. doi:10.1039/B920480F. PMID 20372701.
- ^ Vincent, J. B. (2007). "Recent advances in the nutritional biochemistry of trivalent chromium". Proceedings of the Nutrition Society. 63 (1): 41–47. doi:10.1079/PNS2003315. PMID 15070438.
- ^ a b Thor MY; Harnack L; King D; Jasthi B; Pettit J (Dec 2011). "Evaluation of the comprehensiveness and reliability of the chromium composition of foods in the literature". J Food Compost Anal. 24 (8): 1147–1152. doi:10.1016/j.jfca.2011.04.006. PMC 3467697
 . PMID 23066174.
. PMID 23066174.
- ^ Kamerud KL; Hobbie KA; Anderson KA (Aug 28, 2013). "Stainless Steel Leaches Nickel and Chromium into Foods During Cooking". J Agric Food Chem. 61 (39): 9495–501. doi:10.1021/jf402400v. PMC 4284091
 . PMID 23984718.
. PMID 23984718.
- ^ Flint GN; Packirisamy S (1997). "Purity of food cooked in stainless steel utensils". Food Addit Contam. 14 (2): 115–26. doi:10.1080/02652039709374506. PMID 9102344.
- ^ Chromium. IN: Dietary Reference Intakes for Vitamin A, Vitamin K, Arsenic, Boron, Chromium, Chromium, Iodine, Iron, Manganese, Molybdenum, Nickel, Silicon, Vanadium, and Chromium Diarsipkan 2016-10-17 di Wayback Machine.. National Academy Press. 2001, PP.197-223.
- ^ Tolerable Upper Intake Levels For Vitamins And Minerals (PDF), European Food Safety Authority, 2006
- ^ a b Barceloux, Donald G.; Barceloux, Donald (1999). "Chromium". Clinical Toxicology. 37 (2): 173–194. doi:10.1081/CLT-100102418. PMID 10382554.
- ^ a b c d Eastmond, David A.; MacGregor, J. T.; Slesinski, R. S. (2008). "Trivalent Chromium: Assessing the Genotoxic Risk of an Essential Trace Element and Widely Used Human and Animal Nutritional Supplement". Critical Reviews in Toxicology. 38 (3): 173–190. doi:10.1080/10408440701845401. PMID 18324515.
- ^ a b c Katz, Sidney A.; Salem, H. (1992). "The toxicology of chromium with respect to its chemical speciation: A review". Journal of Applied Toxicology. 13 (3): 217–224. doi:10.1002/jat.2550130314. PMID 8326093.
- ^ "NIOSH Pocket Guide to Chemical Hazards #0141". National Institute for Occupational Safety and Health (NIOSH).
- ^ "NIOSH Pocket Guide to Chemical Hazards #0141". National Institute for Occupational Safety and Health (NIOSH).
- ^ Dayan, A. D.; Paine, A. J. (2001). "Mechanisms of chromium toxicity, carcinogenicity and allergenicity: Review of the literature from 1985 to 2000". Human & Experimental Toxicology. 20 (9): 439–451. doi:10.1191/096032701682693062. PMID 11776406.
- ^ Newman, D. (1890). "A case of adeno-carcinoma of the left inferior turbinated body, and perforation of thenasal septum, in the person of a worker in chrome pigments". Glasgow Medical Journal. 33: 469–470.
- ^ Langard, Sverre (1990). "One Hundred Years of Chromium and Cancer: A Review of Epidemiological Evidence and Selected Case Reports". American Journal of Industrial Medicine. 17 (2): 189–214. doi:10.1002/ajim.4700170205. PMID 2405656.
- ^ Cohen, M. D.; Kargacin, B.; Klein, C. B.; Costa, M. (1993). "Mechanisms of chromium carcinogenicity and toxicity". Critical Reviews in Toxicology. 23 (3): 255–281. doi:10.3109/10408449309105012. PMID 8260068.
- ^ Methods to Develop Inhalation Cancer Risk Estimates for Chromium and Nickel Compounds. Research Triangle Park, NC: U.S. Environmental Protection Agency, Office of Air Quality Planning and Standards, Health and Environmental Impacts Division. October 2011. Diakses tanggal 19 March 2015.
- ^ "Chrome Contact Allergy". DermNet NZ.
- ^ Basketter, David; Horev, L.; Slodovnik, D.; Merimes, S.; Trattner, A.; Ingber, A. (2000). "Investigation of the threshold for allergic reactivity to chromium". Contact Dermatitis. 44 (2): 70–74. doi:10.1034/j.1600-0536.2001.440202.x. PMID 11205406.
- ^ Baselt, Randall C. (2008). Disposition of Toxic Drugs and Chemicals in Man (edisi ke-8th). Foster City: Biomedical Publications. hlm. 305–307. ISBN 978-0-9626523-7-0.
- ^ "US water has large amounts of likely carcinogen: study". Yahoo News. 2010-12-19. Diarsipkan dari versi asli tanggal 2010-12-23. Diakses tanggal 2010-12-19.
- ^ (CalEPA Fact Sheet)
Pranala luar[sunting | sunting sumber]
- (Inggris) ATSDR Case Studies in Environmental Medicine: Chromium Toxicity U.S. Department of Health and Human Services
- (Inggris) IARC Monograph "Chromium and Chromium compounds"
- (Inggris) It's Elemental – The Element Chromium
- (Inggris) The Merck Manual – Mineral Deficiency and Toxicity
- (Inggris) National Institute for Occupational Safety and Health – Chromium Page
- (Inggris) Chromium at The Periodic Table of Videos (University of Nottingham)
- (Inggris)
 "Chromium". Encyclopædia Britannica. 6 (edisi ke-11). 1911. hlm. 296–298.
"Chromium". Encyclopædia Britannica. 6 (edisi ke-11). 1911. hlm. 296–298.
| (besar) | |||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | ||||||||||||||||
| 1 | H | He | |||||||||||||||||||||||||||||||
| 2 | Li | Be | B | C | N | O | F | Ne | |||||||||||||||||||||||||
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar | |||||||||||||||||||||||||
| 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | |||||||||||||||
| 5 | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | |||||||||||||||
| 6 | Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | |
| 7 | Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | |
|
| |||||||||||||||||||||||||||||||||



![{\displaystyle {\ce {2[CrO4]^2- + 2H+ <=> [Cr2O7]^2- + H2O}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/26ab9c77b3be8b4725a7922e5f7ab3b95f1f22b0)





