Sejarah kimia
 |
| Kimia |
|---|
Sejarah kimia merepresentasikan rentang waktu dari sejarah kuno sampai sekarang. Pada 1000 SM, peradaban menggunakan teknologi yang pada akhirnya akan membentuk basis berbagai cabang ilmu kimia. Contohnya termasuk mengekstraksi logam dari bijihnya, membuat tembikar dan glasir, memfermentasi bir dan anggur, mengeluarkan bahan kimia dari tumbuh-tumbuhan untuk obat-obatan dan parfum, mengubah lemak menjadi sabun, membuat kaca, dan membuat paduan seperti perunggu.
Protosains kimia, alkimia, tidak berhasil menjelaskan sifat materi dan transformasinya. Namun, dengan melakukan percobaan dan mencatat hasilnya, alkimiawan memantapkan panggung untuk kimia modern. Perbedaannya mulai muncul ketika diferensiasi yang jelas antara kimia dan alkimia dibuat oleh Robert Boyle dalam karyanya The Sceptical Chymist (1661). Sementara alkimia dan kimia berkaitan dengan materi dan transformasinya, kimiawan diakui karena menerapkan metode ilmiah pada karyanya.
Kimia dianggap telah menjadi sains yang mapan melalui karya Antoine Lavoisier, yang mengembangkan hukum kekekalan massa yang menuntut pengukuran yang cermat dan pengamatan kuantitatif terhadap fenomena kimia. Sejarah kimia berhubungan erat dengan sejarah termodinamika, terutama melalui karya Willard Gibbs.[1]
Sejarah kuno[sunting | sunting sumber]
Metalurgi awal[sunting | sunting sumber]
Logam yang tercatat paling awal yang digunakan oleh manusia tampaknya adalah emas yang bisa ditemukan bebas atau "asli". Sejumlah kecil emas alami telah ditemukan di gua-gua Spanyol yang digunakan selama periode Paleolitik akhir, c. 40.000 SM.[2]
Perak, tembaga, timah dan besi meteor asli dapat juga ditemukan, yang memungkinkan pengolahan logam secara terbatas dalam budaya kuno.[3] Senjata Mesir yang terbuat dari besi meteor pada sekitar 3000 SM sangat berharga bak "Belati dari Surga".[4]
Reaksi kimia pertama yang digunakan secara terkendali adalah api. Namun, selama ribuan tahun api hanya dipandang sebagai kekuatan mistis yang bisa mengubah satu zat menjadi zat lain (membakar kayu atau mendidihkan air) saat menghasilkan panas dan cahaya. Api mempengaruhi banyak aspek masyarakat awal. Ini berkisar dari aspek kehidupan sehari-hari yang paling sederhana, seperti memasak dan pencahayaan lingkungan, hingga teknologi yang lebih maju, seperti tembikar, batu bata, dan pencairan logam untuk dijadikan alat.
Apilah yang mendorong penemuan kaca dan pemurnian logam yang pada gilirannya memberi jalan kepada kebangkitan metalurgi. Selama tahap awal metalurgi, metode pemurnian logam dicari, dan emas, yang dikenal di era Mesir kuno pada awal 2900 SM, menjadi logam berharga.
Zaman Perunggu[sunting | sunting sumber]
Logam tertentu dapat diekstraksi dari bijihnya dengan hanya memanaskan batuan dalam api: terutama timah, timbal dan tembaga (pada suhu yang lebih tinggi), sebuah proses yang dikenal sebagai peleburan. Bukti pertama metalurgi ekstraktif ini berasal dari milenium ke-5 dan ke-6 SM, dan ditemukan di situs arkeologi Majdanpek, Yarmovac dan Plocnik, ketiganya di Serbia. Sampai saat ini, peleburan tembaga paling awal ditemukan di situs Belovode,[5] contoh-contoh ini termasuk kapak tembaga dari 5.500 SM yang termasuk dalam budaya Vinča.[6] Tanda-tanda lain dari logam awal ditemukan dari milenium ketiga SM di tempat-tempat seperti Palmela (Portugal), Los Millares (Spanyol), dan Stonehenge (Britania Raya). Namun, seperti yang sering terjadi dengan studi zaman prasejarah, awal mulanya tidak dapat didefinisikan dengan jelas dan sedang berlangsung penemuan-penemuan baru.
Logam pertama ini adalah logam tunggal atau seperti yang ditemukan. Dengan menggabungkan tembaga dan timah, bisa dibuat logam unggul, paduan yang disebut perunggu, sebuah pergeseran besar dalam teknologi yang dimulai pada Zaman Perunggu sekitar 3.500 SM. Zaman Perunggu adalah periode perkembangan budaya manusia saat pengolahan logam paling maju (setidaknya secara sistematis dan banyak digunakan) mencakup teknik peleburan tembaga dan timah dari tempaan bijih tembaga yang terjadi secara alami, dan kemudian melebur bijih tersebut untuk menghasilkan perunggu. Bijih alami ini biasanya mengandung arsen sebagai ketakmurnian. Langkanya bijih tembaga/timah tercermin dari kenyataan bahwa tidak ada perunggu timah di Asia barat sebelum 3000 SM.
Setelah Zaman Perunggu, sejarah metalurgi ditandai oleh tentara yang mencari persenjataan yang lebih baik. Negara-negara di Eurasia menjadi makmur saat mereka membuat paduan yang superior, yang pada gilirannya membuat armor dan senjata yang lebih baik. Hal ini sering menentukan hasil pertempuran. Kemajuan signifikan dalam metalurgi dan alkimia dibuat di India kuno.[7]
Zaman Besi[sunting | sunting sumber]
Ekstraksi besi dari bijihnya menjadi logam yang bisa diolah jauh lebih sulit daripada tembaga atau timah. Ini tampaknya telah ditemukan oleh bangsa Het pada sekitar 1200 SM, sebagai tanda dimulainya Zaman Besi. Rahasia ekstraksi dan pengolahan besi merupakan faktor kunci keberhasilan bangsa Filistin.[4][8]
Dengan kata lain, Zaman Besi mengacu pada kemunculan metalurgi besi. Perkembangan sejarah metalurgi besi dapat ditemukan dalam berbagai macam budaya dan peradaban masa lalu. Ini termasuk, antara lain, kerajaan-kerajaan kuno dan abad pertengahan serta kekaisaran Timur Tengah dan Timur Dekat, Iran kuno, Mesir kuno, Nubia kuno, dan Anatolia (Turki), Nok Kuno, Kartago, bangsa Yunani dan Romawi di Eropa kuno, Eropa abad pertengahan, Tiongkok kuno dan abad pertengahan, India kuno dan abad pertengahan, Jepang kuno dan abad pertengahan. Banyak aplikasi, praktik, dan perangkat yang terkait atau terlibat dalam metalurgi yang didirikan di Tiongkok kuno, seperti inovasi tanur tinggi, besi cor, trip hammer bertenaga hidrolik, dan bellows piston aksi ganda.[9][10]
Baharian klasik dan atomisme[sunting | sunting sumber]

Percobaan filosofis untuk merasionalisasi mengapa zat yang berbeda memiliki sifat yang berbeda (warna, densitas, bau), ada dalam beragam keadaan (gas, cair, dan padat), dan bereaksi dengan cara yang berbeda saat terpapar lingkungan, misalnya terkena air atau api atau perubahan suhu, memicu filsuf kuno mendalilkan teori pertama tentang alam dan kimia. Sejarah teori filosofis seperti itu yang berhubungan dengan ilmu kimia mungkin bisa ditelusuri kembali ke setiap peradaban kuno. Aspek umum dalam semua teori ini adalah usaha untuk mengidentifikasi sejumlah kecil unsur klasik utama yang membentuk semua ragam zat di alam. Zat seperti udara, air, dan tanah, bentuk energi, seperti api dan cahaya, dan konsep yang lebih abstrak seperti gagasan, aether, dan surga, biasa terjadi pada peradaban kuno meskipun tidak ada silang budaya; misalnya dalam filsafat Yunani, India, Maya, dan Tiongkok kuno, semua menganggap udara, air, tanah dan api sebagai unsur utama.
Dunia kuno[sunting | sunting sumber]
Sekitar 420 SM, Empedokles menyatakan bahwa semua materi terdiri dari empat unsur elementer—tanah, api, udara dan air. Teori awal atomisme dapat ditelusuri kembali ke zaman Yunani kuno dan India kuno.[11] Atomisme Yunani berasal dari filsuf Yunani Demokritos, yang menyatakan bahwa materi terdiri dari atom yang tak dapat dipisahkan dan tidak dapat dihancurkan, pada sekitar tahun 380 SM. Leukippos juga menyatakan bahwa atom adalah bagian materi yang paling tak dapat dipisahkan. Ini bertepatan dengan deklarasi serupa oleh filsuf India bernama Kanada dalam sutra Vaisheshikanya sekitar periode waktu yang sama.[11] Dengan cara yang sama ia membahas keberadaan gas. Apa yang dinyatakan Kanada melalui kitab sutranya, Demokritos menyatakan melalui renungan filosofisnya. Keduanya mengalami kekurangan data empiris. Tanpa bukti ilmiah, keberadaan atom mudah ditolak. Aristoteles menentang keberadaan atom pada tahun 330 SM. Sebelumnya, pada tahun 380 SM, sebuah teks Yunani yang dikaitkan dengan Polibos berpendapat bahwa tubuh manusia terdiri dari empat segi. Sekitar 300 SM, Epikuros mendalilkan alam semesta atom yang tak terhancurkan di mana manusia sendiri bertanggung jawab untuk mencapai kehidupan yang seimbang.
Dengan tujuan untuk menjelaskan filosofi Epicurean kepada khalayak Romawi, penyair dan filsuf Romawi Lucretius[12] menulis De Rerum Natura (The Nature of Things, Indonesia: Sifat Benda)[13] pada tahun 50 SM. Dalam karya tersebut, Lucretius menyajikan prinsip-prinsip atomisme; sifat pikiran dan jiwa; penjelasan sensasi dan pemikiran; perkembangan dunia dan fenomena; serta menjelaskan berbagai fenomena selestial dan terestrial.
Sebagian besar pengembangan awal metode pemurnian dijelaskan oleh Pliny the Elder dalam Naturalis Historia-nya. Dia berusaha menjelaskan metode tersebut, sekaligus melakukan observasi cepat terhadap keadaan banyak mineral.
Alkimia abad pertengahan[sunting | sunting sumber]

Sistem unsur yang digunakan dalam alkimia Abad Pertengahan dikembangkan terutama oleh alkimiawan Persia Jābir ibn Hayyān dan berakar pada unsur klasik tradisi Yunani.[14] Sistemnya terdiri dari empat unsur Aristoteles udara, tanah, api, dan air di samping dua unsur filosofis: belerang, yang mencirikan prinsip pembakaran; "batu yang terbakar", dan raksa, mencirikan prinsip sifat logam. Mereka dilihat oleh para alkimiawan awal sebagai ungkapan ideal komponen tak terkurangkan alam semesta[15] dan pertimbangan yang lebih besar dalam alkimia filosofis.
Tiga prinsip logam: belerang terhadap sifat kemudahterbakaran atau pembakaran, raksa terhadap volatilitas dan stabilitas, dan garam untuk soliditas, menjadi tria prima dari alkimiawan Swiss, Paracelsus. Dia beralasan bahwa teori empat unsur Aristoteles muncul dalam tubuh sebagai tiga prinsip. Paracelsus melihat prinsip-prinsip ini sebagai fundamental dan membenarkannya dengan cara menjelaskan bagaimana kayu terbakar. Raksa termasuk prinsip kohesif, sehingga bila dibiarkan dalam asap menyebabkan kayu tercerai berai. Asap menggambarkan volatilitas (prinsip yang berubah-ubah), nyala api yang memberi kesan panas menjelaskan kemudahterbakaran (belerang), dan abu yang tersisa menggambarkan soliditas (garam).[16]
Batu filsuf[sunting | sunting sumber]

Alkimia didefinisikan berdasarkan penyelidikan Hermetik untuk batu filsuf, studi yang diselubungi simbo-simbol mistisis, dan sangat berbeda dengan sains modern. Alkimiawan bekerja keras untuk melakukan transformasi pada tingkat esoteris (spiritual) dan/atau eksoteris (praktis).[17] Aspek eksoteris alkimia yang protosaintifik, berkontribusi besar terhadap evolusi kimia di Yunani-Romawi Mesir, Zaman Keemasan Islam, dan kemudian di Eropa. Alkimia dan kimia memiliki ketertarikan pada komposisi dan sifat materi, dan sebelum abad kedelapan belas tidak dipisahkan dalam disiplin ilmu yang berbeda. Istilah chymistry telah digunakan untuk menggambarkan perpaduan antara alkimia dan kimia yang ada sebelum masa ini.[18]
Alkimiawan Barat paling awal, yang hidup pada abad pertama setelah masehi, menemukan peralatan kimia. Bain-marie, atau penangas air (Inggris: water bath) dinamai untuk Mary the Jewess. Karyanya juga memberikan deskripsi pertama tentang tribikos dan kerotakis.[19] Cleopatra the Alchemist menggambarkan tungku dan telah dikreditkan dengan penemuan alembik.[20] Kemudian, kerangka eksperimental yang dibuat oleh Jabir ibn Hayyan mempengaruhi para alkimiawan karena disiplin tersebut bermigrasi melalui dunia Islam, kemudian ke Eropa pada abad kedua belas.
Selama Renaisans, alkimia eksoteris tetap populer dalam bentuk iatrokimia Paracelsianisme, sementara alkimia spiritual berkembang, disesuaikan dengan akar Platonis, Hermetik, dan Gnostiknya. Akibatnya, pencarian simbolis untuk batu filsuf tidak digantikan oleh kemajuan ilmiah, dan masih merupakan domain ilmuwan dan dokter yang dihormati sampai awal abad kedelapan belas. Alkimiawan modern awal yang terkenal karena kontribusi saintifik mereka termasuk Jan Baptist van Helmont, Robert Boyle, dan Isaac Newton.
Masalah yang dihadapi dengan alkimia[sunting | sunting sumber]
Ada beberapa masalah dengan alkimia, seperti yang terlihat dari sudut pandang saat ini. Tidak ada skema penamaan sistematis untuk senyawa baru, dan bahasanya bersifat esoterik dan samar sampai-sampai suatu terminologi memiliki makna yang berbeda bagi orang yang berbeda. Faktanya, menurut The Fontana History of Chemistry (Brock, 1992):
The language of alchemy soon developed an arcane and secretive technical vocabulary designed to conceal information from the uninitiated. To a large degree, this language is incomprehensible to us today, though it is apparent that readers of Geoffrey Chaucer's Canon's Yeoman's Tale or audiences of Ben Jonson's The Alchemist were able to construe it sufficiently to laugh at it.[21]
[ Bahasa alkimia segera mengembangkan kosakata teknis batiniah dan rahasia yang dirancang untuk menyembunyikan informasi dari orang yang belum tahu. Pada tingkat yang lebih besar, bahasa ini tidak bisa kita pahami saat ini, meskipun jelas bahwa pembaca Canon's Yeoman's Tale dari Geoffrey Chaucer atau penonton The Alchemist dari Ben Jonson dapat menafsirkannya dengan cukup memadai untuk menertawakannya.] Error: {{Lang-xx}}: text has italic markup (help)[21]
Kisah Chaucer lebih mengekspos sisi kecurangan alkimia, terutama pembuatan emas palsu dari zat murah. Kurang dari seabad sebelumnya, Dante Alighieri juga menunjukkan kesadaran akan kecurangan ini, sehingga dia menulis menyerahkan semua alkimiawan ke Inferno. Tidak lama kemudian, pada tahun 1317, Paus Yohanes XXII Avignon memerintahkan semua alkimiawan meninggalkan Prancis karena telah membuat uang palsu. Sebuah undang-undang diloloskan di Inggris pada tahun 1403 yang membuat "penggandaan logam" dapat dihukum mati. Meskipun ada tindakan ini dan lainnnya yang tampaknya ekstrem, alkimia tidak mati. Kelas bangsawan dan istimewa masih berusaha menemukan batu filsuf dan obat mujarab kehidupan untuk diri mereka sendiri.[22]
Juga tidak ada metode ilmiah yang disepakati agar eksperimen dapat diulangi. Memang, banyak alkimiawan memasukkan informasi yang tidak relevan ke dalam metode mereka seperti waktu pasang surut atau fase bulan. Sifat esoterik alkimia serta kosakatanya yang dikodifikasi tampaknya lebih berguna dalam menyembunyikan fakta bahwa mereka sebetulnya sama sekali tidak yakin. Pada awal abad ke-14, keretakan tampak tumbuh menggoyang kekokohan alkimia; dan orang menjadi skeptis. Jelas, perlu ada metode ilmiah agar eksperimen dapat diulang oleh orang lain, dan hasilnya perlu dilaporkan dalam bahasa yang jelas yang menjelaskan apa yang diketahui dan tidak diketahui.
Alkimia dalam dunia Islam[sunting | sunting sumber]

Dalam Dunia Islam, orang-orang Muslim menerjemahkan karya bangsa Yunani dan Mesir kuno ke dalam bahasa Arab dan bereksperimen dengan gagasan ilmiah.[23] Perkembangan metode ilmiah modern sangat lambat dan sulit, namun metode ilmiah awal untuk kimia mulai muncul di kalangan kimiawan Muslim awal, yang dimulai dengan kimiawan abad ke-9 Jābir ibn Hayyān (dikenal sebagai "Geber" di Eropa), yang dianggap sebagai "bapak ilmu kimia".[24][25][26][27] Dia memperkenalkan pendekatan sistematis dan eksperimental terhadap penelitian ilmiah yang berbasis laboratorium, berbeda dengan alkimiawan Yunani dan Mesir kuno yang karya-karyanya sebagian besar bersifat alegoris dan sering kali tidak dapat dipahami.[28] Dia juga menemukan dan menamainya alembik (al-anbiq), secara kimia menganalisis banyak zat kimia, menyusun lapidari, membedakan antara alkali dan asam, serta memproduksi ratusan obat.[29] Dia juga menyempurnakan teori lima unsur klasik menjadi teori tujuh unsur alkimia setelah mengidentifikasi raksa dan belerang sebagai unsur kimia.[30]
Di antara kimiawan Muslim berpengaruh lainnya, Abū al-Rayhān al-Bīrūnī,[31] Ibnu Sina[32] dan Al-Kindi menyangkal teori alkimia, terutama teori transmutasi logam; dan ath-Thusi menjelaskan versi kekekalan massa, yang mencatat bahwa suatu materi dapat berubah namun tidak dapat hilang.[33] Ar-Razi membantah teori Aristoteles tentang empat unsur klasik untuk pertama kalinya dan mendirikan dasar kimia modern yang kokoh, dengan menggunakan laboratorium dalam pengertian modern, merancang dan mendeskripsikan lebih dari dua puluh instrumen, yang banyak bagiannya yang masih digunakan sampai sekarang, seperti krus, labu atau labu alas bulat untuk distilasi, dan alembik (bahasa Latin: alembic), dan berbagai jenis tungku atau kompor.
Bagi para praktisi di Eropa, alkimia menjadi perlombaan intelektual setelah alkimia Arab awal tersedia melalui terjemahan bahasa Latin, dan seiring waktu, mereka bangkit. Paracelsus (1493-1541), misalnya, menolak teori 4 unsur dan hanya dengan sedikit pemahaman tentang bahan kimia dan obat-obatan, membentuk hibrida alkimia dan sains dalam apa yang disebut iatrokimia. Paracelsus tidak sempurna dalam membuat eksperimennya benar-benar ilmiah. Misalnya, sebagai perpanjangan teorinya bahwa senyawa baru bisa dibuat dengan menggabungkan raksa dengan belerang, ia pernah membuat apa yang ia anggap "minyak belerang", tetapi sebenarnya adalah dimetil eter, yang tidak mengandung raksa maupun belerang sama sekali.
Abad ke-17 dan ke-18: Kimia awal[sunting | sunting sumber]


Upaya praktis untuk memperbaiki pemurnian bijih dan ekstraksinya untuk melebur logam merupakan sumber informasi penting bagi kimiawan awal pafa abad ke-16, di antaranya Georgius Agricola (1494-1555), yang menerbitkan karya hebatnya De re metallica pada tahun 1556. Karyanya menjelaskan proses penambangan bijih logam yang sangat maju dan kompleks, ekstraksi logam dan metalurgi saat itu. Pendekatannya menyingkirkan mistisisme yang terkait dengan subjek, menciptakan basis praktis yang dapat dikembangkan oleh orang lain. Karya tersebut menggambarkan berbagai jenis tungku yang digunakan untuk melebur bijih, dan merangsang minat terhadap mineral dan komposisinya. Bukan suatu kebetulan bahwa ia memberikan banyak referensi kepada penulis sebelumnya, Pliny the Elder dan Naturalis Historia-nya. Agricola telah digambarkan sebagai "bapak metalurgi".[34]
Pada tahun 1605, Sir Francis Bacon menerbitkan The Proficience and Advancement of Learning, yang berisi deskripsi tentang apa yang kemudian dikenal sebagai metode ilmiah.[35] Pada tahun 1605, Michal Sedziwój menerbitkan risalah alkimia A New Light of Alchemy yang mengusulkan adanya "makanan kehidupan" di dalam udara, yang kemudian dikenal sebagai oksigen. Pada tahun 1615 Jean Beguin menerbitkan the Tyrocinium Chymicum, sebuah buku teks kimia awal, dan di dalamnya tergambar persamaan kimia untuk pertama kalinya.[36] Pada tahun 1637 René Descartes menerbitkan Discours de la méthode, yang berisi garis besar metode ilmiah.
Karya kimiawan Belanda Jan Baptist van Helmont, Ortus medicinae diterbitkan pada tahun 1648; buku ini dikutip oleh beberapa orang sebagai karya transisi besar antara alkimia dan kimia, dan berpengaruh penting pada Robert Boyle. Buku ini berisi hasil berbagai eksperimen dan menetapkan versi awal hukum kekekalan massa. Tidak lama berselang setelah Paracelsus dan iatrokimia, Jan Baptist van Helmont menyarankan bahwa ada zat substansial selain udara dan menamainya - "gas", dari kata Yunani chaos. Selain mengenalkan kata "gas" ke dalam kosakata ilmiah, van Helmont melakukan beberapa percobaan yang melibatkan gas. Jan Baptist van Helmont juga dikenang saat ini atas sebagian besar gagasannya tentang pembentukan spontan dan eksperimen pohon 5 tahunnya, dan juga dianggap sebagai penemu kimia pneumatik.
Robert Boyle[sunting | sunting sumber]


Kimiawan Anglo-Irlandia Robert Boyle (1627-1691) dianggap telah menyempurnakan metode ilmiah modern untuk alkimia dan telah memisahkan kimia dari alkimia.[37] Meskipun penelitiannya jelas berakar pada tradisi alkimia, sebagian besar menganggap Boyle sebagai kimiawan modern pertama, dan oleh karena itu merupakan salah satu pendiri ilmu kimia modern, dan salah satu pelopor metode ilmiah eksperimental modern. Meskipun Boyle bukan penemunya yang asli, dia terkenal dengan hukum Boyle, yang dia sajikan pada tahun 1662:[38] hukum tersebut menggambarkan hubungan proporsional yang berbanding terbalik antara tekanan absolut dan volume gas, jika suhu tetap konstan dalam sistem tertutup.[39]
Boyle juga diakui untuk publikasi mahakaryanya The Sceptical Chymist pada tahun 1661, yang dipandang sebagai buku penting dalam bidang kimia. Dalam karyanya tersebut, Boyle mengemukakan hipotesisnya bahwa setiap fenomena merupakan hasil tumbukan partikel yang sedang bergerak. Boyle meminta kimiawan untuk bereksperimen dan menegaskan bahwa eksperimen membantah pembatasah unsur kimia hanya pada empat unsur klasik: tanah, api, udara, dan air. Dia juga memohon agar berhenti merendahkan kimia di bawah obat atau alkimia, dan menaikkan statusnya menjadi sains. Hal terpenting adalah, dia menganjurkan pendekatan yang ketat terhadap eksperimen ilmiah: dia meyakini bahwa semua teori harus dibuktikan secara eksperimental sebelum dianggap sebagai kebenaran. Karya ini berisi beberapa gagasan modern paling awal: atom, molekul, dan reaksi kimia, serta tonggak dimulainya sejarah kimia modern.
Boyle juga mencoba memurnikan bahan kimia untuk mendapatkan reaksi yang dapat diulangi (reproducible). Dia adalah pendukung vokal dari filosofi mekanik yang diajukan oleh René Descartes yang menjelaskan dan mengukur sifat fisika dan interaksi materi. Boyle adalah seorang atomis, tapi lebih menyukai kata korpuskula (butiran, Inggris: corpuscle) daripada atom. Dia berkomentar bahwa pemecahan materi terkecil di mana sifat-sifatnya dipertahankan pada tingkat korpuskula. Dia juga melakukan banyak penelitian dengan pompa udara, dan mencatat bahwa raksa turun saat udara dipompa keluar. Dia juga mengamati bahwa memompa udara dari wadah akan memadamkan nyala api dan membunuh hewan kecil yang ditempatkan di dalamnya. Boyle membantu meletakkan dasar Revolusi kimia dengan filosofi korpuskular mekanisnya.[40] Boyle mengulangi eksperimen pohon van Helmont, dan merupakan yang pertama menggunakan indikator yang berubah warna seiring dengan perubahan keasaman.
Perkembangan dan matinya teori flogiston[sunting | sunting sumber]

Pada tahun 1702, kimiawan Jerman Georg Stahl menciptakan nama "flogiston" untuk zat yang diyakini dilepaskan dalam proses pembakaran. Sekitar tahun 1735, kimiawan Swedia Georg Brandt menganalisis pigmen biru tua yang ditemukan di bijih tembaga. Brandt menunjukkan bahwa pigmen tersebut mengandung unsur baru, yang kemudian diberi nama kobalt. Pada tahun 1751, seorang kimiawan Swedia bernama Axel Fredrik Cronstedt, yang juga murid Stahl, mengidentifikasi ketakmurnian dalam bijih tembaga sebagai unsur logam yang terpisah, yang dia namakan nikel. Cronstedt adalah salah satu pendiri mineralogi modern.[41] Cronstedt juga menemukan mineral scheelite pada tahun 1751, yang dinamakan tungsten, yang berarti "batu berat" dalam bahasa Swedia.
Pada tahun 1754, kimiawan Skotlandia Joseph Black mengisolasi karbon dioksida, yang disebutnya "udara tetap".[42] Pada tahun 1757, Louis Claude Cadet de Gassicourt, saat meneliti senyawa arsenik, menciptakan cairan berasap Cadet, yang kemudian ditemukan sebagai kakodil oksida, dianggap sebagai senyawa organologam sintetis pertama.[43] Pada 1758, Joseph Black merumuskan konsep kalor laten untuk menjelaskan termokimia perubahan fasa.[44] Pada tahun 1766, ahli kimia Inggris Henry Cavendish mengisolasi hidrogen, yang disebutnya "udara yang mudah terbakar". Cavendish menemukan hidrogen sebagai gas tak berwarna dan tak berbau yang membakar dan bisa membentuk campuran eksplosif dengan udara. Dia menerbitkan sebuah makalah tentang produksi air dengan membakar udara yang mudah terbakar (yaitu hidrogen) di udara terdeflogistikasi (sekarang diketahui sebagai oksigen) Udara terdeflogistikasi merupakan penyusun atmosfer udara (teori flogiston).
Pada 1773, kimiawan Swedia Carl Wilhelm Scheele menemukan oksigen, yang disebutnya "udara api", namun tidak segera mempublikasikan pencapaiannya.[45] Pada tahun 1774, kimiawan Inggris Joseph Priestley secara terpisah mengisolasi oksigen dalam keadaan gasnya, menyebutnya "udara terdeflogistikasi", dan menerbitkan karyanya sebelum Scheele.[46][47] Selama masa hidupnya, reputasi ilmiah Priestley yang cukup penting terletak pada penemuan air soda, tulisannya tentang listrik, dan penemuan beberapa "udara" (gas), yang paling terkenal adalah apa yang oleh Priestley disebut "udara terdeflogistikasi" (oksigen). Meski demikian, tekad Priestley untuk mempertahankan teori flogiston dan menolak apa yang akan menjadi revolusi kimia pada akhirnya membuatnya terisolasi di kalangan komunitas ilmiah.
Pada tahun 1781, Carl Wilhelm Scheele menemukan bahwa asam baru, asam tungstat, dapat dibuat dari scheelite Cronstedt (pada saat bernama tungsten). Scheele dan Torbern Bergman menyarankan ada kemungkinan untuk mendapatkan logam baru dengan mereduksi asam ini.[48] Pada 1783, José dan Fausto Elhuyar menemukan asam yang terbuat dari wolframit yang identik dengan asam tungstat. Belakangan tahun itu, di Spanyol, dua bersaudara tersebut berhasil mengisolasi logam yang sekarang dikenal sebagai tungsten (atau wolfram) dengan mereduksi asam ini dengan arang, dan mereka diakui sebagai penemu unsur tersebut.[49][50]
Volta dan tumpukan Volta[sunting | sunting sumber]

Fisikawan Italia Alessandro Volta membuat sebuah alat untuk mengakumulasi muatan besar dengan serangkaian induksi dan pembumian (grounding). Dia meneliti penemuan "listrik hewan" tahun 1780 oleh Luigi Galvani, dan menemukan bahwa arus listrik dihasilkan dari kontak logam berbeda, dan kaki katak hanya bertindak sebagai detektor. Volta mendemonstrasikan pada tahun 1794 bahwa ketika dua logam dan kain atau kardus yang direndam air garam disusun dalam rangkaian, akan menghasilkan arus listrik.
Pada tahun 1800, Volta menumpuk beberapa pasang cakram tembaga (atau perak) dan seng (elektroda) secara berselang-seling yang dipisahkan oleh kain atau kardus yang direndam dalam air garam (elektrolit) untuk meningkatkan konduktivitas elektrolit.[51] Bila kontak bagian atas dan bawah dihubungkan oleh kawat, arus listrik mengalir melalui tumpukan volta dan kabel penghubung. Sehingga, Volta diakui sebagai penemu baterai listrik pertama untuk menghasilkan listrik. Metode Volta yang menumpuk pelat bundar tembaga dan seng yang dipisahkan oleh cakram karton yang dilembabkan dengan larutan garam disebut tumpukan volta.
Dengan demikian, Volta dianggap sebagai pendiri disiplin ilmu elektrokimia.[52] Sebuah sel galvani (atau sel volta) adalah sel elektrokimia yang menghasilkan energi listrik dari reaksi redoks spontan yang terjadi di dalam sel. Sel ini biasanya terdiri dari dua logam berbeda yang dihubungkan oleh jembatan garam, atau setengah sel yang dipisahkan oleh membran berpori.
Antoine-Laurent de Lavoisier[sunting | sunting sumber]

Meskipun arsip penelitian kimia berasal dari karya Babilonia kuno, Mesir, dan terutama bangsa Arab dan Persia setelah Islam, kimia modern berkembang dari zaman Antoine-Laurent de Lavoisier, seorang kimiawan Prancis yang dianggap sebagai "bapak kimia modern". Lavoisier menunjukkan dengan cermat bahwa transmutasi air menjadi tanah tidak memungkinkan, namun sedimen yang diamati dari air mendidih berasal dari wadah. Dia membakar fosfor dan belerang di udara, dan membuktikan bahwa produk tersebut memiliki bobot lebih dari aslinya. Meski begitu, berat yang didapat pun hilang dari udara. Jadi, pada tahun 1789, dia menetapkan Hukum Kekekalan Massa, yang juga disebut "Hukum Lavoisier."[53]
Dengan mengulang eksperimen Priestley, Lavoisier menunjukkan bahwa udara terdiri dari dua bagian, satu di antaranya digabungkan dengan logam untuk membentuk calx (kalsium oksida). Dalam Considérations Générales sur la Nature des Acides (1778), dia menunjukkan bahwa "udara" yang bertanggung jawab atas pembakaran juga merupakan sumber keasaman. Tahun berikutnya, dia menamakan bagian ini sebagai oksigen (bahasa Yunani untuk "bekas asam"), dan lainnya dinamakannya azote (bahasa Yunani untuk "tanpa kehidupan"). Oleh karena itu, Lavoisier mengklaim penemuan oksigen bersamaan dengan Priestley dan Scheele. Dia juga menemukan bahwa "udara yang mudah terbakar" yang ditemukan oleh Cavendish - yang ia sebut hidrogen (bahasa Yunani untuk "bekas air") - digabungkan dengan oksigen untuk menghasilkan embun, seperti yang dilaporkan oleh Priestley, tampaknya merupakan air. Dalam Reflexions sur le Phlogistique (1783), Lavoisier menunjukkan teori flogiston terkait pembakaran menjadi tidak konsisten. Mikhail Lomonosov secara mandiri membentuk tradisi kimia di Rusia pada abad ke-18. Lomonosov juga menolak teori flogiston, dan mengantisipasi teori kinetika gas. Lomonosov menganggap panas sebagai bentuk gerak, dan menyatakan gagasan kekekalan materi.
Lavoisier bekerja dengan Claude Louis Berthollet dan lainnya untuk merancang sebuah sistem tatanama kimia yang berfungsi sebagai dasar sistem penamaan senyawa kimia modern. Dalam Methods of Chemical Nomenclature (1787), Lavoisier menemukan sistem penamaan dan klasifikasi yang sebagian besar masih digunakan sampai sekarang, termasuk nama-nama seperti asam sulfat, sulfat, dan sulfit. Pada 1785, Berthollet adalah orang pertama yang mengenalkan penggunaan gas klorin sebagai pemutih komersial. Pada tahun yang sama ia pertama kali menentukan komposisi unsur gas amonia. Berthollet pertama kali menghasilkan cairan pemutihan modern pada tahun 1789 dengan melewatkan gas klorin melalui larutan natrium karbonat - hasilnya adalah larutan lemah natrium hipoklorit. Oksidator dan pemutih klorin kuat lainnya yang dia teliti dan yang pertama kali dihasilkan, kalium klorat (KClO3), dikenal sebagai Garam Berthollet. Berthollet juga dikenal karena kontribusi ilmiahnya terhadap teori kesetimbangan kimia melalui mekanisme reaksi kimia balik.

Karya Lavoisier Traité Élémentaire de Chimie (Risalah Dasar Kimia, 1789) adalah buku teks kimia modern pertama, dan menyajikan pandangan terpadu tentang teori kimia baru, berisi pernyataan yang jelas tentang Hukum Kekekalan Massa, dan menolak adanya flogiston. Selain itu, berisi daftar unsur, atau zat yang tidak dapat dipecah lebih jauh, termasuk oksigen, nitrogen, hidrogen, fosforus, raksa, seng, dan belerang. Daftarnya, bagaimanapun, juga termasuk cahaya, dan kalori, yang ia yakini sebagai zat material. Dalam karya tersebut, Lavoisier menggarisbawahi bahwa kimianya adalah berdasarkan pengamatan, dengan pernyataan "Saya telah mencoba ... untuk sampai pada kebenaran dengan menghubungkan fakta-fakta; untuk menekan sebanyak mungkin penggunaan penalaran, yang sering kali merupakan alat yang tidak dapat dipercaya yang menipu kita, untuk mengikuti sebanyak mungkin obor observasi dan eksperimen." Meskipun demikian, ia percaya bahwa keberadaan atom yang sebenarnya secara filosofis tidak mungkin. Lavoisier menunjukkan bahwa organisme membongkar dan menyusun kembali udara atmosfer dengan cara yang sama seperti tubuh yang terbakar.
Dengan Pierre-Simon Laplace, Lavoisier menggunakan kalorimeter untuk memperkirakan panas yang dihasilkan per unit karbon dioksida yang dihasilkan. Mereka menemukan rasio yang sama untuk nyala api dan hewan, menunjukkan bahwa hewan menghasilkan energi dengan jenis pembakaran. Lavoisier percaya pada teori radikal, percaya bahwa radikal, yang berfungsi sebagai kelompok tunggal dalam reaksi kimia, akan bergabung dengan oksigen dalam reaksi. Ia percaya semua asam mengandung oksigen. Dia juga menemukan bahwa berlian adalah bentuk kristal dari karbon.
Sementara banyak partner Lavoisier berpengaruh pada kemajuan kimia sebagai disiplin ilmiah, istrinya Marie-Anne Lavoisier bisa dibilang paling berpengaruh di antara mereka semua. Setelah pernikahan mereka, Madame (Mme.) Lavoisier mulai belajar kimia, bahasa Inggris, dan menggambar untuk membantu suaminya dalam pekerjaannya baik dengan menerjemahkan makalah ke bahasa Inggris, bahasa yang tidak diketahui Lavoisier, atau dengan menyimpan catatan dan menggambar berbagai peralatan yang digunakan Lavoisier di laboratoriumnya.[54] Melalui kemampuannya membaca dan menerjemahkan artikel dari Inggris untuk suaminya, Lavoisier memiliki akses pengetahuan terhadap banyak kemajuan kimia yang terjadi di luar laboratoriumnya.[54] Selanjutnya, Mme. Lavoisier menyimpan rekaman karya Lavoisier dan memastikan karya-karyanya diterbitkan.[54] Tanda pertama potensi sejati Marie-Anne sebagai ahli kimia di laboratorium Lavoisier muncul saat dia menerjemahkan sebuah buku oleh ilmuwan Richard Kirwan. Saat menerjemahkan, dia menemukan dan memperbaiki banyak galat. Saat dia menyajikan terjemahannya, disertakan pula catatannya untuk Lavoisier.[54] Suntingan dan kontribusinya menyebabkan penolakan Lavoisier terhadap teori flogiston.
Lavoisier membuat banyak kontribusi mendasar terhadap ilmu kimia. Setelah karya Lavoisier, kimia memperoleh sifat kuantitatif yang ketat, memungkinkan untuk membuat prediksi yang dapat diandalkan. Revolusi kimia yang dia bawa adalah hasil usaha sadar untuk menyesuaikan semua eksperimen ke dalam kerangka teori tunggal. Dia menetapkan penggunaan keseimbangan kimia secara konsisten, menggunakan oksigen untuk menggulingkan teori flogiston, dan mengembangkan sistem tatanama kimia yang baru. Lavoisier terbunuh ketika terjadi Revolusi Prancis.
Abad ke-19[sunting | sunting sumber]
Pada tahun 1802, kimiawan dan industrialis Prancis Amerika Éleuthère Irénée du Pont, yang mempelajari pembuatan bubuk mesiu dan bahan peledak di bawah Antoine Lavoisier, mendirikan pabrik mesiu di Delaware yang dikenal sebagai E.I. du Pont de Nemours and Company. Revolusi Prancis memaksa keluarganya pindah ke Amerika Serikat di mana du Pont memulai pabrik mesiu di Brandywine River di Delaware. Ingin membuat mesiu terbaik, du Pont waspada tentang kualitas bahan yang dia gunakan. Selama 32 tahun, du Pont menjabat sebagai presiden E.I. du Pont de Nemours and Company, yang akhirnya tumbuh menjadi salah satu perusahaan terbesar dan paling sukses di Amerika.
Sepanjang abad ke-19, kimia dibagi antara mereka yang mengikuti teori atom John Dalton dan mereka yang tidak, seperti Wilhelm Ostwald dan Ernst Mach.[55] Meskipun pendukung teori atom seperti Amedeo Avogadro dan Ludwig Boltzmann membuat kemajuan besar dalam menjelaskan perilaku gas, perselisihan ini akhirnya tidak terselesaikan sampai penelitian eksperimental Jean Perrin tentang penjelasan atom Einstein tentang gerak Brown pada dekade pertama abad ke-20.[55]
Sebelum perselisihan diselesaikan, banyak yang telah menerapkan konsep atomisme pada kimia. Contoh utama adalah teori ion Svante Arrhenius yang mengantisipasi gagasan tentang substruktur atom yang tidak sepenuhnya berkembang sampai abad ke-20. Michael Faraday adalah kimiawan awal lainnya, yang kontribusi utamanya pada kimia adalah elektrokimia, di mana (antara lain) sejumlah listrik selama elektrolisis atau elektrodeposisi logam menunjukkan keterkaitan dengan sejumlah unsur kimia tertentu, dan kuantitas yang tetap dari unsur-unsur itu satu sama lain, dalam rasio tertentu. Temuan ini, seperti rasio gabungan Dalton, adalah petunjuk awal sifat atom materi.
John Dalton[sunting | sunting sumber]

Pada tahun 1803, kimiawan dan ahli meteorologi Inggris John Dalton mengusulkan hukum Dalton, yang menjelaskan hubungan antara komponen dalam campuran gas dan tekanan relatif yang masing-masing berkontribusi pada campuran secara keseluruhan.[56] Ditemukan pada tahun 1801, konsep ini juga dikenal sebagai hukum tekanan parsial Dalton.
Dalton juga mengusulkan sebuah teori atom modern pada tahun 1803 yang menyatakan bahwa semua materi terdiri dari partikel-partikel kecil yang tak terpisahkan yang disebut atom, atom unsur tertentu memiliki karakteristik dan berat yang unik, dan terdapat tiga jenis atom: sederhana (unsur), senyawa (molekul sederhana), dan kompleks (molekul kompleks). Pada tahun 1808, Dalton pertama kali menerbitkan New System of Chemical Philosophy (1808-1827), di mana dia mengemukakan deskripsi ilmiah modern pertama tentang teori atom. Karya ini mengidentifikasi unsur-unsur kimia sebagai jenis atom tertentu, oleh karena itu menolak teori Newton tentang afinitas kimia.
Sebagai gantinya, Dalton menyimpulkan proporsi unsur dalam senyawa dengan mengambil rasio bobot reaktan, menetapkan berat atom hidrogen menjadi identik satu. Setelah Jeremias Benjamin Richter (dikenal dengan istilah stoikiometri), dia mengusulkan agar unsur kimia digabungkan dalam rasio integral. Ini dikenal sebagai hukum perbandingan berganda atau hukum Dalton, dan Dalton memasukkan deskripsi hukum yang jelas dalam New System of Chemical Philosophy. Hukum perbandingan berganda adalah salah satu hukum dasar stoikiometri yang digunakan untuk membangun teori atom. Terlepas dari kepentingan karyanya sebagai pandangan pertama tentang atom sebagai entitas fisika dan pengenalan sistem simbol kimia, New System of Chemical Philosophy mencurahkan teori kalori hampir sebanyak atomisme.
Kimiwawan Prancis Joseph Proust mengusulkan hukum perbandingan tetap, yang menyatakan bahwa unsur-unsur selalu bergabung dalam jumlah kecil, jumlah keseluruhan rasio untuk membentuk senyawa, berdasarkan beberapa percobaan yang dilakukan antara tahun 1797 dan 1804.[57] Bersama dengan hukum perbandingan berganda, hukum perbandingan tetap membentuk dasar stoikiometri. Hukum perbandingan tetap dan komposisi konstan tidak membuktikan bahwa atom ada, namun sulit untuk dijelaskan tanpa mengasumsikan bahwa senyawa kimia terbentuk saat atom bergabung dalam proporsi konstan.
Jöns Jacob Berzelius[sunting | sunting sumber]

Kimiawan Swedia dan murid Dalton, Jöns Jakob Berzelius memulai sebuah program sistematis untuk mencoba pengukuran kuantitatif yang akurat dan tepat serta memastikan kemurnian bahan kimia. Bersama Lavoisier, Boyle, dan Dalton, Berzelius dikenal sebagai bapak kimia modern. Pada tahun 1828 ia menyusun sebuah tabel berat atom relatif, di mana oksigen ditetapkan sama dengan 100, dan termasuk semua unsur yang diketahui pada saat itu. Karya ini memberikan bukti yang mendukung teori atom Dalton: bahwa senyawa kimia anorganik terdiri dari atom yang bergabung sesuai kaidah bilangan bulat. Dia menentukan unsur dasar yang tepat dari sejumlah besar senyawa. Hasilnya sangat menegaskan Hukum Perbandingan Tetap Proust. Dalam daftar beratnya, ia menggunakan oksigen sebagai standar, menetapkan beratnya sama persis dengan 100. Dia juga mengukur bobot 43 unsur. Ia menemukan bahwa bobot atom bukanlah kelipatan bilangan bulat dari berat hidrogen, Berzelius juga membantah hipotesis Prout bahwa unsur-unsur dibangun dari atom hidrogen.
Termotivasi oleh penentuan berat atom yang ekstensif dan keinginan untuk membantu eksperimennya, dia mempekenalkan sistem klasik simbol dan notasi kimia dengan menerbitkan Lärbok i Kemien pada tahun 1808, di mana unsur-unsur disingkat menjadi satu atau dua huruf untuk membuat singkatan yang berbeda dari nama Latin mereka. Sistem notasi kimia ini—di mana unsur-unsur diberi label tertulis sederhana, seperti O untuk oksigen, atau Fe untuk besi, dengan proporsi yang dinotasikan oleh angka—adalah sistem dasar yang sama seperti yang digunakan saat ini. Satu-satunya perbedaan adalah bahwa alih-alih nomor subskrip yang digunakan saat ini (mis., H2O), Berzelius menggunakan superskrip (H2O). Berzelius diakui sebagai yang berhasil mengidentifikasi unsur kimia silikon, selenium, torium, dan serium. Siswa yang bekerja di laboratorium Berzelius juga menemukan litium dan vanadium.
Berzelius mengembangkan teori kombinasi kimia radikal, yang berpendapat bahwa reaksi terjadi karena kelompok atom stabil yang disebut radikal dipertukarkan antar molekul. Dia meyakini bahwa garam adalah senyawa dari asam dan basa, dan menemukan bahwa anion dalam asam akan tertarik pada elektrode positif (anode), sedangkan kation dalam basa akan tertarik pada elektrode negatif (katode). Berzelius tidak percaya pada Teori Vitalisme, namun sebaliknya percaya dengan kekuatan regulatif yang menghasilkan pengorganisasian jaringan dalam organisme. Berzelius juga diakui sebagai yang memperkenalkan istilah kimia "katalisis", "polimer", "isomer", dan "alotrop", walaupun definisi aslinya sangat berbeda dibandingkan penggunaan modern. Sebagai contoh, dia menciptakan istilah "polimer" pada tahun 1833 untuk menggambarkan senyawa organik yang memiliki formula empiris identik namun berbeda berat molekulnya secara keseluruhan, senyawa yang lebih besar digambarkan sebagai "polimer" dari yang paling kecil. Dengan definisi pra-struktural ini, glukosa (C6H12O6) dipandang sebagai polimer formaldehida (CH2O).
Hukum-hukum baru unsur dan gas[sunting | sunting sumber]

Kimiawan Inggris Humphry Davy adalah pelopor dalam bidang elektrolisis, menggunakan tumpukan volta karya Alessandro Volta untuk memecah senyawa umum dan dengan demikian mengisolasi serangkaian unsur baru. Dia melanjutkan elektrolisis lelehan garam dan menemukan beberapa logam baru, terutama natrium dan kalium, unsur yang sangat reaktif yang dikenal sebagai logam alkali. Kalium, logam pertama yang diisolasi dengan elektrolisis, ditemukan pada tahun 1807 oleh Davy, yang mengambilnya dari bahan baku kaustik potas (KOH). Sebelum abad ke-19, tidak ada perbedaan antara kalium dan natrium. Natrium pertama kali diisolasi oleh Davy pada tahun yang sama dengan melewatkan arus listrik melalui natrium hidroksida (NaOH) cair. Ketika Davy mendengar bahwa Berzelius dan Pontin menyiapkan amalgam kalsium melalui elektrolisis kapur dalam merkuri, dia mencobanya sendiri. Davy berhasil, dan menemukan kalsium pada tahun 1808 dengan mengelektrolisis campuran kapur dan merkuri oksida.[58][59] Dia bekerja dengan elektrolisis sepanjang hidupnya dan, pada 1808, dia berhasil mengisolasi magnesium, strontium[60] dan barium.[61]
Davy juga bereksperimen dengan gas dengan menghirupnya. Prosedur percobaan ini hampir terbukti fatal pada beberapa kesempatan, namun mendorong penemuan efek dinitrogen monoksida yang tidak biasa, yang kemudian dikenal sebagai gas gelak. Klor ditemukan pada tahun 1774 oleh kimiawan Swedia Carl Wilhelm Scheele, yang menyebutnya "dephlogisticated marine acid" (lihat teori flogiston) dan secara keliru dianggap mengandung oksigen. Scheele mengamati beberapa sifat gas klorin, seperti efek memutihkan lakmus, efek mematikan serangga, berwarna kuning-hijau, dan baunya yang mirip dengan air raja. Namun, Scheele tidak bisa mempublikasikan temuannya saat itu. Pada tahun 1810, klorin diberi nama saat ini oleh Humphry Davy (berasal dari kata Yunani untuk hijau), yang menegaskan bahwa klorin sebenarnya adalah unsur.[62] Ia juga menunjukkan bahwa oksigen tidak dapat diperoleh dari zat yang dikenal sebagai asam oksimuriat (larutan HCl). Penemuan ini membalikkan definisi Lavoisier tentang asam sebagai senyawa oksigen. Davy adalah dosen yang populer dan mampu bereksperimen.

Kimiawan Prancis Joseph Louis Gay-Lussac berbagi minat dengan Lavoisier dan yang lainnya dalam studi kuantitatif tentang sifat gas. Dari program penelitian utamanya yang pertama pada tahun 1801–1802, dia menyimpulkan bahwa ekspansi volume gas berbanding lurus dengan kenaikan suhu: kesimpulan ini biasanya disebut "hukum Charles", karena Gay-Lussac memberi penghargaan pada Jacques Charles, yang telah sampai pada kesimpulan yang hampir sama pada tahun 1780-an namun tidak mempublikasikannya.[63] Hukum tersebut ditemukan secara terpisah oleh filsuf alam Inggris John Dalton pada tahun 1801, walaupun deskripsi Dalton kurang menyeluruh dibandingkan Gay-Lussac.[64][65] Pada tahun 1804 Gay-Lussac membuat beberapa pendakian tajam di atas 7.000 meter di atas permukaan laut dalam balon berisi hidrogen—sebuah prestasi yang tak tertandingi selama 50 tahun kemudian—yang memungkinkannya menyelidiki aspek lain dari gas. Dia tidak hanya mengumpulkan pengukuran magnetik di berbagai ketinggian, tapi juga mengukur tekanan, suhu, dan kelembaban serrta sampel udara, yang kemudian dianalisis secara kimia.
Pada tahun 1808 Gay-Lussac mengumumkan hal yang mungkin merupakan pencapaian terbesarnya: dari percobaannya sendiri dan orang lain, dia menyimpulkan bahwa gas pada suhu dan tekanan konstan akan bergabung dalam proporsi volume numerik sederhana, dan produk atau produk-produk yang dihasilkan—jika gas—juga menghasilkan proporsi sederhana volume produk terhadap volume reaktan. Dengan kata lain, gas di bawah kondisi suhu dan tekanan yang sama bereaksi satu sama lain dalam rasio volume bilangan bulat kecil. Kesimpulan ini kemudian dikenal sebagai "hukum Gay-Lussac" atau "Hukum Penggabungan Volume". Dengan rekan profesornya di École Polytechnique, Louis Jacques Thénard, Gay-Lussac juga berpartisipasi dalam penelitian elektrokimia awal, meneliti unsur-unsur yang ditemukan dengan metode elektrokimia. Di antara prestasi lainnya, mereka mendekomposisi asam borat dengan menggunakan leburan kalium, sehingga menemukan unsur boron. Keduanya juga mengambil bagian dalam debat kontemporer yang memodifikasi definisi Lavoisier tentang asam dan meneruskan programnya untuk menganalisis senyawa organik untuk kandungan oksigen dan hidrogennya.
Unsur iodium ditemukan oleh kimiawan Prancis Bernard Courtois pada tahun 1811.[66][67] Courtois memberi sampel kepada teman-temannya, Charles Bernard Desormes (1777–1862) dan Nicolas Clément (1779–1841), untuk melanjutkan penelitian. Dia juga memberikan beberapa sampel untuk Gay-Lussac dan fisikawan André-Marie Ampère. Pada tanggal 6 Desember 1813, Gay-Lussac mengumumkan bahwa zat baru tersebut merupakan unsur atau senyawa oksigen.[68][69][70] Gay-Lussac menyarankan nama "iode", dari kata Yunani ιώδες (iodes) untuk ungu (karena warna uap iodium).[66][68] Ampere telah memberikan beberapa sampelnya kepada Humphry Davy. Davy melakukan beberapa percobaan pada zat tersebut dan mencatat kemiripannya dengan klorin.[71] Davy mengirim surat tertanggal 10 Desember ke Royal Society of London yang menyatakan bahwa dia telah mengidentifikasi sebuah unsur baru.[72] Percekcokan meletus antara Davy dan Gay-Lussac tentang siapa yang pertama kali mengidentifikasi iodium, namun kedua ilmuwan tersebut mengakui Courtois sebagai ilmuwan pertama yang mengisolasi unsur tersebut.
Pada tahun 1815, Humphry Davy menemukan lampu Davy, yang memungkinkan penambang di dalam tambang batu bara aman bekerja dengan adanya gas yang mudah terbakar. Terdapat banyak ledakan tambang yang disebabkan oleh lembap api (Inggris: firedamp) atau metana yang sering tersulut oleh api terbuka dari lampu yang digunakan oleh para penambang. Davy membayangkan penggunaan kasa besi untuk menutupi nyala api lampu, sehingga mencegah pembakaran metana di dalam lampu agar tidak menyebar ke atmosfer luar. Meskipun gagasan tentang lampu keselamatan (Inggris: safety lamp) telah ditunjukkan oleh William Reid Clanny dan oleh insinyur tak dikenal (tapi belakangan sangat terkenal) George Stephenson, penggunaan kawat kasa Davy untuk mencegah penyebaran api digunakan oleh banyak penemu lainnya pada desain mereka selanjutnya. Ada beberapa diskusi mengenai apakah Davy telah menemukan prinsip-prinsip di balik lampunya tanpa bantuan karya Smithson Tennant, namun pada umumnya disepakati bahwa kedua pria tersebut masing-masing bekerja secara terpisah. Davy menolak untuk mematenkan lampu tersebut, dan penemuannya menyebabkan dia dianugerahi medali Rumford pada tahun 1816.[73]

Setelah Dalton menerbitkan teori atomnya pada tahun 1808, beberapa gagasan utamanya segera diadopsi oleh sebagian kimiawan. Namun, ketidakpastian bertahan selama setengah abad tentang bagaimana teori atom dikonfigurasi dan diterapkan pada situasi nyata; kimiawan di berbagai negara mengembangkan beberapa sistem atomistik yang tidak kompatibel. Sebuah makalah yang menyarankan jalan keluar dari situasi sulit ini diterbitkan pada awal tahun 1811 oleh fisikawan Italia Amedeo Avogadro (1776-1856), yang menghipotesiskan bahwa volume gas yang sama pada suhu dan tekanan yang sama mengandung jumlah molekul yang sama, kemudian diikuti bahwa berat molekul relatif dari dua gas adalah sama dengan perbandingan densitas kedua gas tersebut di bawah kondisi suhu dan tekanan yang sama. Avogadro juga beralasan bahwa gas sederhana tidak terbentuk dari atom tunggal tapi merupakan molekul senyawa dari dua atau lebih atom. Dengan demikian Avogadro mampu mengatasi kesulitan yang dihadapi Dalton dan lainnya saat Gay-Lussac melaporkan bahwa di atas 100 °C volume uap air dua kali volume oksigen yang digunakan untuk membentuknya. Menurut Avogadro, molekul oksigen telah terbagi menjadi dua atom dalam proses pembentukan uap air.
Hipotesis Avogadro tidak diakui selama setengah abad setelah pertama kali dipublikasikan. Banyak alasan pengabaian ini telah dikutip, termasuk beberapa masalah teoretis, seperti "dualisme" versi Jöns Jakob Berzelius, yang menegaskan bahwa senyawa disatukan oleh daya tarik muatan listrik positif dan negatif, sehingga tidak terbayangkan bahwa bisa ada sebuah molekul yang terdiri dari dua atom dengan muatan listrik yang sama—seperti oksigen. Kendala tambahan untuk mengakuinya adalah kenyataan bahwa banyak kimiawan enggan mengadopsi metode fisika (seperti penentuan densitas uap) untuk memecahkan masalah mereka. Pada pertengahan abad, beberapa tokoh terkemuka mulai memandang eskalasi kekacauan persaingan sistem berat atom dan rumus molekul sebagai tak dapat ditoleransi lagi. Selain itu, bukti kimia murni mulai terkuak yang mengarah pada kemungkinan bahwa pendekatan Avogadro adalah benar. Selama tahun 1850-an, kimiawan yang lebih muda, seperti Alexander Williamson di Inggris, Charles Gerhardt dan Charles-Adolphe Wurtz di Prancis, serta August Kekulé di Jerman, mulai menganjurkan reformasi kimia teoretis agar konsisten dengan teori Avogadro
Wöhler dan debat vitalisme[sunting | sunting sumber]

Pada tahun 1825, Friedrich Wöhler dan Justus von Liebig melakukan penemuan dan penjelasan pertama tentang isomer, yang sebelumnya dinamai oleh Berzelius. Bekerja dengan asam sianat dan asam fulminat, mereka menyimpulkan dengan tepat bahwa isomerisme disebabkan oleh perbedaan susunan atom dalam struktur molekul. Pada tahun 1827, William Prout mengklasifikasikan biomolekul ke dalam kelompok modern: karbohidrat, protein dan lipida. Setelah sifat pembakaran diselesaikan, perselisihan tentang vitalisme dan perbedaan penting antara zat organik dan anorganik dimulai. Pertanyaan vitalisme direvolusi pada tahun 1828 ketika Friedrich Wöhler mensintesis urea, sehingga menetapkan bahwa senyawa organik dapat diproduksi dari bahan awal anorganik dan menyangkal teori vitalisme.
Ini membuka bidang penelitian baru dalam bidang kimia, dan pada akhir abad ke-19, para ilmuwan mampu mensintesis ratusan senyawa organik. Senyawa terpenting di antaranya adalah mauve (ungu muda), magenta, dan pewarna sintetis lainnya, serta aspirin obat yang banyak digunakan. Penemuan sintesis urea buatan memberikan kontribusi besar terhadap teori isomerisme, karena rumus kimia empiris untuk urea dan amonium sianat identik (lihat sintesis Wöhler). Pada tahun 1832, Friedrich Wöhler dan Justus von Liebig menemukan dan menjelaskan gugus fungsional dan radikal dalam kaitannya dengan kimia organik, serta pertama kali mensintesis benzaldehida. Liebig, seorang kimiawan Jerman, memberikan kontribusi besar pada pertanian dan kimia biologi, dan bekerja pada organisasi kimia organik. Liebig dianggap sebagai "bapak industri pupuk" karena penemuan nitrogen sebagai nutrisi tanaman esensial, dan perumusan Hukum Minimum yang menggambarkan efek masing-masing nutrisi pada tanaman pangan.
Pertengahan 1800-an[sunting | sunting sumber]
Pada tahun 1840, Germain Hess mengajukan hukum Hess, sebuah pernyataan awal tentang hukum kekekalan energi, yang menetapkan bahwa perubahan energi dalam proses kimia hanya bergantung pada keadaan bahan awal dan produk dan bukan pada jalur spesifik yang diambil antara keduanya. Pada tahun 1847, Hermann Kolbe memperoleh asam asetat dari sumber yang sepenuhnya anorganik, yang menyangkal vitalisme lebih jauh. Pada tahun 1848, William Thomson, 1st Baron Kelvin (umumnya dikenal sebagai Lord Kelvin) menetapkan konsep nol mutlak, suhu di mana semua gerakan molekuler berhenti. Pada tahun 1849, Louis Pasteur menemukan bahwa bentuk rasemat dari asam tartrat adalah campuran levorotatori dan dekstrorotatori, sehingga menjelaskan sifat rotasi optik dan memajukan bidang stereokimia.[74] Pada tahun 1852, Agustus Beer mengajukan hukum Beer, yang menjelaskan hubungan antara komposisi campuran dengan jumlah cahaya yang akan diserapnya. Berdasarkan sebagian dari karya sebelumnya oleh Pierre Bouguer dan Johann Heinrich Lambert, ia menetapkan teknik analisis yang dikenal sebagai spektrofotometri.[75] Pada tahun 1855, Benjamin Silliman, Jr memelopori metode pemecahan petroleum, yang memungkinkan terjadinya industri petrokimia modern.[76]

Hipotesis Avogadro mulai mendapat daya tarik yang cukup besar di kalangan kimiawan hanya setelah rekan ilmuwan senegaranya Stanislao Cannizzaro menunjukkan nilainya pada tahun 1858, dua tahun setelah kematian Avogadro. Minat kimia Cannizzaro pada awalnya berpusat pada produk alami dan reaksi senyawa aromatik; pada tahun 1853 ia menemukan bahwa ketika benzaldehida diberi perlakuan dengan basa pekat, dihasilkan asam benzoat dan benzil alkohol—suatu fenomena yang dikenal saat ini sebagai reaksi Cannizzaro. Dalam pamfletnya pada tahun 1858, Cannizzaro menunjukkan bahwa kembalinya gagasan Avogadro dapat digunakan sepenuhnya untuk membangun struktur teoretis yang konsisten dan kokoh yang sesuai dengan hampir semua bukti empiris yang ada. Misalnya, dia menunjuk pada bukti yang menyarankan bahwa tidak semua gas elementer terdiri dari dua atom per molekul—ada yang monatomik, kebanyakan diatomik, dan beberapa bahkan lebih kompleks lagi.
Sumber perseteruan lainnya adalah rumus untuk senyawa logam alkali (seperti natrium) dan logam alkali tanah (seperti kalsium), yang, menurut analogi kimianya, kebanyakan ahli kimia ingin menetapkan jenis rumus yang sama. Cannizzaro berpendapat bahwa menempatkan logam-logam ini dalam kategori yang berbeda memiliki hasil yang menguntungkan untuk menghilangkan anomali tertentu saat menggunakan sifat fisiknya untuk menyimpulkan bobot atom. Sayangnya, pamflet Cannizzaro awalnya hanya diterbitkan di Italia dan memiliki sedikit dampak langsung. Terobosan sesungguhnya datang dengan sebuah kongres kimia internasional yang diadakan di kota Karlsruhe, Jerman pada bulan September 1860, di mana sebagian besar kimiawan terkemuka Eropa hadir. Kongres Karlsruhe telah diatur oleh Kekulé, Wurtz, dan beberapa orang lain yang menyukai pandangan Cannizzaro tentang arah kimia yang seharusnya. Berbicara dalam bahasa Prancis (seperti semua orang di sana), kefasihan dan logika Cannizzaro membuat kesan yang tak terhapuskan pada hadirin berkumpul. Selain itu, temannya Angelo Pavesi membagikan pamflet Cannizzaro kepada hadirin di akhir pertemuan; lebih dari satu kimiawan kemudian menulis tentang kesan yang menentukan setelah membaca dokumen yang dibagikan. Misalnya, Lothar Meyer kemudian menulis bahwa saat membaca makalah Cannizzaro, "Timbangan tampak jatuh dari mataku."[77] Cannizzaro memainkan peran penting dalam memenangkan pertarungan untuk reformasi. Sistem yang dianjurkan olehnya, dan segera setelah itu diadopsi oleh sebagian besar ahli kimia terkemuka, secara substansial identik dengan apa yang masih digunakan saat ini.
Perkin, Crookes, dan Nobel[sunting | sunting sumber]
Pada tahun 1856, Sir William Henry Perkin, usia 18, diberi tantangan oleh profesornya, August Wilhelm von Hofmann, berusaha untuk mensintesis kuinina, obat anti malaria, dari tar batubara. Dalam satu percobaan, Perkin mengoksidasi anilin menggunakan kalium dikromat, tetapi toluidina, sebagai ketakmurnian, bereaksi dengan anilin dan menghasilkan padatan hitam—yang berarti sintesis organik "gagal". Ketika membersihkan labu dengan alkohol, Perkin melihat bagian ungu dari larutan: hasil sampingan dari usaha tersebut adalah zat warna sintetis pertama, yang dikenal sebagai mauveine atau ungu Perkin. Penemuan Perkin adalah fondasi industri zat warna sintetis, salah satu industri kimia yang sukses paling awal.
Kontribusi kimiawan Jerman August Kekulé von Stradonitz yang paling penting adalah teori struktur komposisi organiknya, yang digariskan dalam dua artikel yang diterbitkan pada tahun 1857 dan 1858 dan didetailkan dengan sangat rinci di halaman buku yang luar biasa populer Lehrbuch der Organischen Chemie ("Buku Teks Kimia Organik" ), terbitan pertama muncul pada tahun 1859 dan secara bertahap diperluas menjadi empat volume. Kekulé berpendapat bahwa atom karbon tetravalen - yaitu, karbon yang membentuk empat ikatan kimia - dapat dihubungkan bersama untuk membentuk apa yang disebutnya "rantai karbon" atau "kerangka karbon", yang mana atom lain beserta valensinya (seperti hidrogen, oksigen, nitrogen, dan klorin) bisa bergabung. Dia yakin bahwa adalah mungkin bagi kimiawan untuk menentukan rincian arsitektur molekul ini setidaknya untuk senyawa organik sederhana yang dikenal pada zamannya. Kekulé bukan satu-satunya kimiawan yang membuat klaim semacam itu di zamannya. Kimiawan Skotlandia Archibald Scott Couper menerbitkan teori yang hampir sama di saat yang hampir bersamaan, dan kimiawan Rusia Aleksandr Butlerov banyak menjelaskan dan memperluas teori struktur. Namun, sebagian besar yang berlaku di komunitas kimia adalah ide Kekulé.

Kimiawan sekaligus fisikawan Inggris William Crookes terkenal karena studinya tentang sinar katoda, yang fundamental dalam pengembangan fisika atom. Penelitiannya tentang pelepasan listrik melalui gas langka membuatnya mengamati ruang gelap di sekitar katoda, yang sekarang disebut ruang gelap Crookes. Dia menunjukkan bahwa sinar katoda berjalan dalam garis lurus dan menghasilkan fosforesensi dan panas saat mereka menumbuk bahan tertentu. Pelopor tabung hampa udara, Crookes menemukan tabung Crookes - tabung pelepasan eksperimental awal, dengan vakum parsial yang dengannya dia mempelajari perilaku sinar katoda. Dengan diperkenalkannya analisis spektrum oleh Robert Bunsen dan Gustav Kirchhoff (1859-1860), Crookes menerapkan teknik baru untuk mempelajari senyawa selenium. Bunsen dan Kirchoff sebelumnya menggunakan spektroskopi sebagai alat analisis kimia untuk menemukan sesium dan rubidium. Pada tahun 1861, Crookes menggunakan proses ini untuk menemukan talium di beberapa deposit seleniferous. Dia terus meneliti unsur baru itu, mengisolasinya, mempelajari sifat-sifatnya, dan pada tahun 1873 menentukan berat atomnya. Selama studi tentang talium, Crookes menemukan prinsip radiometer Crookes, alat yang mengubah radiasi cahaya menjadi gerakan berputar. Prinsip radiometer ini telah menemukan banyak aplikasi dalam pengembangan alat ukur yang sensitif.
Pada tahun 1862, Alexander Parkes memamerkan Parkesine, salah satu polimer sintetis paling awal, di International Exhibition di London. Penemuan ini merupakan fondasi industri plastik modern. Pada tahun 1864, Cato Maximilian Guldberg dan Peter Waage, berdasarkan gagasan Claude Louis Berthollet, mengusulkan hukum aksi massa. Pada tahun 1865, Johann Josef Loschmidt menentukan jumlah molekul yang tepat dalam satu mol, yang kemudian dinamakan bilangan Avogadro.
Pada tahun 1865, August Kekulé, yang sebagian didasarkan pada karya Loschmidt dan lainnya, membentuk struktur benzena sebagai enam cincin karbon dengan ikatan tunggal dan ganda berselang-seling. Usulan baru Kekulé untuk struktur siklik benzena banyak diperebutkan namun tidak pernah digantikan oleh teori yang lebih baik. Teori ini memberikan dasar ilmiah untuk ekspansi dramatis industri kimia Jerman pada sepertiga terakhir abad ke-19. Saat ini, sebagian besar senyawa organik yang dikenal bersifat aromatik, dan semuanya mengandung setidaknya satu cincin benzen heksagonal dari jenis yang dianjurkan Kekulé. Kekulé juga terkenal karena telah mengklarifikasi sifat senyawa aromatik, yang merupakan senyawa berdasarkan molekul benzena. Pada tahun 1865, Adolf von Baeyer mulai meneliti pewarna indigo, sebuah tonggak sejarah dalam industri modern kimia organik yang merevolusi industri bahan pewarna.
Kimiawan dan penemu Swedia Alfred Nobel menemukan bahwa ketika nitrogliserin dimasukkan ke dalam zat penyerap lembam seperti kieselguhr (tanah diatome), ia menjadi lebih aman dan lebih nyaman untuk ditangani, dan campuran ini ia patenkan pada tahun 1867 sebagai dinamit. Nobel kemudian menggabungkan nitrogliserin dengan berbagai senyawa nitroselulosa, mirip dengan kolodion, namun diimbangi dengan resep yang lebih efisien yang menggabungkan bahan peledak nitrat lainnya, dan diperoleh zat mirip jeli yang transparan, yang merupakan bahan peledak yang lebih kuat daripada dinamit. Gelignite, atau gelatin peledak, seperti namanya, dipatenkan pada tahun 1876; dan diikuti oleh sejumlah kombinasi serupa, dimodifikasi dengan penambahan kalium nitrat dan berbagai zat lainnya.
Tabel periodik Mendeleev[sunting | sunting sumber]

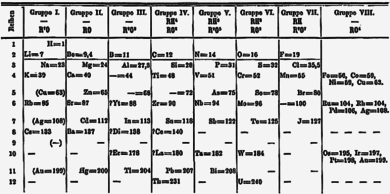
Terobosan penting dalam memahami daftar unsur kimia yang diketahui (dan juga untuk memahami struktur internal atom) adalah karya Dmitri Mendeleev dalam pengembangan tabel periodik modern pertama, atau klasifikasi unsur secara periodik. Mendeleev, seorang kimiawan Rusia, merasa bahwa ada beberapa jenis urutan unsur dan dia menghabiskan lebih dari tiga belas tahun hidupnya untuk mengumpulkan data dan mengumpulkan konsep tersebut, awalnya dengan gagasan untuk menyelesaikan beberapa ketakteraturan di lapangan untuk para siswanya. Mendeleev menemukan bahwa, ketika semua unsur kimia yang diketahui diatur sedemikian rupa sesuai urutan kenaikan berat atom, tabel yang dihasilkan menunjukkan pola berulang, atau periodisitas, sifat dalam golongan unsur. Hukum Mendeleev mengizinkannya membangun sebuah tabel periodik yang sistematis dari semua 66 unsur yang dikenal berdasarkan massa atom, yang dia publikasikan dalam Principles of Chemistry pada tahun 1869. Tabel Periodik pertamanya disusun berdasarkan susunan unsur dalam urutan kenaikan berat atom dan mengelompokkan mereka berdasarkan kemiripan sifat.
Mendeleev memiliki kepercayaan pada validitas hukum periodik bahwa dia mengusulkan perubahan pada nilai bobot atom yang dari beberapa unsur dan, dalam tabel periodiknya versi tahun 1871, meramalkan lokasi unsur yang belum diketahui di dalam tabel bersama dengan sifat-sifatnya mereka. Dia bahkan meramalkan kemungkinan sifat dari tiga unsur yang belum ditemukan, yang disebut ekaboron (Eb), ekaaluminium (Ea), dan ekasilicon (Es), yang terbukti merupakan ramalan yang baik dari sifat skandium, galium, dan germanium, yang masing-masing mengisi titik-titik yang telah ditetapkan oleh Mendeleev pada tabel periodik.
Awalnya sistem periodik tidak menimbulkan minat di kalangan kimiawan. Namun, dengan ditemukannya unsur yang telah diprediksi, terutama galium pada tahun 1875, skandium pada tahun 1879, dan germanium pada tahun 1886, sistem ini mulai mendapat penerimaan yang luas. Bukti-bukti ramalan berikutnya membawa ketenaran kepada Mendeleev sebagai penemu hukum periodik. Pengelolaan ini melampaui upaya klasifikasi sebelumnya oleh Alexandre-Émile Béguyer de Chancourtois, yang menerbitkan heliks telurik, sebuah tabel periodik unsur-unsur versi tiga dimensi pada tahun 1862, John Newlands, yang mengusulkan hukum oktaf (prekursor hukum periodik) pada tahun 1864, dan Lothar Meyer, yang mengembangkan versi awal tabel periodik dengan 28 unsur yang ditata berdasarkan valensi pada tahun 1864. Tabel Mendeleev tidak memasukkan gas mulia, yang belum ditemukan. Secara bertahap, hukum dan tabel periodik menjadi kerangka kerja bagi sebagian besar teori kimia. Pada saat Mendeleev meninggal pada tahun 1907, dia menikmati pengakuan internasional dan telah menerima perbedaan dan penghargaan dari banyak negara.
Pada tahun 1873, Jacobus Henricus van 't Hoff dan Joseph Achille Le Bel, yang bekerja secara terpisah, mengembangkan model ikatan kimia yang menjelaskan eksperimen khiralitas Pasteur dan memberikan penyebab fisik aktivitas optik pada senyawa khiral.[78] Publikasi van 't Hoff, yang disebut Voorstel tot Uitbreiding der Tegenwoordige in de Scheikunde gebruikte Structuurformules in de Ruimte, dll. (Proposal untuk pengembangan rumus struktur kimia 3 dimensi) dan terdiri dari dua belas halaman teks dan satu halaman diagram, memberikan dorongan untuk pengembangan stereokimia. Konsep "atom karbon asimetris", yang dibahas dalam publikasi ini, memberikan penjelasan tentang terjadinya banyak isomer, yang dapat dijelaskan dengan menggunakan rumus struktur saat ini. Pada saat bersamaan ia menunjukkan adanya hubungan antara aktivitas optik dan adanya atom karbon asimetris.
Josiah Willard Gibbs[sunting | sunting sumber]

Karya fisikawan matematika Amerika J. Willard Gibbs pada aplikasi termodinamika sangat berperan dalam mengubah kimia fisik menjadi sains deduktif yang ketat. Selama tahun 1876 sampai 1878, Gibbs meneliti prinsip-prinsip termodinamika, menerapkannya pada proses kompleks yang terlibat dalam reaksi kimia. Ia menemukan konsep potensial kimia, atau "bahan bakar" yang membuat reaksi kimia bekerja. Pada tahun 1876 ia menerbitkan kontribusinya yang paling terkenal, "On the Equilibrium of Heterogeneous Substances", sebuah kompilasi karyanya tentang termodinamika dan kimia fisik yang mengemukakan konsep energi bebas untuk menjelaskan dasar fisika kesetimbangan kimia.[79] Kandungan esai ini adalah awal dari teori Gibbs mengenai fase materi: dia menganggap setiap keadaan materi merupakan fase, dan setiap zat adalah komponen. Gibbs mengambil semua variabel yang terlibat dalam reaksi kimia - suhu, tekanan, energi, volume, dan entropi - dan memasukkannya ke dalam satu persamaan sederhana yang dikenal sebagai kaidah fase Gibbs.
Isi makalah ini mungkin merupakan kontribusinya yang paling menonjol, pengenalan konsep energi bebas, yang sekarang secara universal disebut energi bebas Gibbs untuk menghormatinya. Energi bebas Gibbs menghubungkan kecenderungan sistem fisika atau kimia untuk secara bersamaan menurunkan energinya dan meningkatkan ketakteraturannya, atau entropi, dalam proses alami spontan. Pendekatan Gibbs memungkinkan para peneliti untuk menghitung perubahan energi bebas dalam prosesnya, seperti dalam reaksi kimia, dan seberapa cepat hal itu akan terjadi. Karena hampir semua proses kimia dan banyak proses fisika melibatkan perubahan semacam itu, karyanya telah secara signifikan mempengaruhi aspek teoretis dan pengalaman dari sains ini. Pada tahun 1877, Ludwig Boltzmann menetapkan derivasi statistika dari banyak konsep penting fisika dan kimia, termasuk entropi, dan distribusi kecepatan molekul dalam fase gas.[80] Bersama Boltzmann dan James Clerk Maxwell, Gibbs menciptakan sebuah cabang baru dari teori fisika yang disebut mekanika statistika (istilah yang dia ciptakan), yang menjelaskan hukum termodinamika sebagai konsekuensi dari sifat statistik ensambel besar partikel. Gibbs juga meneliti penerapan persamaan Maxwell terhadap masalah optik fisik. Derivasi Gibbs dari hukum fenomenologis termodinamika dari sifat statistik sistem dengan banyak partikel disajikan dalam buku teks utamanya yang sangat berpengaruh Elementary Principles in Statistical Mechanics, yang diterbitkan pada tahun 1902, setahun sebelum kematiannya. Dalam karyanya itu, Gibbs meninjau kembali hubungan antara hukum termodinamika dan teori statistika gerakan molekul. Melampaui fungsi asli dengan jumlah parsial deret Fourier pada titik diskontinuitas dikenal sebagai fenomena Gibbs.
Akhir abad ke-19[sunting | sunting sumber]
Penemuan insinyur Jerman Carl von Linde tentang proses kontinu pencairan gas dalam jumlah banyak membentuk dasar teknologi refrigerasi modern dan memberikan dorongan dan sarana untuk melakukan penelitian ilmiah pada suhu rendah dan vakum yang sangat tinggi. Dia mengembangkan kulkas metil eter (1874) dan lemari es amonia (1876). Meskipun unit pendingin lain telah dikembangkan sebelumnya, karya Linde adalah yang pertama dirancang dengan tujuan perhitungan efisiensi yang tepat. Pada tahun 1895 ia mendirikan pabrik berskala besar untuk produksi udara cair. Enam tahun kemudian ia mengembangkan metode untuk memisahkan oksigen cair murni dari udara cair yang menghasilkan konversi industri yang luas pada proses yang memanfaatkan oksigen (misal, dalam pembuatan baja).
Pada tahun 1883, Svante Arrhenius mengembangkan teori ion untuk menjelaskan konduktivitas dalam elektrolit.[81] Pada tahun 1884, Jacobus Henricus van 't Hoff menerbitkan Études de Dynamique chimique (Studi Kimia Dinamis), sebuah studi awal mengenai kinetika kimia.[82] Dalam karyanya ini, van 't Hoff memasuki bidang kimia fisik untuk pertama kalinya. Hal yang sangat penting adalah pengembangannya pada hubungan termodinamika umum antara panas konversi dan perpindahan kesetimbangan sebagai hasil variasi suhu. Pada volume konstan, kesetimbangan dalam suatu sistem akan cenderung bergeser ke arah yang berlawanan dari perubahan suhu yang dikenakan pada sistem. Dengan demikian, penurunan suhu menyebabkan panas berkembang sambil meningkatkan suhu hasil penyerapan panas. Prinsip kesetimbangan bergerak ini kemudian (1885) dimasukkan ke dalam bentuk umum oleh Henry Louis Le Chatelier, yang memberikan prinsip untuk memasukkan kompensasi, dengan perubahan volume, untuk perubahan tekanan yang dipaksakan. Prinsip van 't Hoff-Le Chatelier, atau singkatnya prinsip Le Chatelier, menjelaskan respons kesetimbangan kimia dinamis terhadap tekanan eksternal.[83]
Pada tahun 1884, Hermann Emil Fischer mengusulkan struktur purin, struktur kunci dalam banyak biomolekul, yang kemudian disintesisnya pada tahun 1898. Dia juga mulai meneliti kimia glukosa dan gula yang terkait.[84] Pada tahun 1885, Eugene Goldstein menamai sinar katoda, yang kemudian ditemukan terdiri dari elektron, dan sinar kanal, kemudian ditemukan sebagai ion hidrogen positif yang telah dilucuti dari elektron mereka dalam tabung sinar katoda; ini kemudian diberi nama proton.[85] Tahun 1885 juga mengalami penerbitan buku J. H. van 't Hoff L'Équilibre chimique dans les Systèmes gazeux ou dissous à I'État dilué (Kesetimbangan kimia dalam sistem gas atau larutan yang sangat encer), yang membahas teori larutan encer ini. Dalam bukunya, dia menunjukkan bahwa "tekanan osmotik" dalam larutan yang cukup encer sebanding dengan konsentrasi dan suhu absolut sehingga tekanan ini dapat ditunjukkan dengan rumus yang hanya menyimpang dari rumus tekanan gas dengan koefisien i. Dia juga menentukan nilai i dengan berbagai metode, misalnya dengan cara tekanan uap dan hasil François-Marie Raoult pada penurunan titik beku. Dengan demikian van 't Hoff dapat membuktikan bahwa hukum termodinamika tidak hanya berlaku untuk gas, tetapi juga untuk larutan encer. Hukum tekanannya, yang diberikan validitas umum oleh teori disosiasi elektrolitik Arrhenius (1884-1887) - orang asing pertama yang datang untuk bekerja dengannya di Amsterdam (1888) - dianggap paling komprehensif dan penting dalam dunia ilmu alam. Pada tahun 1893, Alfred Werner menemukan struktur oktahedral kompleks kobalt, sehingga membentuk bidang ilmu kimia koordinasi.[86]
Ramsay menemukan gas mulia[sunting | sunting sumber]
Penemuan paling terkenal dibuat oleh kimiawan Skotlandia William Ramsay dalam kimia anorganik. Ramsay terinspirasi oleh penemuan fisikawan Inggris John Strutt, 3rd Baron Rayleigh pada 1892 yang menyatakan bahwa berat atom nitrogen yang ditemukan pada senyawa kimia lebih rendah daripada nitrogen yang ditemukan di atmosfer. Dia menganggap perbedaan ini pada gas ringan yang termasuk dalam senyawa kimia nitrogen, sementara Ramsay menduga adanya gas berat yang sampai sekarang belum ditemukan dalam nitrogen di atmosfer. Dengan menggunakan dua metode yang berbeda untuk menghilangkan semua gas yang diketahui dari udara, Ramsay dan Lord Rayleigh dapat mengumumkan pada tahun 1894 bahwa mereka telah menemukan unsur gas monatomik yang bersifat lembam yang membentuk hampir 1 persen atmosfer; mereka menamainya argon.

Tahun berikutnya, Ramsay membebaskan gas lembam lainnya dari mineral yang disebut kleveit; ini terbukti adalah helium, yang sebelumnya hanya dikenal di spektrum matahari. Dalam bukunya The Gases of the Atmosphere (1896), Ramsay menunjukkan bahwa posisi helium dan argon dalam tabel periodik unsur kimia menunjukkan bahwa setidaknya ada tiga gas mulia lagi yang mungkin ada. Pada tahun 1898 Ramsay dan kimiawan Inggris Morris W. Travers mengisolasi unsur-unsur ini—yang disebut neon, kripton, dan xenon—dari udara yang dicairkan pada suhu rendah dan tekanan tinggi. Sir William Ramsay bekerja dengan Frederick Soddy untuk menunjukkan, pada tahun 1903, bahwa partikel alfa (inti helium) terus diproduksi selama peluruhan radioaktif sampel radium. Ramsay dianugerahi Hadiah Nobel bidang Kimia pada tahun 1904 sebagai pengakuan atas "layanan dalam penemuan unsur gas lembam di udara, dan penentuan tempatnya dalam sistem periodik."
Pada tahun 1897, J. J. Thomson menemukan elektron menggunakan tabung sinar katoda. Pada tahun 1898, Wilhelm Wien menunjukkan bahwa sinar kanal (aliran ion positif) dapat dibelokkan oleh medan magnet, dan bahwa jumlah defleksi sebanding dengan rasio massa terhadap muatan. Penemuan ini akan menghasilkan teknik analisis yang dikenal sebagai spektrometri massa pada tahun 1912.[87]
Marie dan Pierre Curie[sunting | sunting sumber]

Marie Skłodowska-Curie adalah seorang fisikawati dan kimiawati Prancis kelahiran Polandia yang terkenal dengan penelitian rintisannya tentang radioaktivitas. Dia dan suaminya dianggap telah meletakkan batu penjuru zaman nuklir dengan penelitian mereka tentang radioaktivitas. Marie terpesona dengan karya Henri Becquerel, seorang fisikawan Prancis yang menemukan pada tahun 1896 bahwa uranium melepaskan sinar yang mirip dengan sinar-X yang ditemukan oleh Wilhelm Röntgen. Marie Curie mulai mempelajari uranium pada akhir 1897 dan berteori, menurut sebuah artikel tahun 1904 yang dia tulis untuk majalah Century, "bahwa emisi sinar oleh senyawa uranium adalah sifat logam itu sendiri—bahwa itu adalah sifat atom unsur uranium yang terlepas dari keadaan kimia atau fisikanya." Curie mengambil pekerjaan Becquerel beberapa langkah lebih jauh, melakukan eksperimennya sendiri pada sinar uranium. Dia menemukan bahwa sinarnya tetap konstan, tidak peduli kondisi atau bentuk uraniumnya. Sinar itu, dia berteori, berasal dari struktur atom unsur. Ide revolusioner ini menciptakan bidang fisika atom dan Curie menciptakan kata radioaktivitas untuk menjelaskan fenomena tersebut.

Pierre dan Marie lebih jauh mengeksplorasi radioaktivitas dengan bekerja memisahkan zat dalam bijih uranium dan kemudian menggunakan elektrometer untuk melakukan pengukuran radiasi guna 'melacak' jumlah unsur radioaktif renik yang tidak diketahui di antara fraksi yang dihasilkan. Bekerja dengan mineral pitchblende, pasangan ini menemukan unsur radioaktif baru pada tahun 1898. Mereka menamakan unsur tersebut polonium, sesuai negara asal Marie, Polandia. Pada tanggal 21 Desember 1898, pasangan Curie mendeteksi adanya bahan radioaktif lain dalam pitchblende. Mereka mempresentasikan temuan ini pada French Academy of Sciences pada tanggal 26 Desember, mengusulkan bahwa unsur baru itu disebut radium. Pasangan Curie kemudian bekerja untuk mengisolasi polonium dan radium dari senyawa alami untuk membuktikan bahwa keduanya adalah unsur baru. Pada tahun 1902, pasangan Curie mengumumkan bahwa mereka telah menghasilkan satu desigram radium murni, yang menunjukkan keberadaannya sebagai unsur kimia yang unik. Sementara butuh tiga tahun bagi mereka untuk mengisolasi radium, mereka tidak pernah bisa mengisolasi polonium. Seiring dengan ditemukannya dua unsur baru dan teknik penemuan untuk mengisolasi isotop radioaktif, Curie mengawal studi pertama di dunia dalam pengobatan neoplasma, dengan menggunakan isotop radioaktif. Dengan Henri Becquerel dan suaminya, Pierre Curie, dia dianugerahi penghargaan Hadiah Nobel bidang Fisika 1903. Dia adalah pemenang tunggal Hadiah Nobel bidang Kimia 1911. Dia adalah wanita pertama yang memenangkan Hadiah Nobel, dan dia adalah satu-satunya wanita yang memenangkan penghargaan tersebut dalam dua bidang yang berbeda.
Saat bekerja dengan Marie untuk mengekstraksi zat murni dari bijihnya, usaha yang benar-benar membutuhkan sumber daya industri namun dapat mereka capai dalam kondisi yang relatif primitif, Pierre sendiri berkonsentrasi pada studi fisika (termasuk efek luminasi dan kimia) radiasi baru. Melalui aksi medan magnet pada sinar yang dihasilkan oleh radium, ia membuktikan adanya partikel listrik positif, negatif, dan netral; inilah yang kemudian disebut oleh Ernest Rutherford sebagai sinar alfa, beta, dan gamma. Pierre kemudian mempelajari radiasi ini dengan kalorimetri dan juga mengamati efek fisiologis radium, sehingga membuka jalan menuju terapi radium. Di antara penemuan Pierre Curie adalah zat feromagnetik yang menunjukkan transisi suhu kritis, yang di atas suhu tersebut zat kehilangan perilaku feromagnetiknya - ini dikenal sebagai "titik Curie". Dia terpilih menjadi anggota Academy of Sciences (1905), setelah pada tahun 1903 bersama Marie menerima Medali Davy Royal Society yang bergengsi dan bersama-sama dengan Marie dan Becquerel mendapat Hadiah Nobel bidang Fisika. Dia dilindas sebuah kereta kuda di rue Dauphine, Paris pada tahun 1906 dan meninggal seketika. Karya lengkapnya diterbitkan pada tahun 1908.
Ernest Rutherford[sunting | sunting sumber]

Kimia dan fisikawan kelahiran Selandia Baru Ernest Rutherford dianggap sebagai "bapak fisika nuklir." Rutherford terkenal karena menemukan nama alfa, beta, dan gamma untuk mengklasifikasikan berbagai bentuk "sinar" radioaktif yang kurang dipahami pada masanya (sinar alfa dan beta adalah berkas partikel, sedangkan sinar gamma adalah bentuk radiasi elektromagnetik berenergi tinggi). Rutherford membelokkan sinar alfa dengan medan listrik dan medan magnet pada tahun 1903. Bekerja dengan Frederick Soddy, Rutherford menjelaskan bahwa radioaktivitas disebabkan oleh transmutasi unsur, yang sekarang diketahui melibatkan reaksi nuklir.

Dia juga mengamati bahwa intensitas radioaktivitas unsur radioaktif menurun selama jumlah waktu yang unik dan teratur sampai pada titik stabilitas, dan dia menamai waktu menjadi setengah itu dengan "waktu paruh" (Inggris: "half-life"). Pada tahun 1901 dan 1902 ia bekerja dengan Frederick Soddy untuk membuktikan bahwa atom dari satu unsur radioaktif secara spontan akan berubah menjadi atom lain, dengan mengeluarkan potongan atom pada kecepatan tinggi. Pada tahun 1906 di University of Manchester, Rutherford mengawasi sebuah eksperimen yang dilakukan oleh murid-muridnya Hans Geiger (dikenal dengan pencacah Geigernya) dan Ernest Marsden. Dalam eksperimen Geiger–Marsden, seberkas partikel alfa, yang dihasilkan melalui peluruhan radioaktif radon, diarahkan secara normal ke selembar foil emas yang sangat tipis dalam bejana evakuasi. Di bawah model puding prem yang berlaku, partikel alfa semuanya harus melewati foil dan menyentuh layar detektor, atau setidaknya telah dibelokkan, beberapa derajat.
Namun, kenyataannya mengejutkan Rutherford. Meskipun banyak partikel alfa berhasil melewatinya seperti yang diharapkan, banyak lainnya dibelokkan dengan sudut kecil sementara yang lain dipantulkan kembali ke sumber alfa. Mereka mengamati bahwa persentase partikel yang dibelokkan dengan sudut yang jauh lebih besar dari 90 derajat sangat kecil. Percobaan foil emas menunjukkan pembelokan besar untuk sebagian kecil partikel yang dilewatkan. Rutherford menyadari bahwa, karena beberapa partikel alfa dibelokkan atau dipantulkan, atom tersebut memiliki pusat muatan positif terkonsentrasi dengan massa yang relatif besar - Rutherford kemudian menyebut pusat positif ini sebagai "inti atom". Partikel alfa telah menumbuk pusat positif secara langsung atau melewatinya dengan jarak cukup dekat sehingga terpengaruh oleh muatan positifnya. Oleh karena banyak partikel lainnya melewati foil emas, pusat positif harus berukuran relatif kecil dibandingkan dengan ukuran atom keseluruhan - yang berarti bahwa atom tersebut sebagian besar adalah ruang terbuka. Dari hasil penelitiannya, Rutherford mengembangkan model atom yang mirip dengan tata surya, yang dikenal dengan model atom Rutherford. Seperti planet, elektron mengorbit pusat inti atom yang seperti matahari. Untuk karyanya dalam radiasi dan inti atom, Rutherford menerima Hadiah Nobel 1908 bidang Kimia.
Abad ke-20[sunting | sunting sumber]

Pada tahun 1903, Mikhail Tsvet menemukan kromatografi, suatu teknik analisis penting. Pada tahun 1904, Hantaro Nagaoka mengusulkan sebuah model awal nuklir atom, di mana elektron mengorbit inti masif padat. Pada tahun 1905, Fritz Haber dan Carl Bosch mengembangkan proses Haber untuk membuat amonia, sebuah tonggak sejarah dalam kimia industri yang memiliki konsekuensi mendalam dalam pertanian. Proses Haber, atau proses Haber-Bosch, menggabungkan nitrogen dan hidrogen untuk membentuk amonia dalam kuantitas industri untuk produksi pupuk dan amunisi. Produksi pangan untuk setengah populasi dunia saat ini bergantung pada metode ini untuk memproduksi pupuk. Haber, bersama dengan Max Born, mengusulkan siklus Born–Haber sebagai metode untuk mengevaluasi energi kisi suatu padatan ionik. Haber juga telah digambarkan sebagai "bapak perang kimia" karena karyanya mengembangkan dan menyebarkan klorin dan gas beracun lainnya selama Perang Dunia I.

Pada tahun 1905, Albert Einstein menjelaskan gerak Brown dengan cara yang secara definitif membuktikan teori atom. Leo Baekeland menemukan bakelit, salah satu plastik komersial pertama yang sukses. Pada tahun 1909, fisikawan Amerika Robert Andrews Millikan - yang pernah belajar di Eropa di bawah Walther Nernst dan Max Planck - mengukur muatan elektron individual dengan akurasi yang belum pernah terjadi sebelumnya melalui percobaan tetesan minyak, di mana dia mengukur muatan listrik pada tetesan kecil air (dan kemudian minyak). Studinya menetapkan bahwa muatan listrik tetesan tertentu adalah kelipatan dari nilai fundamental pastinya — muatan elektron — dan dengan demikian merupakan konfirmasi bahwa semua elektron memiliki muatan dan massa yang sama. Dimulai pada tahun 1912, dia menghabiskan beberapa tahun untuk meneliti dan akhirnya membuktikan hubungan linier yang diusulkan Albert Einstein antara energi dan frekuensi, dan memberikan dukungan fotolistrik langsung pertama untuk konstanta Planck. Pada tahun 1923 Millikan dianugerahi Hadiah Nobel bidang Fisika.
Pada tahun 1909, S. P. L. Sørensen menemukan konsep pH dan mengembangkan metode untuk mengukur keasaman. Pada tahun 1911, Antonius van den Broek mengusulkan gagasan bahwa unsur pada tabel periodik lebih tepat diatur berdasarkan muatan nuklir positif daripada berat atom. Pada tahun 1911, Konferensi Solvay pertama diadakan di Brussels, mempertemukan sebagian besar ilmuwan paling terkemuka saat itu. Pada tahun 1912, William Henry Bragg dan William Lawrence Bragg mengusulkan hukum Bragg dan mendirikan bidang kristalografi sinar-X, alat penting untuk menjelaskan struktur kristal zat. Pada tahun 1912, Peter Debye mengembangkan konsep dipol molekul untuk menjelaskan distribusi muatan asimetris dalam beberapa molekul.
Niels Bohr[sunting | sunting sumber]

Pada tahun 1913, Niels Bohr, seorang fisikawan Denmark, memperkenalkan konsep mekanika kuantum pada struktur atom dengan mengusulkan apa yang sekarang dikenal sebagai model atom Bohr, di mana elektron didefinisikan secara ketat hanya ada dalam orbit melingkar mengitari inti atom yang serupa dengan anak tangga di sebuah tangga. Model Bohr adalah model planet di mana elektron bermuatan negatif mengorbit sebuah inti atom kecil bermuatan positif yang serupa dengan planet yang mengorbit Matahari (kecuali orbitnya tidak planar) - gaya gravitasi tata surya secara matematis mirip dengan gaya Coulomb (listrik) antara inti yang bermuatan positif dan elektron yang bermuatan negatif.
Dalam model Bohr, elektron mengorbit inti dalam orbit yang memiliki ukuran dan energi yang ditetapkan - tingkat energi dikatakan terkuantisasi, yang berarti bahwa hanya orbit dengan jari-jari tertentu yang diperbolehkan; orbit yang berada di antaranya sama sekali tidak ada. Energi orbit terkait dengan ukurannya - yaitu, energi terendah terdapat pada orbit terkecil. Bohr juga mendalilkan bahwa radiasi elektromagnetik diserap atau dipancarkan saat elektron bergerak dari satu orbit ke orbit yang lain. Karena hanya orbit elektron tertentu yang diizinkan, emisi cahaya yang menyertai lompatan elektron dari keadaan energi tereksitasi ke keadaan dasar menghasilkan spektrum emisi yang unik untuk masing-masing unsur.
Niels Bohr juga meneliti prinsip komplementaritas, yang menyatakan bahwa sebuah elektron dapat ditafsirkan dalam dua sudut pandang yang saling eksklusif dan valid. Elektron dapat diinterpretasikan sebagai model gelombang atau partikel. Hipotesisnya adalah bahwa partikel yang masuk akan menyerang inti dan menciptakan inti senyawa yang tereksitasi. Ini membentuk dasar model tetes cairannya dan kemudian memberikan dasar teori untuk penjelasan fisi nuklir.
Pada tahun 1913, Henry Moseley, yang berkarya sesuai gagasan Van den Broek sebelumnya, memperkenalkan konsep nomor atom untuk memperbaiki kekurangan tabel periodik Mendeleev, yang didasarkan pada berat atom. Puncak karier Frederick Soddy di bidang radiokimia pada tahun 1913 dengan rumusan konsep isotopnya, yang menyatakan bahwa unsur-unsur tertentu terdapat dalam dua atau lebih bentuk yang memiliki bobot atom yang berbeda namun tidak dapat dibedakan secara kimia. Dia dikenang karena membuktikan adanya isotop unsur radioaktif tertentu, dan juga diberi pengakuan, bersama dengan yang lain, atas ditemukannya unsur protaktinium pada tahun 1917. Pada tahun 1913, J.J. Thomson mengembangkan karya Wien dengan menunjukkan bahwa partikel subatomik bermuatan dapat dipisahkan berdasarkan rasio massa terhadap muatan, sebuah teknik yang dikenal sebagai spektrometri massa.
Gilbert N. Lewis[sunting | sunting sumber]
Ahli kimia fisik Amerika Gilbert N. Lewis meletakkan dasar teori ikatan valensi; dia berperan penting dalam mengembangkan teori ikatan berdasarkan jumlah elektron di kelopak "valensi" terluar suatu atom. Pada tahun 1902, ketika Lewis mencoba menjelaskan valensi kepada murid-muridnya, ia menggambarkan atom-atom yang dibangun dari rangkaian kubus konsentris dengan elektron di setiap sudutnya. "Atom kubik" ini menjelaskan delapan golongan dalam tabel periodik dan merepresentasikan gagasannya bahwa ikatan kimia dibentuk oleh transferensi elektron untuk memberi masing-masing atom satu set lengkap delapan elektron terluar (sebuah "oktet").
Teori ikatan kimia Lewis terus berkembang dan, pada tahun 1916, dia menerbitkan artikel seminalnya "The Atom of the Molecule", yang menyarankan agar ikatan kimia adalah sepasang elektron yang dimiliki bersama oleh dua atom. Model Lewis menyamakan ikatan kimia klasik dengan berbagi pasangan elektron di antara dua atom yang berikatan. Lewis memperkenalkan "diagram titik elektron" dalam makalah ini untuk melambangkan struktur elektronik atom dan molekul. Struktur ini sekarang dikenal sebagai struktur Lewis, dan dibahas di hampir setiap buku pengantar kimia.
Tak lama setelah menerbitkan makalahnya pada tahun 1916, Lewis terlibat dalam penelitian militer. Dia tidak kembali ke subjek ikatan kimia sampai tahun 1923, saat dia dengan suka rela meringkas modelnya dalam sebuah monograf pendek berjudul Valence and the Structure of Atoms and Molecules. Perhatiannya kembali pada masalah ini sebagian besar terinspirasi oleh aktivitas kimiawan Amerika dan peneliti General Electric Irving Langmuir, yang antara 1919 dan 1921 mempopulerkan dan menjelaskan model Lewis. Langmuir kemudian memperkenalkan istilah ikatan kovalen. Pada tahun 1921, Otto Stern dan Walther Gerlach menetapkan konsep spin mekanis kuantum dalam partikel subatomik.
Untuk kasus yang tidak melibatkan kepemilikan bersama, Lewis pada tahun 1923 mengembangkan teori pasangan elektron asam dan basa: Lewis mendefinisikan ulang asam sebagai atom atau molekul apapun dengan oktet yang tidak lengkap sehingga mampu menerima elektron dari atom lain; basa, tentu saja, donor elektron. Teorinya dikenal sebagai konsep asam dan basa Lewis. Pada tahun 1923, G. N. Lewis dan Merle Randall menerbitkan Thermodynamics and the Free Energy of Chemical Substances, risalah modern pertama tentang termodinamika kimia.
Tahun 1920-an adalah saksi cepatnya adopsi dan aplikasi ikatan pasangan elektron model Lewis di bidang kimia organik dan kimia koordinasi. Dalam kimia organik, hal ini terutama disebabkan oleh upaya kimiawan Inggris Arthur Lapworth, Robert Robinson, Thomas Lowry, dan Christopher Ingold; sementara dalam kimia koordinasi, model ikatan Lewis dipromosikan melalui upaya kimiawan Amerika Maurice Huggins dan kimiawan Inggris Nevil Sidgwick.
Mekanika kuantum[sunting | sunting sumber]
  | |
  | |
| Dari kiri ke kanan, baris atas: Louis de Broglie (1892–1987) dan Wolfgang Pauli (1900–58); baris kedua: Erwin Schrödinger (1887–1961) dan Werner Heisenberg (1901–76) |
Pada tahun 1924, fisikawan kuantum Prancis Louis de Broglie menerbitkan tesisnya, di mana ia memperkenalkan teori revolusioner gelombang elektron berdasarkan dualitas gelombang–partikel dalam tesisnya. Pada masanya, interpretasi gelombang dan partikel dari cahaya dan materi dipandang saling bertentangan satu sama lain, namun de Broglie menyarankan bahwa karakteristik yang tampaknya berbeda ini justru merupakan perilaku yang sama jika diamati dari perspektif yang berbeda — bahwa partikel dapat berperilaku seperti gelombang, dan gelombang (radiasi) dapat berperilaku seperti partikel. Proposal Broglie menawarkan penjelasan tentang gerak terbatas elektron di dalam atom. Publikasi pertama gagasan Broglie tentang "gelombang materi" tidak banyak menarik perhatian para fisikawan lain, namun salinan tesis doktoralnya jatuh ke tangan Einstein, yang menanggapinya dengan sangat antusias. Einstein menekankan pentingnya karya Broglie secara eksplisit dan dengan mengembangkan lebih lanjut mengenai hal itu.
Pada tahun 1925, fisikawan kelahiran Austria Wolfgang Pauli mengembangkan prinsip pengecualian Pauli, yang menyatakan bahwa tidak ada dua elektron yang mengelilingi satu inti atom yang dapat menempati keadaan kuantum yang sama secara bersamaan, seperti yang dijelaskan oleh empat bilangan kuantum. Pauli memberikan kontribusi besar pada mekanika kuantum dan teori medan kuantum - dia dianugerahi Hadiah Nobel bidang Fisika 1945 atas penemuan prinsip pengecualian Pauli - dan juga fisika zat padat (Inggris: solid-state physics), dan dia berhasil membuat hipotesis tentang adanya neutrino. Selain karya aslinya, ia menulis sintesis lanjutan dari beberapa bidang teori fisika yang dianggap klasik menurut literatur ilmiah.
| Persamaan Schrödinger |
Pada tahun 1926 di usia yang ke-39, fisikawan teoretis Austria Erwin Schrödinger menghasilkan makalah yang memberi dasar mekanika gelombang kuantum. Dalam makalah tersebut, dia menggambarkan persamaan diferensial parsialnya yang merupakan persamaan dasar mekanika kuantum yang memiliki hubungan dengan mekanika atom seperti hubungan antara persamaan gerak Newton dengan astronomi planet. Dengan mengadopsi sebuah proposal yang dibuat oleh Louis de Broglie pada tahun 1924 yang menyatakan bahwa partikel materi memiliki sifat dualisme dan dalam beberapa situasi bertindak seperti gelombang, Schrödinger memperkenalkan sebuah teori yang menggambarkan perilaku sistem tersebut melalui persamaan gelombang yang sekarang dikenal sebagai persamaan Schrödinger. Pemecahan persamaan Schrödinger, tidak seperti pemecahan persamaan Newton, adalah fungsi gelombang yang hanya dapat dikaitkan dengan kemungkinan kejadian fisika. Urutan kejadian orbit planet yang mudah divisualisasikan, dalam mekanika kuantum, digantikan oleh gagasan probabilitas yang lebih abstrak. (Aspek teori kuantum ini membuat Schrödinger dan beberapa fisikawan lainnya sangat tidak bahagia, dan dia mengabdikan sebagian besar sisa hidupnya untuk merumuskan keberatan filosofis terhadap interpretasi teorinya yang telah diterima secara umum, dan bahwa dia telah melakukan banyak hal untuk menciptakan teori tersebut.)
Fisikawan teoretis Jerman Werner Heisenberg adalah salah satu pencipta kunci mekanika kuantum. Pada tahun 1925, Heisenberg menemukan cara untuk merumuskan mekanika kuantum dalam istilah matriks. Untuk penemuan itu, dia dianugerahi Hadiah Nobel bidang Fisika pada tahun 1932. Pada tahun 1927 dia menerbitkan prinsip ketidakpastiannya, di mana dia membangun filosofi yang mempopulerkan namanya. Heisenberg mampu menunjukkan bahwa jika Anda mempelajari sebuah elektron dalam sebuah atom Anda bisa menunjukkan letaknya (lokasi elektron) atau arah perginya (kecepatan elektron), tapi tidak mungkin untuk mengungkapkan keduanya pada saat bersamaan. Dia juga memberikan kontribusi penting pada teori hidrodinamika aliran turbulen, inti atom, feromagnetisme, sinar kosmik, dan partikel subatomik, dan dia berperan dalam merencanakan reaktor nuklir Jerman Barat pertama di Karlsruhe, bersama dengan sebuah reaktor riset di Munich, pada tahun 1957. Terdapat kontroversi yang cukup besar seputar karyanya tentang penelitian atom selama Perang Dunia II.
Kimia kuantum[sunting | sunting sumber]
Beberapa melihat kelahiran kimia kuantum seiring dengan penemuan persamaan Schrödinger dan penerapannya pada atom hidrogen pada tahun 1926. Namun, artikel 1927 dari Walter Heitler dan Fritz London[88] sering dikenal sebagai tonggak pertama dalam sejarah kimia kuantum. Ini adalah aplikasi pertama mekanika kuantum pada molekul hidrogen diatomik, dan dengan juga pada fenomena ikatan kimia. Pada tahun-tahun berikutnya banyak kemajuan yang dicapai oleh, di antaranya Edward Teller, Robert S. Mulliken, Max Born, J. Robert Oppenheimer, Linus Pauling, Erich Hückel, Douglas Hartree, Vladimir Aleksandrovich Fock.
Namun, skeptisisme tetap ada terhadap kekuatan umum mekanika kuantum yang diterapkan pada sistem kimia kompleks. Situasi sekitar tahun 1930 dijelaskan oleh Paul Dirac:[89]
Hukum mendasar fisika yang diperlukan untuk teori matematika dari sebagian besar fisika dan keseluruhan kimia telah sepenuhnya diketahui, dan kesulitannya adalah bahwa penerapan sebenarnya dari hukum ini menyebabkan persamaan menjadi terlalu rumit untuk dapat dipecahkan. Oleh karena itu, menjadi sangat diharapkan bahwa aproksimasi metode praktis untuk menerapkan mekanika kuantum harus dikembangkan, yang dapat mengarah pada penjelasan tentang fitur utama sistem atom kompleks tanpa terlalu banyak komputasi.
Oleh karena itu, metode mekanika kuantum yang dikembangkan pada tahun 1930-an dan 1940-an sering disebut sebagai fisika molekular atau fisika atom teoretis untuk menggarisbawahi fakta bahwa teori tersebut lebih merupakan aplikasi mekanika kuantum pada kimia dan spektroskopi daripada jawaban atas pertanyaan yang relevan secara kimia. Pada tahun 1951, artikel yang merupakan tonggak dalam kimia kuantum adalah makalah seminal Clemens C. J. Roothaan tentang persamaan Roothaan.[90] Ini membuka jalan menuju pemecahan persamaan medan swakonsisten untuk molekul kecil seperti hidrogen atau nitrogen. Komputasi tersebut dilakukan dengan bantuan tabel integral yang dihitung menggunakan komputer tercanggih di masanya.
Pada tahun 1940-an banyak fisikawan beralih dari fisika molekuler atau fisika atom ke fisika nuklir (seperti J. Robert Oppenheimer atau Edward Teller). Glenn T. Seaborg adalah seorang ahli kimia nuklir Amerika yang terkenal karena karyanya tentang isolasi dan identifikasi unsur-unsur transuranium (yang lebih berat daripada uranium). Dia berbagi Hadiah Nobel Kimia tahun 1951 dengan Edwin Mattison McMillan atas penemuan unsur transuranium mereka yang mereka lakukan secara terpisah. Seaborgium dinamai untuk menghormatinya, menjadikannya satu-satunya tokoh, bersama Albert Einstein, yang namanya diabadikan sebagai nama unsur ketika yang bersangkutan masih hidup.
Biologi molekuler dan biokimia[sunting | sunting sumber]
Pada pertengahan abad ke-20, secara prinsip, integrasi fisika dan kimia sangat luas, dengan sifat kimia yang dijelaskan sebagai hasil struktur elektronik atom; buku Linus Pauling berjudul The Nature of the Chemical Bond menggunakan prinsip-prinsip mekanika kuantum untuk menyimpulkan sudut ikatan dalam molekul yang semakin rumit. Meskipun beberapa prinsip yang disimpulkan dari mekanika kuantum dapat memprediksi beberapa fitur kimia secara kualitatif untuk molekul yang relevan secara biologis, namun kesimpulannya masih lebih cenderung pada kumpulan peraturan, observasi, dan resep daripada metode kuantitatif ab initio yang ketat, setidaknya sampai penghujung abad ke-20.
Pendekatan heuristik ini berhasil melalui masa sulitnya ketika pada tahun 1953 James Watson dan Francis Crick menyimpulkan struktur heliks ganda DNA dengan membuat model yang dibatasi oleh dan diinformasikan oleh pengetahuan kimia bagian-bagian penyusunnya serta pola difraksi sinar-X yang diperoleh oleh Rosalind Franklin.[91] Penemuan ini memicu ledakan penelitian tentang biokimia kehidupan.
Pada tahun yang sama, percobaan Miller-Urey menunjukkan bahwa unsur dasar protein, asam amino sederhana, dapat dibangun sendiri dari molekul yang lebih sederhana dalam simulasi proses primordial di Bumi. Meskipun masih banyak pertanyaan tentang sifat sebenarnya dari asal usul kehidupan, ini adalah usaha pertama para ahli kimia untuk mempelajari proses hipotetis di laboratorium dalam kondisi terkendali.
Pada tahun 1983 Kary Mullis merancang sebuah metode untuk amplifikasi in-vitro DNA, yang dikenal sebagai reaksi berantai polimerase (Inggris: polymerase chain reaction, PCR), yang merevolusi proses kimia yang digunakan di laboratorium untuk memanipulasinya. PCR dapat digunakan untuk mensintesis potongan DNA tertentu dan memungkinkan pengurutan DNA organisme, yang memuncak dalam proyek besar genom manusia.
Bagian penting dalam teka-teki heliks ganda dipecahkan oleh salah satu murid Pauling Matthew Meselson dan Frank Stahl, hasil kolaborasi mereka (percobaan Meselson-Stahl) telah disebut sebagai "percobaan paling indah dalam biologi".
Mereka menggunakan teknik sentrifugasi yang mengurutkan molekul menurut perbedaan berat. Karena atom nitrogen adalah komponen DNA, mereka diberi label sehingga terlacak dalam replikasi bakteri.
Akhir abad ke-20[sunting | sunting sumber]

Pada tahun 1970, John Pople mengembangkan program Gaussian yang sangat memudahkan kalkulasi kimia komputasi.[92] Pada tahun 1971, Yves Chauvin menawarkan penjelasan tentang mekanisme reaksi metatesis olefin.[93] Pada tahun 1975, Karl Barry Sharpless dan kelompoknya menemukan reaksi oksidasi stereoselektif termasuk epoksidasi Sharpless,[94][95] dihidroksilasi asimetris Sharpless,[96][97][98] dan oksiaminasi Sharpless.[99][100][101] Pada tahun 1985, Harold Kroto, Robert Curl dan Richard Smalley menemukan fulerena, sebuah kelas molekul karbon besar yang menyerupai kubah geodesi yang dirancang oleh arsitek R. Buckminster Fuller.[102] Pada tahun 1991, Sumio Iijima menggunakan mikroskop elektron untuk menemukan jenis fulerena silinder yang dikenal sebagai karbon nanotube, walaupun ia telah melakukannya lebih awal pada tahun 1951. Bahan ini merupakan komponen penting dalam bidang nanoteknologi.[103] Pada tahun 1994, Robert A. Holton dan kelompoknya mencapai sintesis total Taxol untuk pertama kalinya.[104][105][106] Pada tahun 1995, Eric Cornell dan Carl Wieman membuat kondensat Bose-Einstein pertama, sebuah zat yang menampilkan sifat mekanika kuantum pada skala makroskopik.[107]
Matematika dan kimia[sunting | sunting sumber]
Secara klasik, sebelum abad ke-20, kimia didefinisikan sebagai ilmu tentang sifat materi beserta transformasinya. Oleh karena itu, jelas berbeda dari fisika yang tidak terkait dengan transformasi materi yang dramatis. Selain itu, berbeda dengan fisika, kimia tidak banyak menggunakan matematika. Bahkan ada yang enggan menggunakan matematika dalam kimia. Misalnya, Auguste Comte menulis pada tahun 1830:
Setiap upaya untuk menggunakan metode matematika dalam mempelajari pertanyaan kimia harus dianggap sangat tidak masuk akal dan bertentangan dengan semangat kimia.... jika analisis matematis harus memegang posisi penting dalam kimia - penyimpangan yang hampir tidak mungkin dilakukan - akan terjadi degenerasi ilmu pengetahuan yang cepat dan meluas.
Namun, pada bagian kedua abad ke-19, situasinya berubah dan August Kekulé menulis pada tahun 1867:
Saya lebih berharap bahwa suatu hari nanti kita akan menemukan penjelasan matematiko-mekanis untuk apa yang sekarang kita sebut atom yang akan memberikan penjelasan tentang sifat-sifat mereka.
Ruang lingkup kimia[sunting | sunting sumber]
Seiring telah berevolusinya pemahaman sifat materi, pemahaman diri para praktisi tentang ilmu kimia juga mengalami hal yang sama. Proses evaluasi historis berkelanjutan ini mencakup kategori, istilah, tujuan dan ruang lingkup kimia. Selain itu, perkembangan institusi dan jaringan sosial yang mendukung penelitian kimia merupakan faktor yang sangat signifikan yang memungkinkan produksi, diseminasi dan penerapan pengetahuan kimia. (Lihat Filsafat kimia)
Industri kimia[sunting | sunting sumber]
Bagian akhir abad kesembilan belas adalah saksi atas peningkatan besar dalam eksploitasi minyak bumi yang diekstraksi dari bumi untuk membuat sejumlah bahan kimia dan sebagian besar menggantikan penggunaan minyak ikan paus, tar batubara dan naval stores yang digunakan sebelumnya. Produksi dan penyulingan bahan bakar minyak berskala besar menyediakan bahan baku untuk bahan bakar cair seperti bensin dan solar, pelarut, pelumas, aspal, lilin, dan untuk produksi banyak material umum di dunia modern, seperti serat sintetis, plastik, cat, deterjen, obat farmasi, perekat dan amonia sebagai pupuk serta kegunaan lainnya. Banyak industri ini memerlukan katalis baru dan pemanfaatan teknik kimia untuk menghemat biaya produksi.
Pada pertengahan abad ke-20, kontrol struktur elektronik bahan semikonduktor dibuat presisi dengan penciptaan ingot besar dari kristal tunggal silikon dan germanium yang sangat murni. Pengendalian komposisi kimia yang akurat melalui penggunaan doping dengan unsur lain memungkinkan produksi transistor fase padat pada tahun 1951 dan memungkinkan produksi sirkuit terpadu mungil untuk digunakan pada perangkat elektronik, terutama komputer.
Lihat juga[sunting | sunting sumber]
Sejarah dan linimasa[sunting | sunting sumber]
- Teori atom
- Kupelasi
- Sejarah kromatografi
- Sejarah elektrokimia
- Sejarah biologi molekuler
- Sejarah fisika
- Sejarah sains dan teknologi
- Sejarah tabel periodik
- Sejarah termodinamika
- Sejarah energi
- Sejarah teori molekul
- Sejarah ilmu bahan
- Tahun dalam ilmu
- Nobel kimia
- Linimasa fisika atom dan subatom
- Penemuan unsur kimia
- Linimasa kimia
- Linimasa teknologi bahan
- Linimasa termodinamika
- The Chemical History of a Candle
- The Mystery of Matter: Search for the Elements (PBS film)
Kimiawan/wati terkemuka[sunting | sunting sumber]
sesuai kronologis:
- Daftar kimiawan
- Robert Boyle, 1627–1691
- Joseph Black, 1728–1799
- Joseph Priestley, 1733–1804
- Carl Wilhelm Scheele, 1742–1786
- Antoine Lavoisier, 1743–1794
- Alessandro Volta, 1745–1827
- Jacques Charles, 1746–1823
- Claude Louis Berthollet, 1748–1822
- Amedeo Avogadro, 1776-1856
- Joseph-Louis Gay-Lussac, 1778–1850
- Humphry Davy, 1778–1829
- Jöns Jakob Berzelius, penemu notasi kimia modern, 1779–1848
- Justus von Liebig, 1803–1873
- Louis Pasteur, 1822–1895
- Stanislao Cannizzaro, 1826–1910
- Friedrich August Kekulé von Stradonitz, 1829–1896
- Dmitri Mendeleev, 1834–1907
- Josiah Willard Gibbs, 1839–1903
- J. H. van 't Hoff, 1852–1911
- William Ramsay, 1852–1916
- Svante Arrhenius, 1859–1927
- Walther Nernst, 1864–1941
- Marie Curie, 1867–1934
- Gilbert N. Lewis, 1875–1946
- Otto Hahn, 1879–1968
- Irving Langmuir, 1881–1957
- Linus Pauling, 1901–1994
- Glenn T. Seaborg, 1912–1999
- Robert Burns Woodward, 1917-1979
- Frederick Sanger, 1918-2013
- Geoffrey Wilkinson, 1921-1996
- Rudolph A. Marcus, 1923-
- George Andrew Olah, 1926-
- Elias James Corey, 1928-
- Akira Suzuki, 1930-
- Richard F. Heck, 1931-2015
- Harold Kroto, 1939-2016
- Jean-Marie Lehn, 1939-
- Peter Atkins, 1940-
- Barry Sharpless, 1941-
- Richard Smalley, 1943–2005
- Jean-Pierre Sauvage, 1944-
Catatan[sunting | sunting sumber]
- ^ Selected Classic Papers from the History of Chemistry
- ^ "History of Gold". Gold Digest. Diakses tanggal 2007-02-04.
- ^ Photos, E. (February 1989), "The Question of Meteorictic versus Smelted Nickel-Rich Iron: Archaeological Evidence and Experimental Results", World Archaeology, Archaeometallurgy, 20 (3): 403–421, diakses tanggal 2010-02-08
- ^ a b Keller, W. (1963), The Bible as History, hlm. 156, ISBN 0-340-00312-X
- ^ Radivojević, Miljana; Rehren, Thilo; Pernicka, Ernst; Šljivar, Dušan; Brauns, Michael; Borić, Dušan (2010). "On the origins of extractive metallurgy: New evidence from Europe". Journal of Archaeological Science. 37 (11): 2775. doi:10.1016/j.jas.2010.06.012.
- ^ Neolithic Vinca was a metallurgical culture Stonepages from news sources November 2007
- ^ Will Durant wrote in The Story of Civilization I: Our Oriental Heritage:
"Something has been said about the chemical excellence of cast iron in ancient India, and about the high industrial development of the Gupta times, when India was looked to, even by Imperial Rome, as the most skilled of the nations in such chemical industries as dyeing, tanning, soap-making, glass and cement... By the sixth century the Hindus were far ahead of Europe in industrial chemistry; they were masters of calcinations, distillation, sublimation, steaming, fixation, the production of light without heat, the mixing of anesthetic and soporific powders, and the preparation of metallic salts, compounds and alloys. The tempering of steel was brought in ancient India to a perfection unknown in Europe till our own times; King Porus is said to have selected, as a specially valuable gift from Alexander, not gold or silver, but thirty pounds of steel. The Moslems took much of this Hindu chemical science and industry to the Near East and Europe; the secret of manufacturing "Damascus" blades, for example, was taken by the Arabs from the Persians, and by the Persians from India."
Sesuatu telah dikatakan tentang keunggulan kimia besi tuang di India kuno, dan tentang perkembangan industri yang tinggi pada masa Gupta, ketika India dipandang, bahkan oleh Kekaisaran Roma, sebagai negara yang paling terampil di bidang industri kimia seperti mewarnai, penyamakan, pembuatan sabun, kaca dan semen ... Pada abad keenam, orang-orang Hindu jauh melampaui bangsa Eropa dalam bidang kimia industri; mereka adalah ahli kalsinasi, distilasi, sublimasi, pengukusan, fiksasi, membuat cahaya tanpa panas, pencampuran bubuk anestesi dan soporifik, serta pembuatan garam, senyawa dan paduan logam. Penempaan baja dibawa ke India kuno sampai mencapai kesempurnaan yang tak terbayangkan di Eropa hingga saat ini; Raja Porus dikatakan telah memilih, sebagai hadiah istimewa dari Alexander, bukan emas atau perak, tapi tiga puluh pon baja. Orang-orang Islam mengambil sebagian besar ilmu kimia dan industri kimia Hindu ini ke Timur Dekat dan Eropa; rahasia manufaktur belati "Damaskus", misalnya, diambil oleh orang-orang Arab dari Persia, dan oleh Persia dari India.
- ^ B. W. Anderson (1975) The Living World of the Old Testament, p. 154, ISBN 0-582-48598-3
- ^ R. F. Tylecote (1992) A History of Metallurgy ISBN 0-901462-88-8
- ^ Temple, Robert K.G. (2007). The Genius of China: 3,000 Years of Science, Discovery, and Invention (3rd edition). London: André Deutsch. pp. 44–56. ISBN 978-0-233-00202-6.
- ^ a b Will Durant (1935), Our Oriental Heritage:
"Two systems of Hindu thought propound physical theories suggestively similar to those of Greece. Kanada, founder of the Vaisheshika philosophy, held that the world was composed of atoms as many in kind as the various elements. The Jains more nearly approximated to Democritus by teaching that all atoms were of the same kind, producing different effects by diverse modes of combinations. Kanada believed light and heat to be varieties of the same substance; Udayana taught that all heat comes from the sun; and Vachaspati, like Newton, interpreted light as composed of minute particles emitted by substances and striking the eye."
"Dua sistem pemikiran Hindu mengemukakan teori fisika yang secara sugestif mirip dengan Yunani. Kanada, pendiri filsafat Vaisheshika, berpendapat bahwa dunia terdiri dari atom-atom yang sama banyak dengan berbagai unsur. Orang-orang Jain lebih mendekati Demokritus dengan mengajarkan bahwa semua atom memiliki jenis yang sama, menghasilkan efek yang berbeda dengan beragam cara kombinasi. Kanada percaya bahwa cahaya dan panas menjadi varietas dari zat yang sama; Udyanacharya mengajarkan bahwa semua panas berasal dari matahari; dan Vachaspati, seperti Newton, menafsirkan cahaya sebagai sesuatu yang terdiri dari partikel-partikel kecil yang dipancarkan oleh zat-zat dan mencolok mata."
- ^ Simpson, David (29 June 2005). "Lucretius (c. 99 - c. 55 BCE)". The Internet History of Philosophy. Diakses tanggal 2007-01-09.
- ^ Lucretius (50 BCE). "de Rerum Natura (On the Nature of Things)". The Internet Classics Archive. Massachusetts Institute of Technology. Diakses tanggal 2007-01-09.
- ^ Norris, John A. (2006). "The Mineral Exhalation Theory of Metallogenesis in Pre-Modern Mineral Science". Ambix. 53: 43. doi:10.1179/174582306X93183.
- ^ Clulee, Nicholas H. (1988). John Dee's Natural Philosophy. Routledge. hlm. 97. ISBN 978-0-415-00625-5.
- ^ Strathern, 2000. Page 79.
- ^ Holmyard, E.J. (1957). Alchemy. New York: Dover, 1990. hlm. 15, 16.
- ^ William Royall Newman. Atoms and Alchemy: Chymistry and the experimental origins of the scientific revolution. University of Chicago Press, 2006. p.xi
- ^ Holmyard, E.J. (1957). Alchemy. New York: Dover, 1990. hlm. 48, 49.
- ^ Stanton J. Linden. The alchemy reader: from Hermes Trismegistus to Isaac Newton Cambridge University Press. 2003. p.44
- ^ a b Brock, William H. (1992). The Fontana History of Chemistry. London, England: Fontana Press. hlm. 32–33. ISBN 0-00-686173-3.
- ^ Brock, William H. (1992). The Fontana History of Chemistry. London, England: Fontana Press. ISBN 0-00-686173-3.
- ^ "The History of Ancient Chemistry". Diarsipkan dari versi asli tanggal 2015-03-04. Diakses tanggal 2017-09-20.
- ^ Derewenda, Zygmunt S.; Derewenda, ZS (2007). "On wine, chirality and crystallography". Acta Crystallographica Section A. 64 (Pt 1): 246–258 [247]. Bibcode:2008AcCrA..64..246D. doi:10.1107/S0108767307054293. PMID 18156689.
- ^ John Warren (2005), "War and the Cultural Heritage of Iraq: a sadly mismanaged affair", Third World Quarterly, 26 (4 & 5): 815–830
- ^ Dr. A. Zahoor (1997), JABIR IBN HAIYAN (Geber) Diarsipkan 2017-09-21 di Wayback Machine.
- ^ Paul Vallely, How Islamic inventors changed the world, The Independent, 10 March 2006
- ^ Kraus, Paul, Jâbir ibn Hayyân, Contribution à l'histoire des idées scientifiques dans l'Islam. I. Le corpus des écrits jâbiriens. II. Jâbir et la science grecque,. Cairo (1942-1943). Repr. By Fuat Sezgin, (Natural Sciences in Islam. 67-68), Frankfurt. 2002:
"To form an idea of the historical place of Jabir's alchemy and to tackle the problem of its sources, it is advisable to compare it with what remains to us of the alchemical literature in the Greek language. One knows in which miserable state this literature reached us. Collected by Byzantine scientists from the tenth century, the corpus of the Greek alchemists is a cluster of incoherent fragments, going back to all the times since the third century until the end of the Middle Ages."
"Untuk membentuk sebuah gagasan tentang tempat historis alkimia Jabir dan untuk mengatasi masalah sumber-sumbernya, disarankan untuk membandingkannya dengan literatur alkimia yang tersisa dalam bahasa Yunani. Kita tahu bagaimana menyedihkannya literatur ini ketika sampai pada kita. Dikumpulkan oleh ilmuwan Bizantium dari abad kesepuluh, korpus alkimia Yunani adalah kumpulan fragmen yang tidak koheren, kembali ke masa lalu sejak abad ketiga sampai akhir Abad Pertengahan."
"The efforts of Berthelot and Ruelle to put a little order in this mass of literature led only to poor results, and the later researchers, among them in particular Mrs. Hammer-Jensen, Tannery, Lagercrantz, von Lippmann, Reitzenstein, Ruska, Bidez, Festugiere and others, could make clear only few points of detail…
"Upaya Berthelot dan Ruelle untuk membuat literatur ini sedikit lebih teratur hanya menghasilkan sedikit hasil, dan peneliti selanjutnya, di antaranya khususnya Mrs. Hammer-Jensen, Tannery, Lagercrantz, von Lippmann, Reitzenstein, Ruska, Bidez, Festugiere dan lainnya, bisa menjelaskan beberapa detail saja ...
The study of the Greek alchemists is not very encouraging. An even surface examination of the Greek texts shows that a very small part only was organized according to true experiments of laboratory: even the supposedly technical writings, in the state where we find them today, are unintelligible nonsense which refuses any interpretation.
Studi tentang alkimiawan Yunani tidak terlalu menggembirakan. Bahkan pemeriksaan permukaan yang serupa dengan teks-teks Yunani menunjukkan bahwa hanya sebagian sangat kecil yang diatur menurut percobaan laboratorium yang benar: bahkan tulisan-tulisan teknis yang seharusnya, di negara tempat kita menemukannya sekarang, adalah omong kosong yang menolak penafsiran apapun.
It is different with Jabir's alchemy. The relatively clear description of the processes and the alchemical apparatuses, the methodical classification of the substances, mark an experimental spirit which is extremely far away from the weird and odd esotericism of the Greek texts. The theory on which Jabir supports his operations is one of clearness and of an impressive unity. More than with the other Arab authors, one notes with him a balance between theoretical teaching and practical teaching, between the `ilm and the `amal. In vain one would seek in the Greek texts a work as systematic as that which is presented for example in the Book of Seventy."
Berbeda dengan alkimia Jabir. Gambaran yang relatif jelas tentang proses dan peranti alkimia, klasifikasi metodologis zat, menandai semangat eksperimental yang sangat jauh dari esoterisisme aneh dan ajaib dalam teks-teks Yunani. Teori yang mendukung Jabir dalam operasinya adalah salah satu kejelasan dan kesatuan yang mengesankan. Melampaui penulis Arab lainnya, Jabir adalah seseorang memperhatikan keseimbangan antara pengajaran teoretis dan pengajaran praktis, antara `ilm dan `amal. Sia-sia orang yang mencari dalam teks-teks Yunani sebuah karya sesistematis ini seperti yang disajikan misalnya di dalam Book of Seventy."
(cf. Ahmad Y Hassan. "A Critical Reassessment of the Geber Problem: Part Three". Diakses tanggal 2008-08-09.)
- ^ Will Durant (1980). The Age of Faith (The Story of Civilization, Volume 4), p. 162-186. Simon & Schuster. ISBN 0-671-01200-2.
- ^ Strathern, Paul. (2000), Mendeleyev's Dream – the Quest for the Elements, New York: Berkley Books
- ^ Marmura, Michael E.; Nasr, Seyyed Hossein (1965). "An Introduction to Islamic Cosmological Doctrines. Conceptions of Nature and Methods Used for Its Study by the Ikhwan Al-Safa'an, Al-Biruni, and Ibn Sina by Seyyed Hossein Nasr". Speculum. 40 (4): 744–746. doi:10.2307/2851429. JSTOR 2851429.
- ^ Robert Briffault (1938). The Making of Humanity, p. 196-197.
- ^ Alakbarov, Farid (2001). "A 13th-Century Darwin? Tusi's Views on Evolution". Azerbaijan International. 9: 2.
- ^ Karl Alfred von Zittel (1901) History of Geology and Palaeontology, p. 15
- ^ Asarnow, Herman (2005-08-08). "Sir Francis Bacon: Empiricism". An Image-Oriented Introduction to Backgrounds for English Renaissance Literature. University of Portland. Diarsipkan dari versi asli tanggal 2007-02-01. Diakses tanggal 2007-02-22.
- ^ Crosland, M.P. (1959). "The use of diagrams as chemical 'equations' in the lectures of William Cullen and Joseph Black." Annals of Science, Vol 15, No. 2, June
- ^ "Robert Boyle". Diarsipkan dari versi asli tanggal 2013-12-03. Diakses tanggal 2017-09-20.
- ^ Acott, Chris (1999). "The diving "Law-ers": A brief resume of their lives". South Pacific Underwater Medicine Society journal. 29 (1). ISSN 0813-1988. OCLC 16986801. Diarsipkan dari versi asli tanggal 2011-04-02. Diakses tanggal 17 April 2009.
- ^ Levine, Ira. N (1978). "Physical Chemistry" University of Brooklyn: McGraw-Hill
- ^ Ursula Klein (July 2007). "Styles of Experimentation and Alchemical Matter Theory in the Scientific Revolution". Metascience. Springer. 16 (2): 247–256 [247]. doi:10.1007/s11016-007-9095-8. ISSN 1467-9981.
- ^ Nordisk familjebok – Cronstedt: "den moderna mineralogiens och geognosiens grundläggare" = "the modern mineralogy's and geognosie's founder"
- ^ Cooper, Alan (1999). "Joseph Black". History of Glasgow University Chemistry Department. University of Glasgow Department of Chemistry. Diarsipkan dari versi asli tanggal 2006-04-10. Diakses tanggal 2006-02-23.
- ^ Seyferth, Dietmar (2001). "Cadet's Fuming Arsenical Liquid and the Cacodyl Compounds of Bunsen". Organometallics. 20 (8): 1488–1498. doi:10.1021/om0101947.
- ^ Partington, J.R. (1989). A Short History of Chemistry. Dover Publications, Inc. ISBN 0-486-65977-1.
- ^ Kuhn, 53–60; Schofield (2004), 112–13. Kesulitan dalam mendefinisikan waktu dan tempat "penemuan" oksigen dengan tepat, dalam konteks revolusi kimia yang sedang berkembang, adalah salah satu ilustrasi utama Thomas Kuhn mengenai sifat bertahap dari pergeseran paradigma dalam The Structure of Scientific Revolutions.
- ^ "Joseph Priestley". Chemical Achievers: The Human Face of Chemical Sciences. Chemical Heritage Foundation. 2005.
- ^ "Carl Wilhelm Scheele". History of Gas Chemistry. Center for Microscale Gas Chemistry, Creighton University. 2005-09-11. Diakses tanggal 2007-02-23.
- ^ Saunders, Nigel (2004). Tungsten and the Elements of Groups 3 to 7 (The Periodic Table). Chicago: Heinemann Library. ISBN 1-4034-3518-9.
- ^ "ITIA Newsletter" (PDF). International Tungsten Industry Association. June 2005. Diarsipkan dari versi asli (PDF) tanggal July 21, 2011. Diakses tanggal 2008-06-18.
- ^ "ITIA Newsletter" (PDF). International Tungsten Industry Association. December 2005. Diarsipkan dari versi asli (PDF) tanggal July 21, 2011. Diakses tanggal 2008-06-18.
- ^ Mottelay, Paul Fleury (2008). Bibliographical History of Electricity and Magnetism (edisi ke-Reprint of 1892). Read Books. hlm. 247. ISBN 1-4437-2844-6.
- ^ "Inventor Alessandro Volta Biography". The Great Idea Finder. The Great Idea Finder. 2005. Diakses tanggal 2007-02-23.
- ^ Lavoisier, Antoine (1743-1794) -- from Eric Weisstein's World of Scientific Biography, ScienceWorld
- ^ a b c d "Salinan arsip". Diarsipkan dari versi asli tanggal 2015-04-17. Diakses tanggal 2017-09-20.
- ^ a b Pullman, Bernard (2004). The Atom in the History of Human Thought. Reisinger, Axel. USA: Oxford University Press Inc. ISBN 0-19-511447-7.
- ^ "John Dalton". Chemical Achievers: The Human Face of Chemical Sciences. Chemical Heritage Foundation. 2005.
- ^ "Proust, Joseph Louis (1754-1826)". 100 Distinguished Chemists. European Association for Chemical and Molecular Science. 2005. Diarsipkan dari versi asli tanggal 2008-05-15. Diakses tanggal 2007-02-23.
- ^ Enghag, P. (2004). "11. Sodium and Potassium". Encyclopedia of the elements. Wiley-VCH Weinheim. ISBN 3-527-30666-8.
- ^ Davy, Humphry (1808). "On some new Phenomena of Chemical Changes produced by Electricity, particularly the Decomposition of the fixed Alkalies, and the Exhibition of the new Substances, which constitute their Bases". Philosophical Transactions of the Royal Society of London. Royal Society of London. 98 (0): 1–45. doi:10.1098/rstl.1808.0001.
- ^ Weeks, Mary Elvira (1933). "XII. Other Elements Isolated with the Aid of Potassium and Sodium: Beryllium, Boron, Silicon and Aluminum". The Discovery of the Elements. Easton, Pennsylvania: Journal of Chemical Education. ISBN 0-7661-3872-0.
- ^ Robert E. Krebs (2006). The history and use of our earth's chemical elements: a reference guide. Greenwood Publishing Group. hlm. 80. ISBN 0-313-33438-2.
- ^ Sir Humphry Davy (1811). "On a Combination of Oxymuriatic Gas and Oxygene Gas". Philosophical Transactions of the Royal Society. 101 (0): 155–162. doi:10.1098/rstl.1811.0008.
- ^ Gay-Lussac, J. L. (L'An X – 1802), "Recherches sur la dilatation des gaz et des vapeurs", Annales de chimie, 43: 137–175 . English translation (extract).
On page 157, Gay-Lussac mentions the unpublished findings of Charles: "Avant d'aller plus loin, je dois prévenir que quoique j'eusse reconnu un grand nombre de fois que les gaz oxigène, azote, hydrogène et acide carbonique, et l'air atmosphérique se dilatent également depuis 0° jusqu'a 80°, le cit. Charles avait remarqué depuis 15 ans la même propriété dans ces gaz ; mais n'avant jamais publié ses résultats, c'est par le plus grand hasard que je les ai connus." (Before going further, I should inform [you] that although I had recognized many times that the gases oxygen, nitrogen, hydrogen, and carbonic acid [i.e., carbon dioxide], and atmospheric air also expand from 0° to 80°, citizen Charles had noticed 15 years ago the same property in these gases; but having never published his results, it is by the merest chance that I knew of them.) - ^ J. Dalton (1802) "Essay IV. On the expansion of elastic fluids by heat," Memoirs of the Literary and Philosophical Society of Manchester, vol. 5, pt. 2, pages 595-602.
- ^ http://www.chemistryexplained.com/Fe-Ge/Gay-Lussac-Joseph-Louis.html
- ^ a b Courtois, Bernard (1813). "Découverte d'une substance nouvelle dans le Vareck". Annales de chimie. 88: 304. In French, seaweed that had been washed onto the shore was called "varec", "varech", or "vareck", whence the English word "wrack". Later, "varec" also referred to the ashes of such seaweed: The ashes were used as a source of iodine and salts of sodium and potassium.
- ^ Swain, Patricia A. (2005). "Bernard Courtois (1777–1838) famed for discovering iodine (1811), and his life in Paris from 1798" (PDF). Bulletin for the History of Chemistry. 30 (2): 103. Diarsipkan dari versi asli (PDF) tanggal 2010-07-14. Diakses tanggal 2017-09-20.
- ^ a b Gay-Lussac, J. (1813). "Sur un nouvel acide formé avec la substance décourverte par M. Courtois". Annales de chimie. 88: 311.
- ^ Gay-Lussac, J. (1813). "Sur la combination de l'iode avec d'oxigène". Annales de chimie. 88: 319.
- ^ Gay-Lussac, J. (1814). "Mémoire sur l'iode". Annales de chimie. 91: 5.
- ^ Davy, H. (1813). "Sur la nouvelle substance découverte par M. Courtois, dans le sel de Vareck". Annales de chimie. 88: 322.
- ^ Davy, Humphry (January 1, 1814). "Some Experiments and Observations on a New Substance Which Becomes a Violet Coloured Gas by Heat". Phil. Trans. R. Soc. Lond. 104: 74. doi:10.1098/rstl.1814.0007.
- ^ David Knight, ‘Davy, Sir Humphry, baronet (1778–1829)’, Oxford Dictionary of National Biography, Oxford University Press, 2004 accessed 6 April 2008
- ^ "History of Chirality". Stheno Corporation. 2006. Diarsipkan dari versi asli tanggal 2007-03-07. Diakses tanggal 2007-03-12.
- ^ "Lambert-Beer Law". Sigrist-Photometer AG. 2007-03-07. Diakses tanggal 2007-03-12.
- ^ "Benjamin Silliman, Jr. (1816–1885)". Picture History. Picture History LLC. 2003. Diarsipkan dari versi asli tanggal 2007-07-07. Diakses tanggal 2007-03-24.
- ^ Moore, F. J. (1931). A History of Chemistry. McGraw-Hill. hlm. 182–1184. ISBN 0-07-148855-3. (2nd edition)
- ^ "Jacobus Henricus van't Hoff". Chemical Achievers: The Human Face of Chemical Sciences. Chemical Heritage Foundation. 2005.
- ^ O'Connor, J. J.; Robertson, E.F. (1997). "Josiah Willard Gibbs". MacTutor. School of Mathematics and Statistics University of St Andrews, Scotland. Diarsipkan dari versi asli tanggal 2010-03-27. Diakses tanggal 2007-03-24.
- ^ Weisstein, Eric W. (1996). "Boltzmann, Ludwig (1844–1906)". Eric Weisstein's World of Scientific Biography. Wolfram Research Products. Diakses tanggal 2007-03-24.
- ^ "Svante August Arrhenius". Chemical Achievers: The Human Face of Chemical Sciences. Chemical Heritage Foundation. 2005.
- ^ "Jacobus H. van 't Hoff: The Nobel Prize in Chemistry 1901". Nobel Lectures, Chemistry 1901–1921. Elsevier Publishing Company. 1966. Diakses tanggal 2007-02-28.
- ^ "Henry Louis Le Châtelier". World of Scientific Discovery. Thomson Gale. 2005. Diakses tanggal 2007-03-24.
- ^ "Emil Fischer: The Nobel Prize in Chemistry 1902". Nobel Lectures, Chemistry 1901–1921. Elsevier Publishing Company. 1966. Diakses tanggal 2007-02-28.
- ^ "History of Chemistry". Intensive General Chemistry. Columbia University Department of Chemistry Undergraduate Program. Diakses tanggal 2007-03-24.
- ^ "Alfred Werner: The Nobel Prize in Chemistry 1913". Nobel Lectures, Chemistry 1901–1921. Elsevier Publishing Company. 1966. Diakses tanggal 2007-03-24.
- ^ "Alfred Werner: The Nobel Prize in Physics 1911". Nobel Lectures, Physics 1901–1921. Elsevier Publishing Company. 1967. Diakses tanggal 2007-03-24.
- ^ W. Heitler and F. London, Wechselwirkung neutraler Atome und Homöopolare Bindung nach der Quantenmechanik, Z. Physik, 44, 455 (1927).
- ^ P.A.M. Dirac, Quantum Mechanics of Many-Electron Systems, Proc. R. Soc. London, A 123, 714 (1929).
- ^ C.C.J. Roothaan, A Study of Two-Center Integrals Useful in Calculations on Molecular Structure, J. Chem. Phys., 19, 1445 (1951).
- ^ Watson, J. and Crick, F., "Molecular Structure of Nucleic Acids" Nature, April 25, 1953, hlm. 737–8
- ^ W. J. Hehre, W. A. Lathan, R. Ditchfield, M. D. Newton, and J. A. Pople, Gaussian 70 (Quantum Chemistry Program Exchange, Program No. 237, 1970).
- ^ Catalyse de transformation des oléfines par les complexes du tungstène. II. Télomérisation des oléfines cycliques en présence d'oléfines acycliques Die Makromolekulare Chemie Volume 141, Issue 1, Date: 9 February 1971, Pages: 161–176 Par Jean-Louis Hérisson, Yves Chauvin doi:10.1002/macp.1971.021410112
- ^ Katsuki, T.; Sharpless, K. B. J. Am. Chem. Soc. 1980, 102, 5974. (doi:10.1021/ja00538a077)
- ^ Hill, J. G.; Sharpless, K. B.; Exon, C. M.; Regenye, R. Org. Syn., Coll. Vol. 7, p.461 (1990); Vol. 63, p.66 (1985). (Article)
- ^ Jacobsen, E. N.; Marko, I.; Mungall, W. S.; Schroeder, G.; Sharpless, K. B. J. Am. Chem. Soc. 1988, 110, 1968. (doi:10.1021/ja00214a053)
- ^ Kolb, H. C.; Van Nieuwenhze, M. S.; Sharpless, K. B. Chem. Rev. 1994, 94, 2483–2547. (Review) (doi:10.1021/cr00032a009)
- ^ Gonzalez, J.; Aurigemma, C.; Truesdale, L. Org. Syn., Coll. Vol. 10, p.603 (2004); Vol. 79, p.93 (2002). (Article)
- ^ Sharpless, K. B.; Patrick, D. W.; Truesdale, L. K.; Biller, S. A. J. Am. Chem. Soc. 1975, 97, 2305. (doi:10.1021/ja00841a071)
- ^ Herranz, E.; Biller, S. A.; Sharpless, K. B. J. Am. Chem. Soc. 1978, 100, 3596–3598. (doi:10.1021/ja00479a051)
- ^ Herranz, E.; Sharpless, K. B. Org. Syn., Coll. Vol. 7, p.375 (1990); Vol. 61, p.85 (1983). (Article)
- ^ "The Nobel Prize in Chemistry 1996". Nobelprize.org. The Nobel Foundation. Diakses tanggal 2007-02-28.
- ^ "Benjamin Franklin Medal awarded to Dr. Sumio Iijima, Director of the Research Center for Advanced Carbon Materials, AIST". National Institute of Advanced Industrial Science and Technology. 2002. Diarsipkan dari versi asli tanggal 2007-04-04. Diakses tanggal 2007-03-27.
- ^ First total synthesis of taxol 1. Functionalization of the B ring Robert A. Holton, Carmen Somoza, Hyeong Baik Kim, Feng Liang, Ronald J. Biediger, P. Douglas Boatman, Mitsuru Shindo, Chase C. Smith, Soekchan Kim, et al.; J. Am. Chem. Soc.; 1994; 116(4); 1597–1598. DOI Abstract
- ^ First total synthesis of taxol. 2. Completion of the C and D rings Robert A. Holton, Hyeong Baik Kim, Carmen Somoza, Feng Liang, Ronald J. Biediger, P. Douglas Boatman, Mitsuru Shindo, Chase C. Smith, Soekchan Kim, and et al. J. Am. Chem. Soc.; 1994; 116(4) pp 1599–1600 DOI Abstract
- ^ A synthesis of taxusin Robert A. Holton, R. R. Juo, Hyeong B. Kim, Andrew D. Williams, Shinya Harusawa, Richard E. Lowenthal, Sadamu Yogai J. Am. Chem. Soc.; 1988; 110(19); 6558–6560. Abstract
- ^ "Cornell and Wieman Share 2001 Nobel Prize in Physics". NIST News Release. National Institute of Standards and Technology. 2001. Diarsipkan dari versi asli tanggal 2007-06-10. Diakses tanggal 2007-03-27.
Referensi[sunting | sunting sumber]
- Selected classic papers from the history of chemistry
- Biographies of Chemists
- Eric R. Scerri, The Periodic Table: Its Story and Its Significance, Oxford University Press, 2006.
Bacaan lanjutan[sunting | sunting sumber]
- Servos, John W., Physical chemistry from Ostwald to Pauling: the making of a science in America, Princeton, N.J.: Princeton University Press, 1990. ISBN 0-691-08566-8
- Dokumenter
- BBC (2010). Chemistry: A Volatile History.
Pranala luar[sunting | sunting sumber]
- ChemisLab Diarsipkan 2019-04-05 di Wayback Machine. - Chemists of the Past
- SHAC: Society for the History of Alchemy and Chemistry

