Asam asetat: Perbedaan antara revisi
| Baris 152: | Baris 152: | ||
Asam asetat padat menunjukkan bahwa [[molekul|molekul-molekul]] asam asetat berpasangan membentuk [[dimer]] yang dihubungkan oleh [[ikatan hidrogen]].<ref>Jones, R.E.; Templeton, D.H. (1958). "The crystal structure of acetic acid". ''Acta Crystallogr.'' '''11'''(7), 484–87.</ref> Dimer juga dapat dideteksi pada [[uap]] [[temperatur|bersuhu]] {{Convert|120|C|F}}. Dimer juga terjadi pada larutan encer di dalam pelarut tak-berikatan-hidrogen, dan kadang-kadang pada cairan asam asetat murni.<ref>James M. Briggs; Toan B. Nguyen; William L. Jorgensen. Monte Carlo simulations of liquid acetic acid and methyl acetate with the OPLS potential functions. ''J. Phys. Chem.'' '''1991''', ''95'', 3315-3322.</ref> Dimer dirusak dengan adanya pelarut berikatan hidrogen (misalnya [[air]]). Entalpi disosiasi dimer tersebut diperkirakan 65,0–66,0 kJ/mol, entropi disosiasi sekitar 154–157 J mol<sup>−1</sup> K<sup>−1</sup>.<ref>James B. Togeas. Acetic Acid Vapor: 2. A Statistical Mechanical Critique of Vapor Density Experiments. ''J. Phys. Chem. A'' '''2005''', ''109'', 5438-5444. {{doi|10.1021/jp058004j}}</ref> Sifat dimerisasi ini juga dimiliki oleh asam karboksilat sederhana lainnya.<ref>{{Cite|last = McMurry|first = John|year = 2000|title = Organic Chemistry|edition = 5th|publisher = Brooks/Cole|page = 818|isbn = 0-534-37366-6}}</ref>[[Berkas:Acetic acid cyclic dimer.png|160px|thumb|Dimer siklis dari asam asetat, garis putus-putus melambangkan ikatan hidrogen.|left]] |
Asam asetat padat menunjukkan bahwa [[molekul|molekul-molekul]] asam asetat berpasangan membentuk [[dimer]] yang dihubungkan oleh [[ikatan hidrogen]].<ref>Jones, R.E.; Templeton, D.H. (1958). "The crystal structure of acetic acid". ''Acta Crystallogr.'' '''11'''(7), 484–87.</ref> Dimer juga dapat dideteksi pada [[uap]] [[temperatur|bersuhu]] {{Convert|120|C|F}}. Dimer juga terjadi pada larutan encer di dalam pelarut tak-berikatan-hidrogen, dan kadang-kadang pada cairan asam asetat murni.<ref>James M. Briggs; Toan B. Nguyen; William L. Jorgensen. Monte Carlo simulations of liquid acetic acid and methyl acetate with the OPLS potential functions. ''J. Phys. Chem.'' '''1991''', ''95'', 3315-3322.</ref> Dimer dirusak dengan adanya pelarut berikatan hidrogen (misalnya [[air]]). Entalpi disosiasi dimer tersebut diperkirakan 65,0–66,0 kJ/mol, entropi disosiasi sekitar 154–157 J mol<sup>−1</sup> K<sup>−1</sup>.<ref>James B. Togeas. Acetic Acid Vapor: 2. A Statistical Mechanical Critique of Vapor Density Experiments. ''J. Phys. Chem. A'' '''2005''', ''109'', 5438-5444. {{doi|10.1021/jp058004j}}</ref> Sifat dimerisasi ini juga dimiliki oleh asam karboksilat sederhana lainnya.<ref>{{Cite|last = McMurry|first = John|year = 2000|title = Organic Chemistry|edition = 5th|publisher = Brooks/Cole|page = 818|isbn = 0-534-37366-6}}</ref>[[Berkas:Acetic acid cyclic dimer.png|160px|thumb|Dimer siklis dari asam asetat, garis putus-putus melambangkan ikatan hidrogen.|left]] |
||
=== |
=== Sifat pelarut === |
||
Asam asetat cair adalah [[pelarut protik]] [[hidrofilik]] ([[Molekul polar|polar]]), mirip seperti [[air]] dan [[etanol]]. Asam asetat memiliki [[konstanta dielektrik]] yang sedang yaitu 6,2; sehingga ia bisa melarutkan baik [[senyawa kimia|senyawa]] polar seperi [[garam (kimia)|garam]] [[kimia anorganik|anorganik]] dan [[gula]] maupun senyawa non-polar seperti minyak dan [[unsur kimia|unsur-unsur]] seperti [[sulfur]] dan [[iodin]]. Asam asetat bercampur dengan mudah dengan [[pelarut]] polar atau nonpolar lainnya seperti air, [[kloroform]] dan [[heksana]]. Dengan alkana yang lebih tinggi (dimulai dari [[oktana]]), asam asetat tidak lagi bercampur sempurna, dan kebercampurannya terus menurun berbanding lurus dengan kenaikan rantai n-alkana.<ref>{{Cite|last1 = Zieborak|first1 = K.|first2 = K.|last2 = Olszewski|year = 1958|magazine = Bulletin de L'Academie Polonaise des Sciences-Serie des Sciences Chimiques Geologiques et Geographiques|volume = 6|issue = 2|pages = 3315–3322}}</ref> Sifat kelarutan dan kemudahan bercampur dari asam asetat ini membuatnya digunakan secara luas dalam industri kimia, misalnya sebagai pelarut dalam produksi [[dimetil tereftalat]].<ref name=":2" /> |
Asam asetat cair adalah [[pelarut protik]] [[hidrofilik]] ([[Molekul polar|polar]]), mirip seperti [[air]] dan [[etanol]]. Asam asetat memiliki [[konstanta dielektrik]] yang sedang yaitu 6,2; sehingga ia bisa melarutkan baik [[senyawa kimia|senyawa]] polar seperi [[garam (kimia)|garam]] [[kimia anorganik|anorganik]] dan [[gula]] maupun senyawa non-polar seperti minyak dan [[unsur kimia|unsur-unsur]] seperti [[sulfur]] dan [[iodin]]. Asam asetat bercampur dengan mudah dengan [[pelarut]] polar atau nonpolar lainnya seperti air, [[kloroform]] dan [[heksana]]. Dengan alkana yang lebih tinggi (dimulai dari [[oktana]]), asam asetat tidak lagi bercampur sempurna, dan kebercampurannya terus menurun berbanding lurus dengan kenaikan rantai n-alkana.<ref>{{Cite|last1 = Zieborak|first1 = K.|first2 = K.|last2 = Olszewski|year = 1958|magazine = Bulletin de L'Academie Polonaise des Sciences-Serie des Sciences Chimiques Geologiques et Geographiques|volume = 6|issue = 2|pages = 3315–3322}}</ref> Sifat kelarutan dan kemudahan bercampur dari asam asetat ini membuatnya digunakan secara luas dalam industri kimia, misalnya sebagai pelarut dalam produksi [[dimetil tereftalat]].<ref name=":2" /> |
||
| Baris 241: | Baris 241: | ||
Saat ini, sebagian besar cuka dibuat dalam tangki budidaya terendam, pertama kali dijelaskan pada 1949 oleh Otto Hromatka dan Heinrich Ebner.<ref>{{Cite|author1 = O Hromatka|author2 = H Ebner|year = 1949|title = Investigations on vinegar fermentation: Generator for vinegar fermentation and aeration procedures|journal = Enzymologia|volume = 13|page = 369}}</ref> Dalam metode ini, alkohol difermentasi menjadi cuka dalam tangki sambil terus diaduk, dan oksigen disuplai dengan menggelegakkan udara melalui larutan. Dengan menggunakan aplikasi modern dari metode ini, cuka dengan 15% asam asetat dapat dibuat hanya dalam waktu 24 jam dalam proses batch, bahkan 20% dalam 60 jam proses kontinu.<ref name=":6" /> |
Saat ini, sebagian besar cuka dibuat dalam tangki budidaya terendam, pertama kali dijelaskan pada 1949 oleh Otto Hromatka dan Heinrich Ebner.<ref>{{Cite|author1 = O Hromatka|author2 = H Ebner|year = 1949|title = Investigations on vinegar fermentation: Generator for vinegar fermentation and aeration procedures|journal = Enzymologia|volume = 13|page = 369}}</ref> Dalam metode ini, alkohol difermentasi menjadi cuka dalam tangki sambil terus diaduk, dan oksigen disuplai dengan menggelegakkan udara melalui larutan. Dengan menggunakan aplikasi modern dari metode ini, cuka dengan 15% asam asetat dapat dibuat hanya dalam waktu 24 jam dalam proses batch, bahkan 20% dalam 60 jam proses kontinu.<ref name=":6" /> |
||
=== Fermentasi anaerobik === |
|||
Spesies [[bakteri anaerob]], termasuk anggota dari genus [[Clostridium|''Clostridium'']] atau [[Acetobacterium|''Acetobacterium'']] dapat mengkonversi gula menjadi asam asetat langsung, tanpa menggunakan etanol sebagai perantara. Reaksi kimia keseluruhan yang dilakukan oleh bakteri ini dapat direpresentasikan sebagai:<blockquote>C<sub>6</sub>H<sub>12</sub>O<sub>6</sub> → 3 CH<sub>3</sub>COOH</blockquote>[[Bakteri asetogenik]] menghasilkan asam asetat dari senyawa satu-karbon, termasuk metanol, [[karbon monoksida]], atau campuran [[karbon dioksida]] dan [[hidrogen]]:<blockquote>2 CO<sub>2</sub> + 4 H<sub>2</sub> → CH<sub>3</sub>COOH + 2 H<sub>2</sub>O</blockquote>Kemampuan ''Clostridium'' ini untuk memanfaatkan gula secara langsung, atau untuk menghasilkan asam asetat dari bahan yang lebih murah, berarti bahwa bakteri ini berpotensi menghasilkan asam asetat lebih efisien daripada oksidator etanol seperti ''Acetobacter''. Namun, bakteri ''Clostridium'' lebih peka terhadap asam daripada ''Acetobacter''. Bahkan strain ''Clostridium'' yang paling toleran terhadap asam dapat menghasilkan cuka dengan persentase asam asetat yang sangat sedikit, dibandingkan dengan strain ''Acetobacter'' yang dapat menghasilkan cuka hingga 20% asam asetat. Saat ini, masih lebih efisien memproduksi cuka menggunakan ''Acetobacter'' daripada menggunakan ''Clostridium'' dan kemudian dipekatkan. Akibatnya, meskipun bakteri asetogenik telah dikenal sejak tahun 1940, penggunaan industri mereka tetap terbatas pada beberapa aplikasi ceruk.<ref>{{Cite|author1 = Jia Huey Sim|author2 = Azlina Harun Kamaruddin|author3 = Wei Sing Long|author4 = Ghasem Najafpour|year = 2007|title = Clostridium aceticum—A potential organism in catalyzing carbon monoxide to acetic acid: Application of response surface methodology|journal = Enzyme and Microbial Technology|volume = 40|issue = 5|pages = 1234–1243|doi = 10.1016/j.enzmictec.2006.09.017}}</ref> |
|||
== Penggunaan == |
== Penggunaan == |
||
[[Berkas:Acetic acid winchester.JPG|150px|right|thumb|Botol berisi 2,5 [[liter]] asam asetat di laboratorium]] |
[[Berkas:Acetic acid winchester.JPG|150px|right|thumb|Botol berisi 2,5 [[liter]] asam asetat di laboratorium]] |
||
Asam asetat digunakan sebagai [[pereaksi kimia]] untuk menghasilkan berbagai [[senyawa]] kimia. Sebagian besar (40-45%) dari asam asetat dunia digunakan sebagai bahan untuk memproduksi [[monomer]] [[vinil asetat]] (''vinyl acetate monomer'', VAM). Selain itu asam asetat juga digunakan dalam produksi [[anhidrida asetat]] dan juga [[ester]]. Penggunaan asam asetat lainnya, termasuk penggunaan dalam cuka relatif kecil. |
Asam asetat digunakan sebagai [[pereaksi kimia]] untuk menghasilkan berbagai [[senyawa]] kimia. Sebagian besar (40-45%) dari asam asetat dunia digunakan sebagai bahan untuk memproduksi [[monomer]] [[vinil asetat]] (''vinyl acetate monomer'', VAM). Selain itu asam asetat juga digunakan dalam produksi [[anhidrida asetat]] dan juga [[ester]]. Penggunaan asam asetat lainnya, termasuk penggunaan dalam cuka relatif kecil.<ref name=":2" /><ref name=":3" /> |
||
=== Monomer vinil asetat === |
|||
Penggunaan utama dari asam asetat adalah untuk produksi [[Monomer vinil asetat|monomer vinil asetat (VAM)]]. Pada tahun 2008, aplikasi ini diperkirakan mengkonsumsi sepertiga dari produksi asam asetat dunia.<ref name=":2" /> Reaksinya adalah [[etilena]] dan asam asetat dengan [[oksigen]] melalui [[katalis]] [[paladium]], yang dilakukan dalam fase gas.<ref name=":7">{{Cite|author1 = Günter Roscher|year = 2005|title = VInyl Esters|journal = Ullmann's Encyclopedia of Industrial Chemistry|location = Weinheim|publisher = Wiley-VCH|doi = 10.1002/14356007.a27_419}}</ref><blockquote>2 H<sub>3</sub>C–COOH + 2 C<sub>2</sub>H<sub>4</sub> + O<sub>2</sub> → 2 H<sub>3</sub>C–CO–O–CH=CH<sub>2</sub> + 2 H<sub>2</sub>O</blockquote>Vinil asetat dapat dipolimerisasi menjadi polivinil asetat atau polimer lain, yang merupakan komponen dalam cat dan perekat.<ref name=":7" /> |
|||
=== Produksi ester === |
|||
[[Ester]] utama dari asam asetat biasanya digunakan sebagai pelarut untuk [[tinta]], [[cat]] dan [[pelapis]]. Ester ini termasuk [[etil asetat]], [[N-butil asetat|''n''-butil asetat]], [[isobutil asetat]], dan [[propil asetat]]. Mereka biasanya diproduksi dari asam asetat dan alkohol yang sesuai melalui reaksi yang dikatalisis:<blockquote>H<sub>3</sub>C-COOH + HO-R → H<sub>3</sub>C-CO-O-R + H<sub>2</sub>O, (R = [[Alkil|gugus alkil]] umum)</blockquote>Kebanyakan ester asetat, yang dihasilkan dari [[asetaldehida]] menggunakan [[reaksi Tishchenko]]. Selain itu, eter asetat digunakan sebagai pelarut untuk [[nitroselulosa]], [[Cat akrilik|lak akrilik]], penghilang [[Vernis|pernis]], dan noda kayu. Pertama, glikol monoeter diproduksi dari [[etilena oksida]] atau [[propilena oksida]] dengan alkohol, yang kemudian diesterifikasi dengan asam asetat. Tiga produk utama adalah etilena glikol monoetil eter asetat (EEA), etilena glikol monobutil eter asetat (EBA), dan propilena glikol monometil eter asetat (PMA, lebih dikenal sebagai PGMEA dalam proses manufaktur semikonduktor, tempat ia digunakan sebagai pelarut penahan). Aplikasi ini mengkonsumsi sekitar 15% sampai 20% dari asam asetat di seluruh dunia. Eter asetat, misalnya EEA, telah terbukti berbahaya bagi reproduksi manusia.<ref name=":3" /> |
|||
=== Anhidrida asetat === |
|||
Produk dari [[kondensasi]] dua molekul asam asetat adalah [[anhidrida asetat]]. Produksi anhidrida asetat seluruh dunia adalah aplikasi utama, dan menggunakan sekitar 25% sampai 30% dari produksi asam asetat global. Proses utama melibatkan dehidrasi asam asetat untuk menghasilkan [[ketena]] pada 700–750 °C. Ketena kemudian direaksikan dengan asam asetat untuk mendapatkan anhidrida dengan:<ref name=":8">{{Cite|author1 = Heimo Held|author2 = Alfred Rengstl|author3 = Dieter Mayer|year = 2005|title = Acetic Anhydride and Mixed Fatty Acid Anhydrides|journal = Ullmann's Encyclopedia of Industrial Chemistry|location = Weinheim|publisher = Wiley-VCH|doi = 10.1002/14356007.a01_065}}</ref><blockquote>CH<sub>3</sub>CO<sub>2</sub>H → CH<sub>2</sub>=C=O + H<sub>2</sub>O</blockquote><blockquote>CH<sub>3</sub>CO<sub>2</sub>H + CH<sub>2</sub>=C=O → (CH<sub>3</sub>CO)<sub>2</sub>O</blockquote>Anhidrida asetat adalah [[asetilator]]. Dengan demikian, aplikasi utama adalah pada pembuatan [[selulosa asetat]], [[tekstil]] sintetis yang juga digunakan untuk [[film fotografi]]. Anhidrida asetat juga merupakan pereaksi pada produksi [[heroin]] dan senyawa lainnya.<ref name=":8" /> |
|||
=== Sebagai pelarut === |
|||
Asam asetat glasial adalah [[pelarut protik]] polar yang baik, seperti disebutkan di atas. Ia sering digunakan sebagai pelarut pada [[rekristalisasi]] untuk memurnikan senyawa organik. Asam asetat digunakan sebagai [[pelarut]] dalam produksi [[asam tereftalat]] (TPA), bahan baku untuk [[polietilena tereftalat]] (PET). Pada tahun 2006, sekitar 20% dari asam asetat digunakan untuk produksi TPA.<ref name=":3" /> |
|||
Asam asetat sering digunakan sebagai pelarut untuk reaksi yang melibatkan [[karbokation]], seperti [[alkilasi Friedel-Crafts]]. Sebagai contoh, satu tahap dalam pembuatan [[kamper]] sintetis komersial melibatkan [[penataulangan Wagner-Meerwein]] dari [[kamfena]] menjadi [[isobornil asetat]]; di sini asam asetat bertindak sebagai pelarut dan [[nukleofil]] sekaligus untuk menjebak karbokation yang sudah mengalami [[Reaksi penataan ulang|penataulangan]].<ref>{{Cite|author1 = Sell, Charles S.|year = 2006|chapter = 4.2.15 Bicyclic Monoterpenoids|title = The Chemistry of Fragrances: From Perfumer to Consumer. RSC Paperbacks Series|volume = 38|edition = 2nd|publisher = Royal Society of Chemistry|location = Great Britain|page = 80|isbn = 0-85404-824-3}}</ref> |
|||
Asam asetat glasial digunakan dalam kimia analitik untuk menentukan kadar basa lemah seperti amida organik. Asam asetat glasial merupakan basa yang jauh lebih lemah daripada air, sehingga amida berperilaku sebagai basa kuat dalam media ini. Ia kemudian dapat dititrasi menggunakan asam yang sangat kuat, seperti [[asam perklorat]], yang dilarutkan dalam asam asetat glasial.<ref>{{Cite|author1 = Felgner, Andrea|title = Titration in Non-Aqueous Media|publisher = Sigma-Aldrich}}</ref> |
|||
=== Manfaat medis === |
|||
Asam asetat encer digunakan dalam [[terapi fisik]] menggunakan [[iontoforesis]].<ref>{{Cite|author1 = Kolt, Gregory S.|author2 = Snyder-Mackler, Lynn|year = 2007|title = Physical Therapies in Sport and Exercise|publisher = Elsevier Health Sciences|page = 223|isbn = 978-0-443-10351-3|url = https://books.google.com/books?id=2utRky2VO0UC&pg=PA223}}</ref> |
|||
=== Cuka === |
|||
{{Utama|Cuka}}Cuka biasanya mengandung 4-18% massa asam asetat. Cuka digunakan langsung sebagai [[bumbu]], dan dalam [[Acar|pengawetan]] sayuran dan makanan lain. Cuka meja cenderung lebih encer (4% sampai 8% asam asetat), sementara makanan acar komersial menggunakan larutan yang lebih pekat. Jumlah asam asetat yang digunakan sebagai cuka pada skala dunia tidak besar, tetapi merupakan aplikasi tertua dan paling terkenal.<ref>{{Cite|author1 = Bernthsen, A.|author2 = Sudborough, J.J.|year = 1922|title = Organic Chemistry|location = London|publisher = Blackie and Son|page = 155}}</ref> |
|||
== Keamanan == |
== Keamanan == |
||
Revisi per 18 Januari 2016 09.07
| |||
| |||

| |||
| Nama | |||
|---|---|---|---|
| Nama IUPAC | |||
| Nama IUPAC (sistematis)
Ethanoic acid[5] | |||
| Nama lain | |||
| Penanda | |||
Model 3D (JSmol)
|
|||
| 3DMet | {{{3DMet}}} | ||
| Singkatan | AcOH | ||
| Referensi Beilstein | 506007 | ||
| ChEBI | |||
| ChEMBL | |||
| ChemSpider | |||
| DrugBank | |||
| Nomor EC | |||
| Referensi Gmelin | 1380 | ||
| KEGG | |||
| MeSH | Acetic+acid | ||
PubChem CID
|
|||
| Nomor RTECS | {{{value}}} | ||
| UNII | |||
| Nomor UN | 2789 | ||
CompTox Dashboard (EPA)
|
|||
| |||
| |||
| Sifat | |||
| C2H4O2 | |||
| Massa molar | 60,05 g·mol−1 | ||
| Penampilan | Cairan tak berwarna atau kristal | ||
| Bau | Menyengat/Seperti cuka | ||
| Densitas | 1,049 g cm−3 | ||
| Titik lebur | 289 to 290 K | ||
| Titik didih | 391 to 392 K | ||
| Dapat campur | |||
| log P | -0,322 | ||
| Keasaman (pKa) | 4,76[6] | ||
| Kebasaan (pKb) | 9,24 (kebasaan ion asetat) | ||
| Indeks bias (nD) | 1,371 | ||
| Viskositas | 1,22 mPa s | ||
| 1,74 D | |||
| Termokimia | |||
| Kapasitas kalor (C) | 123,1 J·K−1·mol−1 | ||
| Entropi molar standar (S |
158,0 J·K−1·mol−1 | ||
| Entalpi pembentukan standar (ΔfH |
-483,88--483,16 kJ·mol−1 | ||
| Entalpi pembakaran standar ΔcH |
-875,50--874.82 kJ·mol−1 | ||
| Bahaya | |||
| Piktogram GHS |  
| ||
| Keterangan bahaya GHS | {{{value}}} | ||
| H226, H314 | |||
| P280, P305+351+338, P310 | |||
| Titik nyala | 40 °C | ||
| 427 °C | |||
| Ambang ledakan | 4-16% | ||
| Dosis atau konsentrasi letal (LD, LC): | |||
LD50 (dosis median)
|
3,31 g·kg−1, oral (mencit) | ||
LC50 (konsentrasi median)
|
5.620 ppm (tikus, 1 jam) 16.000 ppm (tikus, 4 hr)[8] | ||
| Batas imbas kesehatan AS (NIOSH): | |||
PEL (yang diperbolehkan)
|
TWA 10 ppm (25 mg/m3)[7] | ||
REL (yang direkomendasikan)
|
TWA 10 ppm (25 mg/m3) ST 15 ppm (37 mg/m3)[7] | ||
IDLH (langsung berbahaya)
|
50 ppm[7] | ||
| Senyawa terkait | |||
Related asam karboksilat
|
Asam format Asam propionat | ||
Senyawa terkait
|
Asetaldehida Asetamida | ||
Kecuali dinyatakan lain, data di atas berlaku pada suhu dan tekanan standar (25 °C [77 °F], 100 kPa). | |||
| Referensi | |||
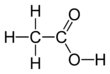
Asam asetat, asam etanoat atau asam cuka[9] adalah senyawa kimia asam organik yang dikenal sebagai pemberi rasa asam dan aroma dalam makanan. Asam cuka memiliki rumus empiris C. Rumus ini seringkali ditulis dalam bentuk CH, CH, atau CH. Asam asetat pekat (disebut asam asetat glasial) adalah cairan higroskopis tak berwarna, dan memiliki titik beku 16,7°C. Cuka mengandung 3–9% volume asam asetat, menjadikannya asam asetat adalah komponen utama cuka selain air. Asam asetat berasa asam dan berbau menyengat. Selain diproduksi untuk cuka konsumsi rumah tangga, asam asetat juga diproduksi sebagai prekursor untuk polivinil asetat dan selulosa asetat. Meskipun digolongkan sebagai asam lemah, asam asetat pekat bersifat korosif dan dapat menyerang kulit.
Asam asetat merupakan salah satu asam karboksilat paling sederhana, setelah asam format. Larutan asam asetat dalam air merupakan sebuah asam lemah, artinya hanya terdisosiasi sebagian menjadi ion H+ dan CH–. Asam asetat merupakan pereaksi kimia dan bahan baku industri yang penting. Asam asetat digunakan dalam produksi polimer seperti polietilena tereftalat, selulosa asetat, dan polivinil asetat, maupun berbagai macam serat dan kain. Dalam industri makanan, asam asetat, dengan kode aditif makanan E260, digunakan sebagai pengatur keasaman. Di rumah tangga, asam asetat encer juga sering digunakan sebagai pelunak air. Sebagai aditif makanan, asam asetat disetujui penggunaannya di banyak negara, termasuk Kanada[10], Uni Eropa[11], Amerika Serikat[12], Australia dan Selandia Baru[13].
Dalam setahun, kebutuhan dunia akan asam asetat mencapai 6,5 juta ton per tahun. 1,5 juta ton per tahun diperoleh dari hasil daur ulang, sisanya diperoleh dari industri petrokimia.[14] Sebagai pereaksi kimia, sumber hayati cukup menarik, tetapi tidak kompetitif. Cuka adalah asam asetat encer, seringkali diproduksi melalui fermentasi dan oksidasi lanjutan etanol.
Tata Nama
Asam asetat merupakan nama trivial atau nama dagang dari senyawa ini, dan merupakan nama yang paling dianjurkan oleh IUPAC. Nama ini berasal dari kata bahasa Latin: acetum, yang berarti cuka. Nama sistematis dari senyawa ini adalah asam etanoat.[15]
Asam asetat glasial merupakan nama trivial yang merujuk pada asam asetat yang bebas-air (anhidrat). Disebut demikian karena asam asetat bebas-air membentuk kristal mirip es pada 16,6 °C (61,9 °F), pada suhu sedikit di bawah suhu ruang.[16]
Singkatan yang paling sering digunakan, dan merupakat singkatan resmi bagi asam asetat adalah AcOH atau HOAc di mana Ac berarti gugus asetil, CH3–C(=O)–. Asetat (CH) disingkat sebagai AcO−. Ac jangan disalahartikan dengan lambang unsur aktinium (Ac).[17] Untuk mendapatkan gambaran struktur yang lebih baik, asam asetat seringkali ditulis sebagai CH3–C(O)OH, CH3–C(=O)OH, CH, dan CH. Dalam konteks reaksi asam-basa, singatan HAc sering digunakan,[18] dengan Ac merupakan singkatan dari asetat. Asetat adalah ion yang dihasilkan dari lepasnya H+ dari asam asetat. Nama asetat dapat pula merujuk pada garam yang mengandung anion ini, atau suatu ester dari asam asetat.[19]
Sejarah

Cuka telah dikenal manusia sejak dahulu kala. Cuka dihasilkan oleh berbagai bakteria penghasil asam asetat, dan asam asetat merupakan hasil samping dari pembuatan bir atau anggur.
Penggunaan asam asetat sebagai pereaksi kimia juga sudah dimulai sejak lama. Pada abat ke-3 Sebelum Masehi, Filsuf Yunani kuno Theophrastos menjelaskan bahwa cuka bereaksi dengan logam-logam membentuk berbagai zat warna, misalnya timbal putih (timbal karbonat), dan verdigris, yaitu suatu zat hijau campuran dari garam-garam tembaga dan mengandung tembaga (II) asetat. Bangsa Romawi menghasilkan sapa, sebuah sirup yang amat manis, dengan mendidihkan anggur yang sudah asam. Sapa mengandung timbal asetat, suatu zat manis yang disebut juga gula timbal dan gula Saturnus. Akhirnya hal ini berlanjut kepada peracunan dengan timbal yang dilakukan oleh para pejabat Romawi.[20]
Pada abad ke-8, ilmuwan Persia Jabir ibn Hayyan menghasilkan asam asetat pekat dari cuka melalui distilasi. Pada masa renaisans, asam asetat glasial dihasilkan dari distilasi kering logam asetat. Pada abad ke-16 ahli alkimia Jerman Andreas Libavius menjelaskan prosedur tersebut, dan membandingkan asam asetat glasial yang dihasilkan terhadap cuka. Ternyata asam asetat glasial memiliki banyak perbedaan sifat dengan larutan asam asetat dalam air, sehingga banyak ahli kimia yang mempercayai bahwa keduanya sebenarnya adalah dua zat yang berbeda. Ahli kimia Prancis Pierre Adet akhirnya membuktikan bahwa kedua zat ini sebenarnya sama.[20][21]
Pada 1847 kimiawan Jerman Hermann Kolbe mensintesis asam asetat dari zat anorganik untuk pertama kalinya. Reaksi kimia yang dilakukan adalah klorinasi karbon disulfida menjadi karbon tetraklorida, diikuti dengan pirolisis menjadi tetrakloroetilena dan klorinasi dalam air menjadi asam trikloroasetat, dan akhirnya reduksi elektrolisis menjadi asam asetat.[22]
Sejak 1910 kebanyakan asam asetat dihasilkan dari cairan piroligneous yang diperoleh dari distilasi kayu. Cairan ini direaksikan dengan kalsium hidroksida menghasilkan kalsium asetat yang kemudian diasamkan dengan asam sulfat menghasilkan asam asetat. Pada saat itu, Jerman memproduksi 10.000 ton asam asetat glasial, sekitar 30% dari yang digunakan untuk produksi zat warna indigo.[20][23]
Oleh karena baik metanol dan karbon monoksida merupakan bahan baku komoditas umum, karbonilasi metanol merupakan daya tarik tersendiri sebagai prekursor asam asetat. Henri Dreyfus di British Celanese mengembangkan cikal bakal pabrik karbonilasi metanol di awal tahun 1925.[24] Namun, kurangnya bahan praktis yang diperlukan dapat menampung campuran reaksi korosif pada tekanan tinggi (200 atm atau lebih) mematahkan komersialisasi proses ini. Proses karbonilasi metanol komersial pertama, menggunakan kobalt sebagai katalis, dikembangkan oleh perusahaan kimia Jerman BASF pada tahun 1963. Pada tahun 1968, katalis berbasis rodium (cis−[Rh(CO)2I2]−) ditemukan yang dapat beroperasi secara efisien pada tekanan rendah dengan hampir tanpa produk sampingan. Perusahaan kimia Amerika Serikat Monsanto Company membangun pabrik pertamanya menggunakan katalis ini pada tahun 1970, dan karbonilasi metanol dengan katalis rodium menjadi metode dominan pada produksi asam asetat (lihat proses Monsanto). Pada akhir 1990an, perusahaan kimia BP Chemicals mengkomersialkan katalis Cativa ([Ir(CO)2I2]−), dengan prekursor iridium[25] untuk efisiensi yang lebih besar. Proses Cativa berkatalis iridium lebih ramah lingkungan dan lebih efisien[26] dan telah menggantikan proses Monsanto.
Sifat-sifat kimia
Keasaman
Atom hidrogen (H) pada gugus karboksil (−COOH) dalam asam karboksilat seperti asam asetat dapat dilepaskan sebagai ion H+ (proton), melalui peroses ionisasi sebagai berikut:
CH3CO2H → CH3CO2− + H+
Oleh karena itu, asam asetat mempunyai sifat asam. Asam asetat adalah asam lemah monoprotik dengan nilai pKa=4,76.[27] Basa konjugasinya adalah asetat (CH3COO−). Basa konjugatnya adalah asetat (CH3COO−). Sebuah larutan 1.0 M asam asetat (kira-kira sama dengan konsentrasi pada cuka rumah) memiliki pH sekitar 2,4; menandakan bahwa sekitar 0,4% molekul asam asetat terdisosiasi.[n 1]
Struktur
Asam asetat padat menunjukkan bahwa molekul-molekul asam asetat berpasangan membentuk dimer yang dihubungkan oleh ikatan hidrogen.[28] Dimer juga dapat dideteksi pada uap bersuhu 120 °C (248 °F). Dimer juga terjadi pada larutan encer di dalam pelarut tak-berikatan-hidrogen, dan kadang-kadang pada cairan asam asetat murni.[29] Dimer dirusak dengan adanya pelarut berikatan hidrogen (misalnya air). Entalpi disosiasi dimer tersebut diperkirakan 65,0–66,0 kJ/mol, entropi disosiasi sekitar 154–157 J mol−1 K−1.[30] Sifat dimerisasi ini juga dimiliki oleh asam karboksilat sederhana lainnya.[31]

Sifat pelarut
Asam asetat cair adalah pelarut protik hidrofilik (polar), mirip seperti air dan etanol. Asam asetat memiliki konstanta dielektrik yang sedang yaitu 6,2; sehingga ia bisa melarutkan baik senyawa polar seperi garam anorganik dan gula maupun senyawa non-polar seperti minyak dan unsur-unsur seperti sulfur dan iodin. Asam asetat bercampur dengan mudah dengan pelarut polar atau nonpolar lainnya seperti air, kloroform dan heksana. Dengan alkana yang lebih tinggi (dimulai dari oktana), asam asetat tidak lagi bercampur sempurna, dan kebercampurannya terus menurun berbanding lurus dengan kenaikan rantai n-alkana.[32] Sifat kelarutan dan kemudahan bercampur dari asam asetat ini membuatnya digunakan secara luas dalam industri kimia, misalnya sebagai pelarut dalam produksi dimetil tereftalat.[14]
Reaksi Kimia
Reaksi dengan senyawa anorganik
Asam asetat bersifat korosif terhadap banyak logam seperti besi, magnesium, dan seng, membentuk gas hidrogen dan garam-garam asetat (disebut logam asetat). Logam asetat juga dapat diperoleh dengan reaksi asam asetat dengan suatu basa yang cocok. Contoh yang terkenal adalah reaksi soda kue (Natrium bikarbonat) bereaksi dengan cuka. Hampir semua garam asetat larut dengan baik dalam air. Salah satu pengecualian adalah kromium (II) asetat. Contoh reaksi pembentukan garam asetat:
Karena aluminium membentuk suatu film aluminium oksida yang tahan asam sehingga melindungi permukaannya, tangki aluminium digunakan untuk menampung dan mengangkut asam asetat. Asetat logam dapat juga diperoleh dari asam asetat dan basa yang sesuai, seperti dalam reaksi populer "baking soda + cuka":
Kimia organik

Asam asetat mengalami reaksi-reaksi asam karboksilat, misalnya menghasilkan garam asetat bila bereaksi dengan alkali, menghasilkan logam etanoat bila bereaksi dengan logam, dan menghasilkan logam etanoat, air dan karbondioksida bila bereaksi dengan garam karbonat atau bikarbonat. Dengan basa kuat (misalnya pereaksi organolitium), asam asetat mengalami deprotonasi menghasilkan LiCH2CO2Li. Reaksi organik yang paling terkenal dari asam asetat adalah pembentukan etanol melalui reduksi, pembentukan turunan asam karboksilat seperti asetil klorida atau anhidrida asetat melalui substitusi nukleofilik. Anhidrida asetat dibentuk melalui kondensasi dua molekul asam asetat. Ester dari asam asetat dapat diperoleh melalui reaksi esterifikasi Fischer, dan juga pembentukan amida. Pada suhu 440 °C, asam asetat terurai menjadi metana dan karbon dioksida, atau ketena dan air.
Deteksi
Asam asetat dapat dikenali dengan baunya yang khas. Selain itu, garam-garam dari asam asetat bereaksi dengan larutan besi(III) klorida, yang menghasilkan warna merah pekat yang hilang bila larutan diasamkan.[33] Garam-garam asetat bila dipanaskan dengan arsenik trioksida (AsO3) membentuk kakodil oksida ((CH3)2As-O-As(CH3)2), yang mudah dikenali dengan bau uapnya yang tidak menyenangkan.[34]
Turunan lain
Garam organik atau anorganik yang dihasilkan dari asam asetat antara lain:
- Natrium asetat, digunakan dalam industri tekstil dan sebagai pengawet makanan (E262).
- Tembaga(II) asetat, digunakan sebagai pigmen dan fungisida.
- Aluminium asetat dan besi(II) asetat—sebagai mordan untuk pewarna.
- Paladium(II) asetat, digunakan sebagai katalis untuk reaksi penjodohan organik seperti reaksi Heck.
- Perak asetat, digunakan sebagai pestisida.
Produk-produk asam asetat tersubstitusi mencakup:
- Asam kloroasetat (monochloroacetic acid, MCA), asam dikloroasetat (ditengarai sebagai produk sampingan), dan asam trikloroasetat. MCA digunakan dalam fabrikasi pewarna indigo.
- Asam bromoasetat, yang jika diesterifikasi menghasilkan pereaksi etil bromoasetat.
- Asam trifluoroasetat, merupakan pereaksi umum dalam sintesis organik.
Jumlah asam asetat yang digunakan dalam aplikasi lain ini (tidak termasuk TPA) meliputi 5–10% dari penggunaan asam asetat dunia. Namun aplikasi-aplikasi ini diperkirakan tidak tumbuh sepesat produksi TPA.[35]
Biokimia
Pada pH fisiologis, asam asetat biasanya terionisasi sempurna membentuk asetat. Gugus asetil yang terdapat pada asam asetat merupakan gugus yang penting bagi biokimia pada hampir seluruh makhluk hidup, seperti gugus asetil yang berikat pada koenzim A menjadi senyawa yang disebut Asetil-KoA, merupakan enzim utama bagi metabolisme karbohidrat dan lemak. Namun, asam asetat bebas memiliki konsentrasi yang kecil dalam sel, karena asam asetat bebas dapat menyebabkan gangguan pada mekanisme pengaturan pH sel. Berbeda dengan asam karboksilat berantai panjang, asam asetat tidak ditemukan pada trigliserida dalam tubuh makhluk hidup. Sekalipun demikian, trigliserida buatan yang memiliki gugus asetat, triasetin (trigliserin asetat), adalah zat aditif yang umum pada makanan, dan juga digunakan dalam kosmetika dan obat-obatan.[36]
Asam asetat diproduksi dan diekskresikan oleh bakteri-bakteri tertentu, misalnya dari genus Acetobacter dan spesies Clostridium acetobutylicum. Bakteri-bakteri ini terdapat pada makanan, air, dan juga tanah, sehingga asam asetat secara alami diproduksi pada buah-buahan/makanan yang telah basi. Asam asetat juga terdapat pelumas vagina manusia dan primata lainnya, berperan sebagai agen anti-bakteri.[37]
Biosintesis asam asetat
Asam asetat merupakan produk katabolisme aerob dalam jalur glikolisis atau perombakan glukosa. Asam piruvat sebagai produk oksidasi glukosa dioksidasi oleh NAD+ terion lalu segera diikat oleh Koenzim-A. Pada prokariota proses ini terjadi di sitoplasma sementara pada eukariota berlangsung pada mitokondria.
Pembuatan

Asam asetat diproduksi secara sintetis maupun secara alami melalui fermentasi bakteri. Sekitar 75% asam asetat yang dibuat untuk digunakan dalam industri kimia diproduksi melalui karbonilasi metanol, yang dijelaskan di bawah.[14] Sisanya dihasilkan melalui metode-metode alternatif. Sekarang hanya 10% dari produksi asam asetat dihasilkan melalui jalur alami, namun kebanyakan hukum yang mengatur bahwa asam asetat yang terdapat dalam cuka haruslah berasal dari proses biologis.[38] Sepanjang tahun 2003–2005, produksi total asam asetat dunia diperkirakan 5 Mt/a (juta ton per tahun), setengahnya diproduksi di Amerika Serikat. Eropa memproduksi sekitar 1 Mt/a dan terus menurun, sedangkan Jepang memproduksi sekitar 0,7 Mt/a. Sebanyak 1,51 Mt/a dihasilkan melalui daur ulang, sehingga total pasar asam asetat mencapai 6,51 Mt/a.[39][35] Sejak saat itu produksi global telah meningkat menjadi 10,7 Mt/a (in 2010), namun selanjutnya, diperkirakan terdapat perlambatan kenaikan produksi.[40] Dua perusahan produsen asam asetat terbesar adalah Celanese dan BP Chemicals. Produsen besar lainnya adalah Millenium Chemicals, Sterling Chemicals, Samsung, Eastman, dan Svensk Etanolkemi.[41]
Karbonilasi metanol
Kebanyakan asam asetat murni dihasilkan melalui karbonilasi. Dalam reaksi ini, metanol dan karbon monoksida bereaksi menghasilkan asam asetat sesuai persamaan:
Proses ini melibatkan iodometana sebagai zat antara, di mana reaksi itu sendiri terjadi dalam tiga tahap. Diperlukan suatu katalis karbonil logam untuk karbonilasi (tahap 2).[38]
Dua proses terkait dengan karbonilasi metanol adalah: proses Monsanto dengan katalis rodium, dan proses Cativa dengan katalis iridium. Proses Cativa lebih ramah lingkungan dan lebih efisien[26] dan telah banyak menggantikan proses sebelumnya. Jumlah katalisis air yang digunakan dalam kedua proses cukup banyak, tetapi proses Cativa memerlukan lebih sedikit air, sehingga reaksi pergeseran air-gas dapat ditekan dan produk sampingan yang dihasilkan juga lebih sedikit.
Dengan mengubah kondisi reaksi, anhidrida asetat dapat juga diproduksi pada kilang yang sama menggunakan katalis rodium.[42]
Oksidasi asetaldehida
Sebelum komersialisasi proses Monsanto, kebanyakan asam asetat diproduksi melalui oksidasi asetaldehida. Sekarang oksidasi asetaldehida merupakan metode produksi asam asetat terpenting kedua, sekalipun tidak kompetitif bila dibandingkan dengan metode karbonilasi metanol.
Asetaldehida yang digunakan dihasilkan melalui oksidasi butana atau nafta ringan, atau hidrasi dari etilena. Saat butena atau nafta ringan dipanaskan bersama udara disertai dengan beberapa ion logam, termasuk ion mangan, kobalt dan kromium, terbentuk peroksida yang selanjutnya terurai menjadi asam asetat sesuai dengan persamaan reaksi di bawah ini.
Umumnya reaksi ini dijalankan pada temperatur dan tekanan sedemikian rupa sehingga tercapai suhu setinggi mungkin namun butana masih berwujud cair. Kondisi reaksi pada umumnya sekitar 150 °C (302 °F) dan 55 atm. Produk sampingan seperti butanon, etil asetat, asam format dan asam propionat juga mungkin terbentuk. Produk sampingan ini juga bernilai komersial dan jika diinginkan kondisi reaksi dapat diubah untuk menghasilkan lebih banyak produk samping, namun pemisahannya dari asam asetat menjadi kendala karena membutuhkan biaya lebih banyak lagi.[43]
Melalui kondisi dan katalis yang sama seperti yang digunakan dalam oksidasi butana, oksigen di udara yang menghasilkan asam asetat dapat mengoksidasi asetaldehida.[43]
- 2 CH3CHO + O2 → 2 CH3COOH
- Di mana reaksi sampingnya :
- CH3CHO + O2 → CH3OH + CO2
- CH3OH + CH3COOH → CH3COOCH3 + H2O
Dengan menggunakan katalis modern, reaksi ini dapat memiliki rendemen (yield) lebih besar dari 95%. Produk samping utamanya adalah etil asetat, asam format, dan formaldehida yang memiliki titik didih lebih rendah daripada asam asetat sehingga dapat dipisahkan dengan mudah melalui distilasi.[43]
Oksidasi etilena
Asetaldehida dapat dibuat dari etilena melalui proses Wacker, dan kemudian dioksidasi seperti di atas. Beberapa waktu terakhir, perusahaan kimia Showa Denko, yang membuka kilang oksidasi etilena di Ōita, Jepang, pada tahun 1997, mengkomersialkan konversi etilena menjadi asam asetat tahap-tunggal yang lebih murah.[43] Proses ini menggunakan katalis logam paladium yang didukung dengan asam heteropoli seperti asam tungstosilikat. Sulit untuk lebih kompetitif daripada karbonilasi metanol untuk kilang yang lebih kecil (100–250 kt/a), bergantung pada harga etilena lokal. Pendekatannya akan berbasis penggunaan teknologi oksidasi fotokatalitik untuk oksidasi selektif etilena dan etana menjadi asam asetat. Tidak seperti katalis oksidasi tradisional, proses oksidasi selektif akan menggunakan radiasi ultraviolet untuk memproduksi asam asetat pada temperatur dan tekanan kamar.
Fermentasi oksidatif
Dalam sejarah manusia, bakteri asam asetat dari genus Acetobacter telah membuat asam asetat dalam bentuk cuka. Dengan adanya oksigen yang cukup, bakteri ini dapat memproduksi cuka dari berbagai bahan makanan beralkohol. Bahan baku yang umum digunakan antara lain sari apel, anggur, dan biji-bijian terfermentasi, malt, beras, atau tepung kentang. Reaksi kimia keseluruhan yang difasilitasi oleh bakteri ini adalah:
C2H5OH + O2 → CH3COOH + H2O
Larutan alkohol encer diinokulasi dengan Acetobacter dan disimpan di tempat yang hangat dan cukup udara akan menjadi cuka setelah beberapa bulan. Metode pembuatan cuka industri mempercepat proses ini dengan meningkatkan pasokan oksigen kepada bakteri.[44]
Batch pertama dari cuka yang dihasilkan oleh fermentasi mungkin mengandung kesalahan dalam proses pembuatan anggur. Jika cendawan difermentasi pada suhu terlalu tinggi, acetobacter akan merusak ragi alami pada buah anggur. Karena permintaan cuka untuk keperluan memasak, kesehatan, dan sanitasi meningkat, pengrajin anggur cepat belajar untuk menggunakan bahan-bahan organik lain untuk menghasilkan cuka pada bulan-bulan musim panas sebelum tersedia buah anggur matang dan siap untuk diproses menjadi anggur. Metode ini lambat, namun, dan tidak selalu berhasil, sebagian pengrajin anggur tidak memahami proses.[45]
Salah satu proses komersial modern pertama adalah "metode cepat" atau "metode Jerman", pertama kali dipraktekkan di Jerman pada tahun 1823. Dalam proses ini, fermentasi berlangsung dalam suatu menara yang dikemas dengan serutan kayu atau arang. Umpan yang mengandung alkohol diteteskan di atas menara, dan udara segar dipasok dari bawah baik secara alami atau konveksi. Peningkatan pasokan udara dalam proses ini mempersingkat waktu produksi cuka dari bulan ke minggu.[46]
Saat ini, sebagian besar cuka dibuat dalam tangki budidaya terendam, pertama kali dijelaskan pada 1949 oleh Otto Hromatka dan Heinrich Ebner.[47] Dalam metode ini, alkohol difermentasi menjadi cuka dalam tangki sambil terus diaduk, dan oksigen disuplai dengan menggelegakkan udara melalui larutan. Dengan menggunakan aplikasi modern dari metode ini, cuka dengan 15% asam asetat dapat dibuat hanya dalam waktu 24 jam dalam proses batch, bahkan 20% dalam 60 jam proses kontinu.[45]
Fermentasi anaerobik
Spesies bakteri anaerob, termasuk anggota dari genus Clostridium atau Acetobacterium dapat mengkonversi gula menjadi asam asetat langsung, tanpa menggunakan etanol sebagai perantara. Reaksi kimia keseluruhan yang dilakukan oleh bakteri ini dapat direpresentasikan sebagai:
C6H12O6 → 3 CH3COOH
Bakteri asetogenik menghasilkan asam asetat dari senyawa satu-karbon, termasuk metanol, karbon monoksida, atau campuran karbon dioksida dan hidrogen:
2 CO2 + 4 H2 → CH3COOH + 2 H2O
Kemampuan Clostridium ini untuk memanfaatkan gula secara langsung, atau untuk menghasilkan asam asetat dari bahan yang lebih murah, berarti bahwa bakteri ini berpotensi menghasilkan asam asetat lebih efisien daripada oksidator etanol seperti Acetobacter. Namun, bakteri Clostridium lebih peka terhadap asam daripada Acetobacter. Bahkan strain Clostridium yang paling toleran terhadap asam dapat menghasilkan cuka dengan persentase asam asetat yang sangat sedikit, dibandingkan dengan strain Acetobacter yang dapat menghasilkan cuka hingga 20% asam asetat. Saat ini, masih lebih efisien memproduksi cuka menggunakan Acetobacter daripada menggunakan Clostridium dan kemudian dipekatkan. Akibatnya, meskipun bakteri asetogenik telah dikenal sejak tahun 1940, penggunaan industri mereka tetap terbatas pada beberapa aplikasi ceruk.[48]
Penggunaan

Asam asetat digunakan sebagai pereaksi kimia untuk menghasilkan berbagai senyawa kimia. Sebagian besar (40-45%) dari asam asetat dunia digunakan sebagai bahan untuk memproduksi monomer vinil asetat (vinyl acetate monomer, VAM). Selain itu asam asetat juga digunakan dalam produksi anhidrida asetat dan juga ester. Penggunaan asam asetat lainnya, termasuk penggunaan dalam cuka relatif kecil.[14][35]
Monomer vinil asetat
Penggunaan utama dari asam asetat adalah untuk produksi monomer vinil asetat (VAM). Pada tahun 2008, aplikasi ini diperkirakan mengkonsumsi sepertiga dari produksi asam asetat dunia.[14] Reaksinya adalah etilena dan asam asetat dengan oksigen melalui katalis paladium, yang dilakukan dalam fase gas.[49]
2 H3C–COOH + 2 C2H4 + O2 → 2 H3C–CO–O–CH=CH2 + 2 H2O
Vinil asetat dapat dipolimerisasi menjadi polivinil asetat atau polimer lain, yang merupakan komponen dalam cat dan perekat.[49]
Produksi ester
Ester utama dari asam asetat biasanya digunakan sebagai pelarut untuk tinta, cat dan pelapis. Ester ini termasuk etil asetat, n-butil asetat, isobutil asetat, dan propil asetat. Mereka biasanya diproduksi dari asam asetat dan alkohol yang sesuai melalui reaksi yang dikatalisis:
H3C-COOH + HO-R → H3C-CO-O-R + H2O, (R = gugus alkil umum)
Kebanyakan ester asetat, yang dihasilkan dari asetaldehida menggunakan reaksi Tishchenko. Selain itu, eter asetat digunakan sebagai pelarut untuk nitroselulosa, lak akrilik, penghilang pernis, dan noda kayu. Pertama, glikol monoeter diproduksi dari etilena oksida atau propilena oksida dengan alkohol, yang kemudian diesterifikasi dengan asam asetat. Tiga produk utama adalah etilena glikol monoetil eter asetat (EEA), etilena glikol monobutil eter asetat (EBA), dan propilena glikol monometil eter asetat (PMA, lebih dikenal sebagai PGMEA dalam proses manufaktur semikonduktor, tempat ia digunakan sebagai pelarut penahan). Aplikasi ini mengkonsumsi sekitar 15% sampai 20% dari asam asetat di seluruh dunia. Eter asetat, misalnya EEA, telah terbukti berbahaya bagi reproduksi manusia.[35]
Anhidrida asetat
Produk dari kondensasi dua molekul asam asetat adalah anhidrida asetat. Produksi anhidrida asetat seluruh dunia adalah aplikasi utama, dan menggunakan sekitar 25% sampai 30% dari produksi asam asetat global. Proses utama melibatkan dehidrasi asam asetat untuk menghasilkan ketena pada 700–750 °C. Ketena kemudian direaksikan dengan asam asetat untuk mendapatkan anhidrida dengan:[50]
CH3CO2H → CH2=C=O + H2O
CH3CO2H + CH2=C=O → (CH3CO)2O
Anhidrida asetat adalah asetilator. Dengan demikian, aplikasi utama adalah pada pembuatan selulosa asetat, tekstil sintetis yang juga digunakan untuk film fotografi. Anhidrida asetat juga merupakan pereaksi pada produksi heroin dan senyawa lainnya.[50]
Sebagai pelarut
Asam asetat glasial adalah pelarut protik polar yang baik, seperti disebutkan di atas. Ia sering digunakan sebagai pelarut pada rekristalisasi untuk memurnikan senyawa organik. Asam asetat digunakan sebagai pelarut dalam produksi asam tereftalat (TPA), bahan baku untuk polietilena tereftalat (PET). Pada tahun 2006, sekitar 20% dari asam asetat digunakan untuk produksi TPA.[35]
Asam asetat sering digunakan sebagai pelarut untuk reaksi yang melibatkan karbokation, seperti alkilasi Friedel-Crafts. Sebagai contoh, satu tahap dalam pembuatan kamper sintetis komersial melibatkan penataulangan Wagner-Meerwein dari kamfena menjadi isobornil asetat; di sini asam asetat bertindak sebagai pelarut dan nukleofil sekaligus untuk menjebak karbokation yang sudah mengalami penataulangan.[51]
Asam asetat glasial digunakan dalam kimia analitik untuk menentukan kadar basa lemah seperti amida organik. Asam asetat glasial merupakan basa yang jauh lebih lemah daripada air, sehingga amida berperilaku sebagai basa kuat dalam media ini. Ia kemudian dapat dititrasi menggunakan asam yang sangat kuat, seperti asam perklorat, yang dilarutkan dalam asam asetat glasial.[52]
Manfaat medis
Asam asetat encer digunakan dalam terapi fisik menggunakan iontoforesis.[53]
Cuka
Cuka biasanya mengandung 4-18% massa asam asetat. Cuka digunakan langsung sebagai bumbu, dan dalam pengawetan sayuran dan makanan lain. Cuka meja cenderung lebih encer (4% sampai 8% asam asetat), sementara makanan acar komersial menggunakan larutan yang lebih pekat. Jumlah asam asetat yang digunakan sebagai cuka pada skala dunia tidak besar, tetapi merupakan aplikasi tertua dan paling terkenal.[54]
Keamanan
Asam asetat pekat bersifat korosif dan karena itu harus digunakan dengan penuh hati-hati. Asam asetat dapat menyebabkan luka bakar, kerusakan mata permanen, serta iritasi pada membran mukosa. Luka bakar atau lepuhan bisa jadi tidak terlihat hingga beberapa jam setelah kontak. Sarung tangan latex tidak melindungi dari asam asetat, sehingga dalam menangani senyawa ini perlu digunakan sarung tangan berbahan karet nitril. Asam asetat pekat juga dapat terbakar di laboratorium, namun dengan sulit. Ia menjadi mudah terbakar jika suhu ruang melebihi 39 °C (102 °F), dan dapat membentuk campuran yang mudah meledak di udara (ambang ledakan: 5.4%-16%).

| Konsentrasi berdasar berat |
Molaritas | Klasifikasi | Frase-R |
|---|---|---|---|
| 10%–25% | 1.67–4.16 mol/L | Iritan (Xi) | R36/38 |
| 25%–90% | 4.16–14.99 mol/L | Korosif (C) | R34 |
| >90% | >14.99 mol/L | Korosif (C) | R10, R35 |
Larutan asam asetat dengan konsentrasi lebih dari 25% harus ditangani di sungkup asap (fume hood) karena uapnya yang korosif dan berbau. Asam asetat encer, seperti pada cuka, tidak berbahaya. Namun konsumsi asam asetat yang lebih pekat adalah berbahaya bagi manusia maupun hewan. Hal itu dapat menyebabkan kerusakan pada sistem pencernaan, dan perubahan yang mematikan pada keasaman darah.
Lihat pula
Catatan kaki
- ^ [H3O+] = 10−2.4 = 0.4 %
Referensi
- ^ Scientific literature reviews on generally recognized as safe (GRAS) food ingredients. National Technical Information Service. 1974. hlm. 1.
- ^ "Chemistry", volume 5, Encyclopedia Britannica, 1961, page 374
- ^ IUPAC, Commission on Nomenclature of Organic Chemistry (1993). "Table 28(a) Carboxylic acids and related groups. Unsubstituted parent structures". A Guide to IUPAC Nomenclature of Organic Compounds (Recommendations 1993). Blackwell Scientific publications. ISBN 0-632-03488-2.
- ^ "Acetic Acid - PubChem Public Chemical Database". The PubChem Project. USA: National Center for Biotechnology Information.
- ^ IUPAC Provisional Recommendations 2004 Chapter P-12.1; page 4
- ^ Ripin, D. H.; Evans, D. A. (4 November 2005). "pKa Table" (PDF). Diakses tanggal 19 July 2015.
- ^ a b c "NIOSH Pocket Guide to Chemical Hazards #0002". National Institute for Occupational Safety and Health (NIOSH).
- ^ "Acetic acid". Immediately Dangerous to Life and Health. National Institute for Occupational Safety and Health (NIOSH).
- ^ Roger Blench; Matthew Spriggs (1999), Archaeology and language, 35, Routledge, ISBN 0415117860, 9780415117869 Periksa nilai: invalid character
|isbn=(bantuan) - ^ "Food and Drug Regulations (C.R.C., c. 870)", Consolidated Regulations, Canadian Department of Justice, 31 May 2013
- ^ UK Food Standards Agency: "Current EU approved additives and their E Numbers"
- ^ US Food and Drug Administration: "Listing of Food Additives Status Part I"
- ^ Australia New Zealand Food Standards Code: "Standard 1.2.4 – Labeling of ingredients"
- ^ a b c d e Hosea Cheung; Robin S. Tanke; G. Paul Torrence (2005), "Acetic Acid", Ullmann's Encyclopedia of Industrial Chemistry, Weinheim: Wiley-VCH, doi:10.1002/14356007.a01_045.pub2
- ^ IUPAC Provisional Recommendations 2004 Chapter P-12.1; page 4
- ^ Armarego, W.L.F.; Chai, Christina (2009), Purification of Laboratory Chemicals (edisi ke-6th), Butterworth-Heinemann, ISBN 1-85617-567-7
- ^ Cooper, Caroline (9 August 2010), Organic Chemist's Desk Reference (edisi ke-2nd), CRC Press, hlm. 102–104, ISBN 1-4398-1166-0
- ^ DeSousa, Luís R. (1995), Common Medical Abbreviations, Cengage Learning, hlm. 97, ISBN 0-8273-6643-4
- ^ Hendrickson, J.B.; Cram, D.J.; Hammond, G.S. (1970), Organic Chemistry (edisi ke-3rd), Tokyo: McGraw Hill Kogakusha, hlm. 135
- ^ a b c Martin, Geoffrey (1917), Industrial and Manufacturing Chemistry (edisi ke-Part 1, Organic), London: Crosby Lockwood, hlm. 330–331
- ^ P. A. Adet (1798), "Mémoire sur l'acide acétique (Memoir on acetic acid)", Annales de Chemie, 27: 299–319
- ^ Goldwhite, Harold (September 2003), "Short summary of the career of the German organic chemist, Hermann Kolbe", New Haven Section Bulletin American Chemical Society, 20 (3)
- ^ Schweppe, Helmut (1979), "Identification of dyes on old textiles", Journal of the American Institute for Conservation, 19 (1/3): 14–23, doi:10.2307/3179569, JSTOR 3179569
- ^ Wagner, Frank S. (1978), Grayson, Martin, ed., "Acetic acid", Kirk-Othmer Encyclopedia of Chemical Technology (edisi ke-3rd), New York: John Wiley & Sons
- ^ Harold A. Wittcoff; Bryan G. Reuben; Jeffery S. Plotkin (2004), Industrial Organic Chemicals (edisi ke-2nd), John Wiley & Sons, ISBN 9780471443858
- ^ a b Lancaster, Mike (2002) Green Chemistry, an Introductory Text, Cambridge: Royal Society of Chemistry, pp. 262–266. ISBN 0-85404-620-8.
- ^ Goldberg, R.; Kishore, N.; Lennen, R. (2002), "Thermodynamic Quantities for the Ionization Reactions of Buffers" (PDF), Journal of Physical and Chemical Reference Data, 31 (2): 231–370, Bibcode:1999JPCRD..31..231G, doi:10.1063/1.1416902
- ^ Jones, R.E.; Templeton, D.H. (1958). "The crystal structure of acetic acid". Acta Crystallogr. 11(7), 484–87.
- ^ James M. Briggs; Toan B. Nguyen; William L. Jorgensen. Monte Carlo simulations of liquid acetic acid and methyl acetate with the OPLS potential functions. J. Phys. Chem. 1991, 95, 3315-3322.
- ^ James B. Togeas. Acetic Acid Vapor: 2. A Statistical Mechanical Critique of Vapor Density Experiments. J. Phys. Chem. A 2005, 109, 5438-5444. DOI:10.1021/jp058004j
- ^ McMurry, John (2000), Organic Chemistry (edisi ke-5th), Brooks/Cole, hlm. 818, ISBN 0-534-37366-6
- ^ Zieborak, K.; Olszewski, K. (1958), Bulletin de L'Academie Polonaise des Sciences-Serie des Sciences Chimiques Geologiques et Geographiques, vol. 6 no. 2, hlm. 3315–3322 Tidak memiliki atau tanpa
|title=(bantuan) - ^ Charlot, G.; Murray, R.G. (1954), Qualitative Inorganic Analysis (edisi ke-4th), CUP Archive, hlm. 110
- ^ Brantley, L.R.; T.M. Cromwell; J.F. Mead (1947), "Detection of acetate ion by the reaction with arsenious oxide to form cacodyl oxide", Journal of Chemical Education, 24 (7): 353, Bibcode:1947JChEd..24..353B, doi:10.1021/ed024p353, ISSN 0021-9584
- ^ a b c d e Suresh, Bala (2003). "Acetic Acid". CEH Report 602.5000, SRI International.
- ^ Fiume, M.Z.; Cosmetic Ingredients Review Expert Panel (June 2003), "Final report on the safety assessment of triacetin", International Journal of Toxicology, 22 (Suppl 2): 1–10, doi:10.1177/1091581803022S203, PMID 14555416
- ^ Edisi eksekutif: J. Buckingham (1996), Dictionary of Organic Compounds, 1 (edisi ke-6th), London: Chapman & Hall, ISBN 0-412-54090-8
- ^ a b Yoneda, Noriyki; Kusano, Satoru; Yasui, Makoto; Pujado, Peter; Wilcher, Steve (2001). Appl. Catal. A: Gen. 221, 253–265.
- ^ "Production report". Chem. Eng. News (July 11, 2005), 67–76.
- ^ Acetic Acid :: Petrochemicals :: World Petrochemicals :: SRI Consulting. http://chemical.ihs.com/WP/Public/Reports/acetic_acid/
- ^ "Reportlinker Adds Global Acetic Acid Market Analysis and Forecasts". Market Research Database. March 2009. p. contents.
- ^ Zoeller, J.R.; Agreda, V.H.; Cook, S.L.; Lafferty, N.L.; Polichnowski, S.W.; Pond, D.M. (1992), "Eastman Chemical Company Acetic Anhydride Process", Catalysis Today, 13 (1): 73–91, doi:10.1016/0920-5861(92)80188-S. Periksa nilai
|doi=(bantuan) - ^ a b c d Sano, Ken‐ichi; Hiroshi Uchida; Syoichirou Wakabayashi (1999), "A new process for acetic acid production by direct oxidation of ethylene", Catalysis Surveys from Japan, 3 (1): 55–60, doi:10.1023/A:1019003230537, ISSN 1384-6574
- ^ Chotani, Gopal K.; Gaertner, Alfred L.; Arbige, Michael V.; Timothy C. Dodge (2007), "Industrial Biotechnology: Discovery to Delivery", Kent and Riegel's Handbook of Industrial Chemistry and Biotechnology, Springer: 32–34, ISBN 978-0-387-27842-1
- ^ a b Otto Hromatka; Heinrich Ebner (1959), "Vinegar by Submerged Oxidative Fermentation", Industrial & Engineering Chemistry, 51 (10): 1279–1280, doi:10.1021/ie50598a033
- ^ Everett P. Partridge (1931), "Acetic Acid and Cellulose Acetate in the United States A General Survey of Economic and Technical Developments", Industrial & Engineering Chemistry, 23 (5): 482–498, doi:10.1021/ie50257a005
- ^ O Hromatka; H Ebner (1949), "Investigations on vinegar fermentation: Generator for vinegar fermentation and aeration procedures", Enzymologia, 13: 369
- ^ Jia Huey Sim; Azlina Harun Kamaruddin; Wei Sing Long; Ghasem Najafpour (2007), "Clostridium aceticum—A potential organism in catalyzing carbon monoxide to acetic acid: Application of response surface methodology", Enzyme and Microbial Technology, 40 (5): 1234–1243, doi:10.1016/j.enzmictec.2006.09.017
- ^ a b Günter Roscher (2005), "VInyl Esters", Ullmann's Encyclopedia of Industrial Chemistry, Weinheim: Wiley-VCH, doi:10.1002/14356007.a27_419
- ^ a b Heimo Held; Alfred Rengstl; Dieter Mayer (2005), "Acetic Anhydride and Mixed Fatty Acid Anhydrides", Ullmann's Encyclopedia of Industrial Chemistry, Weinheim: Wiley-VCH, doi:10.1002/14356007.a01_065
- ^ Sell, Charles S. (2006), "4.2.15 Bicyclic Monoterpenoids", The Chemistry of Fragrances: From Perfumer to Consumer. RSC Paperbacks Series, 38 (edisi ke-2nd), Great Britain: Royal Society of Chemistry, hlm. 80, ISBN 0-85404-824-3
- ^ Felgner, Andrea, Titration in Non-Aqueous Media, Sigma-Aldrich
- ^ Kolt, Gregory S.; Snyder-Mackler, Lynn (2007), Physical Therapies in Sport and Exercise, Elsevier Health Sciences, hlm. 223, ISBN 978-0-443-10351-3
- ^ Bernthsen, A.; Sudborough, J.J. (1922), Organic Chemistry, London: Blackie and Son, hlm. 155
Pranala luar
- (Inggris) Acetic Acid dari Encyclopædia Britannica
- (Inggris) Halaman data asam asetat