Konstanta disosiasi asam
| Asam dan Basa |
|---|
 |
| Tipe Asam |
| Tipe Basa |
Konstanta disosiasi asam (Ka) atau konstanta keasaman adalah sebuah konstanta atau tetapan keseimbangan spesifik untuk sebuah asam dan basa konjugasinya di sebuah larutan berair.[1] Konstanta ini merupakan konstanta kesetimbangan untuk suatu reaksi kimia
yang dikenal sebagai disosiasi dalam konteks reaksi asam-basa. Spesi kimia HA adalah suatu asam yang terdisosiasi menjadi A−
, basa konjugasi dari asam tersebut dan suatu ion hidrogen, H+
.[a] Sistem dikatakan dalam kesetimbangan ketika konsentrasi komponennya tidak akan berubah dari waktu ke waktu, karena reaksi maju dan mundur terjadi dengan laju yang sama.[2]
Konstanta disosiasi didefinisikan sebagai[b]
- or
dengan kuantitas dalam tanda kurung mewakili konsentrasi spesi pada kesetimbangan.[c][3]
Definisi[sunting | sunting sumber]
Menurut definisi awal menurut Arrhenius, asam adalah zat yang berdisosiasi dalam larutan berair, melepaskan ion hidrogen H+
(suatu proton):[4]
Tetapan kesetimbangan untuk reaksi disosiasi ini dikenal sebagai konstanta disosiasi. Proton yang dibebaskan bergabung dengan molekul air menghasilkan ion hidronium (atau oksonium) H
3O+
(proton telanjang tidak ada dalam larutan), sehingga Arrhenius kemudian mengusulkan bahwa disosiasi harus ditulis sebagai reaksi asam-basa:
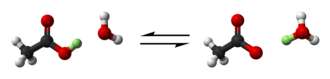
Brønsted dan Lowry menggeneralisasi ini lebih lanjut ke dalam suatu reaksi pertukaran proton:[5][6][7]
Asam kehilangan proton, meninggalkan basa konjugasinya; proton dipindahkan ke basa, menghasilkan asam konjugasi. Untuk larutan encer dari asam HA, basanya adalah air; basa konjugasinya adalah A−
dan asam konjugasinya adalah ion hidronium. Definisi Brønsted–Lowry berlaku pula untuk jenis pelarut lain, seperti dimetil sulfoksida: pelarut S bertindak sebagai basa, menerima proton dan membentuk asam konjugasi SH+
.
Dalam kimia larutan, adalah hal yang biasa untuk menggunakan H+
sebagai singkatan untuk ion hidrogen terlarut, terlepas dari pelarutnya. Dalam larutan berair H+
menyatakan ion hidronium tersolvasi dan bukan proton.[8][9]
Penunjukan asam atau basa sebagai "konjugat" tergantung pada konteksnya. Asam konjugasi BH+
dari basa B berdisosiasi menurut persamaan
yang merupakan kebalikan dari kesetimbangan
Ion hidroksida OH−
, suatu basa yang sangat dikenal, di sini bertindak sebagai basa konjugasi dari asam berair. Asam dan basa dengan demikian masing-masing dianggap hanya sebagai donor dan akseptor proton.
Definisi yang lebih luas dari disosiasi asam meliputi hidrolisis, suatu proses yang melibatkan pembentukan proton oleh adanya pemisahan molekul air. Misalnya, asam borat (B(OH)
3) menghasilkan H
3O+
seperti layaknya donor proton,[10] namun telah dikonfirmasi melalui spektroskopi Raman bahwa hal ini disebabkan oleh kesetimbangan hidrolisis:[11]
Serupa dengan itu, hidrolisis ion logam menyebabkan ion seperti [Al(H
2O)
6]3+ berperilaku layaknya asam lemah:[12]
Menurut definisi awal Lewis, asam adalah suatu zat yang menerima pasangan elektron untuk membentuk ikatan kovalen koordinasi.[13]
Tetapan kesetimbangan[sunting | sunting sumber]
Konstanta disosiasi asam adalah contoh khusus dari konstanta kesetimbangan. Disosiasi asam monoprotik, HA, dalam larutan encer dapat ditulis sebagai
Konstanta kesetimbangan termodinamika dapat didefinisikan sebagai[14]
dengan {X} menyatakan aktivitas, pada kesetimbangan, dari spesi kimia X. adalah tanpa dimensi karena aktivitas tidak berdimensi. Aktivitas produk disosiasi ditempatkan di pembilang, aktivitas reaktan ditempatkan di penyebut. Lihat koefisien aktivitas untuk turunan dari ungkapan ini.

Karena aktivitas adalah hasil kali dari konsentrasi dan koefisien aktivitas (γ) definisi ini juga dapat ditulis sebagai
dengan mewakili konsentrasi HA dan adalah hasil bagi dari koefisien aktivitas.
Basa dan kebasaan[sunting | sunting sumber]
Konstanta kesetimbangan Kb untuk basa biasanya didefinisikan sebagai konstanta asosiasi dari protonasi basa, B, membentuk asam konjugasi, HB+
.
Menggunakan penalaran yang mirip dengan yang digunakan sebelumnya
Kb terkait dengan Ka untuk asam konjugasi. Dalam air, konsentrasi ion hidroksida., [OH−
], berhubungan dengan konsentrasi ion hidrogen K
w = [H+
][OH−
], karenanya
Substitusi ekspresi untuk [OH−
] ke dalam ekspresi untuk Kb menghasilkan
Ketika Ka, Kb dan Kw ditentukan di bawah kondisi suhu dan kekuatan ion yang sama, maka, dengan mengambil kologaritma, bahwa pKb = pKw − pKa. Dalam larutan berair pada 25 °C, pKw adalah 13,9965,[15] sehingga
Faktor yang mempengaruhi nilai pKa[sunting | sunting sumber]
Termodinamika[sunting | sunting sumber]
Konstanta kesetimbangan terkait dengan perubahan Energi Gibbs standar untuk reaksi, sehingga untuk konstanta disosiasi asam
- .
R adalah konstanta gas dan T adalah suhu mutlak. Perhatikan bahwa pKa = −log(Ka) dan 2,303 ≈ ln(10). Pada 25 °C, ΔG⊖ dalam kJ·mol−1 ≈ 5.708 pKa (1 kJ·mol−1 = 1000 joule per mol). Energi bebas terdiri dari entalpi dan entropi.[10]
Perubahan entalpi standar dapat ditentukan dengan kalorimetri atau dengan menggunakan persamaan van 't Hoff, meskipun metode kalorimetri lebih disukai. Ketika perubahan entalpi standar dan konstanta disosiasi asam telah ditentukan, perubahan entropi standar dapat dengan mudah dihitung dari persamaan di atas. Dalam tabel berikut, istilah entropi dihitung dari nilai eksperimen pKa dan ΔH⊖. Data dipilih secara kritis dan dirujuk pada 25 °C dan kekuatan ion nol, dalam air.[10]
| Senyawa | Kesetimbangan | pKa | ΔG⊖ (kJ·mol−1)[d] | ΔH⊖ (kJ·mol−1) | −TΔS⊖ (kJ·mol−1)[e] |
|---|---|---|---|---|---|
| HA = Asam asetat | HA |
4.756 | 27.147 | −0.41 | 27.56 |
| H2A+ = GlisinaH+ | H2A+ |
2.351 | 13.420 | 4.00 | 9.419 |
| HA |
9.78 | 55.825 | 44.20 | 11.6 | |
| H2A = Asam maleat | H2A |
1.92 | 10.76 | 1.10 | 9.85 |
| HA− |
6.27 | 35.79 | −3.60 | 39.4 | |
| H3A = Asam sitrat | H3A |
3.128 | 17.855 | 4.07 | 13.78 |
| H2A− |
4.76 | 27.176 | 2.23 | 24.9 | |
| HA2− |
6.40 | 36.509 | −3.38 | 39.9 | |
| H3A = Asam borat | H3A |
9.237 | 52.725 | 13.80 | 38.92 |
| H3A = Asam fosfat | H3A |
2.148 | 12.261 | −8.00 | 20.26 |
| H2A− |
7.20 | 41.087 | 3.60 | 37.5 | |
| HA2− |
12.35 | 80.49 | 16.00 | 54.49 | |
| HA− = Hidrogen sulfat | HA− |
1.99 | 11.36 | −22.40 | 33.74 |
| H2A = Asam oksalat | H2A |
1.27 | 7.27 | −3.90 | 11.15 |
| HA− |
4.266 | 24.351 | −7.00 | 31.35 |
| Senyawa | Kesetimbangan | pKa | ΔH⊖ (kJ·mol−1) | −TΔS⊖ (kJ·mol−1) |
|---|---|---|---|---|
| B = Amonia | HB+ |
9.245 | 51.95 | 0.8205 |
| B = Metilamina | HB+ |
10.645 | 55.34 | 5.422 |
| B = Trietilamina | HB+ |
10.72 | 43.13 | 18.06 |
Nilai untuk zat yang umum[sunting | sunting sumber]
Terdapat berbagai teknik untuk menentukan nilai pKa dari suatu zat kimia, menyebabkan beberapa perbedaan antara sumber yang berbeda. Nilai yang diukur dengan baik biasanya berada dalam jarak 0,1 unit satu sama lain. Data yang disajikan di sini diambil di 25 °C dalam air.[6][16] Lebih banyak nilai dapat ditemukan di bagian Termodinamika, di atas. Tabel pKa dari asam-asam karbon, yang diukur dalam DMSO, dapat ditemukan pada halaman karbanion.
| Zat kimia | Kesetimbangan | pKa |
|---|---|---|
| BH = Adenina | BH |
4,17 |
| BH+2 |
9,65 | |
| H3A = Asam arsenat | H3A |
2,22 |
| H2A− |
6,98 | |
| HA2− |
11,53 | |
| HA = Asam benzoat | HA |
4,204 |
| HA = Asam butirat | HA |
4,82 |
| H2A = Asam kromat | H2A |
0,98 |
| HA− |
6,5 | |
| B = Kodein | BH+ |
8,17 |
| HA = Kresol | HA |
10.29 |
| HA = Asam format | HA |
3,751 |
| HA = Asam fluorida | HA |
3,17 |
| HA = Asam sianida | HA |
9,21 |
| HA = Hidrogen peroksida (90%) | HA |
11,7 |
| HA = Asam laktat | HA |
3.86 |
| HA = Asam propionat | HA |
4,87 |
| HA = Fenol | HA |
9,99 |
| H2A = Asam L-(+)-Askorbat | H2A |
4,17 |
| HA− |
11,57 |
Lihat pula[sunting | sunting sumber]
- Asidosis
- Alkalosis
- Kesetimbangan kimia
- Fungsi keasaman Hammett: ukuran keasaman yang digunakan untuk larutan asam kuat yang sangat pekat, termasuk superasam.
- pH
Catatan[sunting | sunting sumber]
- ^ Ion hidrogen tidak ada dalam larutan. Ion ini bergabung dengan molekul pelarut; ketika pelarutnya adalah air, ion hidronium terbentuk: H+
+ H
2O → H
3O+
. Reaksi ini bersifat kuantitatif dan karenanya dapat diabaikan dalam konteks kesetimbangan kimia. - ^ Adalah hal yang umum untuk mengutip nilai pK dibanding nilai K. pK = −log10 K. pKa terkadang dinyatakan sebagai konstanta disosiasi asam, namun hal ini, tegasnya, tidak tepat karena pKa adalah kologaritma dari konstanta disosiasi.
- ^ Tersirat dalam definisi ini bahwa hasil bagi dari koefisien aktivitas, bernilai tetap dengan nilai 1 dalam serangkaian kondisi percobaan yang diberikan.
- ^ ΔG⊖ ≈ 2.303RTpKa
- ^ Dihitung di sini, dari nilai ΔH dan ΔG yang diberikan dalam kutipan, menggunakan −TΔS⊖ = ΔG⊖ − ΔH⊖
Referensi[sunting | sunting sumber]
- ^ "Salinan arsip". Diarsipkan dari versi asli tanggal 2007-03-29. Diakses tanggal 2007-03-28.
- ^ Whitten, Kenneth W.; Gailey, Kenneth D.; Davis, Raymond E. (1992). General Chemistry
 (edisi ke-4). Saunders College Publishing. hlm. 660. ISBN 0-03-072373-6.
(edisi ke-4). Saunders College Publishing. hlm. 660. ISBN 0-03-072373-6.
- ^ Petrucci, Ralph H.; Harwood, William S.; Herring, F. Geoffrey (2002). General Chemistry
 (edisi ke-8). Prentice Hall. hlm. 667–8. ISBN 0-13-014329-4.
(edisi ke-8). Prentice Hall. hlm. 667–8. ISBN 0-13-014329-4.
- ^ Miessler, Gary L.; Tarr, Donald A. (1991). Inorganic Chemistry (edisi ke-2). Prentice Hall. ISBN 0-13-465659-8. Chapter 6: Acid–Base and Donor–Acceptor Chemistry
- ^ Bell, R.P. (1973). The Proton in Chemistry
 (edisi ke-2). London: Chapman & Hall. ISBN 0-8014-0803-2. Termasuk pembahasan banyak asam organik Brønsted.
(edisi ke-2). London: Chapman & Hall. ISBN 0-8014-0803-2. Termasuk pembahasan banyak asam organik Brønsted.
- ^ a b Shriver, D.F; Atkins, P.W. (1999). Inorganic Chemistry (edisi ke-3). Oxford: Oxford University Press. ISBN 0-19-850331-8. Chapter 5: Acids and Bases
- ^ Housecroft, C. E.; Sharpe, A. G. (2008). Inorganic Chemistry (edisi ke-3rd). Prentice Hall. ISBN 978-0131755536. Chapter 6: Acids, Bases and Ions in Aqueous Solution
- ^ Headrick, J.M.; Diken, E.G.; Walters, R. S.; Hammer, N. I.; Christie, R.A.; Cui, J.; Myshakin, E.M.; Duncan, M.A.; Johnson, M.A.; Jordan, K.D. (2005). "Spectral Signatures of Hydrated Proton Vibrations in Water Clusters". Science. 308 (5729): 1765–69. Bibcode:2005Sci...308.1765H. doi:10.1126/science.1113094. PMID 15961665.
- ^ Smiechowski, M.; Stangret, J. (2006). "Proton hydration in aqueous solution: Fourier transform infrared studies of HDO spectra". J. Chem. Phys. 125 (20): 204508–204522. Bibcode:2006JChPh.125t4508S. doi:10.1063/1.2374891. PMID 17144716.
- ^ a b c Goldberg, R.; Kishore, N.; Lennen, R. (2002). "Thermodynamic Quantities for the Ionization Reactions of Buffers" (PDF). J. Phys. Chem. Ref. Data. 31 (2): 231–370. Bibcode:2002JPCRD..31..231G. doi:10.1063/1.1416902. Diarsipkan dari versi asli (PDF) tanggal 2008-10-06.
- ^ Jolly, William L. (1984). Modern Inorganic Chemistry. McGraw-Hill. hlm. 198. ISBN 978-0-07-032760-3.
- ^ Burgess, J. (1978). Metal Ions in Solution. Ellis Horwood. ISBN 0-85312-027-7. Section 9.1 "Acidity of Solvated Cations" lists many pKa values.
- ^
Petrucci, R.H.; Harwood, R.S.; Herring, F.G. (2002). General Chemistry
 (edisi ke-8). Prentice Hall. ISBN 0-13-014329-4. hlm. 698
(edisi ke-8). Prentice Hall. ISBN 0-13-014329-4. hlm. 698
- ^ Rossotti, F.J.C.; Rossotti, H. (1961). The Determination of Stability Constants. McGraw–Hill. Chapter 2: Activity and Concentration Quotients
- ^ Lide, D.R. (2004). CRC Handbook of Chemistry and Physics, Student Edition (edisi ke-84th). CRC Press. ISBN 0-8493-0597-7. Section D–152
- ^ Speight, J.G. (2005). Lange's Handbook of Chemistry
 (edisi ke-18). McGraw–Hill. ISBN 0-07-143220-5. Chapter 8
(edisi ke-18). McGraw–Hill. ISBN 0-07-143220-5. Chapter 8
Bacaan lebih lanjut[sunting | sunting sumber]
- Albert, A.; Serjeant, E.P. (1971). The Determination of Ionization Constants: A Laboratory Manual. Chapman & Hall. ISBN 0-412-10300-1. (Previous edition published as Ionization constants of acids and bases. London (UK): Methuen. 1962.)
- Atkins, P.W.; Jones, L. (2008). Chemical Principles: The Quest for Insight
 (edisi ke-4). W.H. Freeman. ISBN 978-1-4292-0965-6.
(edisi ke-4). W.H. Freeman. ISBN 978-1-4292-0965-6. - Housecroft, C. E.; Sharpe, A. G. (2008). Inorganic Chemistry (edisi ke-3rd). Prentice Hall. ISBN 978-0131755536. (Non-aqueous solvents)
- Hulanicki, A. (1987). Reactions of Acids and Bases in Analytical Chemistry. Horwood. ISBN 0-85312-330-6. (translation editor: Mary R. Masson)
- Perrin, D.D.; Dempsey, B.; Serjeant, E.P. (1981). pKa Prediction for Organic Acids and Bases. Chapman & Hall. ISBN 0-412-22190-X.
- Reichardt, C. (2003). Solvents and Solvent Effects in Organic Chemistry (edisi ke-3). Wiley-VCH. ISBN 3-527-30618-8. Chapter 4: Solvent Effects on the Position of Homogeneous Chemical Equilibria.
- Skoog, D.A.; West, D.M.; Holler, J.F.; Crouch, S.R. (2004). Fundamentals of Analytical Chemistry (edisi ke-8). Thomson Brooks/Cole. ISBN 0-03-035523-0.
Pranala luar[sunting | sunting sumber]
- Acidity–Basicity Data in Nonaqueous Solvents Bibliografi yang luas dari nilai pKa dalam DMSO, asetonitril, THF, heptana, 1,2-dikloroetana, dan dalam fasa gas
- Curtipot Perangkat gratis semua-jadi-satu untuk perhitungan kesetimbangan pH dan asam-basa serta untuk simulasi dan analisis kurva titrasi potensiometri dengan lembar bentang
- SPARC Physical/Chemical property calculator Termasuk basis data dengan nilai pKa fase berair, tidak berair, dan gas daripada yang dapat dicari menggunakan SMILES atau nomor registrasi CAS
- Aqueous-Equilibrium Constants nilai pKa untuk berbagai asam dan basa. Termasuk tabel beberapa hasil kali kelarutan
- Panduan gratis interpretasi dan pengukuran pKa dan log p Diarsipkan 2016-08-10 di Wayback Machine. Penjelasan tentang relevansi sifat-sifat ini dengan farmakologi
- Free online prediction tool (Marvin) pKa, log p, log d dll. Dari ChemAxon
- Diagram pKa [1] oleh David A. Evans


![{\displaystyle K_{\text{a}}=\mathrm {\frac {[A^{-}][H^{+}]}{[HA]}} ,}](https://wikimedia.org/api/rest_v1/media/math/render/svg/7cdd9efda0e3a32060020b5c9e5b2c78981b2a93)
![{\displaystyle \mathrm {p} K_{{\ce {a}}}=-\log _{10}K_{\text{a}}=\log _{10}{\frac {{\ce {[HA]}}}{[{\ce {A^-}}][{\ce {H+}}]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/d7af05bf129db2f9bc618fe809660b6e4ff8dce9)







![{\displaystyle {\ce {[Al(H2O)6]^3+ + H2O <=> [Al(H2O)5(OH)]^2+ + H3O+}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/b1c60923d504a87f8bbd22293ac8eaad8341ea41)


![{\displaystyle K^{\ominus }={{\frac {[{\ce {A^-}}][{\ce {H+}}]}{{\ce {[HA]}}}}\Gamma },\quad \Gamma ={\frac {\gamma _{{\ce {A^-}}}\ \gamma _{{\ce {H+}}}}{\gamma _{{\ce {HA}}}\ }}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/6e9373db7091aeb4f51a26757a677b420f0a8418)
![{\displaystyle [{\text{HA}}]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/3cfe8305c0735d25de8cef20edf09ef5144d700a)


![{\displaystyle {\begin{aligned}K_{\text{b}}&=\mathrm {\frac {[HB^{+}][OH^{-}]}{[B]}} \\\mathrm {p} K_{\text{b}}&=-\log _{10}\left(K_{\text{b}}\right)\end{aligned}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/5dea1aac629a595476e18c042a8f4365a50f0efc)
![{\displaystyle \mathrm {[OH^{-}]} ={\frac {K_{\mathrm {w} }}{\mathrm {[H^{+}]} }}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/ab7f583da9f8b50145990ffa4342919930edfa16)
![{\displaystyle K_{\text{b}}={\frac {[\mathrm {HB^{+}} ]K_{\text{w}}}{\mathrm {[B][H^{+}]} }}={\frac {K_{\text{w}}}{K_{\text{a}}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/921c3abd37a1c5c00c31831509d3b090394c0d47)



