Reaksi asam–basa
| Asam dan Basa |
|---|
 |
| Tipe Asam |
| Tipe Basa |
Reaksi asam–basa adalah reaksi kimia yang melibatkan pereaksi asam dan basa, yang dapat digunakan dalam menentukan pH. Beberapa kerangka teoritis menyediakan konsepsi alternatif bagi mekanisme reaksi dan aplikasinya dalam penyelesaian masalah terkait; kerangka tersebut dikenal sebagai teori asam–basa, sebagai contoh, teori asam basa Brønsted–Lowry.
Pentingnya reaksi ini menjadi terlihat jelas dalam analisis reaksi asam–basa bagi spesi fasa gas dan cair, atau ketika sifat suatu asam dan basa tidak terlihat begitu jelas. Konsep pertama reaksi ini dikemukakan oleh kimiawan Perancis Antoine Lavoisier, sekitar tahun 1776.[1]
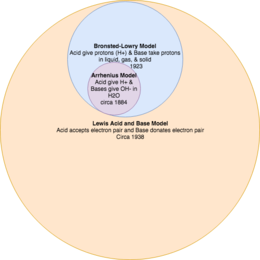
Penting untuk memahami model reaksi asam basa sebagai teori yang saling terkait satu sama lain.[2] Sebagai contoh, model Lewis saat ini memiliki definisi asam basa yang lebih luas, dibandingkan dengan teori Bronsted-Lowry, yang cakupan definisinya lebih luas dibandingkan teori Arrhenius yang lebih terbatas.
Definisi asam–basa[sunting | sunting sumber]
Pengembangan bersejarah[sunting | sunting sumber]
Teori asam oksigen Lavoisier[sunting | sunting sumber]
Konsep ilmiah pertama asam dan basa dipaparkan oleh Lavoisier pada sekitar tahun 1776. Karena pengetahuan Lavoisier mengenai asam kuat terutama terbatas pada asam okso, seperti HNO3 (asam nitrat) and H2SO4 (asam sulfat), yang cenderung mengandung atom pusat dalam bilangan oksidasi tinggi yang dikelilingi oleh oksigen, dan karena ia tidak mengetahui komposisi sebenarnya dari asam hidrohalat (HF, HCl, HBr, dan HI), ia mendefinisikan asam sebagai spesi yang mengandung oksigen, yang faktanya atom oksigen ia namai dari kata Yunani yang berarti "pembentuk-asam" (dari bahasa Yunani οξυς (oxys) berarti "asam" atau "tajam" dan γεινομαι (geinomai) berarti "menimbulkan"). Definisi Lavoisier terus bertahan selama lebih dari 30 tahun, hingga diterbitkannya artikel dan ceramah oleh Sir Humphry Davy tahun 1810 yang membuktikan adanya asam tak beroksigen dalam H2S, H2Te, dan asam hidrohalat. Namun, Davy gagal mengembangkan teori baru, menyimpulkan bahwa "keasaman tidak tergantung pada zat dasar tertentu, tetapi pada pengaturan khusus berbagai zat".[3] Salah satu modifikasi penting dari teori oksigen diberikan oleh Berzelius, yang menyatakan bahwa asam adalah "oksida bukan logam" sedangkan basa adalah "oksida logam".
Teori asam hidrogen Liebig[sunting | sunting sumber]
Tahun 1838, Justus von Liebig mengusulkan bahwa asam adalah spesi yang mengandung hidrogen yang dapat diganti oleh atom logam.[4][5][6] Redefinisi ini didasarkan pada karyanya yang luas pada komposisi kimia asam organik, menyelesaikan perubahan doktrinal dari asam berbasis oksigen ke asam berbasis hidrogen yang dimulai oleh Davy. Definisi Liebig, meskipun sepenuhnya empiris, tetap digunakan selama hampir 50 tahun sampai adopsi definisi Arrhenius.[7]
Definisi Arrhenius[sunting | sunting sumber]

Definisi modern pertama asam dan basa dalam istilah molekuler dirancang oleh Svante Arrhenius.[8][9] Ia melanjutkan karyanya tahun 1884 bersama Friedrich Wilhelm Ostwald dalam menetapkan keberadaan ion di larutan berair dan karenanya membuat Arrhenius menerima Hadiah Nobel dalam Kimia pada tahun 1903.
Seperti yang didefinisikan oleh Arrhenius:
- Asam Arrhenius adalah spesi yang terdisosiasi dalam air untuk membentuk ion hidrogen (H+);[10] sehingga, suatu asam meningkatkan konsentrasi ion H+ dalam larutan berair.
Hal ini menyebabkan protonasi air, atau pembentukan ion hidronium (H3O+).[cat. 1] Karenanya, pada era modern, simbol H+ dianggap sebagai kependekan dari H3O+, karena saat ini diketahui bahwa proton yang berdiri sendiri tidak terdapat sebagai spesi bebas dalam larutan air.[13]
- Basa Arrhenius adalah spesi yang terdisosiasi dalam air untuk membentuk ion hidroksida (OH−); sehingga, suatu basa meningkatkan konsentrasi ion OH− dalam larutan berair."
Secara keseluruhan, untuk memenuhi syarat sebagai asam Arrhenius, setelah dimasukkan ke dalam air, spesi kimia tersebut harus menyebabkan, secara langsung atau sebaliknya:
- Peningkatan konsentrasi hidronium berair, atau
- Penurunan konsentrasi hidroksida berair.
Sebaliknya, untuk memenuhi syarat sebagai basa Arrhenius, setelah dimasukkan dalam air, spesi kimia tersebut harus menyebabkan, secara langsung atau sebaliknya:
- Penurunan konsentrasi hidronium berair, atau
- Peningkatan konsentrasi hidroksida berair.
Reaksi asam dengan basa disebut reaksi netralisasi. Produk dari reaksi ini adalah garam dan air.
- asam + basa → garam + air
Definisi Brønsted–Lowry[sunting | sunting sumber]
  | |
| Johannes Nicolaus Brønsted dan Thomas Martin Lowry |
Definisi Brønsted–Lowry, dirumuskan pada tahun 1923, secara independen oleh Johannes Nicolaus Brønsted di Denmark dan Martin Lowry di Inggris,[14][15] didasarkan pada gagasan protonasi basa melalui de-protonasi asam–yaitu, kemampuan asam untuk "mendonorkan" ion hidrogen (H+)—atau dikenal sebagai proton—kepada suatu basa, yang "menerima" proton tersebut.[16][cat. 2]
Reaksi asam–basa, dengan demikian, merupakan pelepasan ion hidrogen dari asam dan penambahannya ke basa.[17] Pelepasan ion hidrogen dari suatu asam menghasilkan basa konjugasi, yang merupakan asam dengan ion hidrogen yang telah lepas. Penerimaan proton oleh basa menghasilkan asam konjugasi, yang merupakan basa dengan ion hidrogen yang telah ditambahkan.
Rumusan umum untuk reaksi asam–basa menurut definisi Brønsted–Lowry adalah:
- HA + B → BH+ + A−
dalam reaksi di atas, HA mewakili asam, B mewakili basa, BH+ mewakili asam konjugasi dari B, dan A− mewakili basa konjugasi dari HA.
Air bersifat amfoterik—yaitu, ia dapat bertindak sebagai asam dan basa. Model Brønsted–Lowry menjelaskan ini, menunjukkan disosiasi air menjadi hidronium dan ion hidroksida berkonsentrasi rendah:
- H2O + H2O
 H3O+ + OH−
H3O+ + OH−
Persamaan ini dijelaskan dalam diagram berikut:

Definisi Lewis[sunting | sunting sumber]

Kebutuhan hidrogen Arrhenius dan Brønsted–Lowry dihapus oleh definisi reaksi asam-basa Lewis, yang dibuat oleh Gilbert N. Lewis pada tahun 1923,[18] pada tahun yang sama dengan Brønsted–Lowry, tetapi itu tidak diuraikan olehnya sampai tahun 1938.[3] Alih-alih mendefinisikan reaksi asam-basa dalam hal proton atau spesi terikat lainnya, definisi Lewis mendefinisikan basa (dirujuk sebagai basa Lewis) sebagai spesi yang dapat menyumbangkan pasangan elektron sunyi, dan asam (suatu asam Lewis) merupakan spesi yang dapat menerima pasangan elektron tersebut.[19]
Sebagai contoh, boron trifluorida, BF3 adalah asam Lewis yang khas. Ia dapat menerima sepasang elektron karena memiliki kekosongan dalam orbitalnya. Ion fluorida memiliki oktet penuh dan dapat mendonorkan sepasang elektron. Karenanya:
- BF3 + F− → BF−4
ia merupakan asam lewis yang khas. Seluruh senyawa berunsur golongan 13 dengan rumus AX3 dapat bertindak sebagai asam Lewis. Serupa dengan itu, senyawa berunsur golongan 15 dengan rumus DY3, seperti amina, NR3, dan fosfina, PR3, dapat bertindak sebagai basa Lewis. Aduk, hasil reaksi asam basa Lewis memiliki rumus X3A←DY3 dengan ikatan kovalen koordinasi, disimbolkan dengan ←, antara atom A (akseptor) dan D (donor). Rumusan untuk reaksi asam–basa menurut definisi Lewis adalah:
Lihat pula[sunting | sunting sumber]
- Titrasi asam–basa
- Bilangan donor
- Konfigurasi elektron
- Metode Gutmann–Beckett
- Struktur Lewis
- Substitusi nukleofilik dan reaksi redoks
- Protonasi dan Deprotonasi
- Struktur resonansi
Catatan[sunting | sunting sumber]
- ^ Rekomendasi IUPAC terbaru sekarang menyarankan istilah "hidronium" yang lebih baru[11] digunakan dalam mendukung istilah "oksonium" yang lebih lama diterima[12] untuk menggambarkan mekanisme reaksi seperti yang ditentukan dalam definisi Brønsted–Lowry dan definisi sistem pelarut lebih jelas, dengan definisi Arrhenius berfungsi sebagai garis besar umum karakter asam-basa.[10]
- ^ "Pelepasan proton dari inti atom tidak terjadi–hal tersebut akan membutuhkan energi yang jauh lebih banyak daripada yang terlibat dalam disosiasi asam."
Referensi[sunting | sunting sumber]
- ^ Miessler & Tarr 1991, hlm. 166–Daftar penemuan yang dikaitkan dengan Antoine Lavoisier sebagai tokoh pertama yang menempatkan teori ilmiah dalam kaitannya dengan asam okso.
- ^ Paik, Seoung-Hey (2015). "Understanding the Relationship Among Arrhenius, Brønsted–Lowry, and Lewis Theories". Journal of Chemical Education (dalam bahasa Inggris). 92 (9): 1484–1489. Bibcode:2015JChEd..92.1484P. doi:10.1021/ed500891w.
- ^ a b Hall, Norris F. (March 1940). "Systems of Acids and Bases". Journal of Chemical Education. 17 (3): 124–128. Bibcode:1940JChEd..17..124H. doi:10.1021/ed017p124.
- ^ Miessler & Tarr 1991
- ^ Meyers 2003, hlm. 156
- ^ Miessler & Tarr 1991, hlm. 166–tabel penemuan yang dikaitkan dengan publikasi Justus von Liebig sejak 1838
- ^ Finston & Rychtman 1983, hlm. 140–146
- ^ Miessler G.L. dan Tarr D.A. Inorganic Chemistry (edisi ke-2, Prentice-Hall 1999) hlm. 154 ISBN 0-13-841891-8
- ^ Whitten K.W., Galley K.D. and Davis R.E. General Chemistry (edisi ke-4, Saunders 1992) hlm. 356 ISBN 0-03-072373-6
- ^ a b Miessler & Tarr 1991, hlm. 165
- ^ Murray, Kermit K.; Boyd, Robert K.; Eberlin, Marcos N.; Langley, G. John; Li, Liang; Naito, Yasuhide (June 2013) [2006]. "Standard definition of terms relating to mass spectrometry recommendations". Pure and Applied Chemistry. 85 (7): 1515–1609. doi:10.1351/PAC-REC-06-04-06. (Dalam dokumen ini, tidak ada referensi untuk penghentian istilah "oksonium", yang juga masih diterima, karena masih terdapat dalam buku Emas IUPAC, melainkan mengungkapkan preferensi untuk istilah "Hidronium".)
- ^ "oxonium ylides". IUPAC Compendium of Chemical Terminology (interactive version) (edisi ke-2.3.3). International Union of Pure and Applied Chemistry. 2014. Diakses tanggal 9 May 2007.
- ^ LeMay, Eugene (2002). Chemistry. Upper Saddle River, New Jersey: Prentice-Hall. hlm. 602. ISBN 978-0-13-054383-7.
- ^ Brönsted, J.N. (1923). "Einige Bemerkungen über den Begriff der Säuren und Basen" [Some observations about the concept of acids and bases]. Recueil des Travaux Chimiques des Pays-Bas. 42 (8): 718–728.
- ^ Lowry, T.M. (1923). "The uniqueness of hydrogen". Journal of the Society of Chemical Industry. 42 (3): 43–47.
- ^ Miessler & Tarr 1991, hlm. 167–169–Menurut halaman ini, definisi aslinya adalah bahwa "asam memiliki kecenderungan kehilangan proton"
- ^ Clayden et al. 2000, hlm. 182–184
- ^ Miessler & Tarr 1991, hlm. 166–Daftar penemuan yang dikaitkan dengan tanggal publikasi/rilis untuk teori Lewis sejak 1924.
- ^ Miessler & Tarr 1991, hlm. 170–172
Daftar pustaka[sunting | sunting sumber]
- Clayden, Jonathan; Greeves, Nick; Warren, Stuart; Wothers, Peter (2000). Organic Chemistry (dalam bahasa Inggris) (edisi ke-1). Oxford University Press.
- Finston, H.L.; Rychtman, A.C. (1983). A New View of Current Acid-Base Theories (dalam bahasa Inggris). New York: John Wiley & Sons.
- Meyers, R. (2003). The Basics of Chemistry (dalam bahasa Inggris). Greenwood Press.
- Miessler, G.L.; Tarr, D.A. (1991). Inorganic Chemistry (dalam bahasa Inggris).
