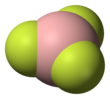Boron trifluorida
| |||
| Nama | |||
|---|---|---|---|
| Nama lain
Boron fluorida, Trifluoroborana
| |||
| Penanda | |||
| |||
Model 3D (JSmol)
|
|||
| 3DMet | {{{3DMet}}} | ||
| ChEBI | |||
| ChemSpider | |||
| Nomor EC | |||
PubChem CID
|
|||
| Nomor RTECS | {{{value}}} | ||
| UNII | |||
| Nomor UN | Terkompresi: 1008. Boron trifluorida dihidrat: 2851. | ||
CompTox Dashboard (EPA)
|
|||
| |||
| |||
| Sifat | |||
| BF3 | |||
| Massa molar | 67.82 g/mol (anhidrat) 103.837 g/mol (dihidrat) | ||
| Penampilan | gas tak berwarna (anhidrat) cairan tak berwarna (dihidrat) | ||
| Densitas | 0.00276 g/cm3 (gas anhidrat) 1.64 g/cm3 (dihidrat) | ||
| Titik lebur | −1.268 °C (−2.250 °F; −995 K) | ||
| Titik didih | −1.003 °C (−1.773 °F; −730 K) | ||
| dekomposisi eksotermik[1] (anhidrat) sangat larut (dihidrat) | |||
| Kelarutan | larut dalam benzena, toluena, heksana, kloroform dan metilen klorida | ||
| Tekanan uap | >50 atm (20 °C)[2] | ||
| 0 D | |||
| Termokimia | |||
| Kapasitas kalor (C) | 50.46 J/mol K | ||
| Entropi molar standar (S |
254.3 J/mol K | ||
| Entalpi pembentukan standar (ΔfH |
-1137 kJ/mol | ||
| Energi bebas Gibbs (ΔfG) | -1120 kJ/mol | ||
| Bahaya[4][5] | |||
| Lembar data keselamatan | Templat:ICSC-small | ||
| Piktogram GHS |   
| ||
| Keterangan bahaya GHS | {{{value}}} | ||
| H330, H314[note 1] | |||
| Titik nyala | Tidak mudah terbakar | ||
| Dosis atau konsentrasi letal (LD, LC): | |||
LC50 (konsentrasi median)
|
1227 ppm (tikus, 2 jam) 39 ppm (guinea pig, 4 jam) 418 ppm (tikus, 4 jam)[3] | ||
| Batas imbas kesehatan AS (NIOSH): | |||
PEL (yang diperbolehkan)
|
C 1 ppm (3 mg/m3)[2] | ||
REL (yang direkomendasikan)
|
C 1 ppm (3 mg/m3)[2] | ||
IDLH (langsung berbahaya)
|
25 ppm[2] | ||
| Senyawa terkait | |||
Anion lain
|
Boron triklorida Boron tribromida Boron triiodida | ||
Kation lainnya
|
Aluminium fluorida Galium(III) fluorida Indium(III) fluorida Talium(III) fluorida | ||
Senyawa terkait
|
Boron monofluorida | ||
Kecuali dinyatakan lain, data di atas berlaku pada suhu dan tekanan standar (25 °C [77 °F], 100 kPa). | |||
| Referensi | |||
Boron trifluorida adalah senyawa anorganik dengan rumus kimia BF3. Gas toksik tak berwarna yang berbau menyengat ini membentuk asap putih dalam kelembaban udara. Senyawa ini merupakan asam Lewis yang sangat berguna dan blok pembangun yang penting bagi senyawa boron lainnya.
Penemuan
[sunting | sunting sumber]Boron trifluorida ditemukan pada tahun 1808 oleh Joseph Louis Gay-Lussac dan Louis Jacques Thénard, yang mencoba untuk mengisolasi "asam fluorat" (yaitu, asam hidrofluorat) dengan menggabungkan kalsium fluorida dengan vitrifikasi asam borat. Uap yang dihasilkan gagal mengikis kaca, sehingga mereka menamakannya gas fluoborat.[7][8]
Struktur dan ikatan
[sunting | sunting sumber]Geometri molekul BF3 adalah trigonal planar. Simetri D3h yang dimilikinya sesuai dnegan prediksi dari teori VSEPR. Molekul ini tidak memiliki momen dipol berdasarkan simetri tinggi. Molekulnya isoelektronik dengan anion karbonat, CO32−.
BF3 umumnya dirujuk sebagai "kekurangan elektron," suatu deskripsi yang diperkuat oleh reaktivitas eksotermiknya terhadap basa Lewis.
Dalam boron trihalida, BX3, panjang ikatan B-X (1.30 Å) lebih pendek dari yang diharapkan untuk ikatan tunggal,[9] dan pendeknya ikatan ini mungkin mengindikasikan kuatnya ikatan-π B-X dalam fluorida. Penjelasan yang halus memanggil simetris - memungkinkan tumpang tindih orbital p pada atom boron dengan kombinasi fase di antara tiga orbital p yang sama berorientasi pada atom fluorin.[9] Yang lain menunjukkan sifat ionik ikatan pada BF3.[10]
Sintesis dan penanganan
[sunting | sunting sumber]BF3 diproduksi oleh reaksi boron oksida dengan hidrogen fluorida:
- B2O3 + 6 HF → 2 BF3 + 3 H2O
Biasanya HF diproduksi in situ dari asam sulfat dan fluorit. (CaF2).[11] Kira-kira 2300-4500 ton boron trifluorida diproduksi setiap tahunnnya.[12]
Pada skala laboratorium, BF3 diproduksi melalui dekomposisi termal dari garam diazonium:[13]
Sebagai alternatif, bahan kimia dapat disintesis dari natrium tetrafluoroborat, boron trioksida, dan asam sulfat:[14]
- 6 NaBF4 + B2O3 + 6 H2SO4 → 8 BF3 + 6 NaHSO4 + 3 H2O
Boron trifluorida anhidrat memiliki titik didih sebesar −100.3 C dan suhu kritis sebesar −12.3 C, sehingga bisa disimpan sebagai cairan berpendingin hanya di antara suhu tersebut. Kapal penyimpan atau pengangkut harus dirancang untuk menahan tekanan internal, karena kegagalan sistem pendingin dapat menyebabkan tekanan naik menuju tekanan kritis sebesar 49.85 bar (4.985 MPa).[15]
Boron trifluorida bersifat korosif. Logam yang sesuai untuk penanganan peralatan boron trifluorida meliputi baja tahan karat, monel, dan hastelloy. Dengan adanya kelembaban, senyawa ini menimbulkan korosi pada baja, termasuk baja tahan karat. Senyawa ini bereaksi dengan poliamida. Politetrafluoroetilena, poliklorotrifluoroetilena, polivinilidena fluorida, dan polipropilena menunjukkan ketahanan yang memuaskan. Gemuk yang digunakan pada peralatan harus berbasis fluorokarbon, karena boron trifluorida bereaksi dengan yang berbasis hidrokarbon.[16]
Reaksi
[sunting | sunting sumber]Tidak seperti aluminium dan galium trihalida, boron trihalida seluruhnya berupa monomerik. Mereka mengalami reaksi pertukaran halida yang cepat:
- BF3 + BCl3 → BF2Cl + BCl2F
Karena fasilitas proses pertukaran ini, campuran halida tidak dapat diperoleh dalam bentuk murni.
Boron trifluorida adalah asam Lewis serbaguna yang membentuk aduk (adduct) dengan basa Lewis seperti fluorida dan eter:
Garam tetrafluoroborat umumnya digunakan sebagai anion non-koordinasi. Aduknya dengan dietil eter, boron trifluorida dietil eterat atau hanya boron trifluorida eterat (BF3 · O(Et)2) adalah cairan yang mudah ditangani dan akibatnya banyak ditemui sebagai sumber laboratorium bagi BF3. Hal ini stabil sebagai larutan eter, namun tidak secara stoikiometri. Aduk umum lainnya adalah adisi dengan dimetil sulfida. (BF3 · S(Me)2), yang dapat ditangani sebagai cairan yang rapi.
Kegunaan
[sunting | sunting sumber]Kimia organik
[sunting | sunting sumber]Boron trifluorida paling penting digunakan sebagai pereaksi dalam sintesis organik, biasanya sebagai asam Lewis.[12][17] Contohnya meliputi:
- Menginisiasi reaksi polimerisasi senyawa kimia tak jenuh, seperti polieter
- Sebagai katalis dalam beberapa reaksi isomerisasi, asilasi,[18] alkilasi, esterifikasi, dehidrasi,[19] kondensasi, adisi aldol Mukaiyama, dan reaksi lainnya[20]
Kegunaan lain
[sunting | sunting sumber]Penggunaan lain yang kurang umum untuk boron trifluorida meliputi:
- Diterapkan sebagai dopan dalam implantasi ion
- Sebagai dopan semikonduktor tipe-p untuk silikon yang tumbuh secara epitaksial
- Digunakan dalam detektor neutron yang sensitif di ruang ionisasi dan perangkat untuk memantau tingkat radiasi di atmosfer Bumi
- Dalam fumigasi
- Sebagai fluks untuk solder magnesium
- Untuk mempersiapkan diborana[14]
Catatan
[sunting | sunting sumber]- ^ Within the European Union, the following additional hazard statement (EUH014) must also be displayed on labelling: Reacts violently with water.
Referensi
[sunting | sunting sumber]- ^ http://www.nap.edu/openbook.php?record_id=4911&page=266
- ^ a b c d "NIOSH Pocket Guide to Chemical Hazards #0062". National Institute for Occupational Safety and Health (NIOSH).
- ^ "Boron trifluoride". Immediately Dangerous to Life and Health. National Institute for Occupational Safety and Health (NIOSH).
- ^ Templat:CLP Regulation
- ^ Templat:PGCH-ref.
- ^ http://www.newenv.com/resources/nfpa_chemicals
- ^ Gay-Lussac, J. L.; Thénard, L. J. (1809). "Sur l'acide fluorique". Annales de Chimie. 69: 204–220.
- ^ Gay-Lussac, J. L.; Thénard, L. J. (1809). "Des propriétés de l'acide fluorique et sur-tout de son action sur le métal de la potasse". Mémoires de Physique et de Chimie de la Société d’Arcueil. 2: 317–331.
- ^ a b Greenwood, Norman N.; Earnshaw, A. (1997), Chemistry of the Elements (edisi ke-2), Oxford: Butterworth-Heinemann, ISBN 0-7506-3365-4
- ^ Gillespie, Ronald J. (1998). "Covalent and Ionic Molecules: Why Are BeF2 and AlF3 High Melting Point Solids whereas BF3 and SiF4 Are Gases?". Journal of Chemical Education. 75 (7): 923. doi:10.1021/ed075p923.
- ^ Holleman, A. F.; Wiberg, E. (2001). Inorganic Chemistry. San Diego: Academic Press. ISBN 0-12-352651-5.
- ^ a b Brotherton, R. J.; Weber, C. J.; Guibert, C. R.; Little, J. L. (2005), "Boron Compounds", Ullmann's Encyclopedia of Industrial Chemistry, Weinheim: Wiley-VCH, doi:10.1002/14356007.a04_309
- ^ Flood, D. T. (1933). "Fluorobenzene". Org. Synth. 13: 46; Coll. Vol. 2: 295.
- ^ a b Brauer, Georg (1963). Handbook of Preparative Inorganic Chemistry. 1 (edisi ke-2nd). Newyork: Academic Press. hlm. 220 & 773. ISBN 978-0121266011.
- ^ Yaws, C. L., ed. (1999). Chemical Properties Handbook. McGraw-Hill. hlm. 25.
- ^ "Boron trifluoride". Gas Encyclopedia. Air Liquide. Diarsipkan dari versi asli tanggal 2006-12-06. Diakses tanggal 2017-06-20.
- ^ Heaney, H. (2001). "Boron Trifluoride". Encyclopedia of Reagents for Organic Synthesis. doi:10.1002/047084289X.rb250. ISBN 0-471-93623-5.
- ^ Mani, Rama I.; Erbert, Larry H.; Manise, Daniel (1991). "Boron Trifluoride in the Synthesis of Plant Phenolics: Synthesis of Phenolic Ketones and Phenyl Stryl Ketones" (PDF). Journal of Tennessee Academy of Science. 66 (1): 1–8. Diarsipkan dari versi asli (PDF) tanggal 2016-10-27. Diakses tanggal 27 October 2016.
- ^ Sowa, F. J.; Hennion, G. F.; Nieuwland, J. A. (1935). "Organic Reactions with Boron Fluoride. IX. The Alkylation of Phenol with Alcohols". Journal of the American Chemical Society. 57 (4): 709–711. doi:10.1021/ja01307a034.
- ^ "Boron Trifluoride (BF3) Applications". Honeywell. Diarsipkan dari versi asli tanggal 2013-09-08. Diakses tanggal 2017-06-20.
Pranala luar
[sunting | sunting sumber]- "Safety and Health Topics: Boron Trifluoride". OSHA. Diarsipkan dari versi asli tanggal 2008-03-31. Diakses tanggal 2017-06-20.
- "BORON TRIFLUORIDE ICSC: 0231". International Chemical Safety Cards. CDC.
- "Boron & Compounds: Overview". National Pollutant Inventory. Australian Government.
- "Fluoride Compounds: Overview". National Pollutant Inventory. Australian Government.
- "Boron trifluoride". WebBook. NIST.
- "Boron Trifluoride (BF3) Applications". Honeywell. Diarsipkan dari versi asli tanggal 2013-09-08. Diakses tanggal 2017-06-20.