Unsur golongan 8: Perbedaan antara revisi
←Mengalihkan ke Golongan tabel periodik#Nama golongan |
Membuat artikel Unsur Golongan 8 |
||
| Baris 1: | Baris 1: | ||
{{hatnote|Untuk ''Golongan VIIIA'', golongan paling kanan pada Tabel Periodik, lihat [[Gas mulia]].}} |
|||
#ALIH [[Golongan_tabel_periodik#Nama_golongan]] |
|||
{{utama|besi|ruthenium|osmium|hassium}} |
|||
{{Tabel periodik (golongan 8)}} |
|||
'''Golongan 8''' adalah suatu [[Golongan tabel periodik|golongan]] [[unsur kimia]] pada [[tabel periodik]]. Anggotanya adalah [[besi]] (Fe), [[ruthenium]] (Ru), [[osmium]] (Os) dan [[hassium]] (Hs). Semuanya adalah [[logam transisi]]. Seperti golongan lainnya, anggota golongan ini menunjukkan pola pada [[konfigurasi elektron]]nya, terutama pada kelopak terluar, yang menghasilkan tren perilaku kimia. |
|||
"Golongan 8" adalah [[Golongan tabel periodik|nama IUPAC]] modern untuk golongan ini; nama versi lamanya adalah ''golongan VIIIB'' menurut [[Chemical Abstracts Service|CAS]], sistem AS atau ''golongan VIIIA'' menurut IUPAC lama, sistem Eropa. |
|||
Golongan 8 jangan dirancukan dengan nama golongan lama ''VIIIA'' menurut [[Golongan tabel periodik|CAS/US]]. Golongan itu sekarang disebut [[Gas mulia|golongan 18]]. |
|||
==Kimia== |
|||
[[Hassium]] belum diisolasi dalam bentuk murni makroskopik, dan sifatnya belum diamati secara meyakinkan; hanya [[besi]], [[rutenium]], dan [[osmium]] yang memiliki sifat yang telah dikonfirmasi secara eksperimen. Ketiga unsur tersebut adalah logam transisi putih keperakan, keras, dan memiliki [[titik leleh]] dan [[titik didih]] tinggi. |
|||
{| class="wikitable" border="1" cellpadding="3" cellspacing="0"; style="float:left; clear:left; |
|||
|- |
|||
![[Nomor atom|Z]] !! [[Unsur kimia|Unsur]] !! [[Kelopak elektron|Jumlah elektron/kelopak]] |
|||
|- |
|||
| 26 || [[besi]] || 2, 8, 14, 2 |
|||
|- |
|||
| 44 || [[ruthenium]] || 2, 8, 18, 15, 1 |
|||
|- |
|||
| 76 || [[osmium]] || 2, 8, 18, 32, 14, 2 |
|||
|- |
|||
| 108 || [[hassium]] || 2, 8, 18, 32, 32, 14, 2 |
|||
|} |
|||
<div style="float: right; margin: 2px; font-size:85%;"> |
|||
{| class="wikitable" |
|||
|+Tingkat oksidasi stabil unsur golongan 8<ref name="G&E">{{Greenwood&Earnshaw}}, pp. 27–28.</ref> |
|||
! Unsur |
|||
!colspan="8"| Tingkat oksidasi stabil |
|||
|- |
|||
|[[besi]]|| || ||+6|| || ||+3||+2 |
|||
|- |
|||
|[[ruthenium]]||+8|| ||+6||+5||+4||+3||+2 |
|||
|- |
|||
|[[osmium]]||+8|| ||+6||+5||+4||+3||+2 |
|||
|}</div> |
|||
Besi menunjukkan karakteristik sifat kimia [[logam transisi]], misalnya kemampuan membentuk tingkat oksidasi yang bervariasi dan mampu membentuk ikatan koordinasi dan kimia organologam: memang penemuan senyawa besi, [[ferosena]]<!--ferrocene-->, yang memberi perubahan revolusioner pada bidang ini pada akhir 1950an.<ref name=Greenwood905>Greenwood and Earnshaw, p. 905</ref> Besi kadang-kadang dianggap sebagai prototipe untuk seluruh blok [[logam transisi]], karena kelimpahannya dan perannya yang besar sekali dalam perkembangan teknologi kemanusiaan.<ref name=Greenwood1070>Greenwood and Earnshaw, p. 1070</ref> Keduapuluh enam elektronnya tertata dalam [[Konfigurasi elektron|konfigurasi]] [Ar]3d{{sup|6}}4s{{sup|2}}, dengan elektron 3d dan 4s nya relatif memiliki energi yang berdekatan, sehingga dapat kehilangan elektron dalam jumlah yang bervariasi dan tidak ada titik yang jelas ionisasi lebih lanjut yang tidak menguntungkan.<ref name=Greenwood1074>Greenwood and Earnshaw, pp. 1074–5</ref> |
|||
Besi membentuk senyawa utamanya dalam [[Bilangan oksidasi|tingkat oksidasi]] +2 dan +3. Menurut tradisi, senyawa besi(II) disebut [[Fero (besi)|fero]] dan senyawa besi(III) disebut [[Feri (besi)|feri]]. Besi juga dapat memiliki tingkat oksidasi yang lebih tinggi, contohnya adalah [[kalium ferat]] (K<sub>2</sub>FeO<sub>4</sub>), berwarna ungu, yang mengandung besi dengan bilangan oksidasi +6. Besi(IV) adalah bentuk antara yang umum dalam banyak reaksi oksidasi biokimia.<ref>{{Cite journal| doi = 10.1021/ar700027f|title = High-Valent Iron(IV)–Oxo Complexes of Heme and Non-Heme Ligands in Oxygenation Reactions|date = 2007|last1 = Nam|first1 = Wonwoo|journal = Accounts of Chemical Research|volume = 40|pages = 522–531|pmid = 17469792|issue = 7}}</ref><ref name="HollemanAF">{{Cite book|publisher = Walter de Gruyter|date = 1985|edition = 91–100|pages = 1125–1146|isbn = 3-11-007511-3|title = Lehrbuch der Anorganischen Chemie|first1 = Arnold F.|last1 = Holleman|last2 = Wiberg|first2 = Egon|last3 = Wiberg|first3 = Nils|chapter = Iron|language = German}}</ref> Sejumlah senyawa [[organologam]] mengandung tingkat oksidasi formal +1, 0, −1, atau bahkan −2. Tingkat oksidasi dan sifat ikatan lainnya sering diuji menggunakan teknik [[spektroskopi Mössbauer]].<ref>{{Cite book|chapter = Mössbauer Spectroscopy and the Coordination Chemistry of Iron|first1 = William Michael|last1 = Reiff|first2 = Gary J.|last2 = Long|title = Mössbauer spectroscopy applied to inorganic chemistry|publisher = Springer|date = 1984|isbn = 978-0-306-41647-7|pages = 245–283}}</ref> Terdapat juga banyak [[senyawa valensi campuran]] yang berintikan besi(II) dan besi(III) sekaligus, seperti [[magnetit]] dan [[biru Prusia]] (Fe<sub>4</sub>(Fe[CN]<sub>6</sub>)<sub>3</sub>).<ref name="HollemanAF" /> Senyawa yang disebutkan terakhir di atas digunakan sebagai "biru" tradisional dalam [[cetak biru]].<ref>{{Cite book|chapter = An introduction in monochrome|pages = 11–19|first = Mike|last = Ware|publisher = NMSI Trading Ltd|title = Cyanotype: the history, science and art of photographic printing in Prussian blue|isbn = 978-1-900747-07-3|date = 1999|url = https://books.google.com/?id=C-7I69gFIbMC&pg=PA11}}</ref> |
|||
[[Berkas:Iron(III) chloride hexahydrate.jpg|thumb|alt=Some canary-yellow powder sits, mostly in lumps, on a laboratory watch glass.|[[Besi(III) klorida]] hidrat, dikenal juga sebagai feri klorida]] |
|||
Tidak seperti logam lainnya, besi tidak membentuk [[amalgam]] dengan raksa. Oleh sebab itu, raksa diperdagangkan dalam botol besi berukuran {{Lb to kg|76|abbr = yes}}.<ref>{{Cite book|title = Hand-book of chemistry|volume = 6|first = Leopold|last1 = Gmelin|authorlink = Leopold Gmelin|pages = 128–129|chapter = Mercury and Iron|url = https://books.google.com/?id=nosMAAAAYAAJ&pg=PA128|publisher = Cavendish Society|date = 1852}}</ref> |
|||
[[Keadaan oksidasi|Tingkat oksidasi]] ruthenium berkisar antara 0 dan +8, serta −2. Sifat [[Senyawa kimia|senyawa]] ruthenium dan osmium sering kali mirip. Keadaan +2, +3, dan +4 adalah yang paling umum. Prekursor yang paling umum adalah [[ruthenium triklorida]], seatu padatan merah yang definisi kimianya lemah tetapi merupakan bahan kimia sintetis serbaguna.<ref name=cotton>{{cite book|last = Cotton|first = Simon|title = Chemistry of Precious Metals| pages = 1–20|publisher = Springer-Verlag New York, LLC|date = 1997|isbn = 0-7514-0413-6|url = https://books.google.com/books?id=6VKAs6iLmwcC&pg=PA2}}</ref> |
|||
Osmium membentuk senyawa dengan [[tingkat oksidasi]] mulai dari -2 sampai +8. Tingkat oksidasi yang paling umum adalah +2, +3, +4, dan +8. Tingkat oksidasi +8 adalah yang tertinggi kedua yang dicapai oleh unsur kimia setelah +9 yang dicapai oleh iridium<ref>{{cite web|url=http://www.rsc.org/chemistryworld/2014/10/iridium-oxide-cation-oxidation-state-9|title=Iridium forms compound in +9 oxidation state}}</ref> dan hanya ditemui pada [[xenon]],<ref name="selig">{{cite journal|title=Xenon tetroxide – Preparation + Some Properties|journal=Science| date=1964 |volume=143|pages=1322–3| doi=10.1126/science.143.3612.1322|pmid=17799234|issue=3612|jstor=1713238|bibcode=1964Sci...143.1322S|last1=Selig|first1=H.|display-authors=4|last2=Claassen|first2=H. H.|last3=Chernick|first3=C. L.|last4=Malm|first4=J. G.|last5=Huston|first5=J. L.}}</ref><ref>{{cite journal|title=Xenon tetroxide – Mass Spectrum|journal=Science|date=1964|volume=143|pages=1162–3|doi=10.1126/science.143.3611.1161-a|pmid=17833897|issue=3611|jstor=1712675|bibcode=1964Sci...143.1161H|last1=Huston|first1=J. L.|last2=Studier|first2=M. H.|last3=Sloth|first3=E. N.}}</ref> [[ruthenium]],<ref>{{cite journal|doi=10.1595/147106704X10801|title=Oxidation States of Ruthenium and Osmium|date=2004|author=Barnard, C. F. J.|journal=Platinum Metals Review|volume=48|issue=4|page=157}}</ref> [[hassium]],<ref>{{cite web|url=http://www.gsi.de/documents/DOC-2003-Jun-29-2.pdf|title=Chemistry of Hassium|accessdate=2007-01-31|date=2002|work=Gesellschaft für Schwerionenforschung mbH|format=PDF}}</ref> dan [[iridium]].<ref>{{cite journal|doi=10.1002/anie.200902733|title=Formation and Characterization of the Iridium Tetroxide Molecule with Iridium in the Oxidation State +VIII|date=2009|last1=Gong|first1=Yu|last2=Zhou|first2=Mingfei|last3=Kaupp|first3=Martin|last4=Riedel|first4=Sebastian|journal=Angewandte Chemie International Edition|volume=48|issue=42|page=7879}}</ref> Tingkat oksidasi −1 dan −2 yang diwakili oleh dua senyawa reaktif {{chem|Na|2|[Os|4|(CO)|13|]}} dan {{chem|Na|2|[Os(CO)|4|]}} digunakan dalam sintesis [[Kimia kluster#Kluster karbonil logam transisi|senyawa kluster]] osmium.<ref>{{cite journal|doi=10.1016/0022-328X(93)83250-Y|title=Preparation of [Os<sub>3</sub>(CO)<sub>11</sub>]<sup>2−</sup> and its reactions with Os<sub>3</sub>(CO)<sub>12</sub>; structures of [Et<sub>4</sub>N] [HOs<sub>3</sub>(CO)<sub>11</sub>] and H<sub>2</sub>OsS<sub>4</sub>(CO)|date=1993|last =Krause|first=J.|journal=Journal of Organometallic Chemistry|volume=454|pages=263–271|display-authors=4|last2=Siriwardane|first2=Upali|last3=Salupo|first3=Terese A.|last4=Wermer|first4=Joseph R.|last5=Knoeppel|first5=David W.|last6=Shore|first6=Sheldon G.}}</ref><ref>{{cite journal|doi=10.1021/ic00141a019|title=Mononuclear hydrido alkyl carbonyl complexes of osmium and their polynuclear derivatives|date=1982|first=Willie J.|last=Carter|display-authors=4|author2=Kelland, John W. |author3=Okrasinski, Stanley J. |author4=Warner, Keith E. |author5= Norton, Jack R. | journal=Inorganic Chemistry|volume=21|issue=11|pages=3955–3960}}</ref> |
|||
Senyawa yang paling umum dengan keadaan oksidasi +8 adalah [[osmium tetroksida]]. Senyawa beracun ini terbentuk saat serbuk osmium terpapar udara. Ia adalah padatan kuning pucat yang sangat mudah menguap, larut dalam air, dan berbau kuat. Serbuk osmium memiliki bau khas osmium tetroksida.<ref name="mager">{{cite book| last = Mager Stellman| first = J.| title = Encyclopaedia of Occupational Health and Safety| url = https://books.google.com/books?id=nDhpLa1rl44C| date = 1998| publisher = International Labour Organization| isbn = 978-92-2-109816-4| oclc = 35279504 | pages = 63.34| chapter = Osmium }}</ref> Osmium tetroksida membentuk osmat {{chem|OsO|4|(OH)|2|2-}} merah pada reaksi dengan basa. Dengan [[amonia]], ia membentuk nitrido-osmat {{chem|OsO|3|N|-}}.<ref name="Holle">{{cite book| author2 = Wiberg, E.| author3 = Wiberg, N.| last = Holleman| first = A. F.| title = Inorganic Chemistry| edition = 1st| date = 2001| publisher = Academic Press| isbn = 0-12-352651-5| oclc = 47901436 }}</ref><ref name="Griffith">{{cite journal|journal=Quarterly Review of the Chemical Society|date=1965|volume=19|issue=3|pages=254–273|doi=10.1039/QR9651900254|title=Osmium and its compounds|first=W. P.|last=Griffith}}</ref><ref>{{cite book| author = Subcommittee on Platinum-Group Metals, Committee on Medical and Biologic Effects of Environmental Pollutants, Division of Medical Sciences, Assembly of Life Sciences, National Research Council | title = Platinum-group metals| url = https://books.google.com/books?id=yEcrAAAAYAAJ| date = 1977| publisher = National Academy of Sciences| isbn = 0-309-02640-7| page = 55 }}</ref> Osmium tetroksida mendidih pada 130 °[[Celsius|C]] dan merupakan [[oksidator]] kuat. Sebaliknya, [[osmium dioksida]] ({{chem|OsO|2}}) berwarna hitam, tidak mudah menguap, lebih tidak reaktif dan lebih tidak beracun. |
|||
Hassium adalah anggota keenam dari deret logam transisi 6d dan diperkirakan jauh lebih menyerupai [[Golongan platina|logam golongan platina]].<ref name="DoiX">{{cite journal|doi=10.1595/147106708X297486|title=The Periodic Table and the Platinum Group Metals|date=2008|last1=Griffith|first1=W. P.|journal=Platinum Metals Review|volume=52|issue=2|pages=114–119}}</ref> Perhitungan [[potensial ionisasi]]nya, [[jari-jari atom]], energi orbital, dan aras dasar dari keadaan terionisasinya mirip dengan [[osmium]], menyiratkan bahwa sifat-sifat hassium akan sesuai dengan [[unsur golongan 8]] lainnya: [[besi]], [[ruthenium]], dan osmium.<ref name=Haire>{{cite book| title=The Chemistry of the Actinide and Transactinide Elements| editor1-last=Morss|editor2-first=Norman M.| editor2-last=Edelstein| editor3-last=Fuger|editor3-first=Jean| last1=Hoffman|first1=Darleane C. |last2=Lee |first2=Diana M. |last3=Pershina |first3=Valeria |chapter=Transactinides and the future elements| publisher= [[Springer Science+Business Media]]| year=2006| isbn=1-4020-3555-1| location=Dordrecht, The Netherlands| edition=3rd| ref=CITEREFHaire2006}}</ref><ref name="Hs-chemistry">[http://www-win.gsi.de/kernchemie/English/Research/Elements/Element_108_hasssium_eng.htm Element 108, hassium, Hs]</ref> Beberapa sifat ini dikonfirmasi berdasarkan eksperimen kimia fase gasnya.<ref name="Duellmann">Dullman, C.E. [http://www.yumpu.com/en/document/view/7293741/superheavy-element-research-superheavy-element-research Superheavy Element Research Superheavy Element - News from GSI and Mainz]. University Mainz</ref><ref name="HsO4">{{cite journal |last1=Düllmann |first1=Ch. E. |last2=Dressler |first2=R. |last3=Eichler |first3=B. |last4=Gäggeler |first4=H. W. |last5=Glaus |first5=F. |last6=Jost |first6=D. T. |last7=Piguet |first7=D. |last8=Soverna |first8=S. |last9=Türler |first9=A. |last10=Brüchle |first10=W. |last11=Eichler |first11=R. |last12=Jäger |first12=E. |last13=Pershina |first13=V. |last14=Schädel |first14=M. |last15=Schausten |first15=B. |last16=Schimpf |first16=E. |last17=Schött |first17=H.-J. |last18=Wirth |first18=G. |last19=Eberhardt |first19=K. |last20=Thörle |first20=P. |last21=Trautmann |first21=N. |last22=Ginter |first22=T. N. |last23=Gregorich |first23=K. E. |last24=Hoffman |first24=D. C. |last25=Kirbach |first25=U. W. |last26=Lee |first26=D. M. |last27=Nitsche |first27=H. |last28=Patin |first28=J. B. |last29=Sudowe |first29=R. |last30=Zielinski |first30=P. M. |last31=Timokhin |first31=S. N. |last32=Yakushev |first32=A. B. |last33=Vahle |first33=A. |last34=Qin |first34=Z. |date=2003 |title=First chemical investigation of hassium (Hs, Z=108) |journal=Czechoslovak Journal of Physics |volume=53 |issue=1 Supplement |pages=A291–A298 |doi=10.1007/s10582-003-0037-4 |url=http://link.springer.com/article/10.1007%2Fs10582-003-0037-4 |accessdate=17 November 2012|display-authors=8|bibcode = 2003CzJPS..53A.291D}}</ref><ref name="GSI-Hs">{{Cite web|url=http://www.gsi.de/documents/DOC-2003-Jun-29-2.pdf|title=Chemistry of Hassium|accessdate=2007-01-31|date=2002|work= Gesellschaft für Schwerionenforschung mbH|format=PDF}}</ref> Unsur golongan 8 menggambarkan luasnya keberagaman keadaan oksidasi, tetapi rutenium dan osmium memberi gambaran secara cepat tentang keadaan oksidasi golongan mereka yaitu +8 (keadaan oksidasi tertinggi kedua untuk semua unsur, yang sangat jarang dijumpai pada unsur lain). Keadaan ini menjadi semakin stabil dari atas ke bawah sepanjang golongan.<ref name="G&E"/><ref name="superheavy-chemistry"/><ref name=Barnard>{{cite journal|doi=10.1595/147106704X10801|title=Oxidation States of Ruthenium and Osmium|date=2004|author=Barnard, C. F. J.|journal=Platinum Metals Review|volume=48|issue=4|pages=157–158|last2=Bennett}}</ref> Dengan demikian, hassium diharapkan membentuk keadaan stabil pada tingkat oksidasi +8.<ref name="HsO4"/> Analog dengan kongenernya yang lebih ringan, hassium juga diharapkan menunjukkan keadaan stabil pada tingkat oksidasi yang lebih rendah, seperti +6, +5, +4, +3, dan +2.<ref name="emsley">{{cite book|last=Emsley|first=John|title=Nature's Building Blocks: An A-Z Guide to the Elements|edition=New|year=2011|publisher=Oxford University Press|location=New York, NY|isbn=978-0-19-960563-7|page=215–7}}</ref><ref name=Haire/><ref name="hassocene">{{cite web |url=http://www-win.gsi.de/tasca08/contributions/TASCA08_Cont_Duellmann1.pdf |title=Investigation of group 8 metallocenes @ TASCA |last1=Düllmann |first1=Christoph E. |date=31 October 2008 |work=7th Workshop on Recoil Separator for Superheavy Element Chemistry TASCA 08 |publisher=[[Gesellschaft für Schwerionenforschung]] |accessdate=25 March 2013}}</ref> Pastinya, hassium(IV) diharapkan lebih stabil daripada hassium(VIII) dalam larutan berair.<ref name=Haire/> |
|||
Unsur-unsur golongan 8 menunjukkan sifat kimia [[oksida]] yang sangat berbeda, sehingga memungkinkan ekstrapoliasi hassium menjadi lebih mudah. Seluruh anggota yang lebih ringan memiliki tetroksida, baik yang sudah terbukti maupun hipotetis, MO<sub>4</sub>.<ref name="FeO4">{{cite journal|doi=10.1595/147106704X10801|title=Higher Oxidation States of Iron in Solid State: Synthesis and Their Mössbauer Characterization – Ferrates – ACS Symposium Series (ACS Publications)|date=2008|author1=Yurii D. Perfiliev|author2=Virender K. Sharma|url=http://pubs.acs.org/doi/abs/10.1021/bk-2008-0985.ch007|volume=48|issue=4|pages=157–158|journal=Platinum Metals Review}}</ref> Daya oksidasi mereka semakin menurun sesuai meningkatnya nomor atom dalam satu golongan. FeO{{sub|4}} tidak dikenal karena [[afinitas elektron]]nya<ref group=Catatan>Jumlah energi yang dilepaskan ketika satu elektron ditambahkan pada atom atau molekul netral untuk membentuk ion negatif.</ref> teramat besar<ref name="Compendiumof">{{GoldBookRef |title=Electron affinity |file=E01977}}</ref> yang mengakibatkan pembentukan [[oksoanion]] yang telah dikenal yaitu [[ferat|ferat(VI)]], {{chem|FeO|4|2-}}.<ref>{{Cite journal|title=FeO<sub>4</sub>: A unique example of a closed-shell cluster mimicking a superhalogen|doi=10.1103/PhysRevA.59.3681|date=1999|author=Gutsev, Gennady L.|journal=Physical Review A|volume=59|pages=3681–3684|last2=Khanna|first2=S.|last3=Rao|first3=B.|last4=Jena|first4=P.|bibcode = 1999PhRvA..59.3681G|issue=5 }}</ref> [[Rutenium tetroksida]], RuO{{sub|4}}, yang dibentuk melalui [[oksidasi]] rutenium(VI) dalam suasana [[asam]], mudah mengalami [[redoks|reduksi]] menjadi rutenat(VI), {{chem|RuO|4|2-}}.<ref>{{cite book |last1= Cotton|first1=S. A.|title= Chemistry of Precious Metals|date= 1997|publisher= Chapman and Hall|location= London|isbn= 978-0-7514-0413-5}}</ref><ref>{{Cite book | last1 = Martín | first1 = V. S. | last2 = Palazón | first2 = J. M. | last3 = Rodríguez | first3 = C. M. | last4 = Nevill | first4 = C. R. | chapter = Ruthenium(VIII) Oxide | doi = 10.1002/047084289X.rr009.pub2 | title = Encyclopedia of Reagents for Organic Synthesis | year = 2006 | isbn = 0471936235 | pmid = | pmc = }}</ref> Oksidasi logam rutenium di udara membentuk dioksidanya, RuO{{sub|2}}.<ref>{{cite|first1=G.M.|last1=Brown|first2=J.H.|last2=Butler|year=1997|title=New method for the characterization of domain morphology of polymer blends using ruthenium tetroxide staining and low voltage scanning electron microscopy (LVSEM)|journal=Polymer|volume=38|issue=15|pages=3937–3945}}</ref> Sebaliknya, osmium terbakar membentuk [[osmium tetroksida|tetroksida]] yang stabil, OsO{{sub|4}},<ref>{{cite book|title=Encyclopaedia of Occupational Health and Safety|first=J.|last=Mager Stellman|chapter=Osmium|isbn=978-92-2-109816-4|date=1998|publisher=International Labour Organization|pages=63.34|url=https://books.google.com/?id=nDhpLa1rl44C |oclc=35279504 }}</ref><ref>{{Housecroft2nd|pages=671–673, 710}}</ref> yang membentuk kompleks dengan ion hidroksida membentuk kompleks osmium(VIII)-''at'', [OsO<sub>4</sub>(OH)<sub>2</sub>]<sup>2−</sup>.<ref name=thompson>{{cite web | author = Thompson, M. | publisher = [[Bristol University]] | title = Osmium tetroxide (OsO<sub>4</sub>) | url = http://www.chm.bris.ac.uk/motm/oso4/oso4h.htm | accessdate = 2012-04-07 }}</ref> Oleh karena itu, sifat eka-osmium untuk hassium dapat ditunjukkan dengan pembentukan tetroksida stabil yang sangat volatil HsO<sub>4</sub>,<ref name="emsley"/><ref name=Haire/><ref name="Duellmann"/><ref name="GSI-Hs"/><ref name="superheavy-chemistry">{{cite book |title=The Chemistry of Superheavy Elements |first=Matthias |last=Schädel |publisher=Springer |date=2003 |isbn=978-1402012501 |page=269 |accessdate=November 17, 2012 |url=https://www.google.com/books?id=3ItA4fExU7wC}}</ref> yang mengalami kompleksasi dengan [[hidroksida]] membentuk hassat(VIII), [HsO<sub>4</sub>(OH)<sub>2</sub>]<sup>2−</sup>.<ref name="CALLISTO">[http://www.gsi.de/informationen/wti/library/scientificreport2003/files/172.pdf CALLISTO result]</ref> Rutenium tetroksida dan osmium tetroksida keduanya mudah menguap, karena [[geometri molekul tetrahedral]] simetrinya dan keduanya bermuatan netral; hassium tetroksida diperkirakan memiliki kemiripan sebagai padatan yang sangat mudah menguap. Tren volatilitas tetroksida golongan 8 diketahui sebagai berikut: RuO<sub>4</sub> < OsO<sub>4</sub> > HsO<sub>4</sub>, yang telah dibuktikan secara tuntas melalui hasil perhitungan. Khususnya, [[entalpi]] [[adsorpsi]] terhitung<ref group=Catatan>energi yang dibutuhkan untuk [[adhesi|mengadhesi]] atom, molekul, atau ion dari [[gas]], [[cairan]], atau [[padatan]] terlarut pada [[ilmu permukaan|permukaan]]</ref> HsO{{sub|4}} adalah −(45,4 ± 1) kJ·mol<sup>−1</sup> pada [[kuarsa]], sangat cocok dengan nilai eksperimen −(46 ± 2) kJ·mol<sup>−1</sup>.<ref>{{cite journal |last=Pershina |first=V. |last2=Anton |first2=J. |last3=Jacob |first3=T. |date=18 September 2008 |title=Fully relativistic density-functional-theory calculations of the electronic structures of MO<sub>4</sub> (M = Ru, Os, and element 108, Hs) and prediction of physisorption |url=http://journals.aps.org/pra/abstract/10.1103/PhysRevA.78.032518 |journal=[[Physical Review A]] |volume=78 |issue=3 |access-date=March 25, 2015 |doi=10.1103/PhysRevA.78.032518}}</ref> |
|||
==Sejarah== |
|||
[[File:Mars symbol.svg|left|thumb|80px|alt=A circle, with a short, simple arrow shape extending diagonally upwards and rightwards from its edge|Lambang [[Mars]] telah digunakan sejak zaman kuno untuk mewakili besi.]] [[File:QtubIronPillar.JPG|thumb|alt=An pillar, slightly fluted, with some ornamentation at its top. It is black, slightly weathered to a dark brown near the base. It is around {{convert|7|m|ft|abbr=off|sp=us}} tall. It stands upon a raised circular base of stone, and is surrounded by a short, square fence.|[[Pilar Besi Delhi]] adalah contoh metodologi ekstraksi dan pengolahan besi di zaman India awal.]] |
|||
Besi merupakan salah satu unsur yang tidak diragukan lagi telah dikenal sejak zaman prasejarah.<ref>Weeks, p.4</ref> Ia telah diolah atau ditempa selama ribuan tahun. Namun, benda besi yang berumur panjang lebih jarang daripada benda yang terbuat dari emas atau perak karena besi mudah mengalami korosi (berkarat).{{sfn|Weeks|1968|p=29}} |
|||
[[File:Meteorite iron harpoon.jpg|thumb|Kepala tombak besi dari [[Greenland]]. Tombak gading bertepi besi menggunakan besi meteorit dari [[meteorit Cape York]], salah satu meteorit besi terbesar yang diketahui.]] |
|||
Manik-manik yang terbuat dari [[besi meteor]] ditemukan di Gerzah, Mesir oleh G. A. Wainwright pada tahun 3500 SM atau sebelumnya.{{sfn|Weeks|1968|p=31}}<!-- Typo on page 31 refers to "G. W." but reference at end of chapter says "G. A." --> Manik-manik tersebut mengandung nikel 7,5%, yang merupakan pertanda berasal meteor karena besi yang ditemukan di kerak bumi umumnya hanya memiliki ketakmurnian nikel yang sangat kecil. Besi meteor sangat dihargai karena berasal dari "surga" dan sering digunakan untuk menempa senjata dan peralatan.{{sfn|Weeks|1968|p=31}} Sebagai contoh, sebuah [[belati besi Tutankhamun|belati]] yang terbuat dari besi meteor yang ditemukan di makam [[Tutankhamun]], mengandung proporsi besi, kobal, dan nikel yang serupa dengan meteorit yang ditemukan di daerah tersebut, akibat deposit dari hujan meteor kuno.<ref name="Bjorkman 1973">{{cite journal|last=Bjorkman|first=Judith Kingston|title=Meteors and Meteorites in the ancient Near East |journal=Meteoritics |date=1973 |pages=91–132 |doi=10.1111/j.1945-5100.1973.tb00146.x |volume=8}}</ref><ref name="Comelli">{{cite journal |author1=Daniela Comelli |author2=Massimo D'orazio |author3=Luigi Folco |author4=Mahmud El-Halwagy |author5=Tommaso Frizzi |author6=Roberto Alberti |author7=Valentina Capogrosso |author8=Abdelrazek Elnaggar |author9=Hala Hassan |author10=Austin Nevin |author11=Franco Porcelli |author12=Mohamed G. Rashed |author13=Gianluca Valentini |title=The meteoritic origin of Tutankhamun's iron dagger blade |journal=Meteoritics & Planetary Science |date=2016 |volume= 51|pages= 1301–1309|doi=10.1111/maps.12664 |url=http://onlinelibrary.wiley.com/doi/10.1111/maps.12664/full}}</ref><ref name="walshx">{{cite news | last=Walsh | first=Declan | title=King Tut's Dagger Made of 'Iron From the Sky,' Researchers Say | newspaper=[[The New York Times]] | quote=... the blade's composition of iron, nickel and cobalt was an approximate match for a meteorite that landed in northern Egypt. The result "strongly suggests an extraterrestrial origin" | date=2 June 2016 | url=https://www.nytimes.com/2016/06/03/world/middleeast/king-tuts-dagger-made-of-iron-from-the-sky-researchers-say.html | accessdate=4 June 2016}}</ref> Benda yang kemungkinan terbuat dari besi oleh orang Mesir berasal dari 3000 sampai 2500 SM.{{sfn|Weeks|1968|p=29}} Besi meteorit cukup lunak dan ulet serta mudah ditempa dengan metode [[tempa dingin]] ([[:en:Cold working|''cold working'']]) namun bisa menjadi rapuh saat dipanaskan karena kandungan [[nikel]]nya.<ref>{{Cite book|url=https://books.google.com/books?id=-CQ4AQAAIAAJ&pg=PA492&lpg=PA492&dq=meteoreisen+weich+br%25C3%25BCchig&source=bl&ots=vFKJAOcmWw&sig=7m9AYwZI3B6jDW63gjCDRQDY3XI&hl=de&sa=X&ved=0ahUKEwiO3rC2vpfPAhWnCMAKHcGTC8EQ6AEIITAB#v=onepage&q=meteoreisen%2520weich%2520br%25C3%25BCchig&f=false|title=Technisches wörterbuch oder Handbuch der Gewerbskunde ... : Bearb. nach Dr. Andrew Ure's Dictionary of arts, manufactures and mines|last=Ure|first=Andrew|date=1843|publisher=G. Haase|year=|isbn=|location=|pages=492|language=de|via=}}</ref> |
|||
Produksi besi pertama dimulai pada [[Zaman perunggu tengah|Zaman Perunggu Tengah]] tetapi memerlukan beberapa abad sebelum besi dapat menggantikan perunggu. Sampel [[Peleburan (metalurgi)|leburan]] besi dari [[Asmar, Afghanistan|Asmar]], Mesopotamia dan Tall Chagar Bazaar di Siria bagian utara dibuat pada rentang waktu antara 3000 dan 2700 SM.{{sfn|Weeks|1968|p=32}} [[Bangsa Het]] memantapkan kekaisarannya di [[Anatolia]] bagian pusat-utara pada sekitar 1600 SM. Mereka nampaknya adalah yang pertama memahami produksi besi dari bijihnya dan menganggapnya hal yang sangat penting dalam masyarakan mereka.<ref>McNutt, Paula (1990 1). The Forging of Israel: Iron Technology, Symbolism and Tradition in Ancient Society. A&C Black.</ref> Bangsa Het mulai melebur besi antara tahun 1500 dan 1200 SM dan praktek tersebut menyebar ke Timur Dekat setelah kejatuhan kekaisaran mereka pada tahun 1180 SM.{{sfn|Weeks|1968|p=32}} Periode setelahnya disebut sebagai [[Zaman Besi]]. |
|||
Pada tahun 1774, [[Antoine Lavoisier]] menggunakan reaksi kukus air dengan logam besi di dalam tabung besi pijar untuk membuat [[hidrogen]], dalam penelitiannya yang mengarah pada pengungkapan [[hukum kekekalan massa]], yang berperan penting dalam mengubah kimia dari sains kualitatif menjadi kuantitatif.<ref>[http://www.eric.ed.gov/ERICWebPortal/search/recordDetails.jsp?searchtype=keyword&ERICExtSearch_SearchValue_0=EJ128341&ERICExtSearch_SearchType_0=kw&_pageLabel=RecordDetails&objectId=0900019b8005c793&accno=EJ128341&_nfls=false], Robert D. Whitaker, [[Journal of Chemical Education]], 52, 10, 658–659, Oct 75</ref> |
|||
[[Jöns Berzelius]] dan [[Gottfried Osann]] hampir menemukan rutenium pada tahun 1827.<ref>{{cite journal|url = https://books.google.com/books?id=x57C3yhRPUAC&pg=PA391|pages = 391–392|title = New Metals in the Uralian Platina|volume = 2|issue = 11|date = 1827| journal = The Philosophical Magazine|doi=10.1080/14786442708674516}}</ref> Mereka meneliti residu yang ditinggalkan setelah melarutkan platina mentah dari [[Pegunungan Ural]] dalam [[air raja]]. Berzelius tidak menemukan logam asing apapun, tetapi Osann berpikiran bahwa ia menemukan tiga logam baru, yang disebut pluranium, rutenium, dan polinium. Perbedaan pendapat ini memicu kontroversi berkepanjangan antara Berzelius dan Osann mengenai komposisi residu.<ref name="DiscoRu">{{cite journal|title = The Discovery of Ruthenium| first = V. N.|last = Pitchkov|journal = Platinum Metals Review|volume = 40|issue = 4|date = 1996|pages =181–188|url = http://www.platinummetalsreview.com/dynamic/article/view/pmr-v40-i4-181-188}}</ref> Setelah Osann tidak mampu mengulang isolasi ruteniumnya, ia akhirnya melepas klaimnya.<ref name="DiscoRu" /><ref name="Osann2">{{cite journal | author = Osann, Gottfried | title = Berichtigung, meine Untersuchung des uralschen Platins betreffend | journal = [[Annalen der Physik|Poggendorffs Annalen der Physik und Chemie]] | volume = 15 | year = 1829 | page = 158 | url = http://gallica.bnf.fr/ark:/12148/bpt6k15100n.image.f168.langDE}}</ref> Nama "rutenium" dipilih oleh Osann karena sampel yang dianalisis berasal dari Pegunungan Ural di Rusia.<ref name="Osann">{{cite journal | author = Osann, Gottfried | title = Fortsetzung der Untersuchung des Platins vom Ural | journal = [[Annalen der Physik|Poggendorffs Annalen der Physik und Chemie]] | volume = 14 | issue = 6 | year = 1828 | pages = 329–257 | url = http://gallica.bnf.fr/ark:/12148/bpt6k150998/f337.image.langDE| bibcode = 1828AnP....89..283O | doi = 10.1002/andp.18280890609 }} Kalimat asli di [http://gallica.bnf.fr/ark:/12148/bpt6k150998/f347.image.langDE p. 339] adalah: "Da dieses Metall, welches ich nach den so eben beschriebenen Eigenschaften als ein neues glaube annehmen zu müssen, sich in größerer Menge als das früher erwähnte in dem uralschen Platin befindet, und auch durch seinen schönen, dem Golde ähnlichen metallischen Glanz sich mehr empfiehlt, so glaube ich, daß der Vorschlag, das zuerst aufgefundene neue Metall Ruthenium zu nennen, besser auf dieses angewendet werden könne."</ref> Nama itu sendiri berasal dari [[Ruthenia]], bahasa Latin untuk [[Rus' (nama)|Rus']], daerah bersejarah yang sekarang meliputi [[Rusia]] bagian barat, [[Ukraina]], [[Belarus]], dan sebagian [[Slovakia]] dan [[Polandia]]. |
|||
Pada tahun 1844, [[Karl Ernst Claus]], ilmuwan Rusia keturunan [[Jerman Baltik]], menunjukkan bahwa senyawa yang dipreparasi oleh Gottfried Osann mengandung sejumlah kecil rutenium, yang juga telah [[Penemuan unsur kimia|ditemukan]] oleh Claus pada tahun yang sama.<ref name="Weeks8">{{cite journal|doi = 10.1021/ed009p1017|title = The discovery of the elements. VIII. The platinum metals|date = 1932|last1 = Weeks|first1 = Mary Elvira|authorlink1=Mary Elvira Weeks|journal = Journal of Chemical Education|volume = 9|page = 1017|bibcode = 1932JChEd...9.1017W|issue = 6}}</ref> Claus mengisolasi rutenium dari residu platinum produksi rubel saat ia bekerja di [[Universitas Kazan]], [[Kazan]],<ref name="DiscoRu"/> dengan cara yang sama dengan penemuan osmium, kongenernya yang lebih berat, empat dasawarsa sebelumnya.<ref name=Greenwood1071>Greenwood and Earnshaw, p. 1071</ref> Claus menunjukkan bahwa rutenium oksida mengandung logam baru dan memperoleh 6 gram rutenium dari bagian platina mentah yang tidak larut dalam [[air raja]].<ref name="DiscoRu"/> Memilih nama untuk unsur baru ini, Claus menyatakan: {{quote|"Saya menamakan unsur baru ini ''ruthenium'', untuk menghormati Tanah Air saya. Saya berhak menyebutnya dengan nama ini karena Tuan Osann melepaskan ruteniumnya dan kata itu belum ada dalam ilmu kimia."|Karl Ernst Claus}}<ref name="DiscoRu" /><ref>{{cite journal |author = Karl Claus |title=О способе добывания чистой платины из руд |journal=Горный журнал (Mining Journal) |year=1845 | volume = 7 (3) | pages = 157–163 |language=Russian}}</ref> |
|||
Osmium ditemukan pada tahun 1803 oleh [[Smithson Tennant]] dan [[William Hyde Wollaston]] di [[London]], [[Inggris]].<ref>{{cite journal|title=Osmium|journal=Metallurgist|volume=18|issue= 2|date=1974|doi=10.1007/BF01132596|pages=155–157|first=S. I.|last=Venetskii}}</ref> Penemuan osmium saling terkait dengan platina dan logam [[golongan platina]] lainnya. Platina mencapai Eropa sebagai ''platina'' ("perak kecil"), yang pertama kali ditemukan pada abad ke-17 di tambang perak di sekitar [[Departemen Chocó]], [[Colombia]].<ref>{{cite journal|title=The Platinum of New Granada: Mining and Metallurgy in the Spanish Colonial Empire|author=McDonald, M.|journal=Platinum Metals Review|volume=3|issue=4|date=959|pages=140–145|url=http://www.platinummetalsreview.com/dynamic/article/view/pmr-v3-i4-140-145}}</ref> Penemuan bahwa logam ini bukan paduan, tapi unsur baru yang berbeda, dipublikasikan pada tahun 1748.<ref>{{cite book|author=Juan, J.|author2=de Ulloa, A.|date=1748|title=Relación histórica del viage a la América Meridional|volume=1|page=606|language=Spanish}}</ref> Kimiawan yang mempelajari platina melarutkannya dalam [[air raja]]<ref group=Catatan>campuran [[asam klorida]] pekat dan [[asam nitrat]] pekat (3:1)</ref> untuk membuat larutan garamnya. Mereka selalu mengamati terdapat sejumlah kecil residu gelap yang tidak larut.<ref name="hunt" /> [[Joseph Louis Proust]] mengira bahwa residunya adalah [[grafit]].<ref name="hunt">{{cite journal|title=A History of Iridium|first=L. B.|last=Hunt|journal=Platinum Metals Review|volume=31|issue=1|date=1987|url=http://www.platinummetalsreview.com/pdf/pmr-v31-i1-032-041.pdf|accessdate=2012-03-15|pages=32–41}}</ref> [[Victor Collet-Descotils]], [[Antoine François, comte de Fourcroy]], dan [[Louis Nicolas Vauquelin]] juga mengamati iridium, residu hitam platina pada tahun 1803, namun tidak mendapatkan cukup bahan untuk penelitian lebih lanjut.<ref name="hunt" />. Kemudian dua kimiawan Prancis Antoine-François Fourcroy dan Nicolas-Louis Vauquelin mengidentifikasi logam dalam residu platina yang mereka sebut ‘''ptène''’.<ref>{{Cite journal|last=Haubrichs|first=Rolf|last2=Zaffalon|first2=Pierre-Leonard|date=2017|title=Osmium vs. ‘Ptène’: The Naming of the Densest Metal|url=http://www.technology.matthey.com/article/61/3/190-196/|journal=Johnson Matthey Technology Review|volume=61|pages=|doi=10.1595/205651317x695631|via=}}</ref> |
|||
Pada tahun 1803, [[Smithson Tennant]] menganalisis residu yang tidak larut dan menyimpulkan bahwa residu tersebut pasti mengandung logam baru. Vauquelin mengolah serbuk itu dengan alkali dan asam secara bergantian<ref name="Emsley"/> dan memperoleh oksida baru yang mudah menguap, yang dia yakini dari logam baru ini—yang dinamakannya ''ptene'', dari {{lang-el|πτηνος}} (ptènos) untuk bersayap.<ref name="griffith">{{cite journal|doi=10.1595/147106704X4844|title=Bicentenary of Four Platinum Group Metals. Part II: Osmium and iridium – events surrounding their discoveries|author=Griffith, W. P.|journal=Platinum Metals Review|volume=48|issue=4|date=2004|pages=182–189}}</ref><ref>{{cite book|title=A System of Chemistry of Inorganic Bodies|author=Thomson, T.|authorlink=Thomas Thomson (chemist)|publisher=Baldwin & Cradock, London; and William Blackwood, Edinburgh|date=1831|page=693}}</ref> Bagaimanapun, Tennant, yang memiliki keuntungan dengan jumlah residu jauh lebih banyak, melanjutkan penelitiannya dan mengidentifikasi dua unsur yang sebelumnya tidak ditemukan dalam residu hitam, iridium dan osmium.<ref name="hunt" /><ref name="Emsley"/> Ia memperoleh larutan kuning (kemungkinan ''cis''–<nowiki>[</nowiki>Os(OH)<sub>2</sub>O<sub>4</sub><nowiki>]</nowiki><sup>2−</sup>) melalui reaksi dengan [[natrium hidroksida]] pada panas membara. Setelah pengasaman dia bisa mendistilasi OsO<sub>4</sub> yang terbentuk.<ref name="griffith"/> Dia menamakannya osmium dari [[bahasa Yunani]] ''osme'' yang berarti "bau", karena bau abu dan bau asap [[osmium tetroksida]] yang mudah menguap.<ref name="weeks">{{cite book|title=Discovery of the Elements|pages=414–418|author=Weeks, M. E.|date= 1968|edition=7|publisher=Journal of Chemical Education|isbn=0-8486-8579-2|oclc=23991202}}</ref> Penemuan unsur baru ini didokumentasikan dalam sebuah surat kepada [[Royal Society]] pada tanggal 21 Juni 1804.<ref name="hunt"/><ref>{{cite journal|title= On Two Metals, Found in the Black Powder Remaining after the Solution of Platina|first=S.|last=Tennant|journal=Philosophical Transactions of the Royal Society|volume=94|date=1804|pages=411–418|jstor=107152|doi=10.1098/rstl.1804.0018}}</ref> |
|||
[[File:Adenauerallee-2011-hessentag-099.jpg|thumb|left|200px|Festival [[Hessentag]] pada tahun 2011, merayakan budaya negara bagian [[Hesse]] di Jerman, senama dari hassium]] |
|||
Sintesis elemen 108 pertama kali dicoba pada tahun 1978 oleh tim peneliti Rusia yang dipimpin oleh [[Yuri Oganessian]] dan [[Vladimir Utyonkov]] di [[Joint Institute for Nuclear Research]] (JINR) di [[Dubna]], menggunakan reaksi yang menghasilkan isotop hassium-270 dan hassium-264. Data tersebut tidak pasti dan mereka melakukan percobaan baru pada hassium lima tahun kemudian, di mana kedua isotop ini juga menghasilkan hassium-263; percobaan hassium-264 diulang kembali dan dikonfirmasi pada tahun 1984.<ref name=emsley/> |
|||
Hassium [[Penemuan unsur kimia|resmi ditemukan]] pada tahun 1984 oleh kelompok peneliti Jerman yang dipimpin oleh [[Peter Armbruster]] dan [[Gottfried Münzenberg]] di [[GSI Helmholtz Centre for Heavy Ion Research|''GSI Helmholtz Centre for Heavy Ion Research'']] (Gesellschaft für Schwerionenforschung, GSI) di [[Darmstadt]]. Para peneliti ini membombardir target [[timbal]]-208 dengan inti besi-58 yang dipercepat untuk menghasilkan 3 atom [[isotop]] hassium-265.<ref name="84Mu01">{{cite journal |last1=Münzenberg |first1=G. |last2=Armbruster |first2=P. |last3=Folger |first3=H. |last4=Heßberger |first4=F. P. |last5=Hofmann |first5=S. |last6=Keller |first6=J. |last7=Poppensieker |first7=K. |last8=Reisdorf |first8=W. |last9=Schmidt |first9=K.-H. |first10=H.-J.|last10=Schött|first11=M. E.|last11=Leino|first12=R.|last12=Hingmann|date=1984 |title=The identification of element 108 |journal=Zeitschrift für Physik A |volume=317 |issue=2 |pages=235–236 |doi=10.1007/BF01421260 |url=http://www.gsi-heavy-ion-researchcenter.org/forschung/kp/kp2/ship/108-discovery.pdf |accessdate=20 October 2012|display-authors=9|bibcode = 1984ZPhyA.317..235M }}</ref> |
|||
{{clear}} |
|||
==Keterjadian== |
|||
[[File:Roussillon_sentier_des_ocres2.JPG|thumb|Jalan bawah tanah di Roussillon]] |
|||
[[Besi telurik]] ({{lang-en|[[:en:Telluric iron|telluric iron]]}}) atau [[besi]] logam jarang dijumpai di permukaan bumi karena cenderung teroksidasi, tetapi oksidanya menyerap dan mewakili bijih utama. Sementara ia menyusun sekitar 5% dari [[kerak bumi]], baik [[inti dalam]] dan [[inti luar|luar]] bumi diyakini mengandung paduan [[besi]]-[[nikel]] dalam jumlah besar mencapai 35% dari massa bumi secara keseluruhan. Besi merupakan unsur yang paling melimpah di bumi, namun hanya unsur paling melimpah keempat di kerak bumi, setelah [[oksigen]], [[silikon]], dan [[aluminium]].<ref>{{cite web|url=http://www.webelements.com/iron/geology.html|title=Iron: geological information|publisher=WebElements|accessdate=23 May 2010}}</ref><ref>{{Cite journal|last-author-amp=yes|date=1980|title=Chemical composition of Earth, Venus, and Mercury|url=http://www.pnas.org/content/77/12/6973|journal=[[Proc. Natl. Acad. Sci.]]|volume=77|issue=12|pages=6973–6977|bibcode=1980PNAS...77.6973M|doi=10.1073/pnas.77.12.6973|pmc=350422|pmid=16592930|author=John W. Morgan|author2=Edward Anders}}</ref> Sebagian besar besi dalam kerak bumi ditemukan bergabung dengan oksigen seperti mineral [[besi oksida]] seperti [[hematit]] ({{chem2|Fe|2|O|3}}), [[magnetit]] ({{chem2|Fe|3|O|4}}), dan [[siderit]] ({{chem2|FeCO|3}}). Banyak [[batuan beku]] juga mengandung mineral sulfida [[pirhotit]] dan [[pentlandit]].<ref name=mindat>{{cite web|url=http://www.mindat.org/min-3328.html |publisher=Mindat.org| title=Pyrrhotite|accessdate=2009-07-07}}</ref><ref name=Klein>{{cite|last1=Klein|first1=Cornelis|last2=Cornelius|first2=S. Hurlbut, Jr.|title=Manual of Mineralogy|publisher=Wiley|edition=20th|year=1985|pages=278-9|isbn=0-471-80580-7}}</ref> |
|||
Sebagai unsur di urutan 74 [[Kelimpahan unsur dalam kerak bumi|kelimpahan dalam kerak bumi]], [[rutenium]] relatif langka,<ref name="Emsley">{{cite book|title = Nature's Building Blocks: An A-Z Guide to the Elements|last = Emsley|first=J.|publisher = Oxford University Press|date = 2003|location = Oxford, England, UK|isbn = 0-19-850340-7|chapter = Ruthenium|pages=368–370}}</ref> dijumpai hanya sekitar 100 [[bagian per triliun]].<ref name=Greenwood1071>Greenwood and Earnshaw, p. 1071</ref> Unsur ini umumnya ditemukan dalam bijih bersama logam golongan platina lainnya di [[Pegunungan Ural]] dan di Amerika Utara dan Selatan. Jumlah kecil tetapi penting secara komersial juga ditemukan di [[pentlandit]] yang diekstraksi dari [[Greater Sudbury|Sudbury]], [[Ontario]], [[Kanada]], dan pada deposit [[piroksenit]] di [[Afrika Selatan]]. Bentuk asli rutenium adalah mineral yang sangat langka (Ir menggantikan sebagian Ru dalam strukturnya).<ref name="USGS-YB-2006">{{cite web|url = http://minerals.usgs.gov/minerals/pubs/commodity/platinum/myb1-2006-plati.pdf |publisher = United States Geological Survey USGS|accessdate = 2008-09-16|title = 2006 Minerals Yearbook: Platinum-Group Metals| first = Micheal W.|last = George}}</ref><ref name="USGS-CS-2008">{{cite web|url = http://minerals.usgs.gov/minerals/pubs/commodity/platinum/mcs-2008-plati.pdf |publisher = United States Geological Survey USGS|accessdate = 2008-09-16|title = Commodity Report: Platinum-Group Metals}}</ref> |
|||
Meskipun [[Kelimpahan unsur|osmium adalah salah satu unsur bernomor genap, yang menempatkannya di bagian atas unsur yang biasa ditemukan di luar angkasa]], [[osmium]] adalah unsur stabil [[Kelimpahan unsur dalam kerak bumi|paling sedikit]] di kerak bumi dengan fraksi massa rata-rata 50 [[bagian per triliun]] di [[kerak benua]].<ref name="wede">{{cite journal|doi=10.1016/0016-7037(95)00038-2|pages=1217–1232|title=The composition of the continental crust|date=1995|issue=7|author=Wedepohl, Hans K|journal=Geochimica et Cosmochimica Acta|volume=59|bibcode=1995GeCoA..59.1217W}}</ref> |
|||
Osmium ditemukan di alam sebagai unsur mandiri atau dalam [[logam paduan|paduan]] alami; terutama paduan iridium-osmium, [[osmiridium]] (kaya akan osmium), dan [[Osmiridium|iridosmium]] (kaya akan iridium).<ref name="Emsley"/> Pada deposit [[nikel]] dan [[tembaga]], logam golongan platina terdapat sebagai [[sulfida]] (yaitu, (Pt,Pd)S)), [[telurida]] (misalnya, PtBiTe), [[antimonida]] (misalnya, PdSb), dan [[arsenida]] (misalnya, PtAs{{sub|2}}); dalam semua senyawa ini platina ditukar dengan sejumlah kecil iridium dan osmium. Seperti halnya semua logam golongan platina, osmium dapat ditemukan secara alami pada paduan dengan nikel atau [[tembaga alami|tembaga]].<ref>{{cite journal|doi=10.1016/j.mineng.2004.04.001|journal=Minerals Engineering|volume=17|issue=9–10|date=2004|pages=961–979|title=Characterizing and recovering the platinum group minerals—a review|first=Z.|last=Xiao|author2=Laplante, A. R.}}</ref> |
|||
[[Hassium]] tidak diketahui terjadi secara alami di Bumi; [[waktu paruh]] semua isotop yang diketahui cukup pendek sehingga tidak ada hassium [[Unsur primordial|primordial]] yang dapat bertahan sampai hari ini. Ini tidak mengesampingkan kemungkinan isotop tak diketahui yang berumur panjang atau [[isomer nuklir]] yang ada, beberapa di antaranya masih bisa ada dalam jumlah [[radioisotop renik|renik]] saat ini jika mereka berumur cukup lama. Pada awal 1960-an, diperkirakan bahwa isomer hassium yang berumur panjang dapat terjadi secara alami di Bumi dalam jumlah renik. Teori ini muncul untuk menjelaskan kerusakan radiasi ekstrem pada beberapa mineral yang tidak mungkin disebabkan oleh [[radioisotop]] alami yang diketahui, namun bisa disebabkan oleh unsur-unsur superberat.<ref name="emsley"/> |
|||
Pada tahun 1963, ilmuwan [[Uni Soviet]] [[Victor Cherdyntsev]], yang sebelumnya mengklaim adanya [[curium]]-247 purba,<ref>{{cite journal |last1=Cherdyntsev |first1=V. V. |last2=Mikhailov |first2=V. F. |date=1963 |title=The Primordial Transuranium Isotope in Nature |journal=Geokhimiya |volume=1 |pages=3–14 |url=http://www.osti.gov/energycitations/product.biblio.jsp?osti_id=4748393 |accessdate=10 August 2013}}</ref> mengklaim telah menemukan unsur 108 (khususnya, isotop {{sup|267}}Hs, yang diperkirakan memiliki waktu paruh 400 sampai 500 juta tahun) dalam [[molibdenit]] alami dan menyarankan nama ''sergenium'' dengan lambang Sg<ref group=Catatan>pada saat itu, lambang Sg belum digunakan untuk [[seaborgium]]</ref> sesuai nama kota kuno Serik di sepanjang [[Jalan Sutera]] di [[Kazakhstan]] tempat sampel molibdenitnya berasal.<ref name="emsley"/> Alasannya untuk mengklaim bahwa sergenium adalah homolog yang lebih berat dari osmium adalah bahwa mineral yang diduga mengandung sergenium membentuk oksida volatil ketika direbus dalam [[asam nitrat]], serupa dengan osmium. Temuannya dikritik oleh [[V. M. Kulakov]] dengan alasan bahwa beberapa sifat yang diklaim Cherdyntsev dimiliki oleh sergenium tidak sesuai dengan fisika nuklir saat itu.<ref>{{cite journal |last1=Kulakov |first1=V. M. |date=1970 |title=Has element 108 been discovered? |journal=Soviet Atomic Energy |volume=29 |issue=5 |pages=1166–8 |doi=10.1007/BF01666716 }}</ref> |
|||
==Produksi== |
|||
Produksi besi atau baja merupakan proses yang terdiri dari dua tahap utama. Pada tahap pertama bongkah besi diproduksi dalam tanur. Sebagai alternatif, bisa dilakukan reduksi langsung. Pada tahap kedua, bongkah besi diubah menjadi besi tempa, baja, atau besi cor.<ref name=Greenwood1073>Greenwood and Earnshaw, p. 1073</ref><!--https://books.google.com/books?id=xkVPNtRagDkC--> |
|||
[[File:Chinese Fining and Blast Furnace.jpg|thumb|Proses pematangan leburan [[bijih besi]] untuk membuat besi tempa dari besi bongkahan. Gambar kanan menampilkan pria bekerja pada tanur. Dari ensiklopedia ''Tiangong Kaiwu'', diterbitkan pada tahun 1637 oleh [[Song Yingxing]].]] [[File:Iron-Making.jpg|thumb|Cara ekstraksi besi pada abad ke-19]] |
|||
Untuk beberapa keperluan terbatas bila diperlukan, besi murni diproduksi di laboratorium dalam jumlah kecil dengan mereduksi oksida atau hidroksida murni dengan hidrogen, atau membentuk besi pentakarbonil dan memanaskannya sampai 250 °C sehingga terdekomposisi menjadi serbuk besi murni.<ref name="Greenwood1071"/> Metode lain adalah elektrolisis fero klorida pada katode besi.<ref>{{cite|first=H.|last=Lux|section=Metallic Iron|title=Handbook of Preparative Inorganic Chemistry|edition=2nd|editor=G. Brauer|publisher=Academic Press|year=1963|location=NY|volume=2|pages=1490–1}}</ref> |
|||
Sekitar 12 ton rutenium ditambang setiap tahunnya dengan cadangan dunia diperkirakan 5.000 ton.<ref name="Emsley"/> Komposisi campuran logam [[golongan platina]] (''platinum group metal'', PGM) yang ditambang sangat bervariasi, tergantung pada formasi geokimia. Misalnya, PGM yang ditambang di Afrika Selatan mengandung rutenium rata-rata 11% sementara PGM yang ditambang di bekas Uni Sovyet hanya mengandung 2% (1992).<ref>{{cite book|url = https://books.google.com/books?id=Wm6QMRaX9C4C&pg=PA69|page =69|isbn = 978-0-87335-100-3|editor = Hartman, H. L.|editor2 = Britton, S. G.|date = 1992|publisher = Society for Mining, Metallurgy, and Exploration|location = Littleton, Colo.|title = SME mining engineering handbook}}</ref><ref>{{cite journal|url = http://canmin.geoscienceworld.org/cgi/content/abstract/12/2/104|journal = The Canadian Mineralogist|date = 1973| volume = 12|issue = 2|pages = 104–112|title = The nomenclature of the natural alloys of osmium, iridium and ruthenium based on new compositional data of alloys from world-wide occurrences| first = Donald C.|last = Harris|author2=Cabri, L. J. }}</ref> Rutenium, osmium, dan iridium dianggap sebagai minoritas dalam logam golongan platina.<ref name=Greenwood1074/><!--Greenwood and Earnshaw, p. 1074</ref>--> |
|||
Osmium diperoleh secara komersial sebagai produk sampingan dari penambangan dan pengolahan [[nikel]] dan [[tembaga]]. Selama [[Teknik ekstraksi tembaga|electrorefining tembaga]] dan nikel, logam mulia seperti perak, emas dan logam golongan platina, bersama dengan unsur non-logam seperti [[selenium]] dan [[telurium]] mengendap di bagian bawah sel sebagai ''lumpur anode'', yang merupakan bahan awal untuk ekstraksi mereka.<ref name="usgs2008-summary">{{cite journal|author=George, M. W.|title=Platinum-group metals|journal=U.S. Geological Survey Mineral Commodity Summaries|publisher=USGS Mineral Resources Program|format=PDF|date=2008|url=http://minerals.usgs.gov/minerals/pubs/commodity/platinum/mcs-2008-plati.pdf}}</ref><ref name="MinYb2006">{{cite book|url=http://minerals.usgs.gov/minerals/pubs/commodity/platinum/myb1-2006-plati.pdf|publisher=United States Geological Survey USGS|accessdate=2008-09-16|title=2006 Minerals Yearbook: Platinum-Group Metals|first=M. W.|last=George}}</ref> Untuk memisahkan logam-logam tersebut, pertama-tama mereka harus dilarutkan. Tersedia beberapa metode tergantung pada proses pemisahan dan komposisi campuran; dua metode yang representatif adalah (1) dilebur dengan [[natrium peroksida]] yang diikuti dengan pelarutan dalam [[air raja]], dan (2) pelarutan dalam campuran [[klorin]] dengan [[asam klorida]].<ref name="kirk-pt">{{cite book |title=Kirk Othmer Encyclopedia of Chemical Technology |first = R. J.|last=Seymour|author2=O'Farrelly, J. I. |chapter=Platinum-group metals|doi=10.1002/0471238961.1612012019052513.a01.pub2|date=2001|publisher=Wiley}}</ref><ref name="ullmann-pt">{{cite book |author=Renner, H. |display-authors=4 |author2=Schlamp, G. |author3=Kleinwächter, I. |author4=Drost, E. |author5=Lüschow, H. M. |author6=Tews, P. |author7=Panster, P. |author8=Diehl, M. |author9=Lang, J. |author10=Kreuzer, T. |author11=Knödler, A. |author12=Starz, K. A. |author13=Dermann, K. |author14=Rothaut, J. |author15=Drieselman, R.|chapter=Platinum group metals and compounds|title=Ullmann's Encyclopedia of Industrial Chemistry |publisher=Wiley|date=2002|doi=10.1002/14356007.a21_075}}</ref> Osmium, rutenium, rhodium dan iridium dapat dipisahkan dari platina, emas dan logam dasar berdasarkan ketaklarutannya dalam air raja, sebagai residu padat. Rhodium dapat dipisahkan dari residu dengan perlakuan menggunakan lelehan [[natrium bisulfat]]. Residu yang tidak larut, yang mengandung Ru, Os dan Ir, diberi perlakuan dengan [[natrium oksida]], di mana Ir tidak larut, menghasilkan garam Ru dan Os yang larut dalam air. Setelah dioksidasi menjadi oksida volatil, {{chem2|RuO|4}} dipisahkan dari {{chem2|OsO|4}} dengan presipitasi {{chem2|(NH|4|)|3|RuCl|6}} menggunakan amonium klorida. |
|||
==Aplikasi== |
|||
Besi adalah logam yang paling banyak digunakan, terhitung lebih dari 90% produksi logam di seluruh dunia. UGSG memberikan produksi besi termasuk daur ulang dengan 998Mt, sedangkan aluminium (39Mt), tembaga (18Mt), seng (11Mt) dan timah (8.6Mt) menambahkan hingga 77 Mt, semuanya termasuk daur ulang. Ini lebih seperti 8% daripada 5. Biayanya yang rendah dan kekuatannya tinggi membuatnya sangat diperlukan dalam aplikasi teknik seperti konstruksi mesin dan [[peralatan mesin]], [[mobil]], [[lambung kapal|lambung]] [[kapal]] besar, dan komponen struktural untuk [[bangunan]]. Oleh karena besi murni cukup lunak, besi paling sering dipadukan dengan unsur paduan untuk membuat baja.<ref name=Greenwood10701>Greenwood and Earnshaw, pp. 1070–1</ref> |
|||
Karena mengeraskan paduan platina dan paladium, rutenium digunakan dalam [[Sakelar|sakelar listrik]], di mana film tipis cukup untuk mencapai daya tahan yang diinginkan. Dengan sifat serupa dan biaya lebih rendah daripada rhodium,<ref name="Hunt 1969 126–138">{{cite journal |first = L. B. |last = Hunt|author2=Lever, F. M. |journal = Platinum Metals Review|volume = 13 |issue = 4|date = 1969 |pages = 126–138|title = Platinum Metals: A Survey of Productive Resources to industrial Uses|url = http://www.platinummetalsreview.com/pdf/pmr-v13-i4-126-138.pdf}}</ref> sakelar listrik adalah penggunaan utama rutenium.<ref name="USGS-YB-2006"/><ref>{{cite journal|doi = 10.1016/j.ccr.2004.08.015|title = Chemical and electrochemical depositions of platinum group metals and their applications|date = 2005|author = Rao, C|journal = Coordination Chemistry Reviews|volume = 249|page = 613|last2 = Trivedi|first2 = D.|issue = 5–6}}</ref> Pelat diaplikasikan ke logam dasar dengan cara [[penyepuhan elektrik]] (''electroplating'')<ref>{{cite journal|doi = 10.1016/S0026-0576(00)83089-5|title = Ruthenium plating|date = 1999|author = Weisberg, A|journal = Metal Finishing|volume = 97|page = 297}}</ref> atau [[pembersitan]] (''sputtering'').<ref>{{cite book|isbn = 978-0-87170-285-2| url = https://books.google.com/books?id=EkStW7v8VPkC&pg=RA3-PA550|page = 184|author = Prepared under the direction of the ASM International Handbook Committee|author2 = Merrill L. Minges, technical chairman|date = 1989|publisher = ASM International|location = Materials Park, OH|title = Electronic materials handbook}}</ref> |
|||
Rutenium dioksida dengan timbal dan bismut ruthenat digunakan pada resistor chip film tebal.<ref>{{cite journal|doi =10.1007/s10854-006-0036-x|title =Microstructure development and electrical properties of RuO2-based lead-free thick film resistors|date =2006|author =Busana, M. G.|journal =Journal of Materials Science: Materials in Electronics|volume =17|page =951|last2 =Prudenziati|first2 =M.|last3 =Hormadaly|first3 =J.|issue =11}}</ref><ref>{{cite journal|doi = 10.1016/j.matlet.2006.05.015|title = Environment friendly perovskite ruthenate based thick film resistors|date = 2007|author = Rane, Sunit|journal = Materials Letters|volume = 61|page = 595|last2 = Prudenziati|first2 = Maria|last3 = Morten|first3 = Bruno|issue = 2}}</ref><ref>{{cite book|isbn = 978-0-8247-1934-0| url = https://books.google.com/books?id=c2YxCCaM9RIC&pg=PA184|pages = 184, 345|editor = Slade, Paul G.|date = 1999|publisher = Dekker|location = New York, NY|title = Electrical contacts : principles and applications}}</ref><!--http://md1.csa.com/partners/viewrecord.php?requester=gs&collection=TRD&recid=N8113268AH--> Dua aplikasi elektronik ini menyumbang 50% konsumsi ruthenium.<ref name="Emsley"/> |
|||
Osmium jarang digunakan dalam keadaan murni, karena oksidanya sangat volatil dan toksik, namun justru sering dipadu dengan logam lainnya. Paduan tersebut digunakan dalam aplikasi dengan berkeausan tinggi. Paduan osmium seperti [[osmiridium]] sangat keras dan, bersama logam golongan platina lainnya, digunakan di ujung [[pulpen]], poros instrumen, dan sakelar, karena mereka dapat menahan keausan dari penggunaan masif. Mereka juga digunakan untuk ujung [[stilus]] [[fonograf]] era piringan hitam, sekitar tahun 1945 sampai 1955. Meskipun sangat awet dibandingkan dengan stilus baja dan kromium, ujung paduan osmium jauh lebih cepat aus, dan lebih mahal, daripada pesaingnya [[intan]] dan [[safir]], sehingga pemakaiannya dihentikan.<ref>{{cite book| author = Stephen D. Cramer| author2 = Bernard S. Covino, Jr.| last-author-amp = yes| title = ASM Handbook Volume 13B. Corrosion: Materials| url = https://books.google.com/books?id=wGdFAAAAYAAJ| date = 2005| publisher = ASM International| isbn = 978-0-87170-707-9 }}</ref> |
|||
==Pencegahan== |
|||
Serbuk halus logam osmium bersifat [[piroporisitas|piroporis]]<ref name="Appraisal">{{cite journal|journal=Environmental Health Perspectives|date=1974|pages=201–213|title=Osmium: An Appraisal of Environmental Exposure|first=Ivan C.|last=Smith |author2=Carson, Bonnie L. |author3=Ferguson, Thomas L. |doi=10.2307/3428200|volume=8|pmid=4470919|pmc=1474945|jstor=3428200}}</ref> dan bereaksi dengan oksigen pada suhu ruang, membentuk [[osmium tetroksida]] yang mudah menguap. Beberapa senyawa osmium juga berubah menjadi tetroksida jika ada oksigen.<ref name="Appraisal "/> Hal ini membuat osmium tetroksida menjadi sumber kontak utama dengan lingkungan. |
|||
Osmium tetroksida sangat mudah menguap dan menembus kulit dengan mudah, dan sangat [[toksik]] jika terhirup, tertelan, dan terkena kulit.<ref name="ToxOs">{{cite journal|journal=Journal of Chemical Health and Safety|volume =14|issue=5|date=2007|doi=10.1016/j.jchas.2007.07.003|title=Toxic tips: Osmium tetroxide|first=William E.|last=Luttrell|author2=Giles, Cory B.|pages=40–41}}</ref> Uap osmium tetroksida di udara pada konsentrasi rendah dapat menyebabkan kongesti [[paru-paru]] dan kerusakan [[Kulit manusia|kulit]] atau [[Mata manusia|mata]], dan karenanya harus digunakan di dalam [[lemari asam]].<ref name="mager">{{cite book| last = Mager Stellman| first = J.| title = Encyclopaedia of Occupational Health and Safety| url = https://books.google.com/books?id=nDhpLa1rl44C| date = 1998| publisher = International Labour Organization| isbn = 978-92-2-109816-4| oclc = 35279504 | pages = 63.34| chapter = Osmium }}</ref> Osmium tetroksida cepat direduksi oleh [[minyak sayur]] [[Lemak tak jenuh ganda|tak jenuh ganda]], seperti [[minyak jagung]], menjadi senyawa yang relatif lembam (''inert'').<ref>{{cite web|url=http://blink-prod.ucsd.edu/Blink/External/Topics/How_To/0,1260,15753,00.html |title=How to Handle Osmium Tetroxide |accessdate=2009-06-02 |publisher=University of California, San Diego |deadurl=yes |archiveurl=https://web.archive.org/web/20060221232331/http://blink-prod.ucsd.edu/Blink/External/Topics/How_To/0,1260,15753,00.html |archivedate=February 21, 2006 }}</ref> |
|||
==Peran biologis== |
|||
Dari empat unsur golongan 8, hanya [[besi]] yang diketahui memiliki peran biologis. |
|||
[[File:Heme b.svg|thumb|Struktur [[heme|Heme b]]; [[ligan]] protein tambahan akan menempel pada Fe.]] |
|||
Besi merupakan nutrisi penting bagi semua organisme hidup, dari archaea hingga manusia. Ia merupakan komponen utama dalam [[hemoglobin]], protein yang membuat darah merah dan mentransfer oksigen ke otot, dan juga ditemukan pada banyak protein lainnya. Rutenium, osmium, dan kalium tidak memiliki peran yang diketahui dalam tubuh manusia. |
|||
Besi terlibat dalam banyak proses biologis.<ref>{{cite book |
|||
|last1=Dlouhy |first1=Adrienne C. |last2=Outten|first2=Caryn E. |
|||
|editor1-first=Lucia |editor1-last=Banci |series=Metal Ions in Life Sciences |volume=12 |
|||
|title=Metallomics and the Cell |date=2013 |publisher=Springer |isbn=978-94-007-5560-4|doi=10.1007/978-94-007-5561-1_8}} electronic-book {{ISBN|978-94-007-5561-1}} {{ISSN|1559-0836}} electronic-{{ISSN|1868-0402}}</ref><ref> |
|||
{{cite book |
|||
|first1=Gereon M. |
|||
|last1=Yee |
|||
|first2=William B. |
|||
|last2=Tolman |
|||
|editor=Peter M.H. Kroneck |editor2=Martha E. Sosa Torres |
|||
|title=Sustaining Life on Planet Earth: Metalloenzymes Mastering Dioxygen and Other Chewy Gases |
|||
|series=Metal Ions in Life Sciences |
|||
|volume=15 |
|||
|year=2015 |
|||
|publisher=Springer |
|||
|pages=131–204 |
|||
|doi=10.1007/978-3-319-12415-5_5 |
|||
}} |
|||
</ref> Ini adalah logam transisi terpenting di semua organisme hidup.<ref name=Greenwood1098>Greenwood and Earnshaw, pp. 1098–1104</ref> Protein besi dijumpai dalam seluruh organisme hidup: [[arkea]], [[bakteri]] dan [[eukariota]], termasuk manusia. Misalnya, warna darah disebabkan oleh hemoglobin, suatu protein yang mengandung besi. Seperti yang diilustrasikan oleh hemoglobin, besi seringkali terikat pada [[Kofaktor (biokimia)|kofaktor]], seperti [[heme]], yang bukan senyawa protein dan sering melibatkan ion logam, yang diperlukan agar aktivitas biologi protein dapat berlangsung. [[Klaster besi-belerang]] bersifat pervasif dan termasuk [[nitrogenase]], enzim yang bertanggung jawab untuk [[fiksasi nitrogen]] biologis. Peran utama protein yang mengandung besi adalah transportasi dan penyimpanan oksigen, selain transfer elektron.<ref name=Greenwood1098/> |
|||
Besi adalah [[unsur renik]] yang penting yang dijumpai di hampir semua organisme hidup. Enzim dan protein yang mengandung zat besi, yang sering mengandung [[gugus prostetik]] [[heme]], berpartisipasi dalam banyak oksidasi biologis dan transportasi. Contoh protein yang ditemukan pada organisme tingkat tinggi meliputi hemoglobin, [[sitokrom]] (lihat [[besi bervalensi tinggi]]<!--high-valent iron-->), dan [[katalase]].<ref>{{Cite book| first1 = S. J.|last1 = Lippard|first2 = J. M.|last2 = Berg|title = Principles of Bioinorganic Chemistry|publisher = University Science Books|place = Mill Valley|date = 1994|isbn = 0-935702-73-3}}</ref> Manusia dewasa rata-rata mengandung besi sebanyak 0,005% berat badan, atau sekitar empat gram, yang tiga perempatnya dalam bentuk hemoglobin – tingkat yang tetap konstant meskipun hanya menyerap satu miligram besi per hari,<ref name=Greenwood1098/> karena tubuh manusia mendaur ulang hemoglobin untuk mendapatkan kembali besinya.<ref>{{Cite journal |
|||
| last1 = Kikuchi | first1 = G. |
|||
| last2 = Yoshida | first2 = T. |
|||
| last3 = Noguchi | first3 = M. |
|||
| doi = 10.1016/j.bbrc.2005.08.020 |
|||
| title = Heme oxygenase and heme degradation |
|||
| journal = Biochemical and Biophysical Research Communications |
|||
| volume = 338 |
|||
| issue = 1 |
|||
| pages = 558–567 |
|||
| year = 2005 |
|||
| pmid = 16115609 |
|||
| pmc = |
|||
}}</ref> |
|||
==Catatan== |
|||
{{reflist|group=Catatan}} |
|||
==Referensi== |
|||
{{Reflist|30em}} |
|||
{{Compact periodic table}} |
|||
{{Navbox tabel periodik}} |
|||
{{Unsur golongan 8}} |
|||
{{DEFAULTSORT:Golongan 08}} |
|||
[[Kategori:Golongan tabel periodik]] |
|||
Revisi per 1 Agustus 2017 09.24
| Golongan 8 dalam tabel periodik | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| |||||||||
| ↓ Periode | |||||||||
| 4 | Besi (Fe) 26 Logam transisi | ||||||||
| 5 | Ruthenium (Ru) 44 Logam transisi | ||||||||
| 6 | Osmium (Os) 76 Logam transisi | ||||||||
| 7 | Hassium (Hs) 108 Logam transisi | ||||||||
|
Keterangan
| |||||||||
Golongan 8 adalah suatu golongan unsur kimia pada tabel periodik. Anggotanya adalah besi (Fe), ruthenium (Ru), osmium (Os) dan hassium (Hs). Semuanya adalah logam transisi. Seperti golongan lainnya, anggota golongan ini menunjukkan pola pada konfigurasi elektronnya, terutama pada kelopak terluar, yang menghasilkan tren perilaku kimia.
"Golongan 8" adalah nama IUPAC modern untuk golongan ini; nama versi lamanya adalah golongan VIIIB menurut CAS, sistem AS atau golongan VIIIA menurut IUPAC lama, sistem Eropa.
Golongan 8 jangan dirancukan dengan nama golongan lama VIIIA menurut CAS/US. Golongan itu sekarang disebut golongan 18.
Kimia
Hassium belum diisolasi dalam bentuk murni makroskopik, dan sifatnya belum diamati secara meyakinkan; hanya besi, rutenium, dan osmium yang memiliki sifat yang telah dikonfirmasi secara eksperimen. Ketiga unsur tersebut adalah logam transisi putih keperakan, keras, dan memiliki titik leleh dan titik didih tinggi.
| Z | Unsur | Jumlah elektron/kelopak |
|---|---|---|
| 26 | besi | 2, 8, 14, 2 |
| 44 | ruthenium | 2, 8, 18, 15, 1 |
| 76 | osmium | 2, 8, 18, 32, 14, 2 |
| 108 | hassium | 2, 8, 18, 32, 32, 14, 2 |
| Unsur | Tingkat oksidasi stabil | |||||||
|---|---|---|---|---|---|---|---|---|
| besi | +6 | +3 | +2 | |||||
| ruthenium | +8 | +6 | +5 | +4 | +3 | +2 | ||
| osmium | +8 | +6 | +5 | +4 | +3 | +2 | ||
Besi menunjukkan karakteristik sifat kimia logam transisi, misalnya kemampuan membentuk tingkat oksidasi yang bervariasi dan mampu membentuk ikatan koordinasi dan kimia organologam: memang penemuan senyawa besi, ferosena, yang memberi perubahan revolusioner pada bidang ini pada akhir 1950an.[2] Besi kadang-kadang dianggap sebagai prototipe untuk seluruh blok logam transisi, karena kelimpahannya dan perannya yang besar sekali dalam perkembangan teknologi kemanusiaan.[3] Keduapuluh enam elektronnya tertata dalam konfigurasi [Ar]3d64s2, dengan elektron 3d dan 4s nya relatif memiliki energi yang berdekatan, sehingga dapat kehilangan elektron dalam jumlah yang bervariasi dan tidak ada titik yang jelas ionisasi lebih lanjut yang tidak menguntungkan.[4]
Besi membentuk senyawa utamanya dalam tingkat oksidasi +2 dan +3. Menurut tradisi, senyawa besi(II) disebut fero dan senyawa besi(III) disebut feri. Besi juga dapat memiliki tingkat oksidasi yang lebih tinggi, contohnya adalah kalium ferat (K2FeO4), berwarna ungu, yang mengandung besi dengan bilangan oksidasi +6. Besi(IV) adalah bentuk antara yang umum dalam banyak reaksi oksidasi biokimia.[5][6] Sejumlah senyawa organologam mengandung tingkat oksidasi formal +1, 0, −1, atau bahkan −2. Tingkat oksidasi dan sifat ikatan lainnya sering diuji menggunakan teknik spektroskopi Mössbauer.[7] Terdapat juga banyak senyawa valensi campuran yang berintikan besi(II) dan besi(III) sekaligus, seperti magnetit dan biru Prusia (Fe4(Fe[CN]6)3).[6] Senyawa yang disebutkan terakhir di atas digunakan sebagai "biru" tradisional dalam cetak biru.[8]

Tidak seperti logam lainnya, besi tidak membentuk amalgam dengan raksa. Oleh sebab itu, raksa diperdagangkan dalam botol besi berukuran 76 lb (34 kg).[9]
Tingkat oksidasi ruthenium berkisar antara 0 dan +8, serta −2. Sifat senyawa ruthenium dan osmium sering kali mirip. Keadaan +2, +3, dan +4 adalah yang paling umum. Prekursor yang paling umum adalah ruthenium triklorida, seatu padatan merah yang definisi kimianya lemah tetapi merupakan bahan kimia sintetis serbaguna.[10]
Osmium membentuk senyawa dengan tingkat oksidasi mulai dari -2 sampai +8. Tingkat oksidasi yang paling umum adalah +2, +3, +4, dan +8. Tingkat oksidasi +8 adalah yang tertinggi kedua yang dicapai oleh unsur kimia setelah +9 yang dicapai oleh iridium[11] dan hanya ditemui pada xenon,[12][13] ruthenium,[14] hassium,[15] dan iridium.[16] Tingkat oksidasi −1 dan −2 yang diwakili oleh dua senyawa reaktif Na2[Os4(CO)13] dan Na2[Os(CO)4] digunakan dalam sintesis senyawa kluster osmium.[17][18]
Senyawa yang paling umum dengan keadaan oksidasi +8 adalah osmium tetroksida. Senyawa beracun ini terbentuk saat serbuk osmium terpapar udara. Ia adalah padatan kuning pucat yang sangat mudah menguap, larut dalam air, dan berbau kuat. Serbuk osmium memiliki bau khas osmium tetroksida.[19] Osmium tetroksida membentuk osmat OsO4(OH)2−2 merah pada reaksi dengan basa. Dengan amonia, ia membentuk nitrido-osmat OsO3N−.[20][21][22] Osmium tetroksida mendidih pada 130 °C dan merupakan oksidator kuat. Sebaliknya, osmium dioksida (OsO2) berwarna hitam, tidak mudah menguap, lebih tidak reaktif dan lebih tidak beracun.
Hassium adalah anggota keenam dari deret logam transisi 6d dan diperkirakan jauh lebih menyerupai logam golongan platina.[23] Perhitungan potensial ionisasinya, jari-jari atom, energi orbital, dan aras dasar dari keadaan terionisasinya mirip dengan osmium, menyiratkan bahwa sifat-sifat hassium akan sesuai dengan unsur golongan 8 lainnya: besi, ruthenium, dan osmium.[24][25] Beberapa sifat ini dikonfirmasi berdasarkan eksperimen kimia fase gasnya.[26][27][28] Unsur golongan 8 menggambarkan luasnya keberagaman keadaan oksidasi, tetapi rutenium dan osmium memberi gambaran secara cepat tentang keadaan oksidasi golongan mereka yaitu +8 (keadaan oksidasi tertinggi kedua untuk semua unsur, yang sangat jarang dijumpai pada unsur lain). Keadaan ini menjadi semakin stabil dari atas ke bawah sepanjang golongan.[1][29][30] Dengan demikian, hassium diharapkan membentuk keadaan stabil pada tingkat oksidasi +8.[27] Analog dengan kongenernya yang lebih ringan, hassium juga diharapkan menunjukkan keadaan stabil pada tingkat oksidasi yang lebih rendah, seperti +6, +5, +4, +3, dan +2.[31][24][32] Pastinya, hassium(IV) diharapkan lebih stabil daripada hassium(VIII) dalam larutan berair.[24]
Unsur-unsur golongan 8 menunjukkan sifat kimia oksida yang sangat berbeda, sehingga memungkinkan ekstrapoliasi hassium menjadi lebih mudah. Seluruh anggota yang lebih ringan memiliki tetroksida, baik yang sudah terbukti maupun hipotetis, MO4.[33] Daya oksidasi mereka semakin menurun sesuai meningkatnya nomor atom dalam satu golongan. FeO4 tidak dikenal karena afinitas elektronnya[Catatan 1] teramat besar[34] yang mengakibatkan pembentukan oksoanion yang telah dikenal yaitu ferat(VI), FeO2−4.[35] Rutenium tetroksida, RuO4, yang dibentuk melalui oksidasi rutenium(VI) dalam suasana asam, mudah mengalami reduksi menjadi rutenat(VI), RuO2−4.[36][37] Oksidasi logam rutenium di udara membentuk dioksidanya, RuO2.[38] Sebaliknya, osmium terbakar membentuk tetroksida yang stabil, OsO4,[39][40] yang membentuk kompleks dengan ion hidroksida membentuk kompleks osmium(VIII)-at, [OsO4(OH)2]2−.[41] Oleh karena itu, sifat eka-osmium untuk hassium dapat ditunjukkan dengan pembentukan tetroksida stabil yang sangat volatil HsO4,[31][24][26][28][29] yang mengalami kompleksasi dengan hidroksida membentuk hassat(VIII), [HsO4(OH)2]2−.[42] Rutenium tetroksida dan osmium tetroksida keduanya mudah menguap, karena geometri molekul tetrahedral simetrinya dan keduanya bermuatan netral; hassium tetroksida diperkirakan memiliki kemiripan sebagai padatan yang sangat mudah menguap. Tren volatilitas tetroksida golongan 8 diketahui sebagai berikut: RuO4 < OsO4 > HsO4, yang telah dibuktikan secara tuntas melalui hasil perhitungan. Khususnya, entalpi adsorpsi terhitung[Catatan 2] HsO4 adalah −(45,4 ± 1) kJ·mol−1 pada kuarsa, sangat cocok dengan nilai eksperimen −(46 ± 2) kJ·mol−1.[43]
Sejarah
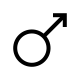

Besi merupakan salah satu unsur yang tidak diragukan lagi telah dikenal sejak zaman prasejarah.[44] Ia telah diolah atau ditempa selama ribuan tahun. Namun, benda besi yang berumur panjang lebih jarang daripada benda yang terbuat dari emas atau perak karena besi mudah mengalami korosi (berkarat).[45]

Manik-manik yang terbuat dari besi meteor ditemukan di Gerzah, Mesir oleh G. A. Wainwright pada tahun 3500 SM atau sebelumnya.[46] Manik-manik tersebut mengandung nikel 7,5%, yang merupakan pertanda berasal meteor karena besi yang ditemukan di kerak bumi umumnya hanya memiliki ketakmurnian nikel yang sangat kecil. Besi meteor sangat dihargai karena berasal dari "surga" dan sering digunakan untuk menempa senjata dan peralatan.[46] Sebagai contoh, sebuah belati yang terbuat dari besi meteor yang ditemukan di makam Tutankhamun, mengandung proporsi besi, kobal, dan nikel yang serupa dengan meteorit yang ditemukan di daerah tersebut, akibat deposit dari hujan meteor kuno.[47][48][49] Benda yang kemungkinan terbuat dari besi oleh orang Mesir berasal dari 3000 sampai 2500 SM.[45] Besi meteorit cukup lunak dan ulet serta mudah ditempa dengan metode tempa dingin (cold working) namun bisa menjadi rapuh saat dipanaskan karena kandungan nikelnya.[50]
Produksi besi pertama dimulai pada Zaman Perunggu Tengah tetapi memerlukan beberapa abad sebelum besi dapat menggantikan perunggu. Sampel leburan besi dari Asmar, Mesopotamia dan Tall Chagar Bazaar di Siria bagian utara dibuat pada rentang waktu antara 3000 dan 2700 SM.[51] Bangsa Het memantapkan kekaisarannya di Anatolia bagian pusat-utara pada sekitar 1600 SM. Mereka nampaknya adalah yang pertama memahami produksi besi dari bijihnya dan menganggapnya hal yang sangat penting dalam masyarakan mereka.[52] Bangsa Het mulai melebur besi antara tahun 1500 dan 1200 SM dan praktek tersebut menyebar ke Timur Dekat setelah kejatuhan kekaisaran mereka pada tahun 1180 SM.[51] Periode setelahnya disebut sebagai Zaman Besi.
Pada tahun 1774, Antoine Lavoisier menggunakan reaksi kukus air dengan logam besi di dalam tabung besi pijar untuk membuat hidrogen, dalam penelitiannya yang mengarah pada pengungkapan hukum kekekalan massa, yang berperan penting dalam mengubah kimia dari sains kualitatif menjadi kuantitatif.[53]
Jöns Berzelius dan Gottfried Osann hampir menemukan rutenium pada tahun 1827.[54] Mereka meneliti residu yang ditinggalkan setelah melarutkan platina mentah dari Pegunungan Ural dalam air raja. Berzelius tidak menemukan logam asing apapun, tetapi Osann berpikiran bahwa ia menemukan tiga logam baru, yang disebut pluranium, rutenium, dan polinium. Perbedaan pendapat ini memicu kontroversi berkepanjangan antara Berzelius dan Osann mengenai komposisi residu.[55] Setelah Osann tidak mampu mengulang isolasi ruteniumnya, ia akhirnya melepas klaimnya.[55][56] Nama "rutenium" dipilih oleh Osann karena sampel yang dianalisis berasal dari Pegunungan Ural di Rusia.[57] Nama itu sendiri berasal dari Ruthenia, bahasa Latin untuk Rus', daerah bersejarah yang sekarang meliputi Rusia bagian barat, Ukraina, Belarus, dan sebagian Slovakia dan Polandia.
Pada tahun 1844, Karl Ernst Claus, ilmuwan Rusia keturunan Jerman Baltik, menunjukkan bahwa senyawa yang dipreparasi oleh Gottfried Osann mengandung sejumlah kecil rutenium, yang juga telah ditemukan oleh Claus pada tahun yang sama.[58] Claus mengisolasi rutenium dari residu platinum produksi rubel saat ia bekerja di Universitas Kazan, Kazan,[55] dengan cara yang sama dengan penemuan osmium, kongenernya yang lebih berat, empat dasawarsa sebelumnya.[59] Claus menunjukkan bahwa rutenium oksida mengandung logam baru dan memperoleh 6 gram rutenium dari bagian platina mentah yang tidak larut dalam air raja.[55] Memilih nama untuk unsur baru ini, Claus menyatakan:
"Saya menamakan unsur baru ini ruthenium, untuk menghormati Tanah Air saya. Saya berhak menyebutnya dengan nama ini karena Tuan Osann melepaskan ruteniumnya dan kata itu belum ada dalam ilmu kimia."
— Karl Ernst Claus
Osmium ditemukan pada tahun 1803 oleh Smithson Tennant dan William Hyde Wollaston di London, Inggris.[61] Penemuan osmium saling terkait dengan platina dan logam golongan platina lainnya. Platina mencapai Eropa sebagai platina ("perak kecil"), yang pertama kali ditemukan pada abad ke-17 di tambang perak di sekitar Departemen Chocó, Colombia.[62] Penemuan bahwa logam ini bukan paduan, tapi unsur baru yang berbeda, dipublikasikan pada tahun 1748.[63] Kimiawan yang mempelajari platina melarutkannya dalam air raja[Catatan 3] untuk membuat larutan garamnya. Mereka selalu mengamati terdapat sejumlah kecil residu gelap yang tidak larut.[64] Joseph Louis Proust mengira bahwa residunya adalah grafit.[64] Victor Collet-Descotils, Antoine François, comte de Fourcroy, dan Louis Nicolas Vauquelin juga mengamati iridium, residu hitam platina pada tahun 1803, namun tidak mendapatkan cukup bahan untuk penelitian lebih lanjut.[64]. Kemudian dua kimiawan Prancis Antoine-François Fourcroy dan Nicolas-Louis Vauquelin mengidentifikasi logam dalam residu platina yang mereka sebut ‘ptène’.[65]
Pada tahun 1803, Smithson Tennant menganalisis residu yang tidak larut dan menyimpulkan bahwa residu tersebut pasti mengandung logam baru. Vauquelin mengolah serbuk itu dengan alkali dan asam secara bergantian[66] dan memperoleh oksida baru yang mudah menguap, yang dia yakini dari logam baru ini—yang dinamakannya ptene, dari Yunani: πτηνος (ptènos) untuk bersayap.[67][68] Bagaimanapun, Tennant, yang memiliki keuntungan dengan jumlah residu jauh lebih banyak, melanjutkan penelitiannya dan mengidentifikasi dua unsur yang sebelumnya tidak ditemukan dalam residu hitam, iridium dan osmium.[64][66] Ia memperoleh larutan kuning (kemungkinan cis–[Os(OH)2O4]2−) melalui reaksi dengan natrium hidroksida pada panas membara. Setelah pengasaman dia bisa mendistilasi OsO4 yang terbentuk.[67] Dia menamakannya osmium dari bahasa Yunani osme yang berarti "bau", karena bau abu dan bau asap osmium tetroksida yang mudah menguap.[69] Penemuan unsur baru ini didokumentasikan dalam sebuah surat kepada Royal Society pada tanggal 21 Juni 1804.[64][70]

Sintesis elemen 108 pertama kali dicoba pada tahun 1978 oleh tim peneliti Rusia yang dipimpin oleh Yuri Oganessian dan Vladimir Utyonkov di Joint Institute for Nuclear Research (JINR) di Dubna, menggunakan reaksi yang menghasilkan isotop hassium-270 dan hassium-264. Data tersebut tidak pasti dan mereka melakukan percobaan baru pada hassium lima tahun kemudian, di mana kedua isotop ini juga menghasilkan hassium-263; percobaan hassium-264 diulang kembali dan dikonfirmasi pada tahun 1984.[31]
Hassium resmi ditemukan pada tahun 1984 oleh kelompok peneliti Jerman yang dipimpin oleh Peter Armbruster dan Gottfried Münzenberg di GSI Helmholtz Centre for Heavy Ion Research (Gesellschaft für Schwerionenforschung, GSI) di Darmstadt. Para peneliti ini membombardir target timbal-208 dengan inti besi-58 yang dipercepat untuk menghasilkan 3 atom isotop hassium-265.[71]
Keterjadian

Besi telurik (bahasa Inggris: telluric iron) atau besi logam jarang dijumpai di permukaan bumi karena cenderung teroksidasi, tetapi oksidanya menyerap dan mewakili bijih utama. Sementara ia menyusun sekitar 5% dari kerak bumi, baik inti dalam dan luar bumi diyakini mengandung paduan besi-nikel dalam jumlah besar mencapai 35% dari massa bumi secara keseluruhan. Besi merupakan unsur yang paling melimpah di bumi, namun hanya unsur paling melimpah keempat di kerak bumi, setelah oksigen, silikon, dan aluminium.[72][73] Sebagian besar besi dalam kerak bumi ditemukan bergabung dengan oksigen seperti mineral besi oksida seperti hematit (Fe), magnetit (Fe), dan siderit (FeCO). Banyak batuan beku juga mengandung mineral sulfida pirhotit dan pentlandit.[74][75]
Sebagai unsur di urutan 74 kelimpahan dalam kerak bumi, rutenium relatif langka,[66] dijumpai hanya sekitar 100 bagian per triliun.[59] Unsur ini umumnya ditemukan dalam bijih bersama logam golongan platina lainnya di Pegunungan Ural dan di Amerika Utara dan Selatan. Jumlah kecil tetapi penting secara komersial juga ditemukan di pentlandit yang diekstraksi dari Sudbury, Ontario, Kanada, dan pada deposit piroksenit di Afrika Selatan. Bentuk asli rutenium adalah mineral yang sangat langka (Ir menggantikan sebagian Ru dalam strukturnya).[76][77]
Meskipun osmium adalah salah satu unsur bernomor genap, yang menempatkannya di bagian atas unsur yang biasa ditemukan di luar angkasa, osmium adalah unsur stabil paling sedikit di kerak bumi dengan fraksi massa rata-rata 50 bagian per triliun di kerak benua.[78]
Osmium ditemukan di alam sebagai unsur mandiri atau dalam paduan alami; terutama paduan iridium-osmium, osmiridium (kaya akan osmium), dan iridosmium (kaya akan iridium).[66] Pada deposit nikel dan tembaga, logam golongan platina terdapat sebagai sulfida (yaitu, (Pt,Pd)S)), telurida (misalnya, PtBiTe), antimonida (misalnya, PdSb), dan arsenida (misalnya, PtAs2); dalam semua senyawa ini platina ditukar dengan sejumlah kecil iridium dan osmium. Seperti halnya semua logam golongan platina, osmium dapat ditemukan secara alami pada paduan dengan nikel atau tembaga.[79]
Hassium tidak diketahui terjadi secara alami di Bumi; waktu paruh semua isotop yang diketahui cukup pendek sehingga tidak ada hassium primordial yang dapat bertahan sampai hari ini. Ini tidak mengesampingkan kemungkinan isotop tak diketahui yang berumur panjang atau isomer nuklir yang ada, beberapa di antaranya masih bisa ada dalam jumlah renik saat ini jika mereka berumur cukup lama. Pada awal 1960-an, diperkirakan bahwa isomer hassium yang berumur panjang dapat terjadi secara alami di Bumi dalam jumlah renik. Teori ini muncul untuk menjelaskan kerusakan radiasi ekstrem pada beberapa mineral yang tidak mungkin disebabkan oleh radioisotop alami yang diketahui, namun bisa disebabkan oleh unsur-unsur superberat.[31]
Pada tahun 1963, ilmuwan Uni Soviet Victor Cherdyntsev, yang sebelumnya mengklaim adanya curium-247 purba,[80] mengklaim telah menemukan unsur 108 (khususnya, isotop 267Hs, yang diperkirakan memiliki waktu paruh 400 sampai 500 juta tahun) dalam molibdenit alami dan menyarankan nama sergenium dengan lambang Sg[Catatan 4] sesuai nama kota kuno Serik di sepanjang Jalan Sutera di Kazakhstan tempat sampel molibdenitnya berasal.[31] Alasannya untuk mengklaim bahwa sergenium adalah homolog yang lebih berat dari osmium adalah bahwa mineral yang diduga mengandung sergenium membentuk oksida volatil ketika direbus dalam asam nitrat, serupa dengan osmium. Temuannya dikritik oleh V. M. Kulakov dengan alasan bahwa beberapa sifat yang diklaim Cherdyntsev dimiliki oleh sergenium tidak sesuai dengan fisika nuklir saat itu.[81]
Produksi
Produksi besi atau baja merupakan proses yang terdiri dari dua tahap utama. Pada tahap pertama bongkah besi diproduksi dalam tanur. Sebagai alternatif, bisa dilakukan reduksi langsung. Pada tahap kedua, bongkah besi diubah menjadi besi tempa, baja, atau besi cor.[82]


Untuk beberapa keperluan terbatas bila diperlukan, besi murni diproduksi di laboratorium dalam jumlah kecil dengan mereduksi oksida atau hidroksida murni dengan hidrogen, atau membentuk besi pentakarbonil dan memanaskannya sampai 250 °C sehingga terdekomposisi menjadi serbuk besi murni.[59] Metode lain adalah elektrolisis fero klorida pada katode besi.[83]
Sekitar 12 ton rutenium ditambang setiap tahunnya dengan cadangan dunia diperkirakan 5.000 ton.[66] Komposisi campuran logam golongan platina (platinum group metal, PGM) yang ditambang sangat bervariasi, tergantung pada formasi geokimia. Misalnya, PGM yang ditambang di Afrika Selatan mengandung rutenium rata-rata 11% sementara PGM yang ditambang di bekas Uni Sovyet hanya mengandung 2% (1992).[84][85] Rutenium, osmium, dan iridium dianggap sebagai minoritas dalam logam golongan platina.[4]
Osmium diperoleh secara komersial sebagai produk sampingan dari penambangan dan pengolahan nikel dan tembaga. Selama electrorefining tembaga dan nikel, logam mulia seperti perak, emas dan logam golongan platina, bersama dengan unsur non-logam seperti selenium dan telurium mengendap di bagian bawah sel sebagai lumpur anode, yang merupakan bahan awal untuk ekstraksi mereka.[86][87] Untuk memisahkan logam-logam tersebut, pertama-tama mereka harus dilarutkan. Tersedia beberapa metode tergantung pada proses pemisahan dan komposisi campuran; dua metode yang representatif adalah (1) dilebur dengan natrium peroksida yang diikuti dengan pelarutan dalam air raja, dan (2) pelarutan dalam campuran klorin dengan asam klorida.[88][89] Osmium, rutenium, rhodium dan iridium dapat dipisahkan dari platina, emas dan logam dasar berdasarkan ketaklarutannya dalam air raja, sebagai residu padat. Rhodium dapat dipisahkan dari residu dengan perlakuan menggunakan lelehan natrium bisulfat. Residu yang tidak larut, yang mengandung Ru, Os dan Ir, diberi perlakuan dengan natrium oksida, di mana Ir tidak larut, menghasilkan garam Ru dan Os yang larut dalam air. Setelah dioksidasi menjadi oksida volatil, RuO dipisahkan dari OsO dengan presipitasi (NH''"; menggunakan amonium klorida.
Aplikasi
Besi adalah logam yang paling banyak digunakan, terhitung lebih dari 90% produksi logam di seluruh dunia. UGSG memberikan produksi besi termasuk daur ulang dengan 998Mt, sedangkan aluminium (39Mt), tembaga (18Mt), seng (11Mt) dan timah (8.6Mt) menambahkan hingga 77 Mt, semuanya termasuk daur ulang. Ini lebih seperti 8% daripada 5. Biayanya yang rendah dan kekuatannya tinggi membuatnya sangat diperlukan dalam aplikasi teknik seperti konstruksi mesin dan peralatan mesin, mobil, lambung kapal besar, dan komponen struktural untuk bangunan. Oleh karena besi murni cukup lunak, besi paling sering dipadukan dengan unsur paduan untuk membuat baja.[90]
Karena mengeraskan paduan platina dan paladium, rutenium digunakan dalam sakelar listrik, di mana film tipis cukup untuk mencapai daya tahan yang diinginkan. Dengan sifat serupa dan biaya lebih rendah daripada rhodium,[91] sakelar listrik adalah penggunaan utama rutenium.[76][92] Pelat diaplikasikan ke logam dasar dengan cara penyepuhan elektrik (electroplating)[93] atau pembersitan (sputtering).[94]
Rutenium dioksida dengan timbal dan bismut ruthenat digunakan pada resistor chip film tebal.[95][96][97] Dua aplikasi elektronik ini menyumbang 50% konsumsi ruthenium.[66]
Osmium jarang digunakan dalam keadaan murni, karena oksidanya sangat volatil dan toksik, namun justru sering dipadu dengan logam lainnya. Paduan tersebut digunakan dalam aplikasi dengan berkeausan tinggi. Paduan osmium seperti osmiridium sangat keras dan, bersama logam golongan platina lainnya, digunakan di ujung pulpen, poros instrumen, dan sakelar, karena mereka dapat menahan keausan dari penggunaan masif. Mereka juga digunakan untuk ujung stilus fonograf era piringan hitam, sekitar tahun 1945 sampai 1955. Meskipun sangat awet dibandingkan dengan stilus baja dan kromium, ujung paduan osmium jauh lebih cepat aus, dan lebih mahal, daripada pesaingnya intan dan safir, sehingga pemakaiannya dihentikan.[98]
Pencegahan
Serbuk halus logam osmium bersifat piroporis[99] dan bereaksi dengan oksigen pada suhu ruang, membentuk osmium tetroksida yang mudah menguap. Beberapa senyawa osmium juga berubah menjadi tetroksida jika ada oksigen.[99] Hal ini membuat osmium tetroksida menjadi sumber kontak utama dengan lingkungan.
Osmium tetroksida sangat mudah menguap dan menembus kulit dengan mudah, dan sangat toksik jika terhirup, tertelan, dan terkena kulit.[100] Uap osmium tetroksida di udara pada konsentrasi rendah dapat menyebabkan kongesti paru-paru dan kerusakan kulit atau mata, dan karenanya harus digunakan di dalam lemari asam.[19] Osmium tetroksida cepat direduksi oleh minyak sayur tak jenuh ganda, seperti minyak jagung, menjadi senyawa yang relatif lembam (inert).[101]
Peran biologis
Dari empat unsur golongan 8, hanya besi yang diketahui memiliki peran biologis.

Besi merupakan nutrisi penting bagi semua organisme hidup, dari archaea hingga manusia. Ia merupakan komponen utama dalam hemoglobin, protein yang membuat darah merah dan mentransfer oksigen ke otot, dan juga ditemukan pada banyak protein lainnya. Rutenium, osmium, dan kalium tidak memiliki peran yang diketahui dalam tubuh manusia.
Besi terlibat dalam banyak proses biologis.[102][103] Ini adalah logam transisi terpenting di semua organisme hidup.[104] Protein besi dijumpai dalam seluruh organisme hidup: arkea, bakteri dan eukariota, termasuk manusia. Misalnya, warna darah disebabkan oleh hemoglobin, suatu protein yang mengandung besi. Seperti yang diilustrasikan oleh hemoglobin, besi seringkali terikat pada kofaktor, seperti heme, yang bukan senyawa protein dan sering melibatkan ion logam, yang diperlukan agar aktivitas biologi protein dapat berlangsung. Klaster besi-belerang bersifat pervasif dan termasuk nitrogenase, enzim yang bertanggung jawab untuk fiksasi nitrogen biologis. Peran utama protein yang mengandung besi adalah transportasi dan penyimpanan oksigen, selain transfer elektron.[104]
Besi adalah unsur renik yang penting yang dijumpai di hampir semua organisme hidup. Enzim dan protein yang mengandung zat besi, yang sering mengandung gugus prostetik heme, berpartisipasi dalam banyak oksidasi biologis dan transportasi. Contoh protein yang ditemukan pada organisme tingkat tinggi meliputi hemoglobin, sitokrom (lihat besi bervalensi tinggi), dan katalase.[105] Manusia dewasa rata-rata mengandung besi sebanyak 0,005% berat badan, atau sekitar empat gram, yang tiga perempatnya dalam bentuk hemoglobin – tingkat yang tetap konstant meskipun hanya menyerap satu miligram besi per hari,[104] karena tubuh manusia mendaur ulang hemoglobin untuk mendapatkan kembali besinya.[106]
Catatan
- ^ Jumlah energi yang dilepaskan ketika satu elektron ditambahkan pada atom atau molekul netral untuk membentuk ion negatif.
- ^ energi yang dibutuhkan untuk mengadhesi atom, molekul, atau ion dari gas, cairan, atau padatan terlarut pada permukaan
- ^ campuran asam klorida pekat dan asam nitrat pekat (3:1)
- ^ pada saat itu, lambang Sg belum digunakan untuk seaborgium
Referensi
- ^ a b Greenwood, Norman N.; Earnshaw, A. (1997), Chemistry of the Elements (edisi ke-2), Oxford: Butterworth-Heinemann, ISBN 0-7506-3365-4, pp. 27–28.
- ^ Greenwood and Earnshaw, p. 905
- ^ Greenwood and Earnshaw, p. 1070
- ^ a b Greenwood and Earnshaw, pp. 1074–5
- ^ Nam, Wonwoo (2007). "High-Valent Iron(IV)–Oxo Complexes of Heme and Non-Heme Ligands in Oxygenation Reactions". Accounts of Chemical Research. 40 (7): 522–531. doi:10.1021/ar700027f. PMID 17469792.
- ^ a b Holleman, Arnold F.; Wiberg, Egon; Wiberg, Nils (1985). "Iron". Lehrbuch der Anorganischen Chemie (dalam bahasa German) (edisi ke-91–100). Walter de Gruyter. hlm. 1125–1146. ISBN 3-11-007511-3.
- ^ Reiff, William Michael; Long, Gary J. (1984). "Mössbauer Spectroscopy and the Coordination Chemistry of Iron". Mössbauer spectroscopy applied to inorganic chemistry. Springer. hlm. 245–283. ISBN 978-0-306-41647-7.
- ^ Ware, Mike (1999). "An introduction in monochrome". Cyanotype: the history, science and art of photographic printing in Prussian blue. NMSI Trading Ltd. hlm. 11–19. ISBN 978-1-900747-07-3.
- ^ Gmelin, Leopold (1852). "Mercury and Iron". Hand-book of chemistry. 6. Cavendish Society. hlm. 128–129.
- ^ Cotton, Simon (1997). Chemistry of Precious Metals. Springer-Verlag New York, LLC. hlm. 1–20. ISBN 0-7514-0413-6.
- ^ "Iridium forms compound in +9 oxidation state".
- ^ Selig, H.; Claassen, H. H.; Chernick, C. L.; Malm, J. G.; et al. (1964). "Xenon tetroxide – Preparation + Some Properties". Science. 143 (3612): 1322–3. Bibcode:1964Sci...143.1322S. doi:10.1126/science.143.3612.1322. JSTOR 1713238. PMID 17799234.
- ^ Huston, J. L.; Studier, M. H.; Sloth, E. N. (1964). "Xenon tetroxide – Mass Spectrum". Science. 143 (3611): 1162–3. Bibcode:1964Sci...143.1161H. doi:10.1126/science.143.3611.1161-a. JSTOR 1712675. PMID 17833897.
- ^ Barnard, C. F. J. (2004). "Oxidation States of Ruthenium and Osmium". Platinum Metals Review. 48 (4): 157. doi:10.1595/147106704X10801.
- ^ "Chemistry of Hassium" (PDF). Gesellschaft für Schwerionenforschung mbH. 2002. Diakses tanggal 2007-01-31.
- ^ Gong, Yu; Zhou, Mingfei; Kaupp, Martin; Riedel, Sebastian (2009). "Formation and Characterization of the Iridium Tetroxide Molecule with Iridium in the Oxidation State +VIII". Angewandte Chemie International Edition. 48 (42): 7879. doi:10.1002/anie.200902733.
- ^ Krause, J.; Siriwardane, Upali; Salupo, Terese A.; Wermer, Joseph R.; et al. (1993). "Preparation of [Os3(CO)11]2− and its reactions with Os3(CO)12; structures of [Et4N] [HOs3(CO)11] and H2OsS4(CO)". Journal of Organometallic Chemistry. 454: 263–271. doi:10.1016/0022-328X(93)83250-Y.
- ^ Carter, Willie J.; Kelland, John W.; Okrasinski, Stanley J.; Warner, Keith E.; et al. (1982). "Mononuclear hydrido alkyl carbonyl complexes of osmium and their polynuclear derivatives". Inorganic Chemistry. 21 (11): 3955–3960. doi:10.1021/ic00141a019.
- ^ a b Mager Stellman, J. (1998). "Osmium". Encyclopaedia of Occupational Health and Safety. International Labour Organization. hlm. 63.34. ISBN 978-92-2-109816-4. OCLC 35279504.
- ^ Holleman, A. F.; Wiberg, E.; Wiberg, N. (2001). Inorganic Chemistry (edisi ke-1st). Academic Press. ISBN 0-12-352651-5. OCLC 47901436.
- ^ Griffith, W. P. (1965). "Osmium and its compounds". Quarterly Review of the Chemical Society. 19 (3): 254–273. doi:10.1039/QR9651900254.
- ^ Subcommittee on Platinum-Group Metals, Committee on Medical and Biologic Effects of Environmental Pollutants, Division of Medical Sciences, Assembly of Life Sciences, National Research Council (1977). Platinum-group metals. National Academy of Sciences. hlm. 55. ISBN 0-309-02640-7.
- ^ Griffith, W. P. (2008). "The Periodic Table and the Platinum Group Metals". Platinum Metals Review. 52 (2): 114–119. doi:10.1595/147106708X297486.
- ^ a b c d Hoffman, Darleane C.; Lee, Diana M.; Pershina, Valeria (2006). "Transactinides and the future elements". Dalam Morss; Edelstein, Norman M.; Fuger, Jean. The Chemistry of the Actinide and Transactinide Elements (edisi ke-3rd). Dordrecht, The Netherlands: Springer Science+Business Media. ISBN 1-4020-3555-1.
- ^ Element 108, hassium, Hs
- ^ a b Dullman, C.E. Superheavy Element Research Superheavy Element - News from GSI and Mainz. University Mainz
- ^ a b Düllmann, Ch. E.; Dressler, R.; Eichler, B.; Gäggeler, H. W.; Glaus, F.; Jost, D. T.; Piguet, D.; Soverna, S.; et al. (2003). "First chemical investigation of hassium (Hs, Z=108)". Czechoslovak Journal of Physics. 53 (1 Supplement): A291–A298. Bibcode:2003CzJPS..53A.291D. doi:10.1007/s10582-003-0037-4. Diakses tanggal 17 November 2012.
- ^ a b "Chemistry of Hassium" (PDF). Gesellschaft für Schwerionenforschung mbH. 2002. Diakses tanggal 2007-01-31.
- ^ a b Schädel, Matthias (2003). The Chemistry of Superheavy Elements. Springer. hlm. 269. ISBN 978-1402012501. Diakses tanggal November 17, 2012.
- ^ Barnard, C. F. J.; Bennett (2004). "Oxidation States of Ruthenium and Osmium". Platinum Metals Review. 48 (4): 157–158. doi:10.1595/147106704X10801.
- ^ a b c d e Emsley, John (2011). Nature's Building Blocks: An A-Z Guide to the Elements (edisi ke-New). New York, NY: Oxford University Press. hlm. 215–7. ISBN 978-0-19-960563-7.
- ^ Düllmann, Christoph E. (31 October 2008). "Investigation of group 8 metallocenes @ TASCA" (PDF). 7th Workshop on Recoil Separator for Superheavy Element Chemistry TASCA 08. Gesellschaft für Schwerionenforschung. Diakses tanggal 25 March 2013.
- ^ Yurii D. Perfiliev; Virender K. Sharma (2008). "Higher Oxidation States of Iron in Solid State: Synthesis and Their Mössbauer Characterization – Ferrates – ACS Symposium Series (ACS Publications)". Platinum Metals Review. 48 (4): 157–158. doi:10.1595/147106704X10801.
- ^ IUPAC, Compendium of Chemical Terminology, edisi ke-2 ("Buku Emas") (1997). Versi koreksi daring: (2006–) "Electron affinity".
- ^ Gutsev, Gennady L.; Khanna, S.; Rao, B.; Jena, P. (1999). "FeO4: A unique example of a closed-shell cluster mimicking a superhalogen". Physical Review A. 59 (5): 3681–3684. Bibcode:1999PhRvA..59.3681G. doi:10.1103/PhysRevA.59.3681.
- ^ Cotton, S. A. (1997). Chemistry of Precious Metals. London: Chapman and Hall. ISBN 978-0-7514-0413-5.
- ^ Martín, V. S.; Palazón, J. M.; Rodríguez, C. M.; Nevill, C. R. (2006). "Ruthenium(VIII) Oxide". Encyclopedia of Reagents for Organic Synthesis. doi:10.1002/047084289X.rr009.pub2. ISBN 0471936235.
- ^ Brown, G.M.; Butler, J.H. (1997), "New method for the characterization of domain morphology of polymer blends using ruthenium tetroxide staining and low voltage scanning electron microscopy (LVSEM)", Polymer, 38 (15): 3937–3945
- ^ Mager Stellman, J. (1998). "Osmium". Encyclopaedia of Occupational Health and Safety. International Labour Organization. hlm. 63.34. ISBN 978-92-2-109816-4. OCLC 35279504.
- ^ Housecroft, C. E.; Sharpe, A. G. (2004). Inorganic Chemistry (edisi ke-2nd). Prentice Hall. hlm. 671–673, 710. ISBN 978-0130399137.
- ^ Thompson, M. "Osmium tetroxide (OsO4)". Bristol University. Diakses tanggal 2012-04-07.
- ^ CALLISTO result
- ^ Pershina, V.; Anton, J.; Jacob, T. (18 September 2008). "Fully relativistic density-functional-theory calculations of the electronic structures of MO4 (M = Ru, Os, and element 108, Hs) and prediction of physisorption". Physical Review A. 78 (3). doi:10.1103/PhysRevA.78.032518. Diakses tanggal March 25, 2015.
- ^ Weeks, p.4
- ^ a b Weeks 1968, hlm. 29.
- ^ a b Weeks 1968, hlm. 31.
- ^ Bjorkman, Judith Kingston (1973). "Meteors and Meteorites in the ancient Near East". Meteoritics. 8: 91–132. doi:10.1111/j.1945-5100.1973.tb00146.x.
- ^ Daniela Comelli; Massimo D'orazio; Luigi Folco; Mahmud El-Halwagy; Tommaso Frizzi; Roberto Alberti; Valentina Capogrosso; Abdelrazek Elnaggar; Hala Hassan; Austin Nevin; Franco Porcelli; Mohamed G. Rashed; Gianluca Valentini (2016). "The meteoritic origin of Tutankhamun's iron dagger blade". Meteoritics & Planetary Science. 51: 1301–1309. doi:10.1111/maps.12664.
- ^ Walsh, Declan (2 June 2016). "King Tut's Dagger Made of 'Iron From the Sky,' Researchers Say". The New York Times. Diakses tanggal 4 June 2016.
... the blade's composition of iron, nickel and cobalt was an approximate match for a meteorite that landed in northern Egypt. The result "strongly suggests an extraterrestrial origin"
- ^ Ure, Andrew (1843). Technisches wörterbuch oder Handbuch der Gewerbskunde ... : Bearb. nach Dr. Andrew Ure's Dictionary of arts, manufactures and mines (dalam bahasa Jerman). G. Haase. hlm. 492.
- ^ a b Weeks 1968, hlm. 32.
- ^ McNutt, Paula (1990 1). The Forging of Israel: Iron Technology, Symbolism and Tradition in Ancient Society. A&C Black.
- ^ [1], Robert D. Whitaker, Journal of Chemical Education, 52, 10, 658–659, Oct 75
- ^ "New Metals in the Uralian Platina". The Philosophical Magazine. 2 (11): 391–392. 1827. doi:10.1080/14786442708674516.
- ^ a b c d e Pitchkov, V. N. (1996). "The Discovery of Ruthenium". Platinum Metals Review. 40 (4): 181–188.
- ^ Osann, Gottfried (1829). "Berichtigung, meine Untersuchung des uralschen Platins betreffend". Poggendorffs Annalen der Physik und Chemie. 15: 158.
- ^ Osann, Gottfried (1828). "Fortsetzung der Untersuchung des Platins vom Ural". Poggendorffs Annalen der Physik und Chemie. 14 (6): 329–257. Bibcode:1828AnP....89..283O. doi:10.1002/andp.18280890609. Kalimat asli di p. 339 adalah: "Da dieses Metall, welches ich nach den so eben beschriebenen Eigenschaften als ein neues glaube annehmen zu müssen, sich in größerer Menge als das früher erwähnte in dem uralschen Platin befindet, und auch durch seinen schönen, dem Golde ähnlichen metallischen Glanz sich mehr empfiehlt, so glaube ich, daß der Vorschlag, das zuerst aufgefundene neue Metall Ruthenium zu nennen, besser auf dieses angewendet werden könne."
- ^ Weeks, Mary Elvira (1932). "The discovery of the elements. VIII. The platinum metals". Journal of Chemical Education. 9 (6): 1017. Bibcode:1932JChEd...9.1017W. doi:10.1021/ed009p1017.
- ^ a b c Greenwood and Earnshaw, p. 1071
- ^ Karl Claus (1845). "О способе добывания чистой платины из руд". Горный журнал (Mining Journal) (dalam bahasa Russian). 7 (3): 157–163.
- ^ Venetskii, S. I. (1974). "Osmium". Metallurgist. 18 (2): 155–157. doi:10.1007/BF01132596.
- ^ McDonald, M. (959). "The Platinum of New Granada: Mining and Metallurgy in the Spanish Colonial Empire". Platinum Metals Review. 3 (4): 140–145.
- ^ Juan, J.; de Ulloa, A. (1748). Relación histórica del viage a la América Meridional (dalam bahasa Spanish). 1. hlm. 606.
- ^ a b c d e Hunt, L. B. (1987). "A History of Iridium" (PDF). Platinum Metals Review. 31 (1): 32–41. Diakses tanggal 2012-03-15.
- ^ Haubrichs, Rolf; Zaffalon, Pierre-Leonard (2017). "Osmium vs. 'Ptène': The Naming of the Densest Metal". Johnson Matthey Technology Review. 61. doi:10.1595/205651317x695631.
- ^ a b c d e f Emsley, J. (2003). "Ruthenium". Nature's Building Blocks: An A-Z Guide to the Elements. Oxford, England, UK: Oxford University Press. hlm. 368–370. ISBN 0-19-850340-7.
- ^ a b Griffith, W. P. (2004). "Bicentenary of Four Platinum Group Metals. Part II: Osmium and iridium – events surrounding their discoveries". Platinum Metals Review. 48 (4): 182–189. doi:10.1595/147106704X4844.
- ^ Thomson, T. (1831). A System of Chemistry of Inorganic Bodies. Baldwin & Cradock, London; and William Blackwood, Edinburgh. hlm. 693.
- ^ Weeks, M. E. (1968). Discovery of the Elements (edisi ke-7). Journal of Chemical Education. hlm. 414–418. ISBN 0-8486-8579-2. OCLC 23991202.
- ^ Tennant, S. (1804). "On Two Metals, Found in the Black Powder Remaining after the Solution of Platina". Philosophical Transactions of the Royal Society. 94: 411–418. doi:10.1098/rstl.1804.0018. JSTOR 107152.
- ^ Münzenberg, G.; Armbruster, P.; Folger, H.; Heßberger, F. P.; Hofmann, S.; Keller, J.; Poppensieker, K.; Reisdorf, W.; Schmidt, K.-H.; et al. (1984). "The identification of element 108" (PDF). Zeitschrift für Physik A. 317 (2): 235–236. Bibcode:1984ZPhyA.317..235M. doi:10.1007/BF01421260. Diakses tanggal 20 October 2012.
- ^ "Iron: geological information". WebElements. Diakses tanggal 23 May 2010.
- ^ John W. Morgan & Edward Anders (1980). "Chemical composition of Earth, Venus, and Mercury". Proc. Natl. Acad. Sci. 77 (12): 6973–6977. Bibcode:1980PNAS...77.6973M. doi:10.1073/pnas.77.12.6973. PMC 350422
 . PMID 16592930.
. PMID 16592930.
- ^ "Pyrrhotite". Mindat.org. Diakses tanggal 2009-07-07.
- ^ Klein, Cornelis; Cornelius, S. Hurlbut, Jr. (1985), Manual of Mineralogy (edisi ke-20th), Wiley, hlm. 278–9, ISBN 0-471-80580-7
- ^ a b George, Micheal W. "2006 Minerals Yearbook: Platinum-Group Metals" (PDF). United States Geological Survey USGS. Diakses tanggal 2008-09-16.
- ^ "Commodity Report: Platinum-Group Metals" (PDF). United States Geological Survey USGS. Diakses tanggal 2008-09-16.
- ^ Wedepohl, Hans K (1995). "The composition of the continental crust". Geochimica et Cosmochimica Acta. 59 (7): 1217–1232. Bibcode:1995GeCoA..59.1217W. doi:10.1016/0016-7037(95)00038-2.
- ^ Xiao, Z.; Laplante, A. R. (2004). "Characterizing and recovering the platinum group minerals—a review". Minerals Engineering. 17 (9–10): 961–979. doi:10.1016/j.mineng.2004.04.001.
- ^ Cherdyntsev, V. V.; Mikhailov, V. F. (1963). "The Primordial Transuranium Isotope in Nature". Geokhimiya. 1: 3–14. Diakses tanggal 10 August 2013.
- ^ Kulakov, V. M. (1970). "Has element 108 been discovered?". Soviet Atomic Energy. 29 (5): 1166–8. doi:10.1007/BF01666716.
- ^ Greenwood and Earnshaw, p. 1073
- ^ Lux, H. (1963), "Metallic Iron", dalam G. Brauer, Handbook of Preparative Inorganic Chemistry, 2 (edisi ke-2nd), NY: Academic Press, hlm. 1490–1
- ^ Hartman, H. L.; Britton, S. G., ed. (1992). SME mining engineering handbook. Littleton, Colo.: Society for Mining, Metallurgy, and Exploration. hlm. 69. ISBN 978-0-87335-100-3.
- ^ Harris, Donald C.; Cabri, L. J. (1973). "The nomenclature of the natural alloys of osmium, iridium and ruthenium based on new compositional data of alloys from world-wide occurrences". The Canadian Mineralogist. 12 (2): 104–112.
- ^ George, M. W. (2008). "Platinum-group metals" (PDF). U.S. Geological Survey Mineral Commodity Summaries. USGS Mineral Resources Program.
- ^ George, M. W. 2006 Minerals Yearbook: Platinum-Group Metals (PDF). United States Geological Survey USGS. Diakses tanggal 2008-09-16.
- ^ Seymour, R. J.; O'Farrelly, J. I. (2001). "Platinum-group metals". Kirk Othmer Encyclopedia of Chemical Technology. Wiley. doi:10.1002/0471238961.1612012019052513.a01.pub2.
- ^ Renner, H.; Schlamp, G.; Kleinwächter, I.; Drost, E.; et al. (2002). "Platinum group metals and compounds". Ullmann's Encyclopedia of Industrial Chemistry. Wiley. doi:10.1002/14356007.a21_075.
- ^ Greenwood and Earnshaw, pp. 1070–1
- ^ Hunt, L. B.; Lever, F. M. (1969). "Platinum Metals: A Survey of Productive Resources to industrial Uses" (PDF). Platinum Metals Review. 13 (4): 126–138.
- ^ Rao, C; Trivedi, D. (2005). "Chemical and electrochemical depositions of platinum group metals and their applications". Coordination Chemistry Reviews. 249 (5–6): 613. doi:10.1016/j.ccr.2004.08.015.
- ^ Weisberg, A (1999). "Ruthenium plating". Metal Finishing. 97: 297. doi:10.1016/S0026-0576(00)83089-5.
- ^ Prepared under the direction of the ASM International Handbook Committee; Merrill L. Minges, technical chairman (1989). Electronic materials handbook. Materials Park, OH: ASM International. hlm. 184. ISBN 978-0-87170-285-2.
- ^ Busana, M. G.; Prudenziati, M.; Hormadaly, J. (2006). "Microstructure development and electrical properties of RuO2-based lead-free thick film resistors". Journal of Materials Science: Materials in Electronics. 17 (11): 951. doi:10.1007/s10854-006-0036-x.
- ^ Rane, Sunit; Prudenziati, Maria; Morten, Bruno (2007). "Environment friendly perovskite ruthenate based thick film resistors". Materials Letters. 61 (2): 595. doi:10.1016/j.matlet.2006.05.015.
- ^ Slade, Paul G., ed. (1999). Electrical contacts : principles and applications. New York, NY: Dekker. hlm. 184, 345. ISBN 978-0-8247-1934-0.
- ^ Stephen D. Cramer & Bernard S. Covino, Jr. (2005). ASM Handbook Volume 13B. Corrosion: Materials. ASM International. ISBN 978-0-87170-707-9.
- ^ a b Smith, Ivan C.; Carson, Bonnie L.; Ferguson, Thomas L. (1974). "Osmium: An Appraisal of Environmental Exposure". Environmental Health Perspectives. 8: 201–213. doi:10.2307/3428200. JSTOR 3428200. PMC 1474945
 . PMID 4470919.
. PMID 4470919.
- ^ Luttrell, William E.; Giles, Cory B. (2007). "Toxic tips: Osmium tetroxide". Journal of Chemical Health and Safety. 14 (5): 40–41. doi:10.1016/j.jchas.2007.07.003.
- ^ "How to Handle Osmium Tetroxide". University of California, San Diego. Diarsipkan dari versi asli tanggal February 21, 2006. Diakses tanggal 2009-06-02.
- ^ Dlouhy, Adrienne C.; Outten, Caryn E. (2013). Banci, Lucia, ed. Metallomics and the Cell. Metal Ions in Life Sciences. 12. Springer. doi:10.1007/978-94-007-5561-1_8. ISBN 978-94-007-5560-4. electronic-book ISBN 978-94-007-5561-1 ISSN 1559-0836 electronic-ISSN 1868-0402
- ^ Yee, Gereon M.; Tolman, William B. (2015). Peter M.H. Kroneck; Martha E. Sosa Torres, ed. Sustaining Life on Planet Earth: Metalloenzymes Mastering Dioxygen and Other Chewy Gases. Metal Ions in Life Sciences. 15. Springer. hlm. 131–204. doi:10.1007/978-3-319-12415-5_5.
- ^ a b c Greenwood and Earnshaw, pp. 1098–1104
- ^ Lippard, S. J.; Berg, J. M. (1994). Principles of Bioinorganic Chemistry. Mill Valley: University Science Books. ISBN 0-935702-73-3.
- ^ Kikuchi, G.; Yoshida, T.; Noguchi, M. (2005). "Heme oxygenase and heme degradation". Biochemical and Biophysical Research Communications. 338 (1): 558–567. doi:10.1016/j.bbrc.2005.08.020. PMID 16115609.
| (besar) | |||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | ||||||||||||||||
| 1 | H | He | |||||||||||||||||||||||||||||||
| 2 | Li | Be | B | C | N | O | F | Ne | |||||||||||||||||||||||||
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar | |||||||||||||||||||||||||
| 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | |||||||||||||||
| 5 | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | |||||||||||||||
| 6 | Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | |
| 7 | Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | |
|
| |||||||||||||||||||||||||||||||||



