Amonium besi(II) sulfat
| |

| |
| Nama | |
|---|---|
| Nama IUPAC
Amonium besi(II) sulfat
| |
| Nama lain
Fero amonium sulfat
Amonium besi sulfat Garam Mohr | |
| Penanda | |
| |
Model 3D (JSmol)
|
|
| 3DMet | {{{3DMet}}} |
| ChEBI |
|
| ChemSpider | |
| Nomor EC | |
PubChem CID
|
|
| Nomor RTECS | {{{value}}} |
| UNII |
|
CompTox Dashboard (EPA)
|
|
| |
| |
| Sifat | |
| Fe(SO4)(NH4)2(SO4) (anhidrat) Fe(SO4)(NH4)2(SO4)·6H2O (heksahidrat) | |
| Massa molar | 284,05 g mol−1 (anhidrat) 392,14 g mol−1 (heksahidrat) |
| Penampilan | Padatan biru kehijauan |
| Densitas | 1,86 g/cm3 |
| Titik lebur | 100 hingga 110 °C (212 hingga 230 °F; 373 hingga 383 K) |
| Titik didih | Tak dapat diterapkan |
| 269 g/L (heksahidrat) | |
| Bahaya | |
| Lembar data keselamatan | Fisher MSDS |
| Piktogram GHS | 
|
| Keterangan bahaya GHS | {{{value}}} |
| H315, H319, H335 | |
| P261, P264, P271, P280, P302+352, P304+340, P305+351+338, P312, P321, P332+313, P337+313, P362, P403+233, P405, P501 | |
| Senyawa terkait | |
Senyawa terkait
|
Amonium besi(III) sulfat |
Kecuali dinyatakan lain, data di atas berlaku pada suhu dan tekanan standar (25 °C [77 °F], 100 kPa). | |
| Referensi | |
Amonium besi(II) sulfat, atau garam Mohr, adalah senyawa anorganik dengan rumus (NH4)2Fe(SO4)2(H2O)6. Mengandung dua kation berbeda, Fe2+ dan NH+
4, ia diklasifikasikan sebagai garam ganda dari fero sulfat dan amonium sulfat. Ia adalah reagen laboratorium yang umum karena mudah mengkristal, dan kristal itu menolak oksidasi oleh udara. Seperti garam fero sulfat lainnya, fero amonium sulfat dapat larut dalam air dan menghasilkan kompleks akuo [Fe(H2O)6]2+, yang memiliki geometri molekul oktahedral.[1] Bentuk mineralnya adalah mohrit.
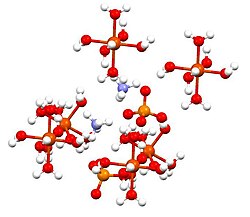
Struktur[sunting | sunting sumber]
Senyawa ini merupakan anggota kelompok sulfat ganda yang disebut Schönit atau garam Tutton. Garam Tutton membentuk kristal monoklinik dan mempunyai rumus M2N(SO4)2·6H2O (M = berbagai monokation). Mengenai ikatannya, kristal terdiri dari pusat [Fe(H2O)6]2+ berbentuk oktahedra, yang memiliki ikatan hidrogen pada sulfat dan amonium.[2]

Nama garam Mohr diambil dari nama ahli kimia Jerman Karl F. Mohr, yang membuat banyak kemajuan penting dalam metodologi titrasi pada abad ke-19.
Aplikasi[sunting | sunting sumber]
Dalam kimia analisis, garam ini merupakan sumber ion fero yang disukai karena padatan ini memiliki umur simpan yang lama dan tahan terhadap oksidasi. Stabilitas ini meluas pada larutan yang mencerminkan pengaruh pH pada pasangan redoks fero–feri. Oksidasi ini lebih mudah terjadi pada pH tinggi. Ion amonium membuat larutan garam Mohr menjadi sedikit asam, sehingga memperlambat proses oksidasi.[1][3] Asam sulfat biasanya ditambahkan ke larutan untuk mengurangi oksidasi menjadi besi feri.
Ia digunakan dalam dosimeter Fricke untuk mengukur sinar gama dosis tinggi.[4]
Pembuatan[sunting | sunting sumber]
Garam Mohr dibuat dengan melarutkan campuran ekuimolar fero sulfat terhidrasi dan amonium sulfat dalam air yang mengandung sedikit asam sulfat, dan kemudian larutan yang dihasilkan dikristalisasikan. Fero amonium sulfat membentuk kristal berwarna hijau muda. Garam ini, ketika dipanaskan, terionisasi menghasilkan semua kation dan anion yang ada di dalamnya.
Kontaminan[sunting | sunting sumber]
Pengotor yang umum meliputi magnesium, nikel, mangan, timbal, dan seng, banyak di antaranya membentuk garam isomorf.[5]
Referensi[sunting | sunting sumber]
- ^ a b Greenwood, Norman N.; Earnshaw, A. (1997), Chemistry of the Elements (edisi ke-2), Oxford: Butterworth-Heinemann, ISBN 0-7506-3365-4
- ^ Ephraim, Fritz (1926). Inorganic Chemistry. tr P. C. L. Thorne. London: Gurney and Jackson. hlm. 484–485.
- ^ "Ammonium Ferrous Sulphate 100 g (Mohr's Salt)". 2012. Diakses tanggal 29 Desember 2023.
- ^ Hickman, C.; Lorrain, S.; Barthe, J.R.; Portal, G. (1986). "Use of Mohr's Salt for High Level Gamma Dosimetry (Up to 108 Gy)". Radiation Protection Dosimetry. Oxford Journals. 17 (1–4): 255–257. doi:10.1093/oxfordjournals.rpd.a079818.
- ^ Vogel, Arthur I. (1961). A Text-book of Quantitative Inorganic Analysis Including Elementary Instrumental Analysis (edisi ke-3). Longmans. hlm. 281–282.
