Keton
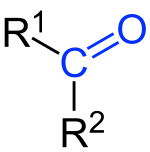
Keton bisa berarti gugus fungsi yang dikarakterisasikan oleh sebuah gugus fungsi karbonil (O=C) yang terhubung dengan dua atom karbon ataupun senyawa kimia yang mengandung gugus karbonil. Keton memiliki rumus umum:
Senyawa karbonil yang berikatan dengan dua karbon membedakan keton dari asam karboksilat, aldehida, ester, amida, dan senyawa-senyawa beroksigen lainnya. Ikatan ganda gugus karbonil membedakan keton dari alkohol dan eter. Keton yang paling sederhana adalah aseton (secara sistematis dinamakan 2-propanon).
Atom karbon yang berada di samping gugus karbonil dinamakan karbon-α. Hidrogen yang melekat pada karbon ini dinamakan hidrogen-α. Dengan keberadaan asam katalis, keton mengalami tautomerisme keto-enol. Reaksi dengan basa kuat menghasilkan enolat.
Tata nama
[sunting | sunting sumber]Secara umum, keton dinamakan dengan tatanama IUPAC dengan menggantikan sufiks -a pada alkana induk dengan -on. Untuk keton yang umumnya dijumpai, nama-nama tradisional digunakan, seperti pada aseton dan benzofenon, nama-nama ini dianggap sebagai nama IUPAC yang dipertahankan [1] walaupun beberapa buku kimia menggunakan nama propanon.
Okso adalah tata nama IUPAC resmi untuk gugus fungsi keton. Namun prefiks lainnya juga digunakan dalam berbeagai buku dan jurnal. Untuk senyawa-senyawa yang umum (terutama pada biokimia), keto atau okso adalah istilah yang digunakan untuk menjelaskan gugus fungsi keton (juga dikenal dengan nama alkanon). Okso juga merujuk pada atom oksigen tunggal yang berkoordinasi dengan logam transisi (okso logam).
Sifat-sifat fisika
[sunting | sunting sumber]
Gugus karbonil bersifat polar, sehingga mengakibatkan senyawa keton polar. Gugus karbonil akan berinteraksi dengan air melalui ikatan hidrogen, sehingga keton larut dalam air. Ia merupakan akseptor ikatan hidrogen, dan bukannya donor, sehingga ia tidak akan membentuk ikatan hidrogen dengan dirinya sendiri. Hal ini membuat keton lebih mudah menguap daripada alkohol dan asam karboksilat.
Pengelompokan keton
[sunting | sunting sumber]Keton dikelompokkan berdasarkan substituen mereka. Salah satu klasifikasi keton membagi senyawa ini menjadi keton simetris dan keton tidak simetris tergantung dari kemungkinan 2 substituen organik bergabung ke pusat karbonil. Aseton dan benzofenon (C6H5C(O)C6H5) termasuk keton simetris. Asetofenon (C6H5C(O)CH3) adalah contoh keton tidak simetris. Di ilmu stereokimia, keton tidak simetris dikenal karena bersifat prokiral.
Keasaman
[sunting | sunting sumber]Hidrogen-α keton lebih asam (pKa ≈ 20) daripada hidrogen alkana biasa (pKa ≈ 50). Hal ini disebabkan oleh stabilisasi resonansi ion enolat yang terbentuk ketika berdisosiasi. Keasaman relatif hidrogen-α sangatlah penting dalam reaksi enolisasi keton dan senyawa karbonil lainnya.
Sifat-sifat spektroskopi
[sunting | sunting sumber]Spektroskopi adalah salah satu cara yang penting untuk mengidentifikasi keton. Keton dan aldehida akan menunjuukkan puncak yang signifikan pada spektroskopi inframerah di sekitar 1700 cm−1 (agak tinggi atau rendah, bergantung pada lingkungan kimiawi)
Sintesis
[sunting | sunting sumber]Terdapat beberapa metode untuk pembuatan keton dalam laboratorium:
- Keton dapat dihasilkan dengan oksidasi alkohol sekunder. Proses ini memerlukan oksidator kuat seperto kalium permanganat, kalium dikromat, atau senyawa lain yang mengandung Cr(VI). Alkohol dioksidasi dengan pemanasan refluks pada larutan asam. Sebagai contoh, 2-propanol dioksidasi menjadi aseton.
- H3C-CH(OH)-CH3 → H3C-CO-CH3
- Dua atom hidrogen dilepas, menjadikan atom oksigen berikatan ganda dengan atom karbon.
- Keton juga bisa dihasilkan dari hidrolisi halida gem.
- Alkuna dapat diubah menjadi enol melalui reaksi hidrasi dengan keberadaan asam dan HgSO4. Tautomerisme enol-keto enol yang dihasilkan akan menghasilkan keton. Reaksi ini akan selalu menghasilkan keton, bahkan untuk alkuna terminal, dan Sia2BH diperlukan apabila diinginkan aldehida.
- Keton aromatik dapat dibuat dengan reaksi Friedel-Crafts, reaksi Houben-Hoesch dan penataan ulang Fries.
- Pada penataan ulang Kornblum–DeLaMare keton dibuat dari peroksida dan basa.
- Pada siklisasi Ruzicka, keton siklik dibuat dari asam dikarboksilat.
- Pada reaksi Nef, keton terbentuk dari hidrolisis garam dari senyawa nitro.
- Pada penggandengan Fukuyama, keton terbentuk dari tioester dengan sebuah senyawa organoseng.
- Keton juga dibuat dari reaksi asil klorida dengan senyawa organolitium atau senyawa organotembaga
- Reaksi Dakin–West menjadi metode efisien untuk membentuk metil keton tertentu dari asam karboksila.[2]
Reaksi
[sunting | sunting sumber]Keton terlibat dalam berbagai macam reaksi organik:
- Adisi nukleofilik. Reaksi keton dengan nukleofil menghasilkan senyawa adisi karbonil tetrahedral.
- reaksi dengan anion alkuna terminal menghasilkan hidroksialkuna
- reaksi dengan amonia atau amina primer menghasilkan imina dan air
- reaksi dengan amina sekunder menghasilkan enamina dan air
- reaksi dengan reagen Grignard menghasilkan magnesium alkoksida dan setelahnya alkohol tersier
- reaksi dengan reagen organolitium juga menghasilkan alkohol tersier
- reaksi dengan alkohol, asam atau basa menghasilkan hemiketal dan air, reaksi lebih jauh menghasilkan ketal dan air. Ini adalah bagian dari reaksi pelindung karbonil.
- reaksi RCOR' dengan natrium amida menghasilkan pembelahan dengan pembentukan amida RCONH2 dan alkana R'H, reaksi ini dikenal sebagai reaksi Haller-Bauer (1909) [3]
- Adisi elektrofilik, reaksi dengan sebuah elektrofil menghasilkan kation yang distabilisasi oleh resonansi.
- reaksi dengan ilida fosfonium pada reaksi Witting menghasilkan alkena
- reaksi dengan air menghasilkan diol geminal
- reaksi dengan tiol menghasilkan tioasetal
- reaksi dengan hidrazina atau turunan hidrazina menghasilkan hidrazon
- reaksi dengan logam hidrida menghasilkan logam alkoksida, kemudian dengan air menghasilkan alkohol
- reaksi enol dengan halogen menghasilkan haloketon-α
- reaksi pada karbon-α keton dengan air berat menghasilkan keton-d berdeuterium
- fragmentasi pada fotokimia reaksi Norrish
- reaksi dengan halogen dan basa metil keton pada reaksi haloform
- reaksi 1,4-aminodiketon menjadi oksazola dengan hidrasi pada sintesis Robinson-Gabriel
- reaksi aril alkil keton dengan sulfur dan amina menghasilkan amida pada reaksi Willgerodt
Aplikasi
[sunting | sunting sumber]Keton sering digunakan pada parfum dan cat untuk menstabilisasi ramuan lainnya sehingga tidak berdegradasi dengan cepat. Kegunaan lainnya adalah sebagai pelarut dan zat antara dalam industri kimia.
Lihat pula
[sunting | sunting sumber]- Ketosis
- Jasad keton (Istilah medis yang merujuk pada semua atau salah satu dari tiga keton yang terdapat pada tubuh).
Referensi
[sunting | sunting sumber]- ^ List of retained IUPAC names retained IUPAC names Link
- ^ Wiley, Richard H.; Borum, O. H. (1953). "3-Acetamido-2-butanone". Organic Syntheses. 33: 1. doi:10.15227/orgsyn.033.0001.
- ^ "Haller-Bauer Reaction". Diarsipkan dari versi asli tanggal 2007-09-10. Diakses tanggal 2008-07-09.


