Asil klorida
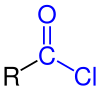
Dalam kimia organik, asil klorida (atau asam klorida) adalah senyawa organik dengan gugus fungsi -COCl. Rumusnya biasanya ditulis RCOCl, di mana R adalah rantai samping. Mereka adalah turunan reaktif dari asam karboksilat. Contoh spesifik dari asil klorida adalah asetil klorida, CH3COCl. Asil klorida adalah bagian terpenting dari asil halida.
Nomenklatur[sunting | sunting sumber]
Dimana bagian asil klorida diprioritaskan, asil klorida diberi nama dengan mengambil nama asam karboksilat induk, dan menggantikan -il klorida untuk -asam ic. Jadi:
- asetil klorida CH3COCl :benzoil klorida C6H5COCl Ketika gugus fungsi lain diprioritaskan, asil klorida dianggap sebagai awalan — chlorocarbonyl-:[1] :(klorokarbonil) asam asetat ClOCCH2COOH
Properti[sunting | sunting sumber]
Karena tidak memiliki kemampuan untuk membentuk ikatan hidrogen, asil klorida memiliki titik didih dan titik leleh yang lebih rendah daripada asam karboksilat yang serupa. Misalnya, asam asetat mendidih pada suhu 118 °C, sedangkan asetil klorida mendidih pada suhu 51 °C. Seperti kebanyakan senyawa karbonil, spektroskopi inframerah mengungkapkan pita dekat 1750 cm−1. Asil klorida stabil yang paling sederhana adalah asetil klorida; formil klorida tidak stabil pada suhu kamar, meskipun dapat dibuat pada -60 °C atau di bawahnya.[2][3] Asil klorida terhidrolisis (bereaksi dengan air).

Sintesis[sunting | sunting sumber]
Rute industri[sunting | sunting sumber]
Rute industri ke asetil klorida melibatkan reaksi asetat anhidrida dengan hidrogen klorida:[5] :(CH3CO)2O + HCl → CH3COCl + CH3CO2 Propionil klorida diproduksi dengan klorinasi asam propionat dengan fosgen:[6] :CH3CH2CO2H + COCl2 → CH3CH 2COCl + HCl + CO2 Benzoil klorida diproduksi dengan hidrolisis parsial benzotriklorida:[7] :C6H5CCl3 + H2O → C6H 5C(O)Cl + 2 HCl Demikian pula, benzotriklorida bereaksi dengan asam karboksilat menjadi asam klorida. Konversi ini dilakukan untuk reaksi 1,4-bis(triklorometil)benzena menghasilkan terefthaloil klorida: : C6H4(CCl3)2 + C6H< sub>4(CO2H)2 → 2 C6H4(COCl) 2 + 2 HCl
Metode laboratorium: tionil klorida[sunting | sunting sumber]
Di laboratorium, asil klorida umumnya dibuat dengan mengolah asam karboksilat dengan tionil klorida (SOCl2).[8] Reaksi dikatalisis oleh dimethylformamide dan zat aditif lainnya.[9]

Tionil klorida[10] adalah reagen yang cocok karena produk sampingnya (HCl, SO2) adalah gas dan residu tionil klorida dapat dengan mudah dihilangkan sebagai akibat titik didihnya yang rendah (76 °C). Reaksi dengan tionil klorida dikatalisis oleh dimethylformamide.[11]
Metode laboratorium: fosfor klorida[sunting | sunting sumber]
Fosfor triklorida (PCl3) juga populer,[12] fosfor pentaklorida (PCl5< /sub>).[13][14] meskipun reagen berlebih diperlukan.[9] Fosfor pentaklorida juga efektif tetapi hanya satu klorida yang ditransfer: ::RCO2H + PCl5 → RCOCl + POCl3 + HCl
Metode laboratorium: oksalil klorida[sunting | sunting sumber]
Metode lain melibatkan penggunaan oksalil klorida: :RCO2H + ClCOCOCl → RCOCl + CO + CO2 + HCl Reaksi dikatalisis oleh dimetilformamida (DMF), yang bereaksi dengan oksalil klorida pada langkah pertama untuk menghasilkan zat antara iminium, yang bereaksi dengan asam karboksilat, mengabstraksi oksida, dan meregenerasi katalis DMF.[11] Relatif untuk tionil klorida, oksalil klorida lebih mahal tetapi juga reagen yang lebih ringan dan karena itu lebih selektif.
Metode laboratorium lainnya[sunting | sunting sumber]
Klorida asam dapat digunakan sebagai sumber klorida.[15] Jadi asetil klorida dapat didestilasi dari campuran benzoil klorida dan asam asetat:[9] :CH3CO2H + C6H5COCl → CH3 COCl + C6H5CO2H Metode lain yang tidak membentuk HCl termasuk Reaksi Appel:[16] :RCO2H + Ph3P + CCl4 → RCOCl + Ph3PO + HCCl 3 Lain adalah penggunaan sianurat klorida:[17] :RCO2H + C3N3Cl3 → RCOCl + C3N3Cl2OH
Reaksi[sunting | sunting sumber]
Asil klorida adalah reaktif, reagen serbaguna.[18] Asil klorida memiliki reaktivitas yang lebih besar daripada karboksilat lainnya turunan asam seperti asam anhidrida, esters atau amida:
Reaksi Nukleofilik[sunting | sunting sumber]
Klorida asam berguna untuk pembuatan amida, ester, anhidrida. Reaksi-reaksi ini menghasilkan klorida, yang mungkin tidak diinginkan. Asil klorida terhidrolisis, menghasilkan asam karboksilat:
Hidrolisis ini biasanya mengganggu daripada disengaja. Asil klorida digunakan untuk membuat asam anhidrida, amida dan esters, dengan mereaksikan klorida asam dengan: garam dari asam karboksilat, sebuah amina , atau alkohol, masing-masing.
Mekanisme[sunting | sunting sumber]
Alkoholisis asil halida (alkoxy-dehalogenation) diyakini berlangsung melalui mekanisme SN2 (Skema 10).[19] Namun, mekanismenya juga bisa tetrahedral atau SN1 dalam pelarut yang sangat polar[20] (sementara reaksi SN2 melibatkan reaksi terpadu, jalur adisi-eliminasi tetrahedral melibatkan perantara yang dapat dilihat).[21]
Basis, mis. piridin atau N,N-dimetilformamida, mengkatalisis asilasi.[11][14] Reagen ini mengaktifkan asil klorida melalui mekanisme katalisis nukleofilik. Amina menyerang ikatan karbonil dan diduga[22] pertama-tama membentuk zat antara tetrahedral sementara dan setelah itu, dengan perpindahan gugus pergi, garam acylammonium kuaterner. Garam acylammonium kuaterner ini lebih rentan terhadap serangan alkohol atau nukleofil lainnya.
Penggunaan dua fase (berair untuk amina, organik untuk asil klorida) disebut reaksi Schotten-Baumann. Pendekatan ini digunakan dalam persiapan nilon melalui apa yang disebut trik tali nilon.[23]).
Bahaya[sunting | sunting sumber]
Asil klorida dengan berat molekul rendah sering lachrymators, dan mereka bereaksi hebat dengan air, alkohol, dan amina.
Referensi[sunting | sunting sumber]
- ^ Nomenklatur Kimia Organik, .htm R-5.7.6 Asam halida[pranala nonaktif permanen]
- ^ Sih, John C. (2001-04-15), "Formyl Chloride", dalam John Wiley & Sons, Ltd, Encyclopedia of Reagents for Organic Synthesis (dalam bahasa Inggris), John Wiley & Sons, Ltd, doi:10.1002/047084289x.rf026, ISBN 9780471936237
- ^ Richard OC Norman; James M. Coxon (16 September 1993). Principles of Organic Synthesis, Edisi ke-3. CRC Press. hlm. 371. ISBN 978-0-7487-6162-3.
- ^ Wang, Hong-Yong; Xie, Min-Hao; Luo, Shi-Neng; Zou, Pei; Liu, Ya-Ling (2009). "3,5-Dinitrobenzoyl chloride". Acta Crystallographica Section E. 65 (10): o2460. doi:10.1107/S1600536809036228. PMC 2970283
 . PMID 21577915.
. PMID 21577915.
- ^ Templat:Referensi paten AS
- ^ Sama, Ulf-Rainer; Kohler, Walter; Gamer, Armin Otto; Keuser, Ullrich (2005), "Asam propionat dan turunannya", Ullmann's Encyclopedia of Industrial Chemistry, Weinheim: Wiley-VCH, doi:10.1002/14356007.a22_223
- ^ Maki, Takao; Takeda, Kazuo (2005), "Asam benzoat dan turunannya", Ullmann's Encyclopedia of Industrial Chemistry, Weinheim: Wiley-VCH, doi:10.1002/14356007.a03_555
- ^ Helferich, B.; Schaefer, W. "n-Butir klorida". Sintesis Organik. 9: 32. doi:10.15227/orgsyn.009.0032.
- ^ a b c Martin Ansell (1972). "Pembuatan asil halida". Dalam Saul Patai. Asil Halida. Kimia Gugus Fungsi PATAI. hlm. 35–68. doi:10.1002/978047071273.ch2. ISBN 9780470771273.
- ^ J. S. Pizey, Reagen Sintetis, Vol. 1, Halsted Press, New York, 1974.
- ^ a b c Clayden, Jonathan. Kimia organik
 . Oxford: Oxford University Press. hlm. 276–296. ISBN 0-19-850346-6.
. Oxford: Oxford University Press. hlm. 276–296. ISBN 0-19-850346-6.
- ^ Allen, C. F.H.; Barker, W. E. "Desoxybenzoin". Sintesis Organik. 12: 16. doi:10.15227/orgsyn.012.0016.
- ^ Adams, Roger. "p-Nitrobenzoyl Chloride". Sintesis Organik. 3: 75. doi:10.15227/orgsyn.003.0075.
- ^ a b Boyd, Robert W.; Morrison, Robert (1992). Kimia Organik. Englewood Cliffs, NJ: Prentice Hall. hlm. 666–762. ISBN 0-13-643669-2.
- ^ L. P. Kyrides. "Fumaryl Chloride". Sintesis Organik. 20. doi:10.15227/orgsyn.020.0051.
- ^ "Triphenylphosphine-carbon tetrachloride Diarsipkan 2010-03-23 di Wayback Machine. Taschner, Michael J. e-EROS: Encyclopedia of Reagents for Organic Synthesis, 2001
- ^ K. Venkataraman. "Sianurat klorida : reagen yang berguna untuk mengubah asam karboksilat menjadi klorida, ester, amida, dan peptida". 20. doi:10.1016/S0040-4039(00)71006-9.
- ^ Sonntag, Norman O. V. (1953-04-01). "Reaksi Asam Alifatik Klorida". Ulasan Kimia (dalam bahasa Inggris). 52 (2): 237–416. doi:10.1021/cr60162a001. ISSN 0009-2665.
- ^ Bentley, T. William; Llewellyn, Gareth; McAlister, J. Anthony (Januari 1996). "SN2 Mekanisme Alkoholisis, Aminolisis, dan Hidrolisis Asetil Klorida". Jurnal Kimia Organik. 61 (22): 7927–7932. doi:10.1021/jo9609844. ISSN 0022-3263. PMID 11667754.
- ^ C. H. Bamford dan CFH Tipper, Kinetika Kimia Komprehensif: Pembentukan Ester dan Hidrolisis dan Reaksi Terkait, Elsevier, Amsterdam, 1972.
- ^ Fox, Joseph M.; Dmitrenko, Olga; Liao, Lian-an; Bach, Robert D. (Oktober 2004). "Studi Komputasi Substitusi Nukleofilik pada Karbon Karbonil: Mekanisme SN 2 versus Intermediet Tetrahedral dalam Sintesis Organik". Jurnal Kimia Organik (dalam bahasa Inggris). 69 (21): 7317–7328. doi:10.1021/jo049494z. ISSN 0022-3263. PMID 15471486.
- ^ Hubbard, Patricia; Britania, William J. (February 1998). "Mekanisme Formasi Ester yang Dikatalis Amina dari suatu Asam Klorida dan Alkohol". Jurnal Kimia Organik (dalam bahasa Inggris). 63 (3): 677–683. doi:10.1021/jo9716643. ISSN 0022-3263. PMID 11672060.
- ^ Morgan, Paul W.; Kwolek, Stephanie L. (April 1959). "Trik tali nilon: Demonstrasi polimerisasi kondensasi". Journal of Chemical Education (dalam bahasa Inggris). 36 (4): 182. Bibcode:1959JChEd..36..182M. doi:10.1021/ed036p182. ISSN 0021-9584.






