Oksima

Oksima adalah suatu senyawa kimia yang termasuk dalam kelompok imina, dengan rumus umum R1R2C=NOH, di mana R1 adalah suatu rantai samping organik dan R2 dapat berupa hidrogen, membentuk suatu aldoksima, atau gugus organik lain, membentuk suatu ketoksima. Oksima tersubstitusi-O membentuk suatu keluarga senyawa yang terkait erat. Amidoksima adalah oksima amida dengan struktur umum RC(=NOH)(NRR').
Oksima biasanya dihasilkan oleh reaksi hidroksilamina dengan aldehida atau keton. Istilah oksima berasal dari abad 19, merupakan kombinasi kata oksigen dan imina.[1]
Struktur dan sifat[sunting | sunting sumber]
Jika kedua rantai samping pada karbon sentral berbeda satu sama lain, oksima dapat memiliki dua bentuk stereoisomerik geometris: isomer syn dan isomer anti, tergantung dari mana kedua rantai samping lebih dekat dengan hidroksil. Kedua bentuk tersebut sering kali cukup stabil untuk dipisahkan satu sama lain dengan teknik standar.
Oksima memiliki tiga pita karakteristik dalam spektrum inframerah, pada panjang gelombang 3600 cm−1 (O−H), 1665 cm−1 (C=N) dan 945 cm−1 (N−O).[2]
Dalam larutan berair, oksima alifatik adalah 102- hingga 103-kali lebih resisten terhadap hidrolisis dibandingkan analog hidrazon.[3]
Preparasi[sunting | sunting sumber]
Oksima dapat disintesis dengan kondensasi dari aldehida atau keton dengan hidroksilamina. Kondensasi aldehida dengan hidroksilamina memberikan aldoksin, dan ketoksi dihasilkan dari keton dan hidroksilamina. Secara umum, oksima hadir sebagai kristal tidak berwarna dan tidak larut dalam air. Oleh karena itu, oksima dapat digunakan untuk identifikasi keton atau aldehida.
Oksida juga dapat diperoleh dari reaksi nitrit seperti isoamil nitrit dengan senyawa yang mengandung atom hidrogen asam. Contohnya adalah reaksi etil asetoasetat dan natrium nitrit dalam asam asetat,[4][5] reaksi metil etil keton dengan etil nitrit dalam asam klorida.[6] dan reaksi serupa dengan propiofenon,[7] reaksi fenasil klorida,[8] reaksi malononitril dengan natrium nitrit dalam asam asetat[9]
Reaksi konseptual terkait adalah reaksi Japp–Klingemann.
Reaksi[sunting | sunting sumber]
Hidrolisis dari oksima berlangsung dengan mudah dengan memanaskan dengan adanya berbagai asam anorganik, dan oksima terurai menjadi keton atau aldehida, dan hidroksilamina. Reduksi oksima oleh logam natrium,[10] amalgam natrium, hidrogenasi, atau reaksi dengan pereaksi hidrida menghasilkan amina.[11] Biasanya reduksi aldoksima menghasilkan amina primer dan amina sekunder; namun, kondisi reaksi dapat diubah (seperti penambahan kalium hidroksida dalam rasio molar 1/30) untuk menghasilkan amina primer semata-mata.[12]
Secara umum, oksima dapat diubah menjadi turunan amida yang sesuai dengan pengobatan dengan berbagai asam. Reaksi ini disebut penataan ulang Beckmann. Dalam reaksi ini, gugus hidroksil dipertukarkan dengan gugus yang berada dalam posisi anti gugus hidroksil. Derivatif amida yang diperoleh dengan penataan ulang Beckmann dapat diubah menjadi asam karboksilat dengan cara hidrolisis (katalis asam atau basa) serta amina dengan degradasi Hoffman amida dengan keberadaan hipoklorit alkali pada suhu 80 derajat celcius, degradasi itu sendiri rentan terhadap reaksi samping, yaitu pembentukan biuret atau polimer sianat. Untuk menghindari reaksi samping ini, kontrol suhu yang ketat perlu dilakukan; Reaksi harus dilakukan pada suhu yang cukup untuk isomerisasi sianat menjadi isosianat.
Selain itu, solvasi yang baik juga penting untuk mensukseskan reaksi tersebut. Penataan ulang Beckmann digunakan untuk sintesis industri kaprolaktam (lihat aplikasi di bawah).
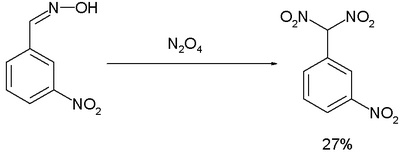
Reaksi Ponzio (1906)[13] mengenai konversi m -nitrobenzaldoksima menjadi m-nitrofenildinitrometana dengan dinitrogen tetroksida merupakan hasil penelitian bahan peledak tinggi seperti-TNT:[14]
Dalam Penataan ulang Neber oksima tertentu dikonversi menjadi keton alfa-amino yang sesuai.
Oksima dapat didehidrasi menggunakan anhidrida asam untuk menghasilkan nitril yang sesuai.
Amidoksima tertentu bereaksi dengan benzenasulfonil klorida menjadi urea tersubstitusi dalam Penataan ulang Tiemann:[15][16]
Kegunaan[sunting | sunting sumber]
Dalam aplikasi terbesar mereka, oksima adalah zat antara dalam produksi industri kaprolaktam, pendahulu Nilon 6. Sekitar setengah dari pasokan sikloheksanon dunia, lebih dari satu miliar kilogram per tahun, diubah menjadi oksima. Dengan adanya katalis asam sulfat, oksima menjalani penataan ulang Beckmann untuk menghasilkan kaprolaktam amida siklik:[17]
Lihat pula[sunting | sunting sumber]
Referensi[sunting | sunting sumber]
- ^ Nama "oksima" berasal dari "oksimida" (yaitu, oksi- + amida). Menurut ahli kimia organik Jerman Victor Meyer (1848-1897) – yang, dengan Alois Janny, mensintesis oksima pertama – suatu "oksimida" adalah suatu senyawa yang mengandung gugus (=N−OH) yang menempel pada atom karbon. Keberadaan oksimida dipertanyakan pada waktu itu (sekitar tahun 1882). (Lihat halaman 1164 dari: Victor Meyer und Alois Janny (1882a) "Ueber stickstoffhaltige Acetonderivate" (On nitrogenous derivatives of acetone), Berichte der Deutschen chemischen Gesellschaft, 15: 1164–1167.) Namun, pada tahun 1882, Meyer dan Janny berhasil mensintesis metilglioksima (CH3C(=NOH)CH(=NOH)), yang mereka namai "Acetoximsäure" (asam asetoksimat) (Meyer & Janny, 1882a, hal. 1166). Selanjutnya, mereka mensintesis 2-propanon, oksima ((CH3)2C=NOH), yang mereka namai "Acetoxim" (asetoksima), analog dengan Acetoximsäure. Dari Victor Meyer dan Alois Janny (1882b) "Ueber die Einwirkung von Hydroxylamin auf Aceton" (On the effect of hydroxylamine on acetone), Berichte der Deutschen chemischen Gesellschaft, 15: 1324–1326, page 1324: "Die Substanz, welche wir, wegen ihrer nahen Beziehungen zur Acetoximsäure, und da sie keine sauren Eigenschaften besitzt, vorläufig Acetoxim nennen wollen, …" (The substance, which we – on account of its close relations to acetoximic acid, and since it possesses no acid properties – will, for the present, name "acetoxime," … )
- ^ Reusch, W. "Infrared Spectroscopy". Virtual Textbook of Organic Chemistry. Michigan State University. Diarsipkan dari versi asli tanggal 2010-06-21. Diakses tanggal 2017-07-10.
- ^ Kalia, J.; Raines, R. T. (2008). "Hydrolytic stability of hydrazones and oximes". Angew. Chem. Int. Ed. 47 (39): 7523–7526. doi:10.1002/anie.200802651. PMC 2743602
 . PMID 18712739.
. PMID 18712739.
- ^ Fischer, Hans (1943). "2,4-Dimethyl-3,5-dicarbethoxypyrrole". Org. Synth.; Coll. Vol. 2: 202.
- ^ Fischer, Hans (1955). "Kryptopyrrole". Org. Synth.; Coll. Vol. 3: 513.
- ^ Semon, W. L. and Damerell, V. R. (1943). "Dimethoxyglyoxime". Org. Synth.; Coll. Vol. 2: 204.
- ^ Hartung, Walter H. and Crossley, Frank (1943). "Isonitrosopropiophenone". Org. Synth.; Coll. Vol. 2: 363.
- ^ Levin, Nathan and Hartung, Walter H. (1955). "ω-chloroisonitrosoacetophenone". Org. Synth.; Coll. Vol. 3: 191.
- ^ Ferris, J. P.; Sanchez, R. A. and Mancuso, R. W. (1973). "p-toluenesulfonate". Org. Synth.; Coll. Vol. 5: 32.
- ^ Suter, C. M.; Moffett, Eugene W. (1934). "The Reduction of Aliphatic Cyanides and Oximes with Sodium and n-Butyl Alcohol". Journal of the American Chemical Society. 56 (2): 487–487. doi:10.1021/ja01317a502.
- ^ George, Frederick; Saunders, Bernard (1960). Practical Organic Chemistry, 4th Ed. London: Longman. hlm. 93 & 226. ISBN 9780582444072.
- ^ Hata, Kazuo (1972). New Hydrogenating Catalysts. New York: John Wiley & Sons Inc. hlm. 193. ISBN 9780470358900.
- ^ Ponzio, Giacomo (1906). "Einwirkung von Stickstofftetroxyd auf Benzaldoxim". J. Prakt. Chem. 73: 494. doi:10.1002/prac.19060730133.
- ^ Fieser, Louis F. and Doering, William von E. (1946). "Aromatic-Aliphatic Nitro Compounds. III. The Ponzio Reaction; 2,4,6-Trinitrobenzyl Nitrate". J. Am. Chem. Soc. 68 (11): 2252. doi:10.1021/ja01215a040.
- ^ Tiemann, Ferdinand (1891). "Ueber die Einwirkung von Benzolsulfonsäurechlorid auf Amidoxime". Chemische Berichte. 24 (2): 4162–4167. doi:10.1002/cber.189102402316.
- ^ Plapinger, Robert; Owens, Omer (1956). "Notes – The Reaction of Phosphorus-Containing Enzyme Inhibitors with Some Hydroxylamine Derivatives". J. Org. Chem. 21 (10): 1186. doi:10.1021/jo01116a610.
- ^ Ritz, Josef; Fuchs, Hugo; Kieczka, Heinz; Moran, William C. (2005), "Caprolactam", Ullmann's Encyclopedia of Industrial Chemistry, Weinheim: Wiley-VCH, doi:10.1002/14356007.a05_031.pub2