Barium klorida
artikel ini perlu dirapikan agar memenuhi standar Wikipedia. |
| |

| |
| Nama | |
|---|---|
| Nama lain | |
| Penanda | |
| |
Model 3D (JSmol)
|
|
| 3DMet | {{{3DMet}}} |
| ChemSpider | |
| Nomor EC | |
PubChem CID
|
|
| Nomor RTECS | {{{value}}} |
| UNII | |
CompTox Dashboard (EPA)
|
|
| |
| |
| Sifat | |
| BaCl2 | |
| Massa molar | 208,23 g/mol (anhidrat) 244,26 g/mol (dihidrat) |
| Penampilan | Padatan putih |
| Densitas | 3,856 g/cm3 (anhidrat) 3.0979 g/cm3 (dihidrat) |
| Titik lebur | 962 °C (960 °C, dihidrat) |
| Titik didih | 1560 °C |
| 31.2 g/100 mL (0 °C) 35.8 g/100 mL (20 °C) 59.4 g/100 mL (100 °C) | |
| Kelarutan | Larut dalam metanol, tidak larut dalam etanol, etil asetat[2] |
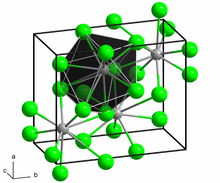
| Struktur | |
| ortogonal (anhidrat) monoklinik (dihidrat) | |
| 7-9 | |
| Termokimia | |
| Entalpi pembentukan standar (ΔfH |
−858,56 kJ/mol |
| Bahaya | |
Klasifikasi UE (DSD) (usang)
|
Beracun (T) Berbahaya (Xn) |
| Frasa-R | R20, R25 |
| Frasa-S | (S1/2), S45 |
| Titik nyala | Tidak-terbakar |
| Dosis atau konsentrasi letal (LD, LC): | |
LD50 (dosis median)
|
78 mg/kg (mencit, oral) 50 mg/kg (marmot, oral)[4] |
LDLo (terendah tercatat)
|
112 mg Ba/kg (kelinci, oral) 59 mg Ba/kg (anjing, oral) 46 mg Ba/kg (tikus, oral)[4] |
| Batas imbas kesehatan AS (NIOSH): | |
PEL (yang diperbolehkan)
|
TWA 0,5 mg/m3[3] |
REL (yang direkomendasikan)
|
TWA 0,5 mg/m3[3] |
IDLH (langsung berbahaya)
|
50 mg/m3[3] |
| Senyawa terkait | |
Anion lain
|
Barium fluorida Barium bromida Barium iodida |
Kation lainnya
|
Berilium klorida Magnesium klorida Kalsium klorida Stronsium klorida Radium klorida Timbal klorida |
Kecuali dinyatakan lain, data di atas berlaku pada suhu dan tekanan standar (25 °C [77 °F], 100 kPa). | |
| Referensi | |
Barium klorida adalah senyawa anorganik dengan rumus molekul BaCl2 yang dapat ditemukan dalam bentuk hidratnya BaCl2.2H2O. Barium klorida merupakan salah satu garam barium yang paling umum larut dalam air.[5] Barium ditemukan oleh Humphry Davy dari Yunani Barat pada tahun 1808.[6]
Sejarah
[sunting | sunting sumber]Barium klorida adalah hasil sampingan dari penemuan radium oleh Marie Curie. Ketika menyempurnakan radium, hasil pemisahan akhir menghasilkan barium klorida dan radium klorida.[7]
| Ciri-ciri | |
|---|---|
| Formula | BaCl2 |
| Rumus sistem Hill | Ba1Cl2 |
| Nomor CAS | [10361-37-2] |
| Formula Berat | 208,232 |
| Kelas | klorida |
| Warna | putih |
| Penampilan | kristal padat |
| Titik lebur | 962 °C |
| Titik didih | 1560 °C |
| Kepadatan | 3900 kg m-3 |
Struktur
[sunting | sunting sumber]BaCl2 mengkristal dalam dua bentuk sehingga disebut dengan kristal polimorf. Barium klorida memiliki bentuk struktur kristal kubik fluorit (CaF2) dan struktur ortorombik cotunnite (PbCl2). BaCl2 bersifat racun sehingga tidak bisa digunakan secara sembarangan.[8]
Kelimpahan di alam
[sunting | sunting sumber]Di alam, barium dapat membentuk mineral Baritin (BaSO4), dan mineral Witerit (BaCO3) berwarna silver.
Pembuatan
[sunting | sunting sumber]Barium klorida dapat dibuat dari barium hidroksida [Ba(OH)2 ] maupun barium karbonat [BaCO3], dengan barium karbonat yang ditemukan secara alami sebagai mineral witherite. Barium klorida dapat pula dibuat dengan mereaksikan asam klorida (HCl) dengan barium karbonat [BaCO3] atau sulfida [BaSO4]. Pada skala industri, terdapat dua langkah pembuatan BaCl2 yang berasal dari mineral barit (barium sulfat).[9]
Reaksi dengan barium sulfida BaSO4+ 4C --> BaS + 4CO
Langkah selanjutnya membutuhkan suhu tinggi sehingga reaksi yang terjadi menjadi BaS + CaCl2 --> BaCl2 + CaS
BaCl2 kemudian dapat tercuci dan mengikat dengan air. Dari larutan barium klorida dihidrat sehingga mengkristal sebagai kristal putih: BaCl2.2H2O
Manfaat
[sunting | sunting sumber]Barium klorida dapat digunakan dalam berbagai bidang. Dalam bidang kimia, material ini sering digunakan sebagai tes untuk ion sulfat, pengerasan baja, dan pembuatan garam barium lainnya serta mendapatkan logam Barium dengan cara elektrolisis. Barium klorida banyak dimanfaatkan dalam pembuatan kembang api untuk memberikan warna hijau terang.
Selain itu, material ini dapat digunakan dalam bidang industri sebagai pletisida, pigmen, deterjen boiler, pemurnian gula, dan pembuatan soda. Barium klorida dapat digunakan sebagai polimer dan stabilisator.[9] Namun, dalam penerapannya, penggunaan material ini cukup terbatas karena sifat racun/toksisitasnya.
Reaksi BaCl2
[sunting | sunting sumber]Reaksi dengan asam
BaCl2 + H2SO4 → BaSO4 + 2 HCl
Reaksi dengan Na2SO4
BaCl2(aq) + Na2SO4(aq) → BaSO4(s) + 2NaCl(aq)[6]
Referensi
[sunting | sunting sumber]- ^ https://play.google.com/books/reader?printsec=frontcover&output=reader&id=nKQ-AAAAYAAJ&pg=GBS.PA64
- ^ Handbook of Chemistry and Physics, 71st edition, CRC Press, Ann Arbor, Michigan, 1990.
- ^ a b c "NIOSH Pocket Guide to Chemical Hazards #0045". National Institute for Occupational Safety and Health (NIOSH).
- ^ a b "Barium (soluble compounds, as Ba)". Immediately Dangerous to Life and Health. National Institute for Occupational Safety and Health (NIOSH).
- ^ https://www.webelements.com/compounds/barium/barium_dichloride.html
- ^ a b https://www.scribd.com/document_downloads/direct/216284775?extension=pptx&ft=1419816449<=1419820059&user_id=128636017&uahk=QB5cfmARQMetyYWn40kHGNOmx7Y
- ^ http://www.riskassessmentservices.co.uk/HazCom/Barium%20Chloride.pdf
- ^ http://www.scribd.com/doc/90952536/Barium-Klorida-Adalah-Senyawa-Anorganik-Dengan-BaCl2-Formula#scribd
- ^ a b https://en.wikipedia.org/wiki/Barium_chloride
