Kalium ferat: Perbedaan antara revisi
←Membuat halaman berisi '{{chembox | verifiedrevid = 428792085 | Name = Kalium ferate | IUPACName = Kalium ferate(VI) | OtherNames = Kalium ferat<br /> Dikalium ferat | ImageFile1 = Potassium...' |
|||
| Baris 44: | Baris 44: | ||
== Sintesis dan struktur == |
== Sintesis dan struktur == |
||
| ⚫ | |||
| ⚫ | [[Georg Ernst Stahl]] (1660 - 1734) pertama kali menemukan bahwa residu terbentuk dengan menyalakan campuran [[kalium nitrat]] (''saltpetre'') dan serbuk besi yang dilarutkan dalam air untuk memberikan larutan berwarna ungu. [[Edmond Frémy]] (1814 - 1894) kemudian menemukan bahwa fusi [[kalium hidroksida]] dan [[besi(III) oksida]] di udara menghasilkan senyawa yang larut dalam air. Komposisi sesuai dengan [[kalium manganat]]. Di [[laboratorium]], K<sub>2</sub>FeO<sub>4</sub> disiapkan dengan mengoksidasi [[basa|larutan alkali]] dari garam besi(III) dengan pemutih klorin pekat.<ref>Schreyer, J. M.; Thompson, G. W.; Ockerman, L. T. "Potassium Ferrate(VI)" Inorganic Syntheses, 1953 volume IV, pages 164-168.</ref> |
||
| ⚫ | Garam bersifat isostruktural dengan K<sub>2</sub>MnO<sub>4</sub>, K<sub>2</sub>SO<sub>4</sub>, dan K<sub>2</sub>CrO<sub>4</sub>. Padatan terdiri dari K<sup>+</sup> dan anion FeO<sub>4</sub><sup>2−</sup> tetrahedral, dengan jarak Fe-O 1,66 Å.<ref>Hoppe, M. L.; Schlemper, E. O.; Murmann, R. K. "Structure of Dipotassium Ferrate(VI)" Acta Crystallographica 1982, volume B38, pp. 2237-2239. {{doi|10.1107/S0567740882008395}}.</ref> Garam barium yang buruk larut, [[Barium ferat|BaFeO<sub>4</sub>]], juga dikenal. |
||
| ⚫ | |||
| ⚫ | [[Georg Ernst Stahl]] (1660 - 1734) pertama kali menemukan bahwa residu terbentuk dengan menyalakan campuran [[kalium nitrat]] (''saltpetre'') dan serbuk besi yang dilarutkan dalam air untuk memberikan larutan berwarna ungu. [[Edmond Frémy]] (1814 - 1894) kemudian menemukan bahwa fusi [[kalium hidroksida]] dan [[besi(III) oksida]] di udara menghasilkan senyawa yang larut dalam air. Komposisi sesuai dengan [[kalium manganat]]. Di [[laboratorium]], K<sub>2</sub>FeO<sub>4</sub> disiapkan dengan mengoksidasi [[basa|larutan alkali]] dari garam besi(III) dengan pemutih klorin pekat. |
||
| ⚫ | Garam bersifat isostruktural dengan K<sub>2</sub>MnO<sub>4</sub>, K<sub>2</sub>SO<sub>4</sub>, dan K<sub>2</sub>CrO<sub>4</sub>. Padatan terdiri dari K<sup>+</sup> dan anion FeO<sub>4</sub><sup>2−</sup> tetrahedral, dengan jarak Fe-O 1,66 Å. |
||
== Properti dan penerapan == |
== Properti dan penerapan == |
||
Revisi per 26 Juni 2019 02.26
| |

| |
| Nama | |
|---|---|
| Nama IUPAC
Kalium ferate(VI)
| |
| Nama lain
Kalium ferat
Dikalium ferat | |
| Penanda | |
| 3DMet | {{{3DMet}}} |
| Nomor EC | |
| Nomor RTECS | {{{value}}} |
| Sifat | |
| K2FeO4 | |
| Massa molar | 198.0392 g/mol |
| Penampilan | padatan ungu gelap |
| Densitas | 2.829 g/cm3, padatan |
| Titik lebur | >198 °C (terurai) |
| larut dalam 1M KOH | |
| Kelarutan dalam kelarutan lainnya | bereaksi dengan kebanyakan larutan |
| Struktur | |
| K2SO4 motif | |
| Tetrahedral | |
| 0 D | |
| Bahaya | |
| Bahaya utama | Oksidator |
| Lembar data keselamatan | External SDS |
| Piktogram GHS |  [1] [1]
|
| Keterangan bahaya GHS | {{{value}}} |
| H272[1] | |
| P210, P220, P221, P280, P370+378, P501[1] | |
| Titik nyala | tidak mudah terbakar |
| Senyawa terkait | |
Anion lain
|
K2MnO4 K2CrO4 K2RuO4 |
Kation lainnya
|
BaFeO4 Na2FeO4 |
Kecuali dinyatakan lain, data di atas berlaku pada suhu dan tekanan standar (25 °C [77 °F], 100 kPa). | |
| Referensi | |
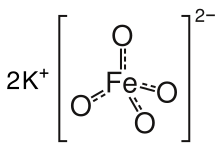
Kalium ferat adalah senyawa kimia dengan rumus K2FeO4. Garam ungu ini bersifat paramagnetik, dan merupakan contoh langka dari senyawa besi(VI). Pada sebagian besar senyawanya, besi memiliki tingkat oksidasi +2 atau +3 (Fe2+ atau Fe3+). Mencerminkan tingkat oksidasi yang tinggi, FeO42− adalah agen pengoksidasi yang kuat.
Sintesis dan struktur

Georg Ernst Stahl (1660 - 1734) pertama kali menemukan bahwa residu terbentuk dengan menyalakan campuran kalium nitrat (saltpetre) dan serbuk besi yang dilarutkan dalam air untuk memberikan larutan berwarna ungu. Edmond Frémy (1814 - 1894) kemudian menemukan bahwa fusi kalium hidroksida dan besi(III) oksida di udara menghasilkan senyawa yang larut dalam air. Komposisi sesuai dengan kalium manganat. Di laboratorium, K2FeO4 disiapkan dengan mengoksidasi larutan alkali dari garam besi(III) dengan pemutih klorin pekat.[2]
Garam bersifat isostruktural dengan K2MnO4, K2SO4, dan K2CrO4. Padatan terdiri dari K+ dan anion FeO42− tetrahedral, dengan jarak Fe-O 1,66 Å.[3] Garam barium yang buruk larut, BaFeO4, juga dikenal.
Properti dan penerapan
Kesulitan utama dengan penggunaan K2FeO4 adalah bahwa ia sering terlalu reaktif, seperti yang ditunjukkan oleh fakta bahwa itu terurai dalam kontak dengan air, terutama dalam air asam: [4]
- 4K2FeO4 + 4 H2O → 3O2 + 2 Fe2O3 + 8KOH
Pada pH tinggi, larutan berair stabil. Larutan ungu tua mirip dengan kalium permanganat (KMnO 4). Ini adalah agen pengoksidasi yang lebih kuat daripada yang terakhir. Sebagai padatan kering, K2FeO4 stabil.
Karena produk samping dari reaksi redoksnya adalah oksida besi seperti karat, K2FeO4 telah dideskripsikan sebagai "oksidan hijau." Ini telah digunakan dalam pengolahan air limbah sebagai oksidan untuk kontaminan organik dan sebagai biosida. Secara mudah, produk reaksi yang dihasilkan adalah besi(III) oksida-hidroksida, flokulan yang sangat baik. Dalam sintesis organik, K2FeO4 mengoksidasi alkohol primer. [5] Sebaliknya, oksidan terkait seperti kromat dianggap berbahaya bagi lingkungan
K2FeO4 juga menarik perhatian sebagai bahan katoda potensial dalam "baterai super besi."
Bentuk-bentuk stabil dari kalium ferat telah diusulkan untuk menghilangkan spesies transuranik, baik yang larut maupun yang tersuspensi, dari larutan-larutan berair. Jumlah tonase diusulkan untuk membantu memulihkan dampak bencana Chernobyl di Belarus. Teknik baru ini berhasil diterapkan untuk menghilangkan berbagai logam berat.
Telah diusulkan sebagai penghenti pendarahan untuk luka baru. [6] [7
Referensi
- ^ a b c d "Indium(III) Chloride". American Elements. Diakses tanggal June 13, 2019.
- ^ Schreyer, J. M.; Thompson, G. W.; Ockerman, L. T. "Potassium Ferrate(VI)" Inorganic Syntheses, 1953 volume IV, pages 164-168.
- ^ Hoppe, M. L.; Schlemper, E. O.; Murmann, R. K. "Structure of Dipotassium Ferrate(VI)" Acta Crystallographica 1982, volume B38, pp. 2237-2239. DOI:10.1107/S0567740882008395.
