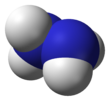
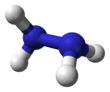
Hidrazina
| |||
| |||
 Hidrazin hidrat
| |||
| Nama | |||
|---|---|---|---|
| Nama IUPAC (sistematis)
Hydrazine[2] | |||
| Nama lain | |||
| Penanda | |||
Model 3D (JSmol)
|
|||
| 3DMet | {{{3DMet}}} | ||
| Referensi Beilstein | 878137 | ||
| ChEBI | |||
| ChEMBL | |||
| ChemSpider | |||
| Nomor EC | |||
| Referensi Gmelin | 190 | ||
| KEGG | |||
| MeSH | Hydrazine | ||
PubChem CID
|
|||
| Nomor RTECS | {{{value}}} | ||
| UNII | |||
| Nomor UN | 2029 | ||
CompTox Dashboard (EPA)
|
|||
| |||
| |||
| Sifat | |||
| N2H4 | |||
| Massa molar | 32,0452 g mol−1 | ||
| Penampilan | Tak berwarna, berasap, cairan seperti minyak[3] | ||
| Bau | seperti amonia[3] | ||
| Densitas | 1,021 g cm−3 | ||
| Titik lebur | 275 K (2 °C; 35 °F) | ||
| Titik didih | 387 K (114 °C; 237 °F) | ||
| dapat campur[3] | |||
| log P | 0,67 | ||
| Tekanan uap | 1 kP (pada 30,7 °C) | ||
| Keasaman (pKa) | 8,10 (N)[4] | ||
| Kebasaan (pKb) | 5,90 | ||
| Indeks bias (nD) | 1,46044 (pada 22 °C) | ||
| Viskositas | 0,876 cP | ||
| Struktur | |||
| Piramida triangular pada N | |||
| 1,85 D[5] | |||
| Termokimia | |||
| Entropi molar standar (S |
121,52 J K−1 mol−1 | ||
| Entalpi pembentukan standar (ΔfH |
50,63 kJ mol−1 | ||
| Bahaya | |||
| Lembar data keselamatan | ICSC 0281 | ||
| Piktogram GHS |     
| ||
| Keterangan bahaya GHS | {{{value}}} | ||
| H226, H301, H311, H314, H317, H331, H350, H410 | |||
| P201, P261, P273, P280, P301+310, P305+351+338 | |||
| Titik nyala | 52 °C (325 K; 126 °F) | ||
| 24 hingga 270 °C (75 hingga 518 °F; 297 hingga 543 K) | |||
| Ambang ledakan | 1,8–99,99% | ||
| Dosis atau konsentrasi letal (LD, LC): | |||
LD50 (dosis median)
|
59–60 mg/kg (oral tikus, mencit)[6] | ||
LC50 (konsentrasi median)
|
260 ppm (tikus, 4 jam) 630 ppm (tikus, 1 jam) 570 ppm (tikus, 4 jam) 252 ppm (mencit, 4 jam)[7] | ||
| Batas imbas kesehatan AS (NIOSH): | |||
PEL (yang diperbolehkan)
|
TWA 1 ppm (1,3 mg/m3) [kulit][3] | ||
REL (yang direkomendasikan)
|
Ca C 0,03 ppm (0,04 mg/m3) [2-jam][3] | ||
IDLH (langsung berbahaya)
|
Ca [50 ppm][3] | ||
| Senyawa terkait | |||
Anion lain
|
tetrafluorohidrazin hidrogen peroksida difosfan difosfor tetraiodida | ||
Kation lainnya
|
hidrazin organik | ||
Related Azana biner
|
Amonia triazana | ||
Senyawa terkait
|
diazena triazena tetrazena difosfena | ||
Kecuali dinyatakan lain, data di atas berlaku pada suhu dan tekanan standar (25 °C [77 °F], 100 kPa). | |||
| Referensi | |||
Hidrazina adalah senyawa anorganik dengan rumus kimia N (juga ditulis sebagai H). Senyawa ini merupakan suatu hidrida pniktogen sederhana yang berupa cairan tak berwarna, mudah terbakar, dan berbau seperti amonia.
Hidrazina sangat beracun dan berbahaya karena sifatnya yang tidak stabil kecuali ditangani dalam larutan. Hingga 2015[update], pasar hidrazina hidrat mencapai $350 juta.[8] Kegunaan utama hidrazin adalah sebagai zat pembuih pada pembuatan busa polimer, tetapi secara signifikan merembet sebagai prekursor untuk katalis polimerisasi dan obat farmasi. Selain itu, hidrazin digunakan dalam beragam bahan bakar roket dan untuk mempersiapkan prekursor gas yang digunakan dalam kantung udara. Hidrazina digunakan dalam daur uap pembangkit listrik baik konvensional maupun nuklir sebagai penangkap oksigen untuk mengendalikan konsentrasi oksigen terlarut sebagai usaha untuk mengurangi korosi. Hidrazina anhidrat bersifat korosif terhadap kaca, dengan cara yang sama seperti asam fluorida.
Sejarah[sunting | sunting sumber]
Nama "hidrazina" dicetuskan oleh Emil Fischer pada tahun 1875; ia berusaha menghasilkan senyawa organik yang terdiri dari hidrazina mono-tersubstitusi.[9] Pada tahun 1887, Theodor Curtius telah memproduksi hidrazina sulfat dengan mengolah diazida organik dengan asam sulfat encer; Namun, ia tidak dapat memperoleh hidrazina murni, meskipun telah diulang-ulang.[10][11][12] Hidrazina anhidrat murni pertama kali disiapkan oleh ahli kimia Belanda Lobry de Bruyn pada tahun 1895.[13][14][15]
Lihat pula[sunting | sunting sumber]
Referensi[sunting | sunting sumber]
- ^ "NIOSH Guide - Hydrazine". Centers for Disease Control. Diakses tanggal 16 August 2012.
- ^ a b "hydrazine - PubChem Public Chemical Database". The PubChem Project. USA: National Center for Biotechnology Information.
- ^ a b c d e f "NIOSH Pocket Guide to Chemical Hazards #0329". National Institute for Occupational Safety and Health (NIOSH).
- ^ Hall H.K. (1957). "Correlation of the Base Strengths of Amines1". J. Am. Chem. Soc. 79 (20): 5441. doi:10.1021/ja01577a030.
- ^ Greenwood, Norman N.; Earnshaw, A. (1997), Chemistry of the Elements (edisi ke-2), Oxford: Butterworth-Heinemann, ISBN 0-7506-3365-4
- ^ Martel, B.; Cassidy, K. (2004). Chemical Risk Analysis: A Practical Handbook. Butterworth–Heinemann. hlm. 361. ISBN 1-903996-65-1.
- ^ "Hydrazine". Immediately Dangerous to Life and Health. National Institute for Occupational Safety and Health (NIOSH).
- ^ "Hydrazine Hydrate Market Size—Industry Share Report 2024". www.gminsights.com.
- ^ Fischer E (1875). "Ueber aromatische Hydrazinverbindungen" [On aromatic hydrazine compounds]. Ber. Dtsch. Chem. Ges. 8: 589–594. doi:10.1002/cber.187500801178.
- ^ Curtius T (1887). "Ueber das Diamid (Hydrazin)" [On diamide (hydrazine)]. Ber. Dtsch. Chem. Ges. 20: 1632–1634. doi:10.1002/cber.188702001368.
- ^ Curtius T, Jay R (1889). "Diazo- und Azoverbindungen der Fettreihe. IV. Abhandlung. Ueber das Hydrazin" [Diazo- and azo- compounds of alkanes. Fourth treatise. On hydrazine.]. Dalam Erdmann OL. Journal für praktische Chemie. 147. Verlag von Johann Ambrosius Barth. On p. 129, Curtius admits: "Das freie Diamid NH2-NH2 ist noch nicht analysirt worden." [Free hydrazine hasn't been analyzed yet.]
- ^ Curtius T, Schulz H (1890). "Ueber Hydrazinehydrat und die Halogenverbindungen des Diammoniums" [On hydrazine hydrate and the halogen compounds of diammonium]. Journal für praktische Chemie. 150. hlm. 521–549.
- ^ Lobry de Bruyn CA (2010). "Sur l'hydrazine (diamide) libre" [On free hydrazine (diamide)]. Recl. Trav. Chim. Pays-Bas. 13 (8): 433–440. doi:10.1002/recl.18940130816.
- ^ Lobry de Bruyn CA (1895). "Sur l'hydrate d'hydrazine" [On the hydrate of hydrazine]. Recl. Trav. Chim. Pays-Bas. 14 (3): 85–88. doi:10.1002/recl.18950140302.
- ^ Lobry de Bruyn CA (1896). "L'hydrazine libre I" [Free hydrazine, Part 1]. Recl. Trav. Chim. Pays-Bas (dalam bahasa Inggris). 15 (6): 174–184. doi:10.1002/recl.18960150606.