2,4-Dinitrofenilhidrazin

| |||
| |||
| Nama | |||
|---|---|---|---|
| Nama IUPAC (preferensi)
(2,4-Dinitrofenil)hidrazin | |||
| Nama lain
2,4-DNPH
2,4-DNP Pereaksi Brady Pereaksi Borche | |||
| Penanda | |||
Model 3D (JSmol)
|
|||
| 3DMet | {{{3DMet}}} | ||
| ChEBI | |||
| ChEMBL | |||
| ChemSpider | |||
| Nomor EC | |||
| KEGG | |||
PubChem CID
|
|||
| Nomor RTECS | {{{value}}} | ||
| UNII | |||
CompTox Dashboard (EPA)
|
|||
| |||
| |||
| Sifat | |||
| C6H6N4O4 | |||
| Massa molar | 198.14 g/mol | ||
| Penampilan | Bubuk merah atau jingga | ||
| Titik lebur | 198 hingga 202 °C (388 hingga 396 °F; 471 hingga 475 K) terurai | ||
| Agak | |||
| Bahaya | |||
| Bahaya utama | Mudah terbakar, mungkin karsinogenik | ||
| Lembar data keselamatan | MSDS | ||
| Piktogram GHS |  
| ||
| Keterangan bahaya GHS | {{{value}}} | ||
| H228, H302, H319 | |||
| P210, P240, P241, P264, P270, P280, P301+312, P305+351+338, P330, P337+313, P370+378, P501 | |||
Kecuali dinyatakan lain, data di atas berlaku pada suhu dan tekanan standar (25 °C [77 °F], 100 kPa). | |||
| Referensi | |||
2,4-Dinitrofenilhidrazin (DNPH, pereaksi Brady, pereaksi Borche) adalah senyawa kimia dengan rumus C6H3(NO2)2NHNH2. Dinitrofenilhidrazin merupakan padatan berwarna merah hingga jingga. Senyawa ini adalah hidrazin tersubstitusi, dan sering digunakan untuk menguji secara kualitatif untuk gugus karbonil yang terkait dengan aldehida dan keton. Turunannya, hidrazon juga dapat digunakan sebagai bukti terhadap identitas senyawa aslinya. Titik lebur turunan ini sering digunakan, dengan mengacu pada basis data nilai, untuk menentukan identitas senyawa karbonil tertentu. Senyawa ini relatif sensitif terhadap guncangan dan gesekan; senyawa ini merupakan mampu meledak sehingga harus penggunaannya harus berhati-hati.[1]
Sintesis[sunting | sunting sumber]
2,4-Dinitrofenilhidrazin tersedia secara komersial biasanya sebagai bubuk basah. Senyawa tersebut dapat dibuat dengan reaksi hidrazin sulfat dengan 2,4-dinitroklorobenzena:[2]
Pereaksi Brady disiapkan dengan melarutkan 2,4-dinitrofenilhidrazin dalam suatu larutan yang mengandung metanol dan sejumlah asam sulfat pekat.[3]
Uji Brady[sunting | sunting sumber]
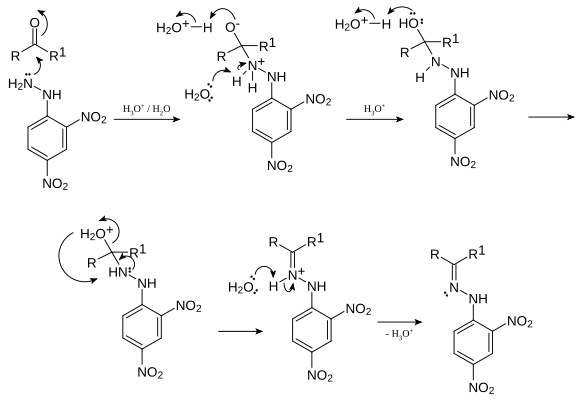
2,4-Dinitrofenilhidrazin dapat digunakan untuk deteksi kualitatif fungsionalitas karbonil dari gugus fungsi keton atau aldehida. Uji positif ditandai oleh pembentukan endapan kuning, jingga atau merah (dikenal sebagai dinitrofenilhidrazon). Jika senyawa karbonil adalah aromatik, maka endapan akan berwarna merah; jika alifatik, maka endapan akan memiliki warna lebih kuning.[4] Reaksi antara 2,4-dinitrofenilhidrazin dan keton menghasilkan hidrazon ditunjukkan di bawah ini:[5]
- RR'C=O + C6H3(NO2)2NHNH2 → C6H3(NO2)2NHN=CRR' + H2O
Reaksi ini, secara keseluruhan, merupakan suatu reaksi kondensasi ketika dua molekul bergabung bersama dengan hilangnya air. Secara mekanis, ini merupakan contoh reaksi adisi-eliminasi: adisi nukleofilik dari gugus -NH2 pada gugus karbonil C=O, diikuti dengan eliminasi molekul H2O:[6]

Kristal hidrazon yang berbeda memiliki titik leleh dan titik didih yang khas, yang memungkinkan identitas suatu zat ditentukan dalam metode yang dikenal sebagai derivatisasi. Secara khusus, penggunaan 2,4-dinitrofenilhidrazin dikembangkan oleh Brady dan Elsmie.[3]
Dinitrofenilhidrazin tidak bereaksi dengan gugus fungsional yang mengandung karbonil lain seperti asam karboksilat, amida, dan ester, yang memiliki stabilitas terkait resonansi ketika pasangan elektron bebas berinteraksi dengan orbital p pada karbon karbonil yang menghasilkan peningkatan delokalisasi dalam molekul. Stabilitas ini akan hilang dengan penambahan pereaksi ke gugus karbonil. Karenanya, senyawa ini lebih tahan terhadap reaksi adisi. Juga, dengan asam karboksilat, ada efek senyawa yang bertindak sebagai basa, meninggalkan karboksilat yang dihasilkan bermuatan negatif dan karenanya tidak lagi rentan terhadap serangan nukleofilik.[7]
Lihat pula[sunting | sunting sumber]
Referensi[sunting | sunting sumber]
- ^ "Bomb disposal squads detonate chemical stocks in British schools". The Guardian. 2 November 2016. Diakses tanggal 19 Maret 2018.
- ^ Allen, C. F. H. (1933). "2,4-Dinitrophenylhydrazine". Org. Synth. 13: 36; Coll. Vol. 2: 228.
- ^ a b Brady, Oscar L.; Elsmie, Gladys V. (1926). "The use of 2:4-dinitrophenylhydrazine as a reagent for aldehydes and ketones". Analyst. 51 (599): 77–78. Bibcode:1926Ana....51...77B. doi:10.1039/AN9265100077.
- ^ "ADDITION-ELIMINATION REACTIONS OF ALDEHYDES AND KETONES". Chemguide.co.uk (dalam bahasa Inggris). Diakses tanggal 27 Juli 2019.
- ^ Sachin S Kadam, Tambe ST, Grampurohit ND & Gaikwad DD (2012). "Review Article on: Chemical Importance of Brady's Reagent" (PDF). International Journal of Research in Pharmacy and Chemistry (dalam bahasa Inggris). 2 (4). ISSN 2231-2781.
- ^ Diadaptasi dari Chemistry in Context, Edisi ke-4, 2000, Graham Hill and John Holman. ISBN 9780073522975.
- ^ Lehman, John W. (2009). Operational Organic Chemistry: A Problem-solving Approach to the Laboratory Course (dalam bahasa Inggris). Pearson Prentice Hall. hlm. 137. ISBN 0136000924.