Eter

Eter adalah suatu senyawa organik yang mengandung gugus R—O—R', dengan R dapat berupa alkil maupun aril.[1] Contoh senyawa eter yang paling umum adalah pelarut dan anestetik dietil eter (etoksietana, CH3-CH2-O-CH2-CH3)[2]. Eter sangat umum ditemukan dalam kimia organik dan biokimia, karena gugus ini merupakan gugus penghubung pada senyawa karbohidrat dan lignin.
Struktur dan ikatan
[sunting | sunting sumber]Eter memiliki ikatan C-O-C yang bersudut ikat sekitar 110° dan jarak C-O sekitar 140 pm. Sawar rotasi ikatan C-O sangatlah rendah. Menurut teori ikatan valensi, hibridisasi oksigen pada senyawa eter adalah sp3.
Oksigen lebih elektronegatif daripada karbon, sehingga hidrogen yang berada pada posisi alfa relatif terhadap eter bersifat lebih asam daripada hidrogen senyawa hidrokarbon. Walau demikian, hidrogen ini kurang asam dibandingkan dengan alfa hidrogen keton.
Struktur serupa
[sunting | sunting sumber]Eter tidak boleh disamakan dengan gugus-gugus sejenis berikut yang mempunyai struktur serupa - R-O-R.
- Senyawa aromatik seperti furan di mana oksigen adalah sebahagian daripada sistem aromatik.
- Senyawa dengan atom-atom karbon yang bersebelahan dengan oksigen terikat dengan oksigen, nitrogen, atau sulfur:
Sifat-sifat fisika
[sunting | sunting sumber]Molekul-molekul eter tidak dapat berikatan hidrogen dengan sesamanya, sehingga mengakibatkan senyawa eter memiliki titik didih yang relatif rendah dibandingkan dengan alkohol.
Eter bersifat sedikit polar karena sudut ikat C-O-C eter adalah 110 derajat, sehingga dipol C-O tidak dapat meniadakan satu sama lainnya. Eter lebih polar daripada alkena, tetapi tidak sepolar alkohol, ester, ataupun amida. walau demikian, keberadaan dua pasangan elektron menyendiri pada atom oksigen eter, memungkinkan eter berikatan hidrogen dengan molekul air.Eter dapat dipisahkan secara sempurna melalui destilasi.
Eter siklik seperti tetrahidrofuran dan 1,4-dioksana sangat larut dalam air karena atom oksigennya lebih terpapar ikatan hidrogen dibandingkan dengan eter-eter alifatik lainnya.
| Beberapa alkil eter | |||||
|---|---|---|---|---|---|
| Eter | Struktur | Titik lebur (°C) | Titidk didih (°C) | Kelarutan dalam 1 L H2O | Momen dipol (D) |
| Dimetil eter | CH3-O-CH3 | -138,5 | -23,0 | 70 g | 1,30 |
| Dietil eter | CH3CH2-O-CH2CH3 | -116,3 | 34,4 | 69 g | 1,14 |
| Tetrahidrofuran | O(CH2)4 | -108,4 | 66,0 | Larut pada semua perbandingan | 1,74 |
| Dioksana | O(C2H4)2O | 11,8 | 101,3 | Larut pada semua perbandingan | 0,45 |
Reaksi
[sunting | sunting sumber]Eter secara umumnya memiliki reaktivitas kimia yang rendah, walaupun ia lebih reaktif daripada alkana. Beberapa contoh reaksi penting eter adalah sebagai berikut.[3]
Pembelahan eter
[sunting | sunting sumber]Walaupun eter tahan terhadap hidrolisis, ia dapat dibelah oleh asam-asam mineral seperi asam bromat dan asam iodat. Asam klorida hanya membelah eter dengan sangat lambat. Metil eter umumnya akan menghasilkan metil halida:
- ROCH3 + HBr → CH3Br + ROH
Reaksi ini berjalan via zat antara onium, yaitu [RO(H)CH3]+Br-.
Beberapa jenis eter dapat terbelah dengan cepat menggunakan boron tribomida (dalam beberapa kasus aluminium klorida juga dapat digunakan) dan menghasilkan alkil bromida.[4] Berganting pada substituennya, beberapa eter dapat dibelah menggunakan berbagai jenis reagen seperti basa kuat.
Pembentukan peroksida
[sunting | sunting sumber]Eter primer dan sekunder dengan gugus CH di sebelah oksigen eter, dapat membentuk peroksida, misalnya dietil eter peroksida. Reaksi ini memerlukan oksigen (ataupun udaara), dan dipercepat oleh cahaya, katalis logam, dan aldehida. Peroksida yang dihasilkan dapat meledak. Oleh karena ini, diisopropil eter dan tetrahidrofuran jarang digunakan sebagai pelarut.
Sebagai basa Lewis
[sunting | sunting sumber]Eter dapat berperan sebagai basa Lewis maupun basa Bronsted. Asam kuat dapat memprotonasi oksigen, menghasilkan "ion onium". Contohnya, dietil eter dapat membentuk kompleks dengan boron trifluorida, yaitu dietil eterat (BF3.OEt2). Eter juga berkooridasi dengan Mg(II) dalam reagen Grignard. Polieter (misalnya eter mahkota) dapat mengikat logam dengan sangat kuat.
Sintesis
[sunting | sunting sumber]Eter dapat disintesis melalui beberapa cara:
Dehidrasi alkohol
[sunting | sunting sumber]Dehidrasi senyawa alkohol dapat menghasilkan eter:
- 2 R-OH → R-O-R + H2O
Reaksi ini memerlukan temperatur yang tinggi (sekitar 125 °C). Reaksi ini dikatalisis oleh asam, biasanya asam sulfat. Metode ini efektif untukn menghasilkan eter simetris, tetapi tidak dapat digunakan untuk menghasilkan eter tak simetris. Dietil eter dihasilkan dari etanol menggunakan metode ini. Eter siklik dapat pula dihasilkan menggunakan metode ini.
Sintesis eter Williamson
[sunting | sunting sumber]Eter dapat pula dibuat melalui substitusi nukleofilik alkil halida oleh alkoksida
- R-ONa + R'-X → R-O-R' + NaX
Reaksi ini dinamakan sintesis eter Williamson. Reaksi ini melibatkan penggunaan alkohol dengan basa kuat, menghasilkan alkoksida, yang diikuti oleh adisi pada senyawa alifatik terkait yang memiliki gugus lepas (R-X). Gugus lepas tersebut dapat berupa iodida, bromida, maupun sulfonat. Metode ini biasanya tidak bekerja dengan baik dengan aril halida (misalnya bromobenzena). Reaksi ini menghasilkan rendemen reaksi yang tinggi untuk halida primer. Halida sekunder dan tersier sangat rawan menjalani reaksi eliminasi E2 seketika berpaparan dengan anion alkoksida yang sangat basa.
Dalam reaksi lainnya yang terkait, alkil halida menjalani substitusi nukleofilik oleh fenoksida. R-X tidak dapat digunakan untuk bereaksi dengan alkohol. Namun, fenol dapat digunakan untuk menggantikan alkohol. Oleh karena fenol bersifat asam, ia dapat bereaksi dengan basa kuat seperti natrium hidroksida, membentuk ion fenoksida. Ion fenoksida ini kemudian mensubstitusi gugus -X pada alkil halida, menghasilkan eter dengan gugus aril yang melekat padanya melalui mekanisme reaksi SN2.
- C6H5OH + OH- → C6H5-O- + H2O
- C6H5-O- + R-X → C6H5OR
Kondensasi Ullmann
[sunting | sunting sumber]Kondensasi Ullmann mirip dengan metode Williamson, kecuali substratnya adalah aril halida. Reaksi ini umumnya memerlukan katalis, misalnya tembaga.
Adisi elektrofilik alkohol ke alkena
[sunting | sunting sumber]Alkohol dapat melakukan reaksi adisi dengan alkena yang diaktivasi secara elektrofilik.
- R2C=CR2 + R-OH → R2CH-C(-O-R)-R2
Katalis asam diperlukan agar reaksi ini dapat berjalan. Biasanya merkuri trifluoroasetat (Hg(OCOCF3)2) digunakan sebagai katalis.
Pembuatan epoksida
[sunting | sunting sumber]Epoksida biasanya dibuat melalui oksidasi alkena. Eposida yang paling penting dalam industri adalah etilena oksida, yang dihasilkan melalui oksidasi etilena dengan oksigen. Epoksida lainnya dapat dihasilkan melalui dua cara:
- Melalui oksidasi alkena dengan peroksiasam seperti Asam meta-kloroperoksibenzoat (m-CPBA).
- Melalui substitusi nukleofilik intramolekuler halohidrin.
Beberapa eter penting
[sunting | sunting sumber]
|
Etilena oksida | Eter siklik yang paling sederhana. |
| Dimetil eter | Merupakan propelan pada aerosol. Merupakan bahan bakar alternatif yang potensial untuk mesin diesel karena mempunyai bilangan cetan sebesar 56-57. | |
| Dietil eter | Merupakan pelarut umum pada suhu rendah (b.p. 34.6 °C), dan dulunya merupakan zat anestetik. Digunakan sebagai cairan starter kontak pada mesin diesel. | |
| Dimetoksietana (DME) | Pelarut pada suhu tinggi (b.p. 85 °C): | |

|
Dioksana | Merupakan eter siklik dan pelarut pada suhu tinggi (b.p. 101.1 °C). |

|
Tetrahidrofuran (THF) | Eter siklik, salah satu eter yang bersifat paling polar yang digunakan sebagai pelarut. |

|
Anisol (metoksibenzena) | Merupakan eter aril dan komponen utama minyak esensial pada biji adas manis. |
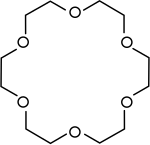
|
Eter mahkota | Polieter siklik yang digunakan sebagai katalis transfer fase. |

|
Polietilen glikol (PEG) | Merupakan polieter linear, digunakan pada kosmetik dan farmasi. |
Referensi
[sunting | sunting sumber]- ^ IUPAC, Compendium of Chemical Terminology, edisi ke-2 ("Buku Emas") (1997). Versi koreksi daring: (2006–) "ethers".
- ^ Rengga, Wara Dyah Pita; Putri, Rr Dewi Artanti. Kimia Organik I: Gugus Fungsi dalam Monomer. Perkumpulan Rumah Cemerlang Indonesia. ISBN 978-623-6478-43-1.
- ^ Wilhelm Heitmann, Günther Strehlke, Dieter Mayer "Ethers, Aliphatic" in Ullmann's Encyclopedia of Industrial Chemistry" Wiley-VCH, Weinheim, 2002. doi:10.1002/14356007.a10_023
- ^ J. F. W. McOmie and D. E. West (1973). "3,3'-Dihydroxylbiphenyl". Org. Synth.; Coll. Vol. 5: 412.
