Magnesium hidrida
| |
| |
| Nama | |
|---|---|
| Nama IUPAC
Magnesium hidrida
| |
| Penanda | |
Model 3D (JSmol)
|
|
| 3DMet | {{{3DMet}}} |
| ChEBI | |
| ChemSpider | |
| Nomor EC | |
PubChem CID
|
|
| Nomor RTECS | {{{value}}} |
| |
| |
| Sifat | |
| MgH2 | |
| Massa molar | 26.3209 g/mol |
| Penampilan | kristal putih |
| Densitas | 1.45 g/cm3 |
| Titik lebur | 285 °C (545 °F; 558 K) berdekomposisi |
| berdekomposisi | |
| Kelarutan | tidak dapat larut dalam eter |
| Struktur | |
| tetragonal | |
| Termokimia | |
| Kapasitas kalor (C) | 35.4 J/mol K |
| Entropi molar standar (S |
31.1 J/mol K |
| Entalpi pembentukan standar (ΔfH |
-75.2 kJ/mol |
| Energi bebas Gibbs (ΔfG) | -35.9 kJ/mol |
| Bahaya | |
| Bahaya utama | piroforik[1] |
| Senyawa terkait | |
Kation lainnya
|
Berilium hidrida Kalsium hidrida Stronsium hidrida Barium hidrida |
| Magnesium monohidrida Mg4H6 | |
Kecuali dinyatakan lain, data di atas berlaku pada suhu dan tekanan standar (25 °C [77 °F], 100 kPa). | |
| Referensi | |
Magnesium hidrida adalah senyawa kimia dengan rumus MgH2, sehingga senyawa ini merupakan hidrida alkali tanah. Senyawa ini telah diteliti untuk mencari kemungkinan apakah senyawa ini dapat dimanfaatkan untuk menyimpan hidrogen.[2]
Pembuatan
[sunting | sunting sumber]Pada tahun 1951, pembuatan unsur ini pertama kali dilaporkan dengan melakukan hidrogenasi terhadap logam Mg dengan tekanan dan suhu yang tinggi (200 atmosfer, 500 °C) dengan katalis MgI2:[3]
- Mg + H2 → MgH2
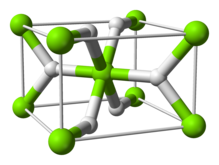
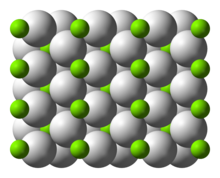
Struktur
[sunting | sunting sumber]Pada suhu ruangan, senyawa ini berbentuk α-MgH2 dengan struktur yang mirip dengan TiO2.[4]
Reaksi
[sunting | sunting sumber]MgH2 dapat dengan mudah bereaksi dengan air untuk menghasilkan gas hidrogen:
- MgH2 + 2 H2O → 2 H2 + Mg(OH)2
Pada suhu 287 °C, senyawa ini berdekomposisi dan membentuk H2 dengan tekanan 1 bar.[5] Tingginya suhu yang diperlukan dianggap sebagai keterbatasan dalam upaya untuk menjadikan MgH2 sebagai senyawa untuk menyimpan hidrogen:[6]
- MgH2 → Mg + H2
Referensi
[sunting | sunting sumber]- ^ Synthesis of magnesium hydride by the reaction of phenylsilane and dibutylmagnesium , Michalczyk M.J., Organometallics; (1992); 11(6); 2307-2309. DOI:10.1021/om00042a055
- ^ Catalytic Synthesis of Organolithium and Organomagnesium Compounds and of Lithium and Magnesium Hydrides - Applications in Organic Synthesis and Hydrogen Storage, Bogdanovic B., Angewandte Chemie International Edition in English, 24, 4, 262–73, DOI:10.1002/anie.198502621
- ^ Egon Wiberg, Heinz Goeltzer, Richard Bauer (1951). "Synthese von Magnesiumhydrid aus den Elementen (Synthesis of Magnesium Hydride from the Elements)" (PDF). Zeitschrift für Naturforschung B. 6b: 394.
- ^ Neutron diffraction study of magnesium deuteride, Zachariasen W.H., Holley C.E, Stamper J.F. Jnr, Acta Crystallogr. (1963) 16, 352-353, DOI:10.1107/S0365110X63000967
- ^ McAuliffe, T. R. (1980). Hydrogen and Energy (edisi ke-illustrated). Springer. hlm. 65. ISBN 978-1-349-02635-7. Extract of page 65
- ^ Hydrogen-storage materials for mobile applications, L. Schlapbach and A. Züttel, Nature 414, 353 (2001).DOI:10.1038/35104634 (PDF) https://web.archive.org/web/20050115181834/http://www.iea.org/textbase/work/2003/linking/Schlapbach%20Paper.PDF. Diarsipkan dari versi asli (PDF) tanggal January 15, 2005. Diakses tanggal August 9, 2008. Tidak memiliki atau tanpa
|title=(bantuan)
