Kondensasi aldol
Kondensasi aldol adalah sebuah reaksi organik antara ion enolat dengan senyawa karbonil, membentuk β-hidroksialdehida atau β-hidroksiketon dan diikuti dengan dehidrasi, menghasilkan sebuah enon terkonjugasi.

Kondensasi aldol sangatlah penting dalam sintesis organik karena menghasilkan ikatan karbon-karbon dengan baik. Kondensasi aldol umumnya didiskusikan pada pelajaran kimia organik tingkat universitas.[1][2][3] Dalam bentuk yang biasa, ia melibatkan adisi nukleofilik sebuah enolat keton ke sebuah aldehida, membentuk β-hidroksi keton, atau sebuah "aldol" (aldehida + alkohol), sebuah unit struktural yang dijumpai pada molekul alami dan obat-obatan.[4][5][6]
Nama kondensasi aldol juga umumnya digunakan untuk merujuk reaksi aldol itu sendiri yang dikatalisasi oleh aldolase (terutama dalam biokimia). Namun reaksi aldol sebenarnya bukanlah sebuah reaksi kondensasi karena ia tidak melibatkan pelepasan molekul yang kecil.
Reaksi antara keton dengan aldehida (kondensasi aldol silang) atau antara dua aldehida juga dinamakan Kondensasi Claisen-Schmidt. Nama reaksi ini berasal dari Rainer Ludwig Claisen dan J. G. Schmidt yang secara terpisah mempublikasi topik ini pada tahun 1880 dan 1881.[7][8][9]
Mekanisme
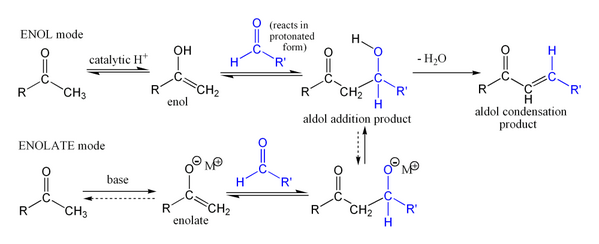
[sunting | sunting sumber]Bagian pertama reaksi ini adalah sebuah reaksi aldol, sedangkan bagian kedua reaksi ini adalah reaksi dehidrasi. Dehidrasi dapat diikuti oleh dekarboksilasi ketika terdapat sebuah gugus karboksil yang aktif. Produk adisi aldol dapat didehidrasi via dua mekanisme, yakni mekanisme enolat yang menggunakan basa kuat dan mekanisme enol yang menggunakan katalis asam.[10]
Mekanisme enolat:
Mekanisme enol:
Jenis-jenis kondensasi
[sunting | sunting sumber]Adalah penting untuk membedakan kondensasi aldol dari reaksi adisi senyawa karbonil lainnya.
- Ketika basa yang digunakan adalah amina dan senyawa hidrogen aktifnya mampu mengaktivasi reaksi, reaksi ini dinamakan kondensasi Knoevenagel.
- Dalam reaksi Perkin, aldehida bersifat aromatik dan enolat dihasilkan dari sebuah anhidrida..
- Kondensasi Claisen melibatkan dua senyawa ester.
- Kondensasi Dieckmann melibatkan dua gugus ester pada molekul yang sama dan menghasilkan senyawa siklik
- Reaksi Henry melibatkan sebuah aldehida dan senyawa nitro alifatik.
- Anulasi Robinson melibatkan keton α,β-takjenuh dan sebuah gugus karbonil
- Pada reaksi Guerbet, sebuah aldehida, yang dihasilkan secara in situ dari alkohol, berswakondensasi membentuk alkohol dimer.
Proses aldoks
[sunting | sunting sumber]Dalam bidang industri, proses Aldok yang dikembangkan oleh Royal Dutch Shell dan Exxon mengubah propilena dan syngas secara langsung menjadi 2-etilheksanol via hidroformilasi menjadi butiraldehida, kondensasi aldol menjadi 2-etilheksenal dan akhirnya hidrogenasi.[11]
Dalam satu kajian, krotonaldehida secara langsung diubah menjadi 2-etulheksanal dalam sebuah sistem paladium / amberlis / karbon dioksida superkritis:[12]
Ruang lingkup
[sunting | sunting sumber]etil 2-metilasetoasetat dan kamfolenat aldehida bereaksi dengan kondensasi aldol.[13] Prosedur sintetik ini[14] umumnya dijumpai pada tipe reaksi ini. Pada proses ini, selain pelepasan air, etanol dan karbondioksida juga dilepaskan pada dekarboksilasi.

Etil glioksilat 2 dan dietil 2-metilglutakonat 1 bereaksi menghasilkan asam isoprenetrikarboksilat 3 dengan natrium etoksida. Produk reaksi ini sangat tidak stabil dan akan melepaskan karbon dioksida, diikuti dengan reaksi sekunder lainnya. Ketidakstabilan ini diduga diakibatkan oleh terikan sterik yang dihasilkan oleh gugus metil dan gugus karboksilat pada struktur cis-dienoid.[15]

Kadang kala kondesasi aldol terdapat pada reaksi multitahap atau pada siklus katalitik seperti pada gambar di bawah:[16]
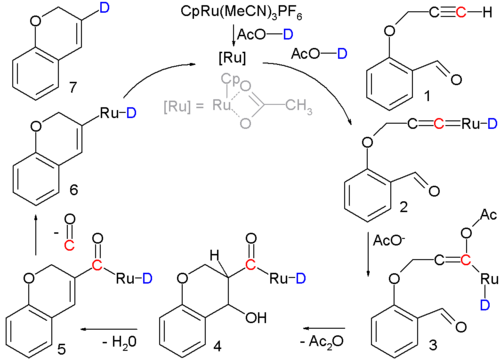
Dalam reaksi ini, sebuah alkunal 1 diubah menjadi sikloalkena 7 dengan sebuah katalis rutenium dan kondensasi terjadi pada zat antara 3 sampai 5. Bukti pendukung mekanisme reaksi ini didasarkan pada penandaan isotopik.[17]
Reaksi antara menton (senyawa kimia) dan anisaldehida sangat rumit karena pemerisaian sterik gugus keton. Larutan menggunakan basa kuat seperti kalium hidroksida dan pelarut yang sangat polar seperti DMSO pada reaksi di bawah:[18]

Oleh karena epimerisasi melalui sebuah ion umum enolat (zat antara A), produk reaksi mempunyai konfigurasi cis (R,R) dan bukannya trans (R,s) seperti yang ada molekul awal reaksi. Oleh karena hanya isomer cis yang mengendap dari larutan, produk ini dihasilkan secara eksklusif.
Lihat pula
[sunting | sunting sumber]Referensi
[sunting | sunting sumber]- ^ Wade, L. G. (6th ed. 2005). Organic Chemistry. Upper Saddle River, New Jersey: Prentice Hall. hlm. 1056–1066. ISBN 0-13-236731-9.
- ^ Smith, M. B.; March, J. (5th ed. 2001). Advanced Organic Chemistry. New York: Wiley Interscience. hlm. 1218–1223. ISBN 0-471-58589-0.
- ^ Mahrwald, R. (2004). Modern Aldol Reactions, Volumes 1 and 2. Weinheim, Germany: Wiley-VCH Verlag GmbH & Co. KGaA. hlm. 1218–1223. ISBN 3-527-30714-1.
- ^ Heathcock, C. H. (1991). Comp. Org. Syn. Oxford: Pergamon. hlm. 133–179. ISBN 0-08-040593-2.
- ^ Mukaiyama T. (1982). "The Directed Aldol Reaction". Org. React. 28: 203–331. doi:10.1002/0471264180.or028.03.
- ^ Paterson, I. (1988). "New Asymmetric Aldol Methodology Using Boron Enolates". Chem. Ind. 12: 390–394.
- ^ L. Claisen and A. Claparede (1881). "Condensationen von Ketonen mit Aldehyden". Berichte der Deutschen chemischen Gesellschaft. 14 (1): 2460–2468. doi:10.1002/cber.188101402192.
- ^ J. G. Schmidt (1881). "Ueber die Einwirkung von Aceton auf Furfurol und auf Bittermandelöl in Gegenwart von Alkalilauge". Berichte der Deutschen chemischen Gesellschaft. 14 (1): 1459–1461. doi:10.1002/cber.188101401306.
- ^ Advanced organic Chemistry, Reactions, mechanisms and structure 3ed. Jerry March ISBN 0-471-85472-7
- ^ Nielsen, A. T.; Houlihan., W. J. Org. React. 1968, 16, 1-438. (Review)
- ^ For example BG 881979
- ^ Continuous catalytic ‘‘one-pot’’ multi-step synthesis of 2-ethylhexanal from crotonaldehyde Tsunetake Seki, Jan-Dierk Grunwaldt and Alfons Baiker Chem. Commun., 2007, 3562–3564 doi:10.1039/b710129e DOI: 10.1039/b710129e
- ^ (E)-6-(2,2,3-Trimethyl-cyclopent-3-enyl)-hex-4-en-3-one Concepcion Bada, Juan M. Castro, Pablo J. Linares-Palomino, Sofia Salido, Joaquan Altarejos Manuel Nogueras, Adolfo Sanchez, Molbank 2004, M388 Online Publication
- ^ Etil 2-metilasetoasetat (2) ditambahkan ke dalam larutan natrium hidrida dalam dioksana yang diaduk. Kamfolenat aldehida (1) kemudian ditambahkan dan campuran direfluks selama 15 jam. 2N asam klordia kemudian ditambahkan dan campuran diekstraksi dengan dietil eter. Lapisan organik dibersihkan dengan 2N asam klorida, natrium bikarbonat jenuh, dan air garam. Fase organik tersebut kemudian dikeringkan dengan natrium sulfat anhidrat dan pelarut diuapkan dalam tekanan rendah, menghasilkan residu yang kemudian dimurnikan dengan distilasi vakum, menghasilkan 3 (58%).
- ^ M. B. Goren, E. A. Sokoloski and H. M. Fales (2005). "2-Methyl-(1Z,3E)-butadiene-1,3,4-tricarboxylic Acid, "Isoprenetricarboxylic Acid"". J. Org. Chem. 70 (18): 7429–7431. doi:10.1021/jo0507892.
- ^ J. A. Varela, C. Gonzalez-Rodriguez, S. G. Rubin, L. Castedo and C. Saa (2006). "Ru-Catalyzed Cyclization of Terminal Alkynals to Cycloalkenes". J. Am. Chem. Soc. 128 (30): 9576–9577. doi:10.1021/ja0610434.
- ^ Katalis rutenium, [CpRu(CH3CN)3]PF6, memiliki sebuah ligan siklopentadienil, tiga ligan asetonitril, dan sebuah ion lawan fosforus heksafluorida; proton asam dalam pelarut (asam asetat) digantikan dengan deuterium sebagai penanda isotopik. Kondisi reaksi: 90 °C, 24 jam. 80% rendemen kimia. Langkah pertama reaksi adalah pembentukan kompleks karbena logam transisi 2. Asam asetat beradisi dengan zat antara ini membentuk enolat 3, diikuti dengan kondensasi aldol menjadi 5, kemudian karbon monoksida dilepaskan menjadi 6. Langkah terakhirnya adalah eliminasi reduktif membentuk sikloalkena.
- ^ Simple and Effective Protocol for Claisen-Schmidt Condensation of Hindered Cyclic Ketones with Aromatic Aldehydes Valeriy Vashchenko, Lidiya Kutulya, Alexander Krivoshey Synthesis 2007: 2125-2134 doi:10.1055/s-2007-983746




