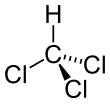
Kloroform
| |||

| |||
| Nama | |||
|---|---|---|---|
| Nama IUPAC
Trikloromatana
| |||
| Nama lain
Trikloromatana; formil triklorida; metana triklorida; metil triklorida; metenil triklorida; TCM; freon 20; refrigerant-20; R-20; UN 1888
| |||
| Penanda | |||
Model 3D (JSmol)
|
|||
| 3DMet | {{{3DMet}}} | ||
| ChEBI | |||
| ChEMBL | |||
| ChemSpider | |||
| Nomor EC | |||
| KEGG | |||
PubChem CID
|
|||
| Nomor RTECS | {{{value}}} | ||
| UNII | |||
CompTox Dashboard (EPA)
|
|||
| |||
| |||
| Sifat | |||
| CHCl3 | |||
| Massa molar | 119,37 g·mol−1 | ||
| Penampilan | Cairan tak berwarna | ||
| Bau | Menyengat, berbau seperti eter | ||
| Densitas | 1,564 g/cm3 (-20 °C) 1,489 g/cm3 (25 °C) 1,394 g/cm3 (60 °C) | ||
| Titik lebur | -63,5 °C | ||
| Titik didih | 61,15 °C terdekomposisi pada 450 °C | ||
| 1,062 g/100 mL (0 °C) 0,809 g/100 mL (20 °C) 0,732 g/100 mL (60 °C) | |||
| Kelarutan | Larut dalam benzena Bercampur dengan dietil eter, minyak, ligroin, alkohol, CCl4, CS2 | ||
| Kelarutan dalam aseton | ≥ 10 g/100 mL (19 °C) | ||
| Kelarutan dalam dimetil sulfoksida | ≥ 10 g/100 mL (19 °C) | ||
| Tekanan uap | 0,62 kPa (-40 °C) 7,89 kPa (0 °C) 25,9 kPa (25 °C) 313 kPa (100 °C) 2,26 MPa (200 °C) | ||
| kH | 3,67 L·atm/mol (24 °C) | ||
| Keasaman (pKa) | 15,7 (20 °C) | ||
| λmaks | 250 nm, 260 nm, 280 nm | ||
| Konduktivitas termal | 0,13 W/m·K (20 °C) | ||
| Indeks bias (nD) | 1,4459 (20 °C) | ||
| Viskositas | 0,563 cP (20 °C) | ||
| Struktur | |||
| Tetrahedral | |||
| 1,15 D | |||
| Termokimia | |||
| Kapasitas kalor (C) | 114,25 J/mol·K | ||
| Entropi molar standar (S |
202,9 J/mol·K | ||
| Entalpi pembentukan standar (ΔfH |
-134,3 kJ/mol | ||
| Energi bebas Gibbs (ΔfG) | -71,1 kJ/mol | ||
| Entalpi pembakaran standar ΔcH |
473,21 kJ/mol | ||
| Farmakologi | |||
| Kode ATC | N01 | ||
| Bahaya | |||
| Bahaya utama | karsinogen[1] | ||
| Piktogram GHS |  
| ||
| Keterangan bahaya GHS | {{{value}}} | ||
| H302, H315, H319, H332, H336, H351, H361, H373 | |||
| P261, P281, P305+351+338 | |||
| Titik nyala | Tidak terbakar | ||
| Dosis atau konsentrasi letal (LD, LC): | |||
LD50 (dosis median)
|
1250 mg/kg (mencit, oral) | ||
LC50 (konsentrasi median)
|
9617 ppm (mancit, 4 jam)[2] | ||
LCLo (terendah tercatat)
|
20.000 ppm (marmot, 2 jam) 7.056 ppm (kucing, 4 jam) 25.000 ppm (manusia, 5 menit)[2] | ||
| Batas imbas kesehatan AS (NIOSH): | |||
PEL (yang diperbolehkan)
|
50 ppm (240 mg/m3)[1] | ||
REL (yang direkomendasikan)
|
Ca ST 2 ppm (9,78 mg/m3) [60-menit][1] | ||
IDLH (langsung berbahaya)
|
500 ppm[1] | ||
Kecuali dinyatakan lain, data di atas berlaku pada suhu dan tekanan standar (25 °C [77 °F], 100 kPa). | |||
| Referensi | |||
Kloroform adalah nama umum untuk triklorometana (CHCl3).[3] Kloroform dikenal karena sering digunakan sebagai bahan pembius, akan tetapi penggunaannya sudah dilarang karena telah terbukti dapat merusak liver dan ginjal.[4] Kloroform kebanyakan digunakan sebagai pelarut nonpolar di laboratorium.[3] Wujudnya pada suhu ruang berupa cairan bening, mudah menguap, dan berbau khas.[3]
Produksi
[sunting | sunting sumber]Kloroform dapat disintesis dengan cara mencampuran etil alkohol atau etanol dengan kalsium hipoklorit. Kalsium hipoklorit merupakan donor unsur klor.[3] Selain kalsium hipoklorit, penyumbang unsur klor yang dapat dipakai adalah pemutih pakaian.[3] Pemutih pakaian memiliki senyawa aktif yaitu asam hipoklorit.[5] Etil alkohol dipanaskan dan dicampurkan dengan kalsium hipoklorit.[3] Untuk mendapatkan kloroform dari reaksi pencampuran ini, terdapat tiga reaksi yang terjadi:
- CH3-CH2OH (etil alkohol) + Cl2 ---> CH3-CHO (asetaldehida) + HCl (asam klorida)
- CH3-CH2OH (asetaldehida) + 3Cl2 ---> CCl3-CHO (trikloroasetaldehida) + 3HCl (asam klorida)
- 2CCl3-CHO (trikloroasetaldehida) + Ca(OH)2 (kalsium hidroksida) ---> 2CH3Cl (kloroform) + (HCOOH)2Ca (kalsium format)
Selain menggunakan etil alkohol, aseton dapat digunakan untuk menggantikan etil alkohol.[3] Reaksi yang terjadi adalah:
- Reaksi klorinasi [3]
- CH3COCH3 (aseton) + 3Cl2 ---> CCl3COCH3 (trikloroaseton) + 3HCl (asam klorida)
- Reaksi hidrolisis [3]
- CCl3COCH3 (trikloroaseton) + Ca(OH)2 ---> 2CH3Cl (kloroform) + (CH3COO)2Ca (kalsium asetat)
- Selain ketiga hal di atas, terdapat pula reaksi klorinasi metana yang membutuhkan suhu 400 °C.[3] Reaksi tersebut terjadi sebagai berikut:
- CH4 (metana) + Cl2 ---> CH3Cl + CH2Cl2 + CHCl3 + CCl4
- Untuk proses ini, kloroform dapat dipisahkan menggunakan distilasi bertingkat, dan proses ini paling banyak diaplikasikan dalam industri.[3]
Penggunaan
[sunting | sunting sumber]Pelarut
[sunting | sunting sumber]Kloroform dapat digunakan untuk mengekstraksi komponen yang tidak larut dalam air seperti lipid dalam proses isolasi DNA.[6] Proses isolasi DNA melibatkan larutan yang berisi campuran fenol, kloroform, dan isoamilalkohol. Campuran ini akan membuat suspensi DNA pada lapisan atas dan pengotor-pengotor akan mengendap pada bagian bawah tabung. Cairan yang berada pada bagian atas tabung akan diproses lebih lanjut untuk analisis DNA, dan bagian pengotor dibuang.[6]
Kloroform digunakan untuk mengekstraksi kafeina dalam minuman.[7] Untuk mendapatkan kafeina tersebut, dalam pemisahannya perlu ditambahkan diklorometana untuk menarik senyawa pengotor.[7] Lapisan kloroform diambil, lalu diuji menggunakan spektrofotometer ultraviolet.[7]
Kloroform dapat digunakan untuk campuran untuk menentukan konsentrasi detergen anionik seperti ''sodium dodesil sulfat''.[8] Metode yang dilakukan dinamakan Methylene Blue Active Substance.[8] Lapisan bagian kloroform diambil lalu diukur menggunakan spektrofotometer pada panjang gelombang 652 nm.[8]
Kloroform juga dapat digunakan untuk mengkuantifikasi secara kasar kandungan lipid dalam suatu sampel.[9] Untuk memisahkan lipid dari pengotor-pengotor lainnya, sering ditambahkan pelarut organik lainnya seperti metanol untuk menarik kandungan protein. Lapisan kloroform diambil lalu diuapkan hingga tersisa lipidnya.[9]
Reagen
[sunting | sunting sumber]Sebagai reagen, kloroform menyediakan gugus diklorokarben CCl2.[10] Kloroform bereaksi dengan natrium hidroksida berair biasanya dengan adanya katalis transfer fase untuk menghasilkan dikklorokarben CCl2.[11][12] Reagen ini memengaruhi ortho-formilasi cincin aromatik teraktivasi seperti fenol, menghasilkan aril aldehida dalam reaksi yang dikenal sebagai reaksi Reimer-Tiemann. Atau, karbena dapat terjebak oleh alkena untuk membentuk turunan siklopropana. Dalam reaksi adisi Kharasch, kloroform membentuk radikal bebas CHCl2 di samping alkena.
Anestesi
[sunting | sunting sumber]Kloroform termasuk dalam anestesi umum yang bekerja pada sistem saraf pusat.
Referensi
[sunting | sunting sumber]- ^ a b c d "NIOSH Pocket Guide to Chemical Hazards #0127". National Institute for Occupational Safety and Health (NIOSH).
- ^ a b "Chloroform". Immediately Dangerous to Life and Health. National Institute for Occupational Safety and Health (NIOSH).
- ^ a b c d e f g h i j k l m n (Inggris)Bahl A, Bahl BS. 2011. A Textbook of Organic Chemistry (for B.Sc Students). New Delhi: S. Chand & Company.
- ^ (Inggris)Stellman JM. 1998. Encyclopaedia of Occupational Health and Safety: Guides, Indexes, Directory. Geneva: International Labour Office.
- ^ (Inggris)Madigan M, Martinko J, Stahl D, Clark D. 2011. Brock Biology of Microorganisms. Ed ke-13. New York: Pearson.
- ^ a b (Indonesia)Suwanto A, Soka S, Candra Krishna Purnawan. 2008. Teknik Percobaan dalam Genetika Molekuler. Jakarta: Penerbit Atma Jaya.
- ^ a b c (Inggris)Bibby Scientific. The quantitative determination of caffeine in beverages and soft drinks using UV wavelength spectroscopy. http://www.jenway.com/adminimages/A09_010A_Determination_of_Caffeine_in_Beverages_using_UV_Wavelength_Spectroscopy(1).pdf
- ^ a b c (Inggris)Shahbazi R, Kermanshahi RK, Gharavi S, Nejad ZM, Borzooee F. 2013. Screening of SDS-degrading bacteria from car wash wastewater and study of the alkylsulfatase enzyme activity. IJM 5(2):153-158.
- ^ a b (Inggris)Amenta JS. 1970. A rapid extraction and quantification of total lipids and lipid fractions in blood and feces. Clin Chem 14(4): 399-346
- ^ Srebnik, M.; Laloë, E. (2001). "Chloroform". Encyclopedia of Reagents for Organic Synthesis. Encyclopedia of Reagents for Organic Synthesis. Wiley. doi:10.1002/047084289X.rc105. ISBN 0471936235.
- ^ (1988) "1,6-Methano[10annulene]". Org. Synth.; Coll. Vol. 6: 731.
- ^ (1988) "Phase-Transfer Hofmann Carbylamine Reaction: tert-Butyl Isocyanide". Org. Synth.; Coll. Vol. 6: 232.