Kadmium iodida

| |
| |

| |
| Nama | |
|---|---|
| Nama IUPAC
Kadmium(II) iodida
| |
| Nama lain
Kadmium diiodida
| |
| Penanda | |
Model 3D (JSmol)
|
|
| 3DMet | {{{3DMet}}} |
| ChemSpider | |
| Nomor EC | |
PubChem CID
|
|
| Nomor RTECS | {{{value}}} |
| UNII | |
CompTox Dashboard (EPA)
|
|
| |
| |
| Sifat | |
| CdI2 | |
| Massa molar | 366,22 g/mol |
| Penampilan | kristal putih hingga kuning pucat |
| Densitas | 5,64(0) g/cm3, padat |
| Titik lebur | 387 °C (729 °F; 660 K) |
| Titik didih | 742 °C (1.368 °F; 1.015 K) |
| 787 g/L (0 °C) 847 g/L (20 °C) 1250 g/L (100 °C) | |
| Kelarutan | larut dalam etanol, aseton, eter dan amonia |
| -117,2·10−6 cm3/mol | |
| Struktur | |
| Trigonal, hP3, space group P3m1, No. 164 | |
| oktahedral | |
| Bahaya | |
| Piktogram GHS |   
|
| Keterangan bahaya GHS | {{{value}}} |
| H301, H331, H351, H373, H400, H410 | |
| P260, P280, P301+330+331, P310, P304+340, P311, P403+233 | |
| Batas imbas kesehatan AS (NIOSH): | |
PEL (yang diperbolehkan)
|
[1910.1027] TWA 0.005 mg/m3 (as Cd)[1] |
REL (yang direkomendasikan)
|
Ca[1] |
IDLH (langsung berbahaya)
|
Ca [9 mg/m3 (as Cd)][1] |
| Senyawa terkait | |
Anion lain
|
Kadmium fluorida Kadmium klorida Kadmium bromida |
Kation lainnya
|
Seng iodida Raksa(II) iodida |
Kecuali dinyatakan lain, data di atas berlaku pada suhu dan tekanan standar (25 °C [77 °F], 100 kPa). | |
| Referensi | |
Kadmium iodida adalah suatu senyawa anorganik dengan rumus CdI2, yang tersusun dari cadmium dan iodin. Ia terkenal karena struktur kristalnya, yang khas untuk senyawa bentuk MX2 dengan efek polarisasi yang kuat.
Penggunaan[sunting | sunting sumber]
Kadmium iodida digunakan dalam litografi, fotografi, elektroplating dan pembuatan fosforus.[2]
Pembuatan[sunting | sunting sumber]
Kadmium iodida dibuat melalui penambahan logam kadmium, atau oksida, hidroksida atau karbonatnya ke asam iodida.
Selain iut, senyawa dapat dibuat dengan memanaskan kadmium dan iodin.
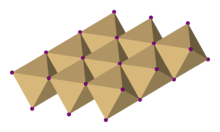
Struktur kristal[sunting | sunting sumber]
Dalam kadmium iodida, anion iodida membentuk pengaturan heksagonal dengan kation kadmium mengisi seluruh situs oktahedral pada lapisan yang berselang seling. Hasil strukturnya berisi kisi berlapis. Struktur dasar yang sama ditemukan juga dalam banyak garam dan mineral lainnya. Kadmium iodida sebagian besar berikatan ionik, dengan sedikit karakter kovalen.[3]
Struktur kristal kadmium iodida dapat dianggap sebagai purwarupa struktur kristal senyawa lainnya. Senyawa dengan karakteristik berikut cenderung mengadopsi struktur CdI2:
- Iodida dari kation yang terpolarisasi sedang; bromida dan klorida dari kation terpolarisasi kuat.
- Hidroksida dari dikation, yaitu senyawa dengan rumus umum M(OH)2
- Sulfida, selenida dan telurida (kalkogen) dari tetrakation, yaitu senyawa dengan rumus umum MX2, dengan X = S, Se, Te.
Senyawa dengan struktur kristal CdI2[sunting | sunting sumber]

Iodida[sunting | sunting sumber]
MgI2, TiI2, VI2, MnI2, FeI2, CoI2, CaI2, PdI2, PbI2.
Klorida dan bromida[sunting | sunting sumber]
MgBr2, TiBr2, VBr2, MnBr2, FeBr2, CoBr2.
Hidroksida dari M2+[sunting | sunting sumber]
Kalkogenida dari M4+[sunting | sunting sumber]
TiS2, ZrS2, SnS2, α-TaS2, PtS2;
TiSe2, ZrSe2, SnSe2, PtSe2; CrSe2
SiTe2, TiTe2, CoTe2, NiTe2, PdTe2, PtTe2.
Lain-lain[sunting | sunting sumber]
Referensi[sunting | sunting sumber]
- ^ a b c "NIOSH Pocket Guide to Chemical Hazards #0087". National Institute for Occupational Safety and Health (NIOSH).
- ^ Pradyot Patnaik. Handbook of Inorganic Chemicals. McGraw-Hill, 2002, ISBN 0-07-049439-8
- ^ Greenwood, Norman N.; Earnshaw, A. (1997), Chemistry of the Elements (edisi ke-2), Oxford: Butterworth-Heinemann, hlm. 1211–1212, ISBN 0-7506-3365-4
