Kalium sulfida
| |
| Nama | |
|---|---|
| Nama IUPAC
Kalium sulfida
| |
| Nama lain
Dikalium monosulfida,
Dikalium sulfida, Kalium monosulfida, Kalium sulfida | |
| Penanda | |
Model 3D (JSmol)
|
|
| 3DMet | {{{3DMet}}} |
| ChemSpider | |
| Nomor EC | |
PubChem CID
|
|
| Nomor RTECS | {{{value}}} |
CompTox Dashboard (EPA)
|
|
| |
| |
| Sifat | |
| K2S | |
| Massa molar | 110.262 g/mol |
| Penampilan | murni: tidak berwarna tidak murni: kuning-coklat |
| Bau | H2S |
| Densitas | 1.74 g/cm3 |
| Titik lebur | 840 °C (1.540 °F; 1.110 K) |
| Titik didih | 912 °C (1.674 °F; 1.185 K) (berdekomposisi) |
| Berubah menjadi KSH, KOH | |
| Kelarutan dalam Pelarut lain | Dapat larut dalam etanol, gliserol tidak dapat larut dalam eter |
| −60.0·10−6 cm3/mol | |
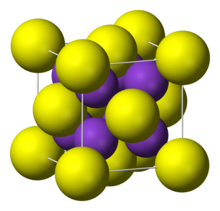
| Struktur | |
| antiFluorit | |
| Bahaya | |
| Bahaya utama | Bahaya untuk lingkungan (N) |
| Frasa-R | R17, R23, R25, R31, R34, R50 |
| Frasa-S | S24, S26 |
| Senyawa terkait | |
Kation lainnya
|
Natrium sulfida, Besi(II) sulfida |
Senyawa terkait
|
Kalium hidrosulfida, Kalium sulfit, Kalium sulfat |
Kecuali dinyatakan lain, data di atas berlaku pada suhu dan tekanan standar (25 °C [77 °F], 100 kPa). | |
| Referensi | |
Kalium sulfida adalah senyawa anorganik dengan rumus K2S. Senyawa padat tidak berwarna ini jarang ditemui karena sangat mudah bereaksi dengan air dan menghasilkan kalium hidrosulfida (KSH) dan kalium hidroksida (KOH).
Struktur[sunting | sunting sumber]
Senyawa ini memiliki "struktur antifluorit", sehingga ion K+ menduduki posisi (F−) dalam fluorit, sementara ion S2− yang lebih besar menduduki posisi kalsium.[1]
Pembuatan[sunting | sunting sumber]
Senyawa ini dapat dibuat dengan memanaskan K2SO4 dengan kokas:
- K2SO4 + 4 C → K2S + 4 CO
Di dalam laboratorium, kalium sulfida murni dapat dibuat dari reaksi kalium dengan sulfur di dalam amonia anhidrat.[2]
Senyawa ini merupakan basa kuat, sehingga mengalami hidrolisis secara menyeluruh jika bereaksi dengan air:
- K2S + H2O → KOH + KSH
Kegunaan dalam kembang api[sunting | sunting sumber]
Kalium sulfida terbentuk saat bubuk hitam dibakar dan merupakan bahan perantara dalam berbagai efek piroteknik, seperti senko hanabi dan beberapa formulasi glitter.[3]
Referensi[sunting | sunting sumber]
- ^ Holleman, A. F.; Wiberg, E. "Inorganic Chemistry" Academic Press: San Diego, 2001. ISBN 0-12-352651-5.
- ^ Handbook of Preparative Inorganic Chemistry, 2nd Ed. Edited by G. Brauer, Academic Press, 1963, NY. Vol. 1. hlm. 360.
- ^ Shimizu, Takeo. "Fireworks: the Art, Science, and Technique." Pyrotechnica Publications: Austin, 1981. ISBN 0-929388-05-4.
