Sulfonasi aromatik
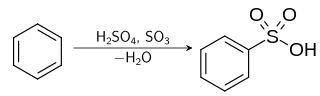
Sulfonasi adalah suatu reaksi organik di mana suatu atom hidrogen pada hidrokarbon aromatik digantikan oleh suatu asam sulfonat (SO3H) dalam suatu substitusi elektrofilik aromatik.[1] Asam aril sulfonat digunakan sebagai bahan utama dari detergen.[2] Bahan ini juga digunakan sebagai bahan dasar dari pewarna dan obat-obatan.
Mekanisme reaksi[sunting | sunting sumber]
Mekanisme reaksi sulfonasi melibatkan pemanasan senyawa aromatik dengan asam sulfat:[3]
- C6H6 + H2SO4 → C6H5SO3H + H2O
Sulfur trioksida atau derivat terprotonasinya merupakan elektrofil sebenarnya dalam substitusi elektrofilik aromatik.
Untuk menuju kesetimbangan, agen pendehidrasi seperti tionil klorida dapat ditambahkan.
- C6H6 + H2SO4 + SOCl2 → C6H5SO3H + SO2 + 2 HCl
Asam klorosulfat dapat pula menjadi agen pendehidrasi yang efektif:
- C6H6 + HSO3Cl → C6H5SO3H + HCl
Berbeda dengan nitrasi aromatik dan kebanyakan substitusi elektrofilik aromatik lainnya reaksi ini merupakan reaksi bolak-balik (reversibel). Sulfonasi berlangsung dalam kondisi asam pekat dan desulfonasi dilakukan dalam asam encer berair yang panas. Kedapatbalikan ini sangat berguna dalam melindungi sistem aromatik karena kedapatbalikan tersebut.

Metode khusus[sunting | sunting sumber]
Banyak metode telah dikembangkan untuk memasukkan gugus sulfonat selain dari arah sulfonasi.
Reaksi Piria[sunting | sunting sumber]

Salah satu reaksi nama yang klasik adalah reaksi Piria (R. Piria, 1851) yang mana nitrobenzena direaksikan dengan suatu logam bisulfit membentuk asam aminosulfonat sebagai hasil penggabungan reduksi gugus nitro dan sulfonasi.[4][5]
Proses sulfonasi pada ban[sunting | sunting sumber]
Dalam proses sulfonasi ban karet (1917),[6] uap benzena dituntun melalui suatu bejana yang mengandung 90% asam sulfat dan suhu yang meningkat dari 100 menjadi 180 °C. Air dan benzena terus dihilangkan dalam kondensor dan lapisan benzena diberikan sebagai umpan balik kepada bejana. Dengan cara ini diperoleh rendemen sebesar 80%.

Sintesis asam sulfanilat dari anilin dan asam sulfat.[7]
Aplikasi[sunting | sunting sumber]
Asam sulfonat aromatik adalah zat antara dalam penyiapan pewarna dan banyak obat-obatan. Sulfonasi dari anilin mengarah kepada sekelompok besar obat sulfa.
Sulfonasi dari polistirena digunakan untuk membuat natrium polistirena sulfonat, suatu resin pertukaran ion yang umum untuk pelunakan air.
-
Polistirena
-
Polistirena sulfonat
-
Natrium polistirena sulfonat
Reaksi aril sulfonat[sunting | sunting sumber]
Sebagai gugus fungsional, asam sulfonat aril menunjukkan dua reaksi yang berbeda:
- Desulfonasi ketika dipanaskan dalam air mendekati 200 °C. Reaksi, suatu hidrolisis, adalah kebalikan dari sulfonasi tersebut. Suhu desulfonasi berkorelasi dengan kemudahan sulfonasi:
- RC6H4SO3H + H2O → RC6H5 + H2SO4H
Reaktivitas ini dimanfaatkan dalam konversi regiospesifik dari 2-klorotoluena melalui klorinasi p-toluenasulfonat, diikuti oleh hidrolisis zat antara.
- Ketika diperlakukan dengan basa kuat, turunan asam benzenasulfonat diubah menjadi fenol (melalui fenoksida).
- C6H5SO3H + 2 NaOH → C6H5ONa + NaHSO4H
lihat pula[sunting | sunting sumber]
Referensi[sunting | sunting sumber]
- ^ March, Jerry (1985). Advanced Organic Chemistry, Reactions, Mechanisms and Structure (dalam bahasa Inggris) (edisi ke-3). John Wiley & Sons. ISBN 0-471-85472-7. .
- ^ Cahyana, A. S., dan Sulistiyowati, W (2020). Wahyuni, Hana Catur, ed. Proses Kimia dalam Industri Manufaktur 2. Sidoarjo: UMSIDA Press. hlm. 32. ISBN 978-623-6833-73-5.
- ^ Otto Lindner, Lars Rodefeld "Benzenesulfonic Acids and Their Derivatives" in Ullmann's Encyclopedia of Industrial Chemistry 2005, Wiley-VCH, Weinheim. doi:10.1002/14356007.a03_507
- ^ Piria, Raffaele (1851). "Über einige Produkte der Einwirkung des schwefligsäuren Ammoniaks auf Nitronaphtalin". Annalen der Chemie und Pharmacie. 78: 31–68. doi:10.1002/jlac.18510780103. ISSN 0075-4617.
- ^ THE PIRIA REACTION. I. THE OVER-ALL REACTION W. H. Hunter, Murray M. Sprung J. Am. Chem. Soc., 1931, 53 (4), pp 1432–1443 doi:10.1021/ja01355a037.
- ^ U.S. Patent 1,210,725
- ^ Siegfried Hauptmann: Organische Chemie, 2nd Edition, VEB Deutscher Verlag für Grundstoffindustrie, Leipzig, 1985, p. 511, ISBN 3-342-00280-8.





