Periodinana Dess–Martin
| |

| |
| Nama | |
|---|---|
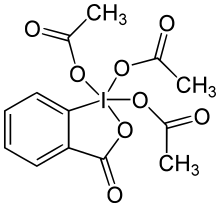
| Nama IUPAC
3-Okso-1,3-dihidro-1λ5,2-benziodoksola-1,1,1-triil triasetat
| |
| Nama lain
Periodinan Dess–Martin
| |
| Penanda | |
Model 3D (JSmol)
|
|
| 3DMet | {{{3DMet}}} |
| ChemSpider | |
| Nomor EC | |
PubChem CID
|
|
| Nomor RTECS | {{{value}}} |
CompTox Dashboard (EPA)
|
|
| |
| |
| Sifat | |
| C13H13IO8 | |
| Massa molar | 424,14 g/mol |
| Penampilan | bubuk, serpihan, atau kristal putih |
| Densitas | 1,362 g/cm3 padat |
| Titik lebur | 103 hingga 133 °C (217 hingga 271 °F; 376 hingga 406 K) |
| Senyawa terkait | |
Senyawa terkait
|
Asam 2-Iodoksibenzoat |
Kecuali dinyatakan lain, data di atas berlaku pada suhu dan tekanan standar (25 °C [77 °F], 100 kPa). | |
| Referensi | |
Periodinana Dess–Martin (bahasa Inggris: Dess–Martin periodinane, disingkat DMP) adalah suatu pereaksi kimia yang digunakan untuk mengoksidasi alkohol primer menjadi aldehida dan alkohol sekunder menjadi keton.[1][2] Periodinana ini memiliki beberapa kelebihan dibandingkan dengan oksidator lainnya yang berbasis kromium dan DMSO, yakni kondisi reaksi yang lebih lembut (temperatur ruangan dan pH netral), waktu reaksi yang lebih singkat, rendemen yang lebih tinggi, proses pengolahan lanjutan yang lebih sederhana, kemoselektivitas yang tinggi, toleransi gugus-gugus fungsi sensitif yang tinggi, dan umur simpan pereaksi yang panjang. Walau demikian, penggunaan pereaksi ini dalam skala industri sulit dilakukan karena biayanya yang tinggi serta potensinya untuk meledak.[3] Pereaksi ini dinamai dari nama kimiawan Amerika Daniel Benjamin Dess and James Cullen Martin, yang mengembangkan pereaksi ini pada tahun 1983. Pereaksi ini dikembangkan dari senyawa IBX. Karena gugus-gugus asetat berikatan dengan atom pusat iodin, DMP lebih reaktif dan lebih mudah larut dalam berbagai pelarut organik daripada IBX.[4]
Pembuatan
[sunting | sunting sumber]Pembuatan DMP dimulai dari sintesis IBX yang didapati dengan mereaksikan asam 2-iodobenzoat dengan okson pada temperatur tinggi selama 3 jam.[5] IBX kemudian diasilasi menggunakan prosedur yang dimodifikasi oleh Ireland dan Liu.[6] Modifikasi ini mengizinkan hasil rendemen reaksi yang tinggi serta prosedur pengolahan lanjutan yang lebih sederhana. Padatan yang dihasilkan dari reaksi ini dapat diisolasi cukup dengan filtrasi dan pembilasan dengan eter. Ireland dan Liu menggunakan sejumlah kecil katalis asam tosilat agar reaksi berjalan dengan tuntas dalam kurun waktu kurang dari 2 jam (lebih cepat dibandingkan dengan sintesis tanpa katalis yang mengambil waktu 24 jam). Rendemen reaksi yang menggunakan prosedur modifikasi ini adalah lebih dari 90%.
Metode asli yang dikembangkan oleh Boeckman and Mullins[7] melibatkan pemanasan larutan kalium bromat, asam sulfat, dan asam 2-iodobenzoat untuk menghasilkan IBX. IBX kemudian diasilasi menggunakan asetat anhidrida dan asam asetat.
Mekanisme oksidasi
[sunting | sunting sumber]Periodinana Dess–Martin utamanya digunakan sebagai oksidator bagi senyawa-senyawa alkohol yang rumit, sensitif dan bergugus fungsi jamak. Salah satu alasan mengapa pereaksi ini cukup efektif adalah selektivitasnya yang tinggi terhadap gugus hidroksil, sehingga alkohol dapat menjalani pertukaran ligan dengan cepat; pertukaran ligan ini merupakan langkah pertama reaksi oksidasi.
Eksperimen menggunakan NMR proton mengindikasikan bahwa satu ekuivalen alkohol membentuk senyawa antara diasetoksialkoksiperiodinana. Asetat kemudian sebagai basa mendeprotonasi hidrogen α alkohol dan selanjutnya menjadi senyawa karbonil, iodinana, dan asam asetat.
Ketika terdapat lebih dari satu ekuivalen alkohol, seperti misalnya diol, maka senyawa antara yang terbentuk adalah asetoksidialkoksiperiodinana. Dikarenakan senyawa antara ini tidak stabil, oksidasi terjadi lebih cepat.[4]
Schreiber dkk. menunjukkan bahwa air meningkatkan laju oksidasi.[8] Dess dan Martin awalnya mengamati bahwa oksidasi etanol menjadi lebih cepat ketika ada satu ekuivalen etanol yang berlebih dalam reaksi. Dipercayai bahwa laju disosiasi ligan asetat terakhir dari iodin menjadi lebih cepat dikarenakan kemampuan pendonoran elektron yang lebih besar dari gugus hidroksil, sehingga ikatan I-OAc melemah.[4]
Kemoselektivitas
[sunting | sunting sumber]Dengan menggunakan kondisi standar, alkohol dapat dioksidasi menjadi aldehida/keton tanpa memengaruhi cincin furan, gugus sulfida, vinil eter, dan amida sekunder.[4] Alkohol alilik, yang sulit dioksidasi menggunakan oksidator lainnya, lebih mudah dioksidasi menggunakan DMP.[9]
Myers dkk. berhasil menentukan bahwa DMP dapat mengoksidasi amino alkohol yang ber-N-proteksi tanpa mengalami epimerisasi (berbanding terbalik dengan oksidator lainnya seperti oksidasi Swern). Senyawa amino alkohol yang berproteksi ini sangatlah penting dalam industri farmasi.[10]
Senyawa alkohol benzilik dan alkohol alilik bereaksi lebih cepat daripada alkohol jenuh.[4] Selain itu, pengoksidasian aldoksim dan ketoksim menjadi aldehida dan keton berjalan lebih cepat daripada pengoksidasian alkohol primer, sekunder, ataupun benzilik.[11]
Lihat pula
[sunting | sunting sumber]- Oksidasi Swern
- Oksidasi Parikh–Doering
- Oksidasi Corey–Kim
- Oksidasi Pfitzner–Moffatt
- Piridinium klorokromat
- Oksidasi Jones
- Oksidasi Ley
- Oksidasi Oppenauer
Referensi
[sunting | sunting sumber]- ^ Dess, D. B.; Martin, J. C. (1983). "Readily accessible 12-I-5 oxidant for the conversion of primary and secondary alcohols to aldehydes and ketones". J. Org. Chem. 48: 4155. doi:10.1021/jo00170a070.
- ^ Boeckman, R. J. In "Encyclopedia of Reagents for Organic Synthesis"; Paquette, L. A., Ed.; Wiley: Chichester, UK, 1995, Vol. 7, pp. 4982–4987. (Review)
- ^ Plumb, J.B.; Harper, D.J. (1990). "Chemical Safety: 2-Iodoxybenzoic acid". Chem. Eng. News. 68: 3. doi:10.1021/cen-v068n029.p002.
- ^ a b c d e Dess, D. B.; Martin, J. C. (1991). "A useful 12-I-5 triacetoxyperiodinane (the Dess-Martin periodinane) for the selective oxidation of primary or secondary alcohols and a variety of related 12-I-5 species". J. Am. Chem. Soc. 113: 7277. doi:10.1021/ja00019a027.
- ^ Frigerio, M.; Santagostino, M.; Sputore, S. (1999). "A User-Friendly Entry to 2-Iodoxybenzoic Acid (IBX)". J. Org. Chem. 64: 4537. doi:10.1021/jo9824596.
- ^ Ireland, R. E.; Liu, L. (1993). "An improved procedure for the preparation of the Dess-Martin periodinane". J. Org. Chem. 58: 2899. doi:10.1021/jo00062a040.
- ^ Boeckman Jr., R. K.; Shao, P.; Mullins, J. J. (2004). "The Dess-Martin Periodinane". Org. Synth.; Coll. Vol. 10: 696.
- ^ Meyer, S. D.; Schreiber, S. L. (1994). "Acceleration of the Dess-Martin Oxidation by Water". J. Org. Chem. 59: 7549. doi:10.1021/jo00103a067.
- ^ Lawrence, N.J.; Crump, J.P.; McGown, A.T.; Hadfield, J.A. (2001). "Reaction of Baylis-Hillman products with Swern and Dess-Martin oxidants". Tetrahedron Lett. 42: 3939. doi:10.1016/S0040-4039(01)00587-1.
- ^ Myers, A.G.; et al. (2000). "Synthesis of highly epimerizable N-protected _-amino aldehydes of high enantiomeric excess". Tetrahedron Lett. 41: 1359. doi:10.1016/S0040-4039(99)02293-5.
- ^ Chaudhari, S.S.; Akamanchi, K.G. (1999). "A mild, chemoselective, oxidative method for deoximation using Dess-Martin periodinane". Synthesis. 1999: 760. doi:10.1055/s-1999-3476.





