Karboksilat: Perbedaan antara revisi
k Bot: Perubahan kosmetika |
k Bot: Perubahan kosmetika |
||
| Baris 1: | Baris 1: | ||
[[Berkas:Carboxylate-resonance-hybrid.png| |
[[Berkas:Carboxylate-resonance-hybrid.png|jmpl|255px|Ion karboksilat]] |
||
[[Berkas:Acrylate-ion-3D-balls.png| |
[[Berkas:Acrylate-ion-3D-balls.png|jmpl|Ion akrilat]] |
||
Suatu '''karboksilat''' adalah suatu [[Garam (kimia)|garam]] atau [[ester]] dari [[asam karboksilat]]. |
Suatu '''karboksilat''' adalah suatu [[Garam (kimia)|garam]] atau [[ester]] dari [[asam karboksilat]]. |
||
Revisi per 6 November 2018 12.18


Suatu karboksilat adalah suatu garam atau ester dari asam karboksilat. Garam karboksilat memiliki rumus umum M(RCOO)n, dengan M adalah logam dan n adalah 1, 2,...; ester karboksilat memiliki rumus umum RCOOR′. R dan R′ adalah gugus organik; R′ ≠ H.
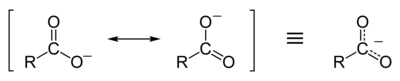
Suatu ion karboksilat adalah basa konjugat dari asam karboksilat, RCOO−. Ia adalah ion bermuatan negatif.
Resonansi stabilisasi ion karboksilat
Asam karboksilat mudah terdisosiasi menjadi anion karboksilat dan ion hidrogen bermuatan positif (proton), jauh lebih mudah daripada alkohol (menjadi ion alkoksida dan proton), karena ion karboksilat distabilkan oleh resonansi. Muatan negatif yang tersisa setelah deprotonasi gugus karboksil terdelokalisasi di antara dua atom oksigen elektronegatif dalam struktur resonansi.
Delokalisasi awan elektron ini berarti bahwa kedua atom oksigen memiliki muatan negatif yang kurang kuat; oleh karena itu, proton positif kurang tertarik kembali ke gugus karboksilat begitu ia telah pergi; sehingga, ion karboksilat lebih stabil. Sebaliknya, ion alkoksida, sekali terbentuk, akan memiliki muatan negatif yang kuat pada atom oksigen, sehingga menyulitkan proton untuk melepaskan diri. Dengan demikian, asam karboksilat memiliki pH yang lebih rendah daripada alkohol: semakin tinggi jumlah proton dalam larutan, semakin rendah pH-nya.[1]
Contoh
- Ion format, HCOO−
- Ion asetat, CH3COO−
- Ion laktat, CH3CH(OH)COO−
- Ion oksalat, (COO)2−2
- Ion sitrat, C3H5O(COO)3−3
Referensi
- ^ Fox, Marye Anne; Whitesell, James K. (1997). Organic Chemistry (edisi ke-2nd). Sudbury, MA: Jones and Bartlett Publishers. ISBN 0-7637-0178-5.