Fosfor



Fosfor adalah zat-zat yang menunjukkan fenomena luminesensi, yaitu mengeluarkan cahaya pendar ketika terkena beberapa jenis energi radiasi. Istilah ini digunakan baik untuk zat fluoresen ataupun fosforesen yang berpendar oleh karena paparan sinar ultraviolet atau cahaya tampak, dan zat katodoluminesen yang berpendar ketika dihantam oleh berkas elektron (sinar katode) dalam tabung sinar katode.
Ketika fosfor terkena radiasi, elektron orbital dalam molekulnya tereksitasi ke tingkat energi yang lebih tinggi; ketika mereka kembali ke tingkat sebelumnya, mereka memancarkan energi sebagai cahaya warna tertentu. Fosfor dapat diklasifikasikan menjadi dua kategori: zat fluoresen yang memancarkan energi segera dan berhenti bersinar ketika radiasi yang mengeksitasi dimatikan, dan zat fosforesen yang memancarkan energi setelah penundaan, sehingga mereka tetap bersinar setelah radiasi dimatikan, meluruh dalam kecerahan selama periode milidetik hingga hari.
Bahan fluoresen digunakan dalam aplikasi di mana fosfor tereksitasi terus menerus: tabung sinar katode (cathode-ray tube, CRT) dan layar tampilan video plasma, layar fluoroskop, lampu fluoresen, sensor skintilasi, dan LED putih, serta cat bercahaya untuk seni cahaya hitam. Fosforesen digunakan di mana cahaya persisten diperlukan, seperti tampilan jam bercahaya dalam gelap dan instrumen pesawat, dan di layar radar untuk memungkinkan 'blip' target tetap terlihat saat pancaran radar berputar. Fosfor CRT distandarisasi mulai sekitar Perang Dunia II dan ditandai dengan huruf "P" diikuti dengan angka.
Fosforus, unsur kimia pemancar cahaya di mana fosfor mendapatkan namanya, memancarkan cahaya karena kemiluminesen, bukan fosforesen.[1]
Proses emisi cahaya[sunting | sunting sumber]
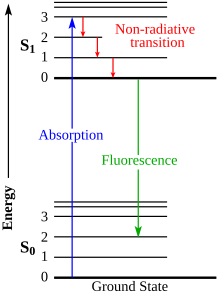
Proses skintilasi pada bahan anorganik disebabkan oleh struktur pita elektronik yang terdapat pada kristal. Partikel yang masuk dapat mengeksitasi elektron dari pita valensi ke pita konduksi atau pita eksiton (terletak tepat di bawah pita konduksi dan dipisahkan dari pita valensi oleh celah energi). Ini meninggalkan lubang terkait di belakang, di pita valensi. Kotoran menciptakan level elektronik di celah terlarang. Eksiton adalah pasangan elektron–lubang terikat longgar yang berkeliaran melalui kisi kristal sampai mereka ditangkap secara keseluruhan oleh pusat pengotor. Yang terakhir kemudian dengan cepat dideeksitasi dengan memancarkan cahaya kilau (komponen cepat). Dalam kasus skintilator, anorganik, pengotor aktivator biasanya dipilih sehingga cahaya yang dipancarkan berada dalam kisaran tampak atau dekat UV, di mana pengganda foto menjadi efektif. Lubang dan elektron tersebut ditangkap secara berurutan oleh pusat pengotor yang menarik keadaan metastabil tertentu yang tidak dapat diakses oleh eksiton. Deeksitasi tertunda dari keadaan pengotor metastabil tersebut, diperlambat oleh ketergantungan pada mekanisme terlarang probabilitas rendah, sekali lagi menghasilkan emisi cahaya (komponen lambat).
Fosfor sering merupakan senyawa logam transisi atau senyawa tanah jarang dari berbagai jenis. Dalam fosfor anorganik, ketidakhomogenan dalam struktur kristal ini biasanya dibuat dengan penambahan sejumlah kecil dopan, pengotor yang disebut dengan aktivator. (Dalam kasus yang jarang terjadi, dislokasi atau cacat kristal lainnya dapat memainkan peran pengotor.) Panjang gelombang yang dipancarkan oleh pusat emisi bergantung pada atom itu sendiri dan pada struktur kristal di sekitarnya.
Lihat pula[sunting | sunting sumber]
Referensi[sunting | sunting sumber]
- ^ Emsley, John (2000). The Shocking History of Phosphorus. London: Macmillan. ISBN 978-0-330-39005-7.
Bibliografi[sunting | sunting sumber]
- Arunachalam Lakshmanan (2008). Luminescence and Display Phosphors: Phenomena and Applications. Nova Publishers. ISBN 978-1-60456-018-3.
Pranala luar[sunting | sunting sumber]
- sejarah tampilan elektroluminesen Diarsipkan 2012-04-30 di Wayback Machine..
- Fluoresen Diarsipkan 2006-04-07 di Wayback Machine., Fosforesen Diarsipkan 2006-04-07 di Wayback Machine.
- Karakteristik Fosfor CRT (nomor P)
- Komposisi fosfor CRT
- Oksinitrida berbasis silikon dan fosfor nitrida untuk LED putih—Ulasan
- [1] Diarsipkan 2023-04-10 di Wayback Machine. & [2] Diarsipkan 2023-04-10 di Wayback Machine. – Manual RCA, Layar fluoresen (hlm. 1 hingga hlm. 24)
- Komposisi Fosfor Anorganik, Persiapan dan Sifat Optik, William M. Yen dan Marvin J. Weber Diarsipkan 2016-03-06 di Wayback Machine.
