Osmosis
Osmosis adalah perpindahan molekul terlarut melalui selaput semipermiabel dari bagian yang lebih encer ke bagian yang lebih pekat atau dari bagian yang konsentrasi pelarut (misalnya air) rendah (hipotonis) ke konsentrasi pelarut (misalnya air) tinggi (hipertonis). Membran semipermeabel harus dapat dilewati oleh pelarut, tetapi tidak oleh zat terlarut, yang mengakibatkan gradien tekanan sepanjang membran.
Osmosis merupakan suatu fenomena alami, tetapi dapat dihambat secara buatan dengan meningkatkan tekanan pada bagian dengan konsentrasi pekat menjadi melebihi bagian dengan konsentrasi yang lebih cair. Gaya per unit luas ang dibutuhkan untuk mencegah mengalirnya pelarut melalui membran permeabel selektif dan masuk ke larutan dengan konsentrasi yang lebih pekat sebanding dengan tekanan turgor.
Tekanan osmotik merupakan sifat koligatif, yang berarti bahwa sifat ini bergantung pada konsentrasi zat terlarut, dan bukan pada sifat zat terlarut itu sendiri.
Osmosis adalah suatu topik yang penting dalam biologi karena fenomena ini dapat menjelaskan mengapa air dapat ditransportasikan ke dalam dan ke luar sel.
Album
[sunting | sunting sumber]- Osmosis
-
Proses terjadinya osmosis, melalui simulasi komputer
-
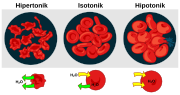
Efek perbedaan larutan terhadap sel darah
-
Sel tumbuhan dalam beberapa lingkungan berbeda
Faktor yang mempengaruhi Osmosis:
- Ukuran molekul yang meresap: Molekul yang lebih kecil daripada garis pusat lubang membran akan meresap dengan lebih mudah.
- Keterlarutan lipid: Molekul yang mempunyai keterlarutan yang tinggi meresap lebih cepat daripada molekul yang kelarutan yang rendah seperti lipid.
- Luas permukaan membran: Kadar resapan menjadi lebih cepat jika luas permukaan membran yang disediakan untuk resapan adalah lebih besar.
- Ketebalan membran: Kadar resapan sesuatu molekul berkadar songsang dengan jarak yang harus dilaluinya. Berbanding dengan satu membran yang tebal, kadar resapan melalui satu membran yang tipis adalah lebih cepat.
- Suhu: Pergerakan molekul dipengaruhi oleh suhu. Kadar resapan akan menjadi lebih cepat pada suhu yang tinggi dibandingkan dengan suhu yang rendah.
Osmosis merupakan difusi air melintasi membran semipermeabel dari daerah dimana air lebih banyak ke daerah dengan air yang lebih sedikit . Osmosis sangat ditentukan oleh potensial kimia air atau potensial air, yang menggambarkan kemampuan molekul air untuk dapat melakukan difusi. Sejumlah besar volume air akan memiliki kelebihan energi bebas daripada volume yang sedikit, di bawah kondisi yang sama.
Energi bebas zuatu zat per unit jumlah, terutama per berat gram molekul (energi bebas mol-1) disebut potensial kimia. Potensial kimia zat terlarut kurang lebih sebanding dengan konsentrasi zat terlarutnya. Zat terlarut yang berdifusi cenderung untuk bergerak dari daerah yang berpotensi kimia lebih tinggi menuju daerah yang berpotensial kimia lebih kecil (Ismail, 2006).
Dalam tubuh organisme multiseluler, air bergerak dari satu sel ke sel lainnya dengan leluasa karena adanya peristiwa osmosis. Selain air,molekul-molekul yang berukuran kecil seperti O2 dan CO2 juga mudah melewati membran sel. Molekul-molekul tersebut akan berdifusi dari daerah dengan konsentrasi tinggi ke konsentrasi rendah. Proses Osmosis akan berhenti jika konsentrasi zat di kedua sisi membran tersebut telah mencapai keseimbangan(Anonim, 2009).Struktur dinding sel dan membran sel berbeda. Membran memungkinkan molekul air melintas lebih cepat daripada unsur terlarut; dinding sel primer biasanya sangat permeabel terhadap keduanya. Memang membran sel tumbuhan memungkinkan berlangsungnya osmosis, tetapi dinding sel yang turgid itulah yang menimbulkan tekanan.
Sel hewan tidak mempunyai dinding, sehingga bila timbul tekanan didalamnya, sel tersebut sering pecah, seperti yang terjadi saat sel darah merah dimasukkan dalam air. Sel yang turgid banyak berperan dalam menegakkan tumbuhan yang tidak berkayu (Salisbury, 1995).Jika dijelaskan sebagai konsep termodinamika, osmosis dapat dianalogikan sebagai proses perubahan entrropi. Komponen solvent murni memiliki entropi rendah, sedangkan komponen berkandungan solut tinggi memiliki entropi yg tinggi juga. Mengikuti Hukum TermoII: setiap perubahan yang terjadi selalu menuju kondisi entropi maksimum, maka solvent akan mengalir menuju tempat yang mengandung solut lebih banyak, sehingga total entropi akhir yang diperoleh akan maksimum. Solvent akan kehilangan entropi,dan solut akan menyerap entropi. Saat kesetimbangan tercapai, entropi akan maksimum, atau gradien (perubahan entropi terhadap waktu) bernilai nol, pada titik ekstrem, dS/dt = 0 (Wibosono, 2009)