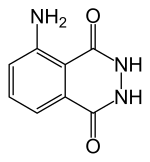
Luminol
| |
| |
| Nama | |
|---|---|
| Nama IUPAC (preferensi)
5-Amino-2,3-dihydrophthalazine-1,4-dione | |
| Nama lain
5-Amino-2,3-dihidro-1,4-ftalazinadion
o-Aminoftaloil hidrazida o-Aminoftalil hidrazida 3-Aminoftalhidrazida 3-Aminoftalat hidrazida | |
| Penanda | |
Model 3D (JSmol)
|
|
| 3DMet | {{{3DMet}}} |
| ChEMBL | |
| ChemSpider | |
| Nomor EC | |
PubChem CID
|
|
| Nomor RTECS | {{{value}}} |
CompTox Dashboard (EPA)
|
|
| |
| |
| Sifat | |
| C8H7N3O2 | |
| Massa molar | 177.16 g/mol |
| Titik lebur | 319 °C |
| Bahaya | |
| Lembar data keselamatan | MSDS for luminol |
Kecuali dinyatakan lain, data di atas berlaku pada suhu dan tekanan standar (25 °C [77 °F], 100 kPa). | |
| Referensi | |
Luminol (C8H7N3O2) adalah suatu zat kimia yang menghasilkan kemiluminesensi, dengan cahaya pendar berwarna biru, ketika dicampur dengan suatu agen pengoksidasi yang sesuai. Luminol merupakan suatu padatan kristalin putih-hingga-kuning-pucat yang larut dalam banyak pelarut organik, namun tak larut dalam air.
Penyidik forensik menggunakan luminol untuk mendeteksi jumlah jejak darah pada tempat kejadian perkara (TKP), karena zat ini bereaksi dengan besi dalam hemoglobin. Ahli biologi menggunakan zat ini dalam asai seluler untuk mendeteksi tembaga, besi, dan sianida, serta protein spesifik pada western blot.
Bila luminol disemprotkan secara merata di suatu area, sejumlah oksidator teraktivasi membuat luminol memancarkan cahaya biru yang dapat dilihat di ruangan yang gelap. Cahaya hanya berlangsung sekitar 30 detik, namun penyidik dapat mendokumentasikan efeknya dengan fotografi pajaran-panjang. Penyidik TKP harus menerapkannya secara merata untuk menghindari hasil yang menyesatkan, karena jejak darah tampak lebih terkonsentrasi di area yang menerima lebih banyak semprotan. Intensitas cahaya tidak menunjukkan jumlah darah atau aktivator lain yang ada, namun hanya menunjukkan distribusi jumlah jejak di daerah tersebut.
Kemiluminesensi[sunting | sunting sumber]

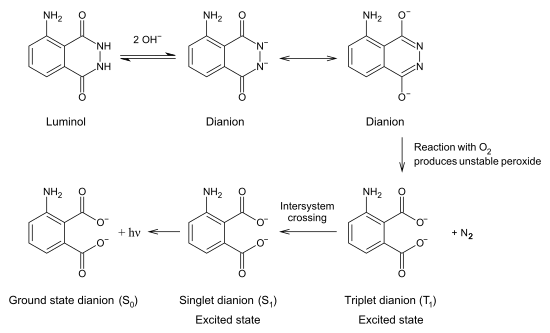
Untuk mengeluarkan pendarannya, luminol harus diaktivasi oleh suatu zat pengoksidasi. Biasanya, suatu larutan mengandung hidrogen peroksida (H2O2) dan ion hidroksida dalam air merupakan aktivatornya. Dalam kehadiran katalis seperti besi atau senyawa periodat, hidrogen peroksida terurai membentuk oksigen dan air:
- 2 H2O2 → O2 + 2 H2O
- H2O2 + KIO4 → KIO3 + O2 + H2O
Pengaturan laboratorium sering menggunakan kalium ferisianida atau kalium periodat untuk katalis. Dalam deteksi darah forensik, katalisnya adalah zat besi yang ada di hemoglobin.[2] Enzim dalam berbagai sistem biologis juga dapat mengkatalisis dekomposisi hidrogen peroksida.
Luminol bereaksi dengan ion hidroksida, membentuk dianion. Oksigen yang dihasilkan dari hidrogen peroksida kemudian bereaksi dengan luminol dianion. Produk dari reaksi ini—suatu peroksida organik tak stabil—dibuat oleh hilangnya molekul nitrogen, perubahan elektron dari keadaan tereksitasi sampai keadaan dasar, dan emisi energi sebagai foton. Emisi ini menghasilkan cahaya biru.
Penggunaan oleh penyidik TKP[sunting | sunting sumber]
Sejarah[sunting | sunting sumber]
Pada tahun 1928, kimiawan Jerman H. O. Albrecht menemukan bahwa darah, di antara zat lainnya, meningkatkan luminesensi luminol dalam larutan alkali hidrogen peroksida.[3][4] Pada tahun 1936, Karl Gleu dan Karl Pfannstiel mengkonfirmasi peningkatan ini dengan adanya hematin, komponen darah.[5] Pada tahun 1937, ilmuwan forensik Jerman Walter Specht membuat penelitian ekstensif tentang aplikasi luminol untuk mendeteksi darah di TKP.[6] Pada tahun 1939, ahli patologi San Francisco, Frederick Proescher dan A. M. Moody membuat tiga pengamatan penting tentang luminol:[7][8]
- meskipun tes ini dugaan, area besar dari material dugaan dapat diperiksa dengan cepat;
- darah yang dikeringkan dan didekomposisi memberikan reaksi yang lebih kuat dan lebih awet daripada darah segar; dan
- jika luminesensi hilang, dapat diproduksi ulang dengan aplikasi larutan luminol-hidrogen peroksida segar; darah kering dapat dibuat luminesen berulang kali.
Teori[sunting | sunting sumber]

Penyidik tempat kejadian perkara (TKP) menggunakan luminol untuk menemukan jejak darah, bahkan jika seseorang telah membersihkan atau menghilangkannya. Penyidik menyemprotkan larutan luminol dan oksidator. Besi dalam darah mengkatalisis luminesensi. Jumlah katalis yang diperlukan untuk menyebabkan reaksi sangat kecil relatif terhadap jumlah luminol, yang memungkinkan pendeteksian bahkan jumlah jejak darah. Cahaya biru berlangsung selama sekitar 30 detik per aplikasi. Mendeteksi cahaya membutuhkan ruangan yang cukup gelap. Setiap cahaya yang terdeteksi dapat didokumentasikan oleh fotografi pajaran-panjang.
Kekurangan[sunting | sunting sumber]
Luminol memiliki kekurangan yang bisa membatasi penggunaannya dalam investigasi TKP:
- Kemiluminesensi luminol juga dapat dipicu oleh sejumlah zat seperti tembaga atau senyawa kimia yang mengandung tembaga,[9] dan pemutih tertentu. Akibatnya, jika seseorang membersihkan TKP secara menyeluruh dengan larutan pemutih, residu pembersih membuat keseluruhan TKP menghasilkan cahaya biru khas, yang secara efektif menyamarkan bukti organik seperti darah.
- Saus lobak, melalui enzim lobak peroksidase, mengkatalisis oksidasi luminol, memancarkan cahaya pada 428 nm (biru dalam spektrum cahaya tampak), yang dapat menyebabkan positif palsu
- Luminol dapat mendeteksi jumlah kecil darah yang ada di urin, dan dapat terdistorsi jika urin hewan hadir di ruangan yang sedang diuji.
- Luminol bereaksi dengan kotoran, menyebabkan cahaya yang sama seolah-olah itu adalah darah.
- Kehadiran luminol dapat mencegah tes lain dilakukan pada barang bukti. Namun, telah ditunjukkan bahwa DNA dapat berhasil diekstraksi dari sampel yang diberi pereaksi luminol.[10]
- Asap berlebih pada ruang tertutup—misal, mobil dimana seseorang sering merokok dapat menyebabkan hasil positif dengan Luminol.[8]
Molekul terkait[sunting | sunting sumber]
- Luminol: 5-amino-2,3-dihidro-1,4-ftalazinadion ; 3-amino-ftalhidrazida ; 1,4-ftalazinadion, 5-amino-2,3-dihidro ; CAS: [521-31-3]
C8H7N3O2 — MW: 177.16
λabs (dalam 0.1 N NaOH) λmax 1 : 347 nm & λmax 2 : 300 nm; EC (pada λmax 1): 7650 L/mol × cm
λabs / λem (MeOH): 355/413 nm - Luminol, garam natrium: natrium 3-amino-ftalhidrazida; CAS: [20666-12-0]
C8H6N3O2Na — MW: 199.12 - Luminol hemihidrat: suatu hidrat dari natrium 3-amino-ftalhidrazida; CAS: [206658-90-4]
C8H6N3O2Na·H2O — MW: 217.16 - Luminol hidroklorida: 3-amino-ftalhidrazida hidroklorida; CAS: [74165-64-3]
C8H7N3O2 · HCl — MW: 213.62 - Isoluminol: 4-aminoftalhidrazida; CAS: [3682-14-1]
C8H7N3O2 – MW: 117.16 (Xi) - Isoluminol monohidrat: 4-aminoftalhidrazida monohidrat
C8H7N3O2 · H2O — MW: 195.15 - Isoluminol ABEI: 4-aminoftalhidrazida monohidrat; CAS: [66612-29-1]
Lihat pula[sunting | sunting sumber]
Referensi[sunting | sunting sumber]
- ^ Merck Index, 11th Edition, 5470.
- ^ Ples, Marek. "Chemiluminescence activated by blood". www.weirdscience.eu (dalam bahasa Polski). Diakses tanggal 2014-12-23.
- ^ H. O. Albrecht (1928) "Über die Chemiluminescenz des Aminophthalsäurehydrazids" (On the chemiluminescence of aminophthalic acid hydrazide) Zeitschrift für Physikalische Chemie 136: 321-330.
- ^ Stuart H. James and William G. Eckert, Interpretation of Bloodstain Evidence at Crime Scenes, 2nd ed. (Boca Raton, Florida: CRC Press LLC, 1998), page 154.
- ^ Gleu, Karl ; Pfannstiel, Karl (1936) "Über 3-aminophthalsaure-hydrazid" Journal für Praktische Chemie 146: 137-150.
- ^ Specht, Walter (1937) "Die Chemiluminescenz des Hämins, ein Hilfsmittel zur Auffindung und Erkennung forensisch wichtiger Blutspuren" (The chemiluminescence of haemin, an aid to the finding and recognition of forensically significant blood traces), Angewandte Chemie 50 (8): 155-157.
- ^ Proescher F. and Moody A.M. (1939) "Detection of blood by means of chemiluminescence," Journal of Laboratory and Clinical Medicine, 24 : 1183–1189.
- ^ a b James, Stuart; Kish, Paul E.; Sutton, Paulette Sutton (2005). Principles of Bloodstsain Pattern Analysis. Boca Raton, London, New York, Singapore: Taylor and Francis Group. hlm. 376. ISBN 0-8493-2014-3.
- ^ Ples, Marek. "Chemiluminescence of luminol activated by copper compound". www.weirdscience.eu (dalam bahasa Polski). Diakses tanggal 23 Desember 2014.
- ^ Technical note about Hemaglow Diarsipkan January 2, 2015, di Wayback Machine.
