Timah(II) klorida

| |
| Nama | |
|---|---|
| Nama IUPAC
Timah(II) klorida
Timah diklorida | |
| Nama lain
Timah klorida
Garam timah Timah protoklorida | |
| Penanda | |
| |
Model 3D (JSmol)
|
|
| 3DMet | {{{3DMet}}} |
| ChEBI | |
| ChemSpider | |
| Nomor EC | |
PubChem CID
|
|
| Nomor RTECS | {{{value}}} |
| Nomor UN | 3260 |
CompTox Dashboard (EPA)
|
|
| |
| |
| Sifat | |
| SnCl2 | |
| Massa molar | 189.60 g/mol (anhidrat) 225.63 g/mol (dihidrat) |
| Penampilan | Padatan kristalin putih |
| Bau | tak berbau |
| Densitas | 3.95 g/cm3 (anhidrat) 2.71 g/cm3 (dihidrat) |
| Titik lebur | 247 °C (477 °F; 520 K) (anhidrat) 37.7 °C (dihidrat) |
| Titik didih | 623 °C (1.153 °F; 896 K) (terurai) |
| 83.9 g/100 ml (0 °C) Terhidrolisis dalam air panas | |
| Kelarutan | larut dalam etanol, aseton, eter, Tetrahidrofuran tak larut dalam xilena |
| −69.0·10−6 cm3/mol | |
| Struktur | |
| Struktur lapis (rantai gugus SnCl3) | |
| Trigonal piramidal (anhidrida) Dihidrat juga berkoordinasi-tiga | |
| Tekuk (fase gas) | |
| Bahaya | |
| Bahaya utama | Iritan, berbahaya bagi organisme air |
| Lembar data keselamatan | ICSC 0955 (anhydrous) ICSC 0783 (dihydrate) |
| Dosis atau konsentrasi letal (LD, LC): | |
LD50 (dosis median)
|
700 mg/kg (tikus, oral) 10,000 mg/kg (kelinci, oral) 250 mg/kg (mouse, oral)[1] |
| Senyawa terkait | |
Anion lain
|
Timah(II) fluorida Timah(II) bromida Timah(II) iodida |
Kation lainnya
|
Germanium diklorida Timah(IV) klorida Timbal(II) klorida |
Kecuali dinyatakan lain, data di atas berlaku pada suhu dan tekanan standar (25 °C [77 °F], 100 kPa). | |
| Referensi | |
Timah(II) klorida adalah suatu padatan kristalin putih dengan rumus kimia SnCl2. Senyawa ini membentuk suatu dihidrat yang stabil, tetapi larutan berairnya cenderung mengalami hidrolisis, terutama jika panas. SnCl2 umum digunakan sebagai agen pereduksi (dalam larutan asam), dan dalam bak elektrolitik untuk pelapisan timah. Timah(II) klorida jangan sampai terkecoh dengan klorida timah lainnya; Timah(IV) klorida (SnCl4).
Struktur kimia[sunting | sunting sumber]
SnCl2 memiliki pasangan elektron sunyi, karenanya molekul dalam fase gas menekuk. Dalam keadaan padat, kristal SnCl2 membentuk rantai yang dihubungkan melalui jembatan klorida seperti yang ditunjukkan. Dihidrat juga berkoordinasi tiga, dengan satu molekul air dikoordinasikan ke timah, dan molekul air kedua dikoordinasikan dengan air yang pertama. Bagian utama dari tumpukan molekul menjadi lapisan ganda di kisi kristal, dengan "kedua" air terjepit di antara lapisan.


Sifat kimia[sunting | sunting sumber]
Timah(II) klorida dapat larut dalam jumlah kurang dari massa airnya sendiri tanpa penguraian yang nyata, namun karena larutannya, hidrolisis encer terjadi untuk membentuk garam basa yang tidak larut:
- SnCl2 (aq) + H2O (l)
 Sn(OH)Cl (s) + HCl (aq)
Sn(OH)Cl (s) + HCl (aq)
Oleh karena itu, jika larutan bening timah(II) klorida digunakan, harus dilarutkan dalam asam klorida (biasanya dari molaritas yang sama atau lebih besar dari timah klorida) untuk mempertahankan keseimbangan ekuilibrium ke sisi kiri (menggunakan prinsip Le Chatelier). Larutan SnCl2 juga tidak stabil terhadap oksidasi oleh udara:
- 6 SnCl2 (aq) + O2 (g) + 2 H2O (l) → 2 SnCl4 (aq) + 4 Sn(OH)Cl (s)
Hal ini dapat dicegah dengan menyimpan larutan diatas gumpalan logam timah.[3]
Ada banyak kasus di mana timah(II) klorida bertindak sebagai zat pereduksi, mereduksi garam perak dan emas menjadi logamnya, dan garam besi(III) menjadi besi(II), misalnya:
- SnCl2 (aq) + 2 FeCl3 (aq) → SnCl4 (aq) + 2 FeCl2 (aq)
Senyawa ini juga mereduksi tembaga(II) menjadi tembaga(I).
Larutan timah(II) klorida juga bisa berfungsi sebagai sumber ion Sn2+, yang dapat membentuk senyawa timah(II) lainnya melalui reaksi pengendapan. Misalnya, reaksi dengan natrium sulfida menghasilkan timah(II) sulfida berwarna coklat/hitam :
- SnCl2 (aq) + Na2S (aq) → SnS (s) + 2 NaCl (aq)
Jika larutan alkali ditambahkan ke dalam SnCl2, endapan putih dari bentuk timah(II) oksida terlarut pada awalnya; Senyawa ini kemudian larut dalam basa berlebih untuk membentuk garam timah seperti natrium stanit:
- SnCl2(aq) + 2 NaOH (aq) → SnO·H2O (s) + 2 NaCl (aq)
- SnO·H2O (s) + NaOH (aq) → NaSn(OH)3 (aq)
SnCl2 anhidrat dapat digunakan untuk membuat berbagai senyawa timah(II) yang menarik dalam pelarut tidak berair. Misalnya, garam litium dari 4-metil-2,6-di-tert-butilfenol bereaksi dengan SnCl2 dalam THF untuk menghasilkan senyawa linear berkoordinasi dua berwarna kuning Sn(OAr)2 (Ar = aril).[4]
Timah(II) klorida juga berperilaku sebagai asam Lewis, membentuk kompleks dengan ligan seperti ion klorida, sebagai contoh:
- SnCl2 (aq) + CsCl (aq) → CsSnCl3 (aq)
Sebagian besar kompleks ini berbentuk piramidal, dan karena kompleks seperti SnCl3 memiliki oktet penuh, ada sedikit kecenderungan untuk menambahkan lebih dari satu ligan. Pasangan elektron dalam kompleks semacam itu tersedia untuk ikatan, dan oleh karena itu kompleks itu sendiri dapat bertindak sebagai basa Lewis atau ligan. Hal ini terlihat pada produk terkait ferosena dari reaksi berikut:
- SnCl2 + Fe(η5-C5H5)(CO)2HgCl → Fe(η5-C5H5)(CO)2SnCl3 + Hg
SnCl2 dapat digunakan untuk membuat berbagai macam senyawa yang mengandung ikatan logam-logam. Misalnya, reaksi dengan dikobalt oktakarbonil:
- SnCl2 + Co2(CO)8 → (CO)4Co-(SnCl2)-Co(CO)4
Preparasi[sunting | sunting sumber]
SnCl2 anhidrat disiapkan dengan penambahan gas hidrogen klorida kering pada logam timah. Dihidrat dibuat dengan reaksi yang sama, dengan menggunakan asam klorida:
- Sn (s) + 2 HCl (aq) → SnCl2 (aq) + H2 (g)
Air kemudian diuapkan dengan hati-hati dari larutan asam untuk menghasilkan kristal SnCl2·2H2O. Dihidrat ini dapat didehidrasi menjadi anhidratnya menggunakan anhidrida asetat.[5]
Kegunaan[sunting | sunting sumber]
Larutan timah(II) klorida yang mengandung sedikit asam klorida digunakan untuk pelapisan baja dengan timah, untuk membuat kaleng. Potensial listrik diterapkan, dan logam timah terbentuk pada katode via elektrolisis.
Timah(II) klorida digunakan sebagai mordan dalam pencelupan tekstil karena memberi warna lebih cerah dengan beberapa pewarna misalnya Cochineal. Mordan ini juga telah digunakan sendiri untuk menambah berat sutra.
Senyawa ini digunakan sebagai katalis dalam produksi plastik asam poliaktat (PLA).
Senyawa ni juga menemukan penggunaan sebagai katalis antara aseton dan hidrogen peroksida untuk membentuk aseton peroksida berbentuk tetramerik.
Timah(II) klorida juga digunakan secara luas sebagai agen pereduksi. Hal ini terlihat dalam penggunaannya untuk cermin perak, di mana logam perak terendapkan di kaca:
- Sn2+ (aq) + 2 Ag+ → Sn4+ (aq) + 2 Ag (s)
Reduksi terkait secara tradisional digunakan sebagai uji analitik Hg2+(aq). Misalnya, jika SnCl2 ditambahkan tetes demi tetes kedalam larutan raksa(II) klorida, endapan putih raksa(I) klorida pertama terbentuk; apabila lebih banyak SnCl2 ditambahkan maka akan berubah warna menjadi hitam dan raksa metalik terbentuk. Timah klorida dapat digunakan untuk menguji keberadaan senyawa emas. SnCl2 ternyata berwarna ungu terang terhadap emas (lihat Ungu Cascius).
Ketika raksa dianalisis dengan menggunakan spektroskopi serapan atom, metode uap dingin harus digunakan, dan timah(II) klorida biasanya digunakan sebagai reduktor.
Dalam kimia organik, SnCl2 terutama digunakan dalam reduksi Stephen, dimana nitril direduksi (melalui garam imidoil klorida menjadi imina yang mudah dihidrolisis menjadi aldehida.[6]
Reaksi biasanya bekerja paling baik dengan nitril aromatik Aril-CN. Reaksi terkait (disebut metode Sonn-Müller) dimulai dengan amida, yang diberi perlakuan dengan PCl5 untuk membentuk garam imidoil klorida.

Reduksi Stephen kurang digunakan saat ini, karena sebagian besar telah digantikan oleh reduksi diisobutilaluminium hidrida.
Sebagai tambahan, SnCl2 digunakan secara selektif untuk mereduksi gugus nitro aromatik menjadi anilina.[7]
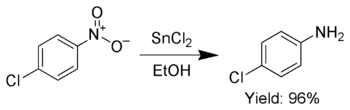
SnCl2 juga mereduksi kuinon menjadi hidrokuinon.
Timah klorida juga ditambahkan sebagai aditif makanan dengan nomor E E512 untuk beberapa makanan kaleng dan botol, di mana ia berfungsi sebagai agen penahan warna dan antioksidan.
SnCl2 digunakan untuk angiografi radionuklida untuk mengurangi agen radioaktif teknesium-99m-perteknetat untuk membantu pengikatan sel darah.
Timah klorida berair digunakan oleh banyak peminat logam mulia dan profesional sebagai indikator emas dan logam golongan platina dalam larutan.[8]
Lelehan SnCl2 dapat dioksidasi untuk membentuk struktur nano SnO2 terkristalisasi penuh.[9][10]
Catatan[sunting | sunting sumber]
- ^ "Timah (senyawa anorganik, sebagai Sn)". Immediately Dangerous to Life and Health. National Institute for Occupational Safety and Health (NIOSH).
- ^ J. M. Leger; J. Haines; A. Atouf (1996). "The high pressure behaviour of the cotunnite and post-cotunnite phases of PbCl2 and SnCl2". J. Phys. Chem. Solids. 57 (1): 7–16. Bibcode:1996JPCS...57....7L. doi:10.1016/0022-3697(95)00060-7.
- ^ H. Nechamkin (1968). The Chemistry of the Elements. New York: McGraw-Hill.
- ^ B. Cetinkaya, I. Gumrukcu, M. F. Lappert, J. L. Atwood, R. D. Rogers and M. J. Zaworotko (1980). "Bivalent germanium, tin, and lead 2,6-di-tert-butylphenoxides and the crystal and molecular structures of M(OC6H2Me-4-But2-2,6)2 (M = Ge or Sn)". J. Am. Chem. Soc. 102 (6): 2088–2089. doi:10.1021/ja00526a054.
- ^ W. L. F. Armarego; C. L. L. Chai (2009). Purification of laboratory chemicals (edisi ke-6). The United States of America: Butterworth-Heinemann.
- ^ Williams, J. W. (1955). "β-Naphthaldehyde". Org. Synth.; Coll. Vol. 3: 626.
- ^ F. D. Bellamy & K. Ou (1984). "Selective reduction of aromatic nitro compounds with stannous chloride in non acidic and non aqueous medium". Tetrahedron Letters. 25 (8): 839–842. doi:10.1016/S0040-4039(01)80041-1.
- ^ "Salinan arsip". Diarsipkan dari versi asli tanggal 2014-06-25. Diakses tanggal 2017-06-02.
- ^ A.R.Kamali, Thermokinetic characterisation of tin(11) chloride, J Therm Anal Calorim 118(2014) 99-104.
- ^ A.R.Kamali et al.Transformation of molten SnCl2 to SnO2 nano-single crystals, Ceram Intern 40 (2014)8533-8538.
Referensi[sunting | sunting sumber]
- N. N. Greenwood, A. Earnshaw, Chemistry of the Elements, 2nd ed., Butterworth-Heinemann, Oxford, UK, 1997.
- Handbook of Chemistry and Physics, 71st edition, CRC Press, Ann Arbor, Michigan, 1990.
- The Merck Index, 7th edition, Merck & Co, Rahway, New Jersey, USA, 1960.
- A. F. Wells, 'Structural Inorganic Chemistry, 5th ed., Oxford University Press, Oxford, UK, 1984.
- J. March, Advanced Organic Chemistry, 4th ed., p. 723, Wiley, New York, 1992.
Pranala luar[sunting | sunting sumber]
- J. M. Leger; J. Haines; A. Atouf (1996). "The high pressure behaviour of the cotunnite and post-cotunnite phases of PbCl2 and SnCl2". J. Phys. Chem. Solids. 57 (1): 7–16. Bibcode:1996JPCS...57....7L. doi:10.1016/0022-3697(95)00060-7.
- Nara, Jun-ichi; Adachia, Sadao (2011). "Optical properties of SnCl2 phosphor". J. Appl. Phys. 109 (083539). doi:10.1063/1.3576118.
- A. P. Singh; H. W. Roesky; E. Carl; D. Stalke; J. Demers; A. Lange (13 Februari 2012). "Lewis Base Mediated Autoionization of GeCl2 and SnCl2". J. Am. Chem. Soc. American Chemical Society. 134 (10): 4998–5003. doi:10.1021/ja300563g.
