Metabolisme obat
Metabolisme obat adalah pemecahan metabolik obat oleh makhluk hidup, biasanya melalui sistem enzimatik khusus. Lebih umum, metabolisme xenobiotik (Yunani: xenos "orang asing" dan biotik "berhubungan dengan makhluk hidup") adalah serangkaian jalur metabolisme yang mengubah struktur kimia xenobiotik, yang merupakan senyawa asing bagi biokimia normal makhluk hidup, contohnya obat atau racun. Reaksi-reaksi ini sering bertindak untuk mendetoksifikasi senyawa beracun (walaupun "zat antara" dalam metabolisme xenobiotik itu sendiri dapat menyebabkan efek toksik). Ilmu yang mempelajari metabolisme obat disebut farmakokinetik .
Metabolisme obat-obatan farmasi merupakan aspek penting dari farmakologi dan ilmu kedokteran. Misalnya, laju metabolisme menentukan durasi dan intensitas aksi farmakologis suatu obat. Metabolisme obat juga mempengaruhi resistensi obat berganda pada penyakit infeksi dan kemoterapi untuk kanker, serta aksi obat sebagai substrat atau penghambat enzim (yang terlibat dalam metabolisme xenobiotik) adalah alasan umum terjadinya interaksi obat yang berbahaya. Jalur ini juga penting dalam ilmu lingkungan, karena metabolisme xenobiotik darimikroorganisme yang menentukan apakah suatu polutan akan terurai selama bioremediasi, atau bertahan di lingkungan. Enzim metabolisme xenobiotik, misalnya saja glutation S-transferase juga penting dalam pertanian, karena mereka dapat menghasilkan resistensi terhadap pestisida dan herbisida.
Metabolisme obat dibagi menjadi tiga fase. Pada fase I, enzim seperti sitokrom P450 oksidase memulai gugus reaktif atau polar pada xenobiotik. Senyawa termodifikasi ini kemudian terkonjugasi menjadi senyawa polar dalam reaksi fase II. Reaksi ini kemudian dikatalisis oleh enzim transferase seperti glutation S-transferase . Akhirnya, pada fase III, xenobiotik terkonjugasi dapat diproses lebih lanjut, sebelum dikenali oleh transporter efflux dan dipompa keluar dari sel. Metabolisme obat sering mengubah senyawa lipofilik menjadi produk hidrofilik yang lebih mudah diekskresikan.
Proses metabolisme obat ini menjadi penting karena dapat menentukan durasi dan intensitas khasiat farmakologis obat. Metabolisme obat sebagian besar terjadi di retikulum endoplasma sel-sel hati. Selain itu, metabolisme obat juga terjadi di sel-sel epitel pada saluran pencernaan, paru-paru, ginjal, dan kulit. Metabolisme obat dipengaruhi oleh beberapa faktor, antara lain: faktor fisiologis (usia, genetika, nutrisi, jenis kelamin), dan penghambatan dan juga induksi enzim yang terlibat dalam proses metabolisme obat. Selain itu, faktor patologis (penyakit pada hati atau ginjal) juga berperan dalam menentukan laju metabolisme obat.[1][2]
Barier permeabilitas dan detoksifikasi[sunting | sunting sumber]
Senyawa yang terpapar pada organisme sebagian besar tidak dapat diprediksi jumlahnya, dan mungkin berbeda dari waktu ke waktu; ini adalah karakteristik utama dari stres toksik xenobiotik.[3] Tantangan utama yang dihadapi oleh sistem detoksifikasi xenobiotik adalah bahwa mereka harus mampu menghilangkan jumlah senyawa xenobiotik yang hampir tak terbatas jumlahnya dari campuran kompleks bahan kimia yang terlibat dalam metabolisme normal. Solusi yang telah berkembang untuk mengatasi masalah ini adalah kombinasi yang elegan dari barier fisik dan sistem enzimatis spesifisitas rendah.
Semua organisme menggunakan membran sel sebagai barier permeabilitas hidrofobik untuk mengontrol akses ke lingkungan internal mereka. Senyawa polar tidak dapat berdifusi melintasi membran sel ini, dan penyerapan molekul yang bermanfaat dimediasi melalui protein transpor yang secara khusus memilih substrat dari campuran ekstraseluler. Penyerapan selektif ini berarti bahwa sebagian besar molekul hidrofilik tidak dapat memasuki sel, karena mereka tidak dikenali oleh transpoerter tertentu. Sebaliknya, difusi senyawa hidrofobik melintasi barier ini tidak dapat dikontrol, dan karenanya organisme tidak dapat menghindarkan xenobiotik larut lemak dengan menggunakan barier membran.
Namun, keberadaan barier permeabilitas berarti bahwa organisme mampu mengembangkan sistem detoksifikasi yang mengeksploitasi hidrofobisitas umum untuk xenobiotik yang permeabel terhadap membran. Oleh karena itu, sistem ini memecahkan masalah spesifisitas dengan memiliki kekhususan substrat yang luas sehingga mereka memetabolisme hampir semua senyawa non-polar.[3] Metabolit yang berguna dikecualikan karena bersifat polar, dan secara umum mengandung satu atau lebih gugus bermuatan.
Detoksifikasi produk sampingan yang reaktif dari metabolisme normal tidak dapat dicapai dengan sistem yang diuraikan di atas, karena spesies ini berasal dari konstituen seluler normal dan biasanya memiliki karakteristik polar yang sama. Namun, karena senyawa ini jumlahnya sedikit, enzim tertentu dapat mengenali dan menghilangkannya. Contoh sistem detoksifikasi spesifik ini adalah sistem glioksalase,[4] yang menghilangkan aldehida reaktif metilglioksal, dan berbagai sistem antioksidan yang menghilangkan spesies oksigen reaktif.[5]
Fase detoksifikasi[sunting | sunting sumber]
Metabolisme xenobiotik sering dibagi menjadi tiga fase: modifikasi, konjugasi, dan ekskresi. Reaksi-reaksi ini bekerja bersama untuk mendetoksifikasi xenobiotik dan mengeluarkannya dari sel.[2]
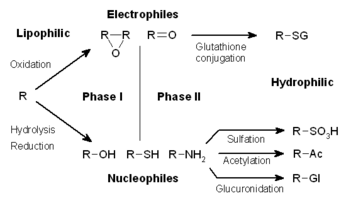
Tahap I – modifikasi[sunting | sunting sumber]
Pada fase I, berbagai enzim bertindak memasukkan gugus reaktif dan polar ke dalam substratnya. Salah satu modifikasi yang paling umum adalah hidroksilasi yang dikatalisis oleh sistem oksidase fungsi campuran yang bergantung pada sitokrom P450. Kompleks enzim ini bertindak menggabungkan atom oksigen ke dalam hidrokarbon nonaktif, yang dapat menghasilkan gugus hidroksil atau dealkilasi N-, O- dan S- pada substrat.[6] Mekanisme reaksi oksidase P450 berlangsung melalui reduksi oksigen yang terikat sitokrom dan pembentukan spesies oxyferryl yang sangat reaktif, menurut skema berikut:[7]
- O 2 + NADPH + H + + RH → NADP + + H 2 O + ROH
Reaksi fase I (reaksi nonsintetik) dapat terjadi melalui oksidasi, reduksi, hidrolisis, siklisasi, desiklisasi, dan penambahan oksigen atau penghilangan hidrogen, yang dilakukan oleh campuran fungsi oksidase, sering kali di hati. Reaksi oksidatif ini biasanya melibatkan sitokrom P450 monooksigenase (sering disingkat CYP), NADPH dan oksigen. Golongan obat farmasi yang menggunakan metode ini untuk metabolismenya meliputi fenotiazin, parasetamol, dan steroid. Jika metabolit dari reaksi fase I cukup polar, mereka dapat dengan mudah diekskresikan pada titik ini. Namun, banyak produk fase I tidak dihilangkan dengan cepat dan mengalami reaksi berikutnya di mana substrat endogen bergabung dengan gugus fungsi yang baru digabungkan untuk membentuk konjugat yang sangat polar.
Oksidasi Fase I yang umum melibatkan konversi ikatan CH menjadi C-OH. Reaksi ini terkadang mengubah senyawa yang tidak aktif secara farmakologis (prodrug) menjadi senyawa yang aktif secara farmakologis. Dengan cara yang sama, Fase I dapat mengubah molekul yang tidak beracun menjadi yang beracun (toksik). Hidrolisis sederhana di lambung biasanya merupakan reaksi yang tidak berbahaya, namun ada beberapa pengecualian. Misalnya, metabolisme asetonitril tahap I ke HOCH2CN, yang dengan cepat berdisosiasi menjadi formaldehida dan hidrogen sianida.[8]
Metabolisme kandidat obat fase I dapat disimulasikan di laboratorium menggunakan katalis non-enzim.[9] Contoh reaksi biomimetik ini cenderung menghasilkan produk yang sering kali mengandung metabolit Fase I. Sebagai contoh, metabolit utama trimebutin, desmetiltromebutin (nor-trimebutine), dapat diproduksi secara efisien dengan oksidasi in vitro dari obat yang tersedia secara komersial. Hidroksilasi gugus N-metil menyebabkan ekspulsi molekul formaldehida, sementara oksidasi gugus O-metil terjadi pada tingkat yang lebih rendah.
Fase II – konjugasi[sunting | sunting sumber]
Dalam reaksi fase II, metabolit xenobiotik teraktivasi ini dikonjugasi dengan glutation (GSH), sulfat, glisin, atau asam glukuronat . Situs pada obat di mana reaksi konjugasi terjadi termasuk gugus karboksi (-COOH), hidroksi (-OH), amino (NH 2), dan tiol (-SH). Produk reaksi konjugasi mengalami peningkatan berat molekul dan cenderung kurang aktif dibandingkan substratnya, tidak seperti reaksi Fase I yang sering menghasilkan metabolit aktif. Penambahan kelompok anionik besar (seperti GSH) mendetoksifikasi elektrofil reaktif dan menghasilkan lebih banyak metabolit polar yang tidak dapat berdifusi melintasi membran, dan oleh karena itu, dapat ditransportasikan secara aktif.
Reaksi-reaksi ini dikatalisis oleh sekelompok besar transferase dengan spesifisitas luas, yang dalam kombinasinya dapat memetabolisme hampir semua senyawa hidrofobik yang mengandung gugus nukleofilik atau elektrofilik.[3] Salah satu kelas yang paling penting dari kelompok ini adalah glutation S-transferase (GST).
| Mekanisme | Enzim yang terlibat | Co-faktor | Lokasi | Sumber |
|---|---|---|---|---|
| metilasi | metiltransferase | S-adenosil-L-metionin | hati, ginjal, paru-paru, SSP | [10] |
| sulfat | sulfotransferase | 3'-fosfoadenosin-5'-fosfosulfat | hati, ginjal, usus | [10] |
| asetilasi |
|
asetil koenzim A | hati, paru-paru, limpa, mukosa lambung, sel darah merah, limfosit | [10] |
| glukuronidasi | UDP-glukuronosiltransferase | UDP-asam glukuronat | hati, ginjal, usus, paru-paru, kulit, prostat, otak | [10] |
| konjugasi glutation | glutation S-transferase | glutation | hati, ginjal | [10] |
| konjugasi glisin | Proses dua langkah:
|
glisin | hati, ginjal | [11] |
Fase III – modifikasi dan ekskresi lebih lanjut[sunting | sunting sumber]
Setelah reaksi fase II, konjugat xenobiotik dapat dimetabolisme lebih lanjut. Contoh umum adalah pemrosesan konjugat glutation menjadi konjugat asetilsistein (asam merkapturat). Di sini, residu γ-glutamat dan glisin dalam molekul glutation dikeluarkan oleh Gamma-glutamil transpeptidase dan dipeptidase. Pada langkah terakhir, residu sistein dalam konjugat diasetilasi.
Konjugat dan metabolitnya dapat diekskresikan dari sel pada fase III, dengan gugus anionik yang bertindak sebagai penanda afinitas pada transporter membran dari segenap protein resistensi obat berganda. Protein ini adalah anggota dari keluarga transporter kaset pengikat-ATP dan dapat mengkatalisis transpor berbagai macam anion hidrofobik yang bergantung pada ATP, dan dengan demikian memindahkan produk fase II ke media ekstraseluler, di mana mereka dapat dimetabolisme lebih lanjut atau diekskresikan.
Toksin endogen[sunting | sunting sumber]
Detoksifikasi metabolit reaktif endogen seperti peroksida dan aldehida reaktif sering kali tidak dapat dicapai dengan sistem yang dijelaskan di atas. Ini adalah hasil dari konstituen seluler normal dan biasanya membagikan karakteristik polar mereka. Namun, karena senyawa ini jumlahnya sedikit, sistem enzimatik mungkin menggunakan pengenalan molekul spesifik untuk mengenali dan menghilangkannya. Oleh karena itu, kemiripan molekul-molekul ini dengan metabolit yang berguna berarti bahwa enzim detoksifikasi yang berbeda biasanya diperlukan untuk metabolisme setiap kelompok toksin endogen. Contoh sistem detoksifikasi spesifik ini adalah sistem glioksalase, yang bertindak untuk membuang aldehida reaktif metilglioksal, dan berbagai sistem antioksidan yang menghilangkan spesies oksigen reaktif.
Faktor yang mempengaruhi metabolisme obat[sunting | sunting sumber]
Durasi dan intensitas aksi farmakologis sebagian besar obat lipofilik ditentukan oleh kecepatan mereka dimetabolisme menjadi produk yang inaktif. Sistem monooksigenase sitokrom P450 adalah jalur yang paling penting dalam hal ini. Secara umum, apapun yang meningkatkan laju metabolisme (misalnya, induksi enzim) dari metabolit aktif secara farmakologis akan menurunkan durasi dan intensitas kerja obat dan sebaliknya (misalnya, inhibisi enzim). Namun, dalam kasus di mana enzim bertanggung jawab untuk memetabolisme pro-drug menjadi obat, induksi enzim dapat mempercepat konversi ini dan meningkatkan kadar obat, berpotensi menyebabkan toksisitas.
Berbagai faktor fisiologis dan patologis juga dapat mempengaruhi metabolisme obat. Faktor fisiologis yang dapat mempengaruhi metabolisme obat termasuk usia, variasi individu (misalnya , farmakogenetik), sirkulasi enterohepatik, nutrisi, flora usus, atau perbedaan jenis kelamin.
Secara umum, obat dimetabolisme lebih lambat pada janin, neonatus, dan manusia serta hewan lanjut usia dibandingkan pada orang dewasa.
Variasi genetik (polimorfisme) menyumbang beberapa variabilitas dalam efek obat. Dengan N-acetyltransferases (terlibat dalam reaksi Fase II), variasi individu menciptakan sekelompok orang yang mengasetilasi secara perlahan (asetilator lambat) dan mengasetilasi dengan cepat, kira-kira 50:50 dalam populasi Kanada. Variasi ini mungkin memiliki konsekuensi dramatis, karena asetilator lambat lebih rentan terhadap toksisitas terkait dosis obat. Kajian tentang pengaruh genetik pada respons obat, termasuk aspek metabolisme, telah melahirkan bidang farmakogenomik.
Enzim sistem monooksigenase sitokrom P450 juga dapat bervariasi antar individu, dengan defisiensi yang terjadi pada 1 – 30% orang, tergantung pada latar belakang etnis mereka.
Dosis, frekuensi, rute pemberian, distribusi jaringan dan pengikatan protein obat juga dapat mempengaruhi metabolismenya.
Faktor patologis juga dapat mempengaruhi metabolisme obat, termasuk penyakit hati , ginjal, atau jantung.
Metode pemodelan dan simulasi in silico memungkinkan metabolisme obat diprediksi dalam populasi pasien virtual sebelum melakukan studi klinis pada subjek manusia. Ini dapat digunakan untuk mengidentifikasi individu yang paling berisiko dari reaksi yang merugikan.
Referensi[sunting | sunting sumber]
- ^ farmakoterapi (2017-06-14). "Mengenal Metabolisme Obat". Farmakoterapi.com. Diakses tanggal 2021-09-02.
- ^ a b Parfati, Nani; Budisutio, Fauna Herawati (2003). Aslam, Mohamed; Tan, Chik Kaw; Prayitno, Adji, ed. Farmakokinetika Klinis (BAB 6 Bagian 2 Pemantauan Peresepan)- Farmasi Klinis (Clinical Pharmacy): Menuju Pengobatan Rasional dan Penghargaan Pilihan Pasien - (dalam bahasa Inggris). Surabaya: PT.Elex Media Komputindo. ISBN 978-979-20-4089-0.
- ^ a b c Jakoby, W. B.; Ziegler, D. M. (1990-12-05). "The enzymes of detoxication". The Journal of Biological Chemistry. 265 (34): 20715–20718. ISSN 0021-9258. PMID 2249981.
- ^ Thornalley, P J (1990-07-01). "The glyoxalase system: new developments towards functional characterization of a metabolic pathway fundamental to biological life". Biochemical Journal. 269 (1): 1–11. ISSN 0264-6021. PMC 1131522
 . PMID 2198020.
. PMID 2198020.
- ^ Sies, H. (1997-03). "Oxidative stress: oxidants and antioxidants". Experimental Physiology. 82 (2): 291–295. doi:10.1113/expphysiol.1997.sp004024. ISSN 0958-0670. PMID 9129943.
- ^ Guengerich, F. P. (2001-06). "Common and uncommon cytochrome P450 reactions related to metabolism and chemical toxicity". Chemical Research in Toxicology. 14 (6): 611–650. doi:10.1021/tx0002583. ISSN 0893-228X. PMID 11409933.
- ^ Schlichting, Ilme; Berendzen, Joel; Chu, Kelvin; Stock, Ann M.; Maves, Shelley A.; Benson, David E.; Sweet, Robert M.; Ringe, Dagmar; Petsko, Gregory A. (2000-03). "The Catalytic Pathway of Cytochrome P450cam at Atomic Resolution". Science (dalam bahasa Inggris). 287 (5458): 1615–1622. doi:10.1126/science.287.5458.1615. ISSN 0036-8075.
- ^ "Acetonitrile (EHC 154, 1993)". inchem.org. Diakses tanggal 2021-09-02.
- ^ Akagah, Bernardin; Lormier, Anh Tuan; Fournet, Alain; Figadère, Bruno (2008-12-21). "Oxidation of antiparasitic 2-substituted quinolines using metalloporphyrin catalysts: scale-up of a biomimetic reaction for metabolite production of drug candidates". Organic & Biomolecular Chemistry. 6 (24): 4494–4497. doi:10.1039/b815963g. ISSN 1477-0539. PMID 19039354.
- ^ a b c d e Liston, H. L.; Markowitz, J. S.; DeVane, C. L. (2001-10). "Drug glucuronidation in clinical psychopharmacology". Journal of Clinical Psychopharmacology. 21 (5): 500–515. doi:10.1097/00004714-200110000-00008. ISSN 0271-0749. PMID 11593076.
- ^ Badenhorst, Christoffel Petrus Stephanus; van der Sluis, Rencia; Erasmus, Elardus; van Dijk, Alberdina Aike (2013-09). "Glycine conjugation: importance in metabolism, the role of glycine N-acyltransferase, and factors that influence interindividual variation". Expert Opinion on Drug Metabolism & Toxicology. 9 (9): 1139–1153. doi:10.1517/17425255.2013.796929. ISSN 1744-7607. PMID 23650932.
