Litium diisopropilamida
| |
| Nama | |
|---|---|
| Nama IUPAC
Litium diisopropilamida
| |
| Nama lain
LDA
| |
| Penanda | |
Model 3D (JSmol)
|
|
| 3DMet | {{{3DMet}}} |
| Nomor EC | |
| Nomor RTECS | {{{value}}} |
CompTox Dashboard (EPA)
|
|
| |
| Sifat | |
| C6H14LiN or LiN(C3H7)2 | |
| Massa molar | 107,1233 g/mol |
| Densitas | 0,79 g/cm³ |
| Bereaksi dengan air | |
| Kebasaan (pKb) | -22 |
| Bahaya | |
| Bahaya utama | korosif |
| Senyawa terkait | |
Kecuali dinyatakan lain, data di atas berlaku pada suhu dan tekanan standar (25 °C [77 °F], 100 kPa). | |
| Referensi | |
Litium diisopropilamida adalah senyawa kimia yang memiliki rumus [(CH3)2CH]2NLi. Umumnya disingkat sebagai LDA, ia adalah basa kuat yang digunakan dalam kimia organik untuk deprotonasi senyawa yang berasam lemah. Reagen ini diterima luas oleh karena ia larut dalam pelarut organik non-polar dan ia non-piroforik. LDA adalah basa non-nukleofilik.
Pembuatan dan struktur[sunting | sunting sumber]
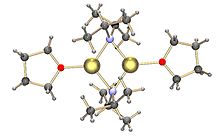
LDA biasanya dibentuk dengan mencampurkan tetrahidrofuran (THF) dingin (0 sampai -78 °C) dengan n-butillitium. Diisopropilamida memiliki nilai pKa 36, sehingga ia sangat cocok digunakan untuk deprotonasi kebanyakan asam karbon, meliputi alkohol dan senyawa karbonil (asam karboksilat, ester, aldehida, dan keton) yang memiliki karbon alfa berhidrogen. Dalam larutan THF, LDA berbentuk dimer [1][2] dan diduga berdisosiasi untuk menjadi basa aktif.
LDA tersedia secara komersial sebagai larutan dengan pelarut polat dan aprotik sepert THF dan eter, walaupun dalam praktiknya ia umumnya dibuat secara in situ.
Basa kinetik vs. termodinamik[sunting | sunting sumber]
Deprotonasi asam karbon dapat berjalan melalui kontrol kinetik maupun kontrol termodinamik. Deprotonasi yang berkontrol kinetik memerlukan basa yang terhalang secara sterik. Sebagai contoh, dalam kasus fenilaseton, deprotonasi dapat menghasilkan dua enolat yang berbeda. LDA akan mendeprotonasi gugus metil yang merupakan deprotonasi kinetik. Basa yang lebih lemah seperti alkoksida, yang mendeprotonasi substrat secara reversibel, dapat menghasilkan enolat benzilik yang lebih stabil. Alternatif dari basa lemah adalah dengan menggunakan basa kuat yang memiliki konsentrasi lebih rendah daripada keton. Sebagai contoh, dengan memakai bubur natrium hidrida dalam THF atau dimetilformamida (DMF), basa hanya akan bereaksi pada permukaan larutan-padat. Molekul keton akan terdeprotonasil secara kinetik. Enolat ini kemudian akan bersentuhan dengan keton lainnya dan enolat termodinamik akan terbentuk melalui perpindahan proton, bahkan dalam pelarut aprotik yang tidak memiliki ion hidronium.
LDA dapat berperean sebagai nukleofil dalam kondisi-kondisi tertentu. Misalnya ia dapat bereaksi dengan tungsten heksakarbonil sebagai bagian dari sintesis diisopropilaminokarbuna. Jika diberikan kondisi yang tepat, LDA akan bereaksi seperti nukleofil dan melakukan reaksi kondensasi. Basa amida lainnya yang lebih terhalang juga diketahui, sebagai contoh, deprotonasi heksametildisilazana (Me3SiNHSiMe3) akan membentuk basa ([(Me3SiNSiMe3]-).
Referensi[sunting | sunting sumber]
- ^ Williard, P. G.; Salvino, J. M. (1993). "Synthesis, isolation, and structure of an LDA-THF complex". Journal of Organic Chemistry. 58 (1): 1–3. doi:10.1021/jo00053a001.
- ^ N.D.R. Barnett, R.E. Mulvey, W. Clegg and P.A. O'Neil (1991). "Crystal structure of lithium diisopropylamide (LDA): an infinite helical arrangement composed of near-linear nitrogen-lithium-nitrogen units with four units per turn of helix". Journal of the American Chemical Society. 113 (21): 8187. doi:10.1021/ja00021a066.
Bacaan lebih lanjut[sunting | sunting sumber]
- Enolate Chemistry Diarsipkan 2007-09-30 di Wayback Machine., University of Regensburg
- Non-nucleophilic Bases Helsinki University of Technology
