Geometri molekul oktahedral
| Geometri molekul oktahedral | |
|---|---|
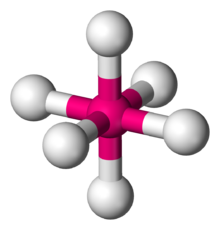 | |
| Contoh | SF6, Mo(CO)6 |
| Kelompok titik | Oh |
| Bilangan sterik | 6 |
| Bilangan koordinasi | 6 |
| Sudut ikatan | 90° |
| μ (Polaritas) | 0 |

Dalam kimia, geometri molekul oktahedral menggambarkan bentuk senyawa dengan enam atom atau kelompok atom atau ligan yang tersusun secara simetris di sekitar atom pusat, yang menentukan simpul simpul oktahedron. Oktahedron memiliki delapan muka, maka diberi awalan okta yang berarti delapan. Oktahedron adalah salah satu padatan Platonis, walaupun molekul oktahedral biasanya memiliki atom di pusatnya dan tidak ada ikatan antara atom-atom ligan. Suatu oktahedron sempurna termasuk dalam kelompok titik Oh. Contoh senyawa oktahedral adalah belerang heksafluorida SF6 dan molibdenum heksakarbonil Mo(CO)6. Istilah "oktahedral" digunakan agak longgar oleh kimiawan, dengan fokus pada geometri ikatan ke atom pusat dan tidak mempertimbangkan perbedaan di antara ligan sendiri. Misalnya, [Co(NH''";, yang tidak oktahedral dalam pengertian matematis karena orientasi ikatan N-H, tetap disebut sebagai oktahedral.[1]
Konsep geometri koordinasi oktahedral dikembangkan oleh Alfred Werner untuk menjelaskan stoikiometri dan isomerisme pada senyawa koordinasi. Pandangannya memungkinkan kimiawan untuk merasionalisasi jumlah isomer dalam senyawa koordinasi. Kompleks logam transisi oktahedral yang mengandung amina dan anion sederhana sering disebut sebagai kompleks tipe Werner.
Isomerisme dalam kompleks oktahedral[sunting | sunting sumber]
Bila dua atau lebih jenis ligan (La, Lb, ...) berikatan koordinasi ke pusat logam oktahedral (M), maka kompleksnya dapat berbentuk sebagai isomer. Sistem penamaan isomer ini bergantung pada jumlah dan susunan ligan yang berbeda.
cis dan trans[sunting | sunting sumber]
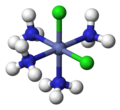
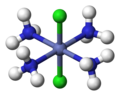
Terdapat dua isomer untuk MLa4Lb2. Isomer MLa4Lb2 ini berorientasi cis, jika ligan Lb saling berdekatan, dan trans, jika gugus Lb berada 180° satu sama lain. Analisis kompleks semacam ini membawa Alfred Werner memenangkan Anugerah Nobel pada tahun 1913 dengan postulat kompleks oktahedralnya.
-
cis-[CoCl''"; -
trans-[CoCl''";
Isomer muka dan meridional[sunting | sunting sumber]
Terdapat dua isomer yang mungkin terjadi untuk MLa3Lb3 – isomer muka (Inggris: facial) (fac) yang mana masing-masing kelompok tiga ligan yang identik terletak pada permukaan oktahedron yang sama mengelilingi atom logam, sehingga, dua dari tiga ligan ini berorientasi cis. Sedangkan isomer meridional (mer) adalah kondisi ketika tiga ligan yang identik terletak pada satu bidang datar yang menembus atom logam.
-
fac-[CoCl3(NH3)3] -
mer-[CoCl3(NH3)3]
Kekhiralan[sunting | sunting sumber]
Senyawa kompleks yang lebih rumit, dengan beberapa ligan yang berbeda-beda atau dengan ligan bidentat dapat membentuk khiral, dengan pasangan isomer yang tidak dapat ditumpangkan di atas masing-masing bayangan cermin atau enensiomernya.
-
Δ-[Fe(ox)3]3− -
Λ-[Fe(ox)3]3− -
Λ-cis-[CoCl2(en)2]+
Lain-lain[sunting | sunting sumber]
Terdapat total enam isomer yang mungkin untuk MLa2Lb2Lc2.[2]
- Satu isomer di mana seluruh tiga pasang ligan yang identik berada pada posisi trans
- Tiga isomer berbeda di mana sepasang ligan identik (La atau Lb atau Lc) berada pada posisi trans, sementara dua lainnya cis.
- Dua ismoer khiral enansiomer di mana seluruh tiga pasang ligan yang identik pada posisi cis.
Jumlah probabilitas isomer dapat mencapai 30 untuk kompleks oktahedral dengan 6 ligan yang berbeda (sebaliknya, hanya dua stereoisomer yang mungkin untuk kompleks tetrahedral dengan empat ligan yang berbeda). Tabel berikut menyajikan seluruh kemungkinan kombinasi untuk ligan monodentat:
| Rumus | Jumlah isomer | Jumlah pasangan enansiomer |
|---|---|---|
| ML6 | 1 | 0 |
| MLa5Lb | 1 | 0 |
| MLa4Lb2 | 2 | 0 |
| MLa4LbLc | 2 | 0 |
| MLa3Lb3 | 2 | 0 |
| MLa3Lb2Lc | 3 | 0 |
| MLa3LbLcLd | 5 | 1 |
| MLa2Lb2Lc2 | 6 | 1 |
| MLa2Lb2LcLd | 8 | 2 |
| MLa2LbLcLdLe | 15 | 6 |
| MLaLbLcLdLeLf | 30 | 15 |
Jadi, semua 15 diastereomer MLaLbLcLdLeLf adalah khiral, sementara untuk MLa2LbLcLdLe, enam diastereomer khiral dan tiga tidak (dengan La adalah trans). Dapat dilihat bahwa koordinasi oktahedral memungkinkan kompleksitas yang jauh lebih besar daripada tetrahedron yang mendominasi kimia organik. MLaLbLcLd tetrahedron berada sebagai pasangan enansiomer tunggal. Agar menghasilkan dua diastereomer dalam senyawa organik, dibutuhkan sekurang-kurangnya dua pusat karbon.
Geometri trigonal prismatik[sunting | sunting sumber]
Untuk senyawa dengan rumus MX, alternatif utama untuk geometri oktahedral adalah geometri trigonal prismatik, yang memiliki simetri D3h. Dalam geometri ini, enam ligan juga ekivalen. Terdapat juga prisma trigonal prisma terdistorsi, dengan simetri C3v. Contoh yang menonjol adalah W(CH''";. Interkonversi kompleks Δ– dan Λ–, yang biasanya berjalan lambat, diperkirakan berlangsung melalui intermediat trigonal prismatik, sebuah proses yang disebut "puntiran Bailar" (Bailar twist). Jalur alternatif untuk rasemisasi kompleks ini adalah puntiran Ray-Dutt (Ray-Dutt twist).
Geometri molekul bioktahedral[sunting | sunting sumber]
Pasangan oktahedra dapat disatukan dengan cara mengganti ligan terminal dengan jembatan ligan. Dengan cara ini geometri koordinasi oktahedral tetap terjaga. Dua motif umum untuk memadukan oktahedra adalah: berbagi tepi dan berbagi muka. Bioktahedra berbagi tepi dan wajah masing-masing memiliki rumus [M''"; dan M. Versi polimer dari pola penautan yang sama memberi stoikiometri [ML''";∞ dan [M(μ−
L)''";∞.
Berbagi tepi atau muka pada oktahedron memberi struktur yang disebut bioktahedral. Banyak senyawa logam pentahalida dan pentaalkoksida yang ada dalam larutan dan padatan mempunyai struktur bioktahedral. Salah satu contohnya adalah niobium pentaklorida. Logam tetrahalida sering berada sebagai polimer dengan oktahedra berbagi tepi. Zirkonium tetraklorida adalah sebuah contoh.[3] Senyawa dengan rantai oktahedral berbagi muka mencakup MoBr3, RuBr3, dan TlBr3.
-
Model bola dan tongkat niobium pentaklorida, senyawa koordinasi bioktahedral.
-
Model bola dan tongkat zirkonium tetraklorida, suatu polimer anorganik berbasis oktahedra berbagi tepi.
-
Model bola dan tongkat molibdenum(III) bromida, suatu polimer anorganik berbasis oktahedra berbagi muka.
-
Tampilan agak di bawah rantai titanium(III) iodida yang menyoroti ligan berbentuk bulan sabit di sekitar oktahedra berbagi muka.
Pemisahan energi orbital-d dalam kompleks oktahedral[sunting | sunting sumber]
Untuk ion bebas, misalnya gas Ni2+ atau Mo0, energi orbital-d adalah sama, yaitu mereka "merosot". Dalam kompleks oktahedral, kemerosotan ini terangkat. Energi dz2 dan dx2−y2, yang disebut perangkat eg, yang menyasar langung pada ligan menjadi tidak stabil. Sebaliknya, energi orbital dxz, dxy, dan dyz, yang disebut perangkat t2g, terstabilkan. Label t2g and eg merujuk pada perwakilan taktereduksi (irreducible representation), yang menjelaskan sifat simetri orbital ini. Perbedaan energi yang memisahkan kedua himpunan ini adalah dasar dari teori medan kristal dan teori medan ligan. Hilangnya degenerasi pada pembentukan kompleks oktahedral dari ion bebas disebut pembelahan medan kristal atau pembelahan medan ligan. Perbedaan energi, yang diberi label Δo, bervariasi sesuai dengan jumlah dan sifat ligan. Jika simetri kompleks lebih rendah daripada oktahedral, tingkat eg dan t2g dapat terbelah lebih lanjut. Sebagai contoh, eg dan t2g dan misalnya mengalami pembelahan lanjutan pada trans-MLa4Lb2.
Kekuatan ligan mengikuti urutan donor elektron sebagai berikut:
Jadi, ligan medan lemah memberikan kenaikan Δo yang kecil dan menyerap cahaya pada panjang gelombang yang lebih panjang.
Reaksi[sunting | sunting sumber]
Mengingat bahwa kompleks oktahedral sedemikian banyak, maka tidak mengherankan apabila berbagai macam reaksi telah dijelaskan. Reaksi-reaksi itu dapat diklasifikasikan sebagai berikut:
- Reaksi penggantian ligan (melalui berbagai mekanisme)
- Reaksi penambahan ligan, termasuk di antaranya, protonasi
- Reaksi redoks (di mana elektron diperoleh atau dilepas)
- Penataan ulang di mana stereokimia relatif ligan berubah dalam ruang koordinasi.
Banyak reaksi kompleks logam transisi oktahedral terjadi dalam air. Bila ligan anionik menggantikan molekul air yang terkoordinasi, reaksinya disebut anasi. Reaksi sebaliknya, air yang menggantikan ligan anionik, disebut akuasi. Sebagai contoh, [CoCl(NH''"; perlahan-lahan terakuasi menjadi [Co(NH''"; dalam air, terutama dengan adanya asam atau basa. Penambahan HCl pekat mengubah kembali kompleks aquo menjadi klorida, melalui proses anasi.
Lihat juga[sunting | sunting sumber]
Referensi[sunting | sunting sumber]
- ^ Von Zelewsky, A. (1995). Stereochemistry of Coordination Compounds. Chichester: John Wiley. ISBN 0-471-95599-X.
- ^ Miessler, G. L.; Tarr, D. A. (1999). Inorganic Chemistry (edisi ke-2nd). Prentice-Hall. hlm. 290. ISBN 0-13-841891-8.
- ^ Wells, A.F. (1984). Structural Inorganic Chemistry. Oxford: Clarendon Press. ISBN 0-19-855370-6.
Pranala luar[sunting | sunting sumber]
- (Inggris) Chem Chemistry, Structures, and 3D Molecules[pranala nonaktif permanen]
- (Inggris) Indiana University Molecular Structure Center Diarsipkan 2004-06-29 di Wayback Machine.
- (Inggris) Point Group Symmetry Examples Diarsipkan 2018-11-29 di Wayback Machine.

![fac-[CoCl3(NH3)3]](http://upload.wikimedia.org/wikipedia/commons/thumb/6/69/Fac-trichlorotriamminecobalt%28III%29.png/109px-Fac-trichlorotriamminecobalt%28III%29.png)
![mer-[CoCl3(NH3)3]](http://upload.wikimedia.org/wikipedia/commons/thumb/5/54/Mer-trichlorotriamminecobalt%28III%29.png/120px-Mer-trichlorotriamminecobalt%28III%29.png)
![Δ-[Fe(ox)3]3−](http://upload.wikimedia.org/wikipedia/commons/thumb/d/df/Delta-tris%28oxalato%29ferrate%28III%29-3D-balls.png/110px-Delta-tris%28oxalato%29ferrate%28III%29-3D-balls.png)
![Λ-[Fe(ox)3]3−](http://upload.wikimedia.org/wikipedia/commons/thumb/6/6e/Lambda-tris%28oxalato%29ferrate%28III%29-3D-balls.png/111px-Lambda-tris%28oxalato%29ferrate%28III%29-3D-balls.png)
![Δ-cis-[CoCl2(en)2]+](http://upload.wikimedia.org/wikipedia/commons/thumb/1/12/Delta-cis-dichlorobis%28ethylenediamine%29cobalt%28III%29.png/78px-Delta-cis-dichlorobis%28ethylenediamine%29cobalt%28III%29.png)
![Λ-cis-[CoCl2(en)2]+](http://upload.wikimedia.org/wikipedia/commons/thumb/8/81/Lambda-cis-dichlorobis%28ethylenediamine%29cobalt%28III%29.png/78px-Lambda-cis-dichlorobis%28ethylenediamine%29cobalt%28III%29.png)