Absorpsi (kimia): Perbedaan antara revisi
k Bot: Perubahan kosmetika |
Tidak ada ringkasan suntingan Tag: Suntingan visualeditor-wikitext |
||
| Baris 1: | Baris 1: | ||
{{distinguish|Adsorpsi}} |
{{distinguish|Adsorpsi}} |
||
{{for|penyerapan cahaya|absorbansi}} |
{{for|penyerapan cahaya|absorbansi}} |
||
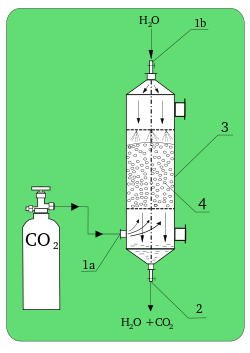
[[File:Absorber.svg|thumb|250px|Penjerap laboratorium. '''1a)''': CO<sub>2</sub> inlet; '''1b)''': H<sub>2</sub>O inlet; '''2)''': outlet '''3)''': kolom absorpsi; '''4)''': kemasan.]] |
|||
[[Berkas:Absorption vs adsorption.svg|jmpl|500px|Penyerapan gas-cair (a) Penyerapan cair-padat (b) mekanisme. Lingkaran biru adalah molekul terlarut.]] |
|||
Dalam ilmu [[kimia]], '''absorpsi''' adalah [[fenomena]] fisika atau kimia atau suatu [[Metode ilmiah|proses]] di mana [[atom]], [[molekul]] atau [[ion]] memasuki fase ruah – bahan [[cairan|cair]] atau [[padat]]. Absorpsi berbeda dengan [[adsorpsi|'''adsorpsi''']], karena molekul-molekul yang mengalami absorpsi memasuki volume, tidak hanya di permukaan saja (seperti yang terjadi pada adsorpsi). Istilah yang lebih umum adalah [[serapan]] ({{lang-en|[[:en:sorption|sorption]]}}), yang meliputi absorpsi, [[adsorpsi]], dan [[pertukaran ion]]. Absorpsi adalah suatu kondisi di mana sesuatu memasuki zat lain.<ref name=Organic-chemistry/> |
|||
Salah satu contoh penyerapan lainnya adalah [[penukaran ion]] di mana terjadi proses pertukaran [[ion]] antara dua [[elektrolit]] atau antara larutan elektrolit dan [[senyawa kompleks]]. |
|||
Dalam banyak proses teknologi penting, absorpsi kimia digunakan untuk proses fisika, misalnya absorpsi [[karbon dioksida]] oleh [[natrium hidroksida]] – semacam proses asam-basa yang tidak mematuhi hukum partisi Nernst. |
|||
{{kimia-stub}} |
|||
Beberapa contoh efek ini dapat dilihat pada artikel [[ekstraksi cair-cair]]. Adalah hal yang mungkin untuk mengekstraksi suatu [[larutan|zat terlarut]] (solut) dari sastu fase [[cairan|cair]] ke fase cair lainnya tanpa reaksi kimia. Contoh solut semacam ini adalah [[gas mulia]] dan [[osmium tetroksida]].<ref name=Organic-chemistry> |
|||
{{cite book|last = McMurry|first = John|title = Fundamentals of Organic Chemistry |
|||
|edition = Fifth|publisher = Agnus McDonald|year = 2003 |
|||
|pages = 409|isbn = 0-534-39573-2}}</ref> |
|||
Proses absorpsi berarti bahwa zat menangkap dan memindahkan energi. ''Absorben'' mendistribusikan bahan yang ditangkapnya secara menyeluruh, sementara ''adsorben'' hanya mendistribusikannya di permukaan saja. |
|||
Proses gas atau cair yang menembus ke dalam badan adsorben secara umum dikenal sebagai absorpsi. |
|||
{{Quote box |
|||
| title = Definisi [[International Union of Pure and Applied Chemistry|IUPAC]] |
|||
| quote = '''Absorpsi:''' Proses suatu bahan (absorbat) diretensi oleh bahan lain (absorben); ini dapat berupa larutan fisik gas, cairan, atau padatan dalam cairan, pengikatan molekul suatu gas, uap, cairan, atau pelarutan bahan pada permukaan padatan melalui gaya fisika, dll. Dalam spektrofotometri, absorpsi cahaya pada panjang gelombang tertentu digunakan untuk mengidentifikasi sifat kimia suatu molekul, atom atau ion dan untuk mengukur konsentrasi spesies-spesies ini.}} |
|||
==Persamaan== |
|||
Jika absorpsi adalah suatu proses fisika yang tidak berhubungan dengan proses fisika atau kimia, biasanya ia memenuhi '''[[hukum distribusi|hukum distribusi Nernst]]''': |
|||
:"perbandingan konsentrasi beberapa spesies zat terlarut dalam dua fase ruah yang saling kontak pada kesetimbangan adalah konstan untuk zat terlarut dan fase ruah terentu": |
|||
:: <math>\frac{[x]_{1}}{[x]_{2}} = \text{constant} = K_{N(x,12)}</math> |
|||
Nilai konstanta K<sub>N</sub> bergantung pada suhu dan disebut '''[[koefisien partisi]]'''. Persamaan ini valid jika konsentrasi tidak terlalu besar dan jika spesies "x" tidak berubah bentuk dalam kedua fase. Jika molekul semacam ini mengalami asosiasi atau [[Disosiasi (kimia)|disosiasi]], maka persamaan ini tetap dapat menjelaskan kesetimbangan antara "x" dalam kedua fase, tetapi hanya untuk bentuk yang sama – konsentrasi seluruh bentuk yang tersisa harus dikalkulasi dengan melibatkan kesetimbangan secara keseluruhan.<ref name=Organic-chemistry/> |
|||
Dalam kasus absorpsi gas, perhitungan konsentrasi dapat dilakukan dengan menggunakan, misalnya [[Hukum gas ideal]], c = p/RT. Cara lainnya, dapat digunakan [[tekanan parsial]] untuk menggantikan konsentrasi. |
|||
==Jenis-jenis absorpsi== |
|||
Absorpsi adalah suatu proses yang dapat berupa kimia (reaktif) maupun fisika (tak-reaktif). |
|||
=== Absorpsi kimia === |
|||
Absorpsi kimia atau absorpsi reaktif adalah reaksi kimia antara bahan yang diabsorpsi dan yang mengabsorbsi. Kadang-kadang, ia merupakan kombinasi dengan absorpsi fisika. Absorpsi jenis ini bergantung pada [[stoikiometri]] reaksi dan konsentrasi reaktannya.<ref>{{cite journal|last=Leiviskä|first=Tiina|author2=Gehör, Seppo|author3=Eijärvi, Erkki|author4=Sarpola, Arja|author5=Tanskanen, Juha|title=Characteristics and potential applications of coarse clay fractions from Puolanka, Finland |journal=Central European Journal of Engineering|date=10 April 2012|volume=2|issue=2|pages=239–247|doi=10.2478/s13531-011-0067-9|bibcode=2012CEJE....2..239L}}</ref> |
|||
==Referensi== |
|||
{{Reflist|2}} |
|||
[[Kategori:Kimia fisik]] |
[[Kategori:Kimia fisik]] |
||
[[Kategori:Gas]] |
|||
[[Kategori:Teknologi gas]] |
|||
Revisi per 18 September 2018 07.42
Dalam ilmu kimia, absorpsi adalah fenomena fisika atau kimia atau suatu proses di mana atom, molekul atau ion memasuki fase ruah – bahan cair atau padat. Absorpsi berbeda dengan adsorpsi, karena molekul-molekul yang mengalami absorpsi memasuki volume, tidak hanya di permukaan saja (seperti yang terjadi pada adsorpsi). Istilah yang lebih umum adalah serapan (Inggris: sorption), yang meliputi absorpsi, adsorpsi, dan pertukaran ion. Absorpsi adalah suatu kondisi di mana sesuatu memasuki zat lain.[1]
Dalam banyak proses teknologi penting, absorpsi kimia digunakan untuk proses fisika, misalnya absorpsi karbon dioksida oleh natrium hidroksida – semacam proses asam-basa yang tidak mematuhi hukum partisi Nernst.
Beberapa contoh efek ini dapat dilihat pada artikel ekstraksi cair-cair. Adalah hal yang mungkin untuk mengekstraksi suatu zat terlarut (solut) dari sastu fase cair ke fase cair lainnya tanpa reaksi kimia. Contoh solut semacam ini adalah gas mulia dan osmium tetroksida.[1]
Proses absorpsi berarti bahwa zat menangkap dan memindahkan energi. Absorben mendistribusikan bahan yang ditangkapnya secara menyeluruh, sementara adsorben hanya mendistribusikannya di permukaan saja.
Proses gas atau cair yang menembus ke dalam badan adsorben secara umum dikenal sebagai absorpsi.
Absorpsi: Proses suatu bahan (absorbat) diretensi oleh bahan lain (absorben); ini dapat berupa larutan fisik gas, cairan, atau padatan dalam cairan, pengikatan molekul suatu gas, uap, cairan, atau pelarutan bahan pada permukaan padatan melalui gaya fisika, dll. Dalam spektrofotometri, absorpsi cahaya pada panjang gelombang tertentu digunakan untuk mengidentifikasi sifat kimia suatu molekul, atom atau ion dan untuk mengukur konsentrasi spesies-spesies ini.
Persamaan
Jika absorpsi adalah suatu proses fisika yang tidak berhubungan dengan proses fisika atau kimia, biasanya ia memenuhi hukum distribusi Nernst:
- "perbandingan konsentrasi beberapa spesies zat terlarut dalam dua fase ruah yang saling kontak pada kesetimbangan adalah konstan untuk zat terlarut dan fase ruah terentu":
Nilai konstanta KN bergantung pada suhu dan disebut koefisien partisi. Persamaan ini valid jika konsentrasi tidak terlalu besar dan jika spesies "x" tidak berubah bentuk dalam kedua fase. Jika molekul semacam ini mengalami asosiasi atau disosiasi, maka persamaan ini tetap dapat menjelaskan kesetimbangan antara "x" dalam kedua fase, tetapi hanya untuk bentuk yang sama – konsentrasi seluruh bentuk yang tersisa harus dikalkulasi dengan melibatkan kesetimbangan secara keseluruhan.[1]
Dalam kasus absorpsi gas, perhitungan konsentrasi dapat dilakukan dengan menggunakan, misalnya Hukum gas ideal, c = p/RT. Cara lainnya, dapat digunakan tekanan parsial untuk menggantikan konsentrasi.
Jenis-jenis absorpsi
Absorpsi adalah suatu proses yang dapat berupa kimia (reaktif) maupun fisika (tak-reaktif).
Absorpsi kimia
Absorpsi kimia atau absorpsi reaktif adalah reaksi kimia antara bahan yang diabsorpsi dan yang mengabsorbsi. Kadang-kadang, ia merupakan kombinasi dengan absorpsi fisika. Absorpsi jenis ini bergantung pada stoikiometri reaksi dan konsentrasi reaktannya.[2]
Referensi
- ^ a b c McMurry, John (2003). Fundamentals of Organic Chemistry (edisi ke-Fifth). Agnus McDonald. hlm. 409. ISBN 0-534-39573-2.
- ^ Leiviskä, Tiina; Gehör, Seppo; Eijärvi, Erkki; Sarpola, Arja; Tanskanen, Juha (10 April 2012). "Characteristics and potential applications of coarse clay fractions from Puolanka, Finland". Central European Journal of Engineering. 2 (2): 239–247. Bibcode:2012CEJE....2..239L. doi:10.2478/s13531-011-0067-9.

![{\displaystyle {\frac {[x]_{1}}{[x]_{2}}}={\text{constant}}=K_{N(x,12)}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/e0ec1ce71d0ce27734b33e4d1dfae04be91ecf13)