Asam hidrazoat
| |

| |

| |
| Nama | |
|---|---|
| Nama IUPAC
Hydrogen azide
| |
| Penanda | |
Model 3D (JSmol)
|
|
| 3DMet | {{{3DMet}}} |
| ChEBI | |
| ChEMBL | |
| ChemSpider | |
| Nomor EC | |
PubChem CID
|
|
| Nomor RTECS | {{{value}}} |
CompTox Dashboard (EPA)
|
|
| |
| |
| Sifat | |
| HN3 | |
| Massa molar | 43,03 g/mol |
| Penampilan | cairan tak berwarna, sangat mudah menguap |
| Densitas | 1,09 g/cm3 |
| Titik lebur | -80 °C |
| Titik didih | 37 °C |
| sangat mudah larut | |
| Kelarutan | larut dalam alkali, alkohol, eter |
| Keasaman (pKa) | 4,6[1] |
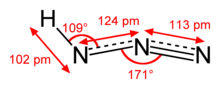
| Struktur | |
| mendekati linier | |
| Bahaya | |
| Bahaya utama | Sangat beracun, mudah meledak, reaktif |
| Frasa-R | R3, R27/28 |
| Frasa-S | S33, S36/37, S38 |
| Senyawa terkait | |
Kation lainnya
|
Natrium azida |
Kecuali dinyatakan lain, data di atas berlaku pada suhu dan tekanan standar (25 °C [77 °F], 100 kPa). | |
| Referensi | |
Asam hidrazoat, dikenal juga sebagai hidrogen azida atau azoimida,[2] adalah suatu senyawa dengan rumus kimia HN3.[3] Ia adalah cairan tak berwarna, mudah menguap, dan mudah meledak pada suhu dan tekanan ruang. Ini merupakan senyawa nitrogen dan hidrogen, dan oleh karenanya merupakan hidrida pniktogen. Hidrogen azida pertama kali diisolasi pada tahun 1890 oleh Theodor Curtius.[4] Asam ini memiliki sedikit aplikasi, tetapi basa konjugatnya, ion azida, bermanfaat dalam proses-proses khusus.
Asam hidrazoat larut dalam air. Asam hidrazoat yang tidak diencerkan memiliki bahaya ledakan[5] dengan entalpi standar pembentukan ΔfHo (l, 298K) = +264 kJmol−1).[6] Jika diencerkan, gas dan larutan airnya (<10%) dapat ditangani dengan aman.
Produksi[sunting | sunting sumber]
Asam ini biasanya dibuat melalui asidifikasi garam azida seperti natrium azida. Larutan normal natrium azida dalam air mengandung sejumlah renik asam hidrazoat dalam kesetimbangan dengan garam azida, tetapi introduksi asam yang lebih kuat dapat mengubah spesies primer dalam larutan menjadi asam hidrazoat. Asam murninya dapat diperolah melalui distilasi fraksional sebagai cairan tak berwarna yang sangat mudah meledak dengan bau yang tidak sedap.
Larutan airnya dapat juga dibuat melalui perlakuan larutan barium azida dengan asam sulfat encer, dilanjutkan penyaringan barium sulfat yang tidak larut.[7]
Ia awalnya disiapkan melalui reaksi larutan air hidrazin dengan asam nitrit.
Oksidator lain, seperti hidrogen peroksida, NOCl, NCl3 atau asam nitrat, dapat pula digunakan.[8]
Reaksi[sunting | sunting sumber]
Sifat asam hidrazoat menunjukkan analogi dengan asam halogen, karena ia membentuk garam timbal, perak dan raksa(I) yang sukar larut (dalam air). Garam logamnya seluruhnya mengkristal dalam bentuk anhidrat dan terdekomposisi pada pemanasan, meninggalkan residu logam murni. Ia bersifat asam lemah (pKa = 4,75.[6]) Garam logam beratnya mudah meledak dan mudah berinteraksi dengan alkil iodida. Azida logam alkali yang lebih berat (kecuali litium) atau logam alkali tanah tidak eksplosif, tetapi terdekomposisi secara lebih terkendali pada pemanasan, meninggalkan gas N yang murni secara spektroskopis.[9] Larutan asam hidrazoat dapat melarutkan banyak logam (misalnya, seng, besi) disertai pembebasan hidrogen dan pembentukan garam, yang disebut azida (dahulu disebut azoimida atau hidrazoat).
Pelarutan dalam asam yang paling kuat menghasilkan garam yang mudah meledak yang mengandung ion H+2, misalnya:[9]
Ion H+2 bersifat isoelektronik dengan diazometana.
Dekomposisi asam hidrazoat, dipicu oleh guncangan, gesekan, percikan, dan sebagainya berlangsung sesuai reaksi berikut:
Toksisitas[sunting | sunting sumber]
Asam hidrazoat mudah menguap dan sangat beracun. Ia memiliki bau tak sedap dan uapnya dapat menyebabkan sakit kepala hebat. Senyawanya berlaku sebagai racun non-kumulatif.
Aplikasi[sunting | sunting sumber]
2-Furonitril, zat antara farmasi dan pemanis buatan potensial telah dibuat dengan rendemen yang bagus melalui perlakuan furfural dengan campuran asam hidrazoat (HN3) dan asam perklorat dengan adanya magnesium perklorat dalam larutan benzena pada suhu 35 °C.[10][11]
Laser iodin fase gas (Inggris: All Gas-phase Iodine Laser, AGIL) mencampur gas asam hidrazoat dengan klorin untuk menghasilkan nitrogen klorida tereksitasi, yang kemudian digunakan untuk membuat laser iodium, ini menghindari kebutuhan cairan kimia laser COIL.
Referensi[sunting | sunting sumber]
- ^ Pradyot Patnaik. Handbook of Inorganic Chemicals. McGraw-Hill, 2002, ISBN 0-07-049439-8
- ^
 Chisholm, Hugh, ed. (1911). "Azoimide". Encyclopædia Britannica. 3 (edisi ke-11). Cambridge University Press.
Chisholm, Hugh, ed. (1911). "Azoimide". Encyclopædia Britannica. 3 (edisi ke-11). Cambridge University Press.
- ^ Dictionary of Inorganic and Organometallic Compounds. Chapman & Hall.
- ^ Curtius, Theodor (1890). "Ueber Stickstoffwasserstoffsäure (Azoimid) N3H". Berichte der deutschen chemischen Gesellschaft. 23 (2): 3023–3033. doi:10.1002/cber.189002302232.
- ^ Furman, David; Dubnikova, Faina; van Duin, Adri C. T.; Zeiri, Yehuda; Kosloff, Ronnie (2016-03-10). "Reactive Force Field for Liquid Hydrazoic Acid with Applications to Detonation Chemistry". The Journal of Physical Chemistry C. 120 (9): 4744–4752. doi:10.1021/acs.jpcc.5b10812. ISSN 1932-7447.
- ^ a b Catherine E. Housecroft; Alan G. Sharpe (2008). "Chapter 15: The group 15 elements". Inorganic Chemistry, 3rd Edition. Pearson. hlm. 449. ISBN 978-0-13-175553-6.
- ^ L . F. Audrieth, C. F. Gibbs Hydrogen Azide in Aqueous and Ethereal Solution" Inorganic Syntheses 1939, vol. 1, pp. 71-79.
- ^ Greenwood, Norman N.; Earnshaw, A. (1997), Chemistry of the Elements (edisi ke-2), Oxford: Butterworth-Heinemann, hlm. 432, ISBN 0-7506-3365-4
- ^ a b Egon Wiberg; Nils Wiberg; Arnold Frederick Holleman (2001). "The Nitrogen Group". Inorganic chemistry. Academic Press. hlm. 625. ISBN 0-12-352651-5.
- ^ P. A. Pavlov; Kul'nevich, V. G. (1986). "Synthesis of 5-substituted furannitriles and their reaction with hydrazine". Khimiya Geterotsiklicheskikh Soedinenii. 2: 181–186.
- ^ B. Bandgar; Makone, S. (2006). "Organic reactions in water. Transformation of aldehydes to nitriles using NBS under mild conditions". Synthetic Communications. 36 (10): 1347–1352. doi:10.1080/00397910500522009.
Pranala luar[sunting | sunting sumber]
- OSHA: Hydrazoic Acid Diarsipkan 2008-04-04 di Wayback Machine.



![{\displaystyle {\ce {HN=N=N + HSbCl6 -> [H2N=N=N]^+ [SbCl6]^-}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/33e54459cc714c5161dd48a7d85e784fefee047f)







