Alkaloid pirrolizidin
Artikel ini perlu diwikifikasi agar memenuhi standar kualitas Wikipedia. Anda dapat memberikan bantuan berupa penambahan pranala dalam, atau dengan merapikan tata letak dari artikel ini.
Untuk keterangan lebih lanjut, klik [tampil] di bagian kanan.
|
Artikel ini sebatang kara, artinya tidak ada artikel lain yang memiliki pranala balik ke halaman ini. Bantulah menambah pranala ke artikel ini dari artikel yang berhubungan atau coba peralatan pencari pranala. Tag ini diberikan pada Januari 2023. |
Alkaloid Pirrolizidin (PA), terdiri dari basa necine yang diesterifikasi dengan asam necine. Basa necine biasanya mencakup: pirrolizidin, hidrokarbon alifatik bisiklik yang terdiri dari dua cincin beranggota lima yang menyatu dengan jembatan nitrogen [1][2].Alkaloid ini menunjukkan hepatotoksik, genotoksik, aktivitas sitotoksik, tumorigenik, dan neurotoksik yang kuat.[1] PA adalah kelas alkaloid berdasarkan struktur pyrrolizidine yang ada di tanaman berbeda keluarga yang tumbuh di seluruh dunia. PA dan PA N-oksida telah diidentifikasi pada spesies di seluruh dunia (3% dari dunia tanaman berbunga). Tanaman yang mengandung PA mungkin termasuk yang paling umum tanaman beracun yang mempengaruhi ternak, satwa liar, dan manusia (Stegelmeier et al., 1999). Secara khusus, manusia yang terkena fitotoksin ini akibat dari mengkonsumsi sumber makanan yang terkontaminasi secara tidak sengaja, termasuk dalam biji-bijian, telur, susu, dan madu, lalu dapat melalui konsumsi langsung tanaman yang mengandung PA dalam obat-obatan herbal (seperti yang digunakan dalam pengobatan tradisional Cina (TCM) dan/atau teh), suplemen makanan, dan makanan fungsional (Coulombe, 2003; Jiang dkk., 2006; McLean, 1970).[3] Secara keseluruhan, PA mewakili sumber paparan racun tanaman yang sering "dipelajari, tetapi berpotensi penting dan "mungkin karsinogen” untuk hewan dan manusia (Schultze dan Roth, 1998).[3]
Sumber PA[sunting | sunting sumber]
Tanaman yang mengandung PA ditemukan di setidaknya 16 keluarga botani di seluruh dunia (Rizk, 1991). Mereka paling umum di hampir semua genus ( Heliotropium sp., Trichodesma sp., dan Symphytum sp.) dari Boraginaceae, terutama genus Senecio sp. dan Eupatorium sp. dari Compositae, dan terutama genus Crotalaria sp. (Leguminosae), Celandine Besar (Chelidonium majus), dan Ariaceae (Castilleja sp.) (28-48). Kavakava (Piper methysticum) mengandung kava pyridonealkaloid, pipermethystine, yang banyak di temukan pada daun dan kulit batang.[3][4][5]
Struktur Kimia dan Klasifikasi[sunting | sunting sumber]
PA dibiosintesis selama metabolisme asam amino dan tidak berwarna, aktif secara optik, dan stabil secara kimia, dengan air yang bervariasi kelarutan (Hartmann et al., 1988; Roeder, 1995; Stewart dan Steenkamp, 2001).[3]
Dalam taksonomi, PA sering dikelompokkan ke dalam subclass dari jenis senecionine, lycopsamine, heliotrine dan monocrotaline. PA tipe-senecionine bersifat generic untuk spesies dari suku Asteraceae Senecioneae tetapi juga ditemukan pada spesies Crotalaria. Jenis lycopsamine terjadi terutama di Boraginaceae, tetapi juga dalam suku Eupatorieae (Asteraceae). Jenis heliotrine secara khusus diproduksi oleh spesies Heliotropium (Boraginaceae) dan jenis monocrotaline menurut spesies Crotalaria (Fabaceae).[2][6][7]

Aktivasi metabolik dan mekanisme toksisitas[sunting | sunting sumber]
Aktivasi metabolik diperlukan untuk sebagian besar PA untuk menimbulkan toksisitas. PA dengan basa necine tak jenuh cenderung beracun. Umumnya, ada tiga jalur metabolisme utama untuk PA (Gambar. 2). Yang paling penting dari jalur ini adalah oksidasi melalui dua langkah, termasuk hidroksilasi basa necinecine pada posisi C3 atau C8 untuk membentuk turunan 3- atau 8-hidroksinesin yang sesuai diikuti oleh dehidrasi spontan untuk menghasilkan turunan dehydropyrrolizidine (pyrrolic ester). Jalur kedua adalah hidrolisis gugus fungsi ester yang terkait dengan posisi C7 dan C9 ke membentuk basa necine dan asam necic. Jalur ketiga adalah N-oksidasi dari basa necine ke PA N-oksida yang sesuai. Memiliki dasar necine yang berbeda, PA tipe otonesin memiliki dua jalur metabolisme utama: pembentukan ester pirol yang sesuai melalui N-demetilasi oksidatif dari basa necine diikuti dengan penutupan cincin (melalui eliminasi formaldehida) dan dehidrasi dan hidrolisis gugus fungsi ester untuk membentuk basa necine yang sesuai dan asam. Baru-baru ini, jalur metabolisme baru, yaitu N-glukuronidasi PA melalui uridine diphosphate glucuronosyltransferase (UGT) 1A4 (Gambar. 2).[6]

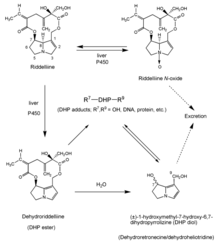
Basa bebas dehydroPA adalah pro-toksin. Setelah menelan, mereka diserap dari usus dan diubah di hati, dengan sitokrom P450 monooksigenase (CYP450), khususnya Isoform CYP3A dan CYP2B pada manusia, menjadi 1-hidroksimetil-7-metabolit ester hidroksi-6,7-dihidropirolizin (ester DHP) (Gambar 3). Metabolit "pyrrolic" ini bersifat bifungsi agen alkilasi biologis nasional yang mampu menyebabkan jaringan kerusakan dan menginduksi mutasi genetik. In vivo N-oksidasi dehydroPAs oleh enzim CYP450 dan yang mengandung avin mono-oksigenase merupakan mekanisme detoksifikasi yang menyebabkan ekskresi dehydroPAs N-oksida yang larut dalam air yang dihasilkan (Gambar 3) Namun, proporsi yang signifikan dari tertelan dehydroPA N-oksida direduksi menjadi bentuk basa bebasnya selama perjalanan melalui usus dan di hati dan dengan demikian, ketika mereka hadir dalam makanan, mereka juga berkontribusi pada hati pembentukan ester DHP genotoksik, mutagenik, merusak jaringan tissue (Gambar 3).[8]
Efek patofisiologis[sunting | sunting sumber]
Kerentanan[sunting | sunting sumber]
Toksisitas PA tergantung pada alkaloid tertentu, sifat paparan, fraksi dan laju bioaktivasi PA menjadi pirol, dan reaktivitas kimia dari pirol yang dihasilkan (Mattocks, 1968, 1986; Stewart dan Steenkamp, 2001). Kerentanan terhadap PA toksisitas juga dapat dipengaruhi oleh berbagai faktor tambahan, termasuk spesies, usia, jenis kelamin, keadaan fisiologis dan nutrisi, spesies tanaman yang dikonsumsi, durasi paparan, dan dosis PA total (Huxtable, 1989; McLean, 1970; Stegelmeier et al., 1999). Meskipun mekanisme serupa untuk toksisitas PA, ternak dan hewan laboratorium memiliki kerentanan yang berbeda terhadap PA. Namun, secara umum, sapi, kuda, babi, ayam, bebek, ikan, tikus, tikus, anjing, primata bukan manusia, dan manusia semuanya rentan terhadap keracunan PA, sedangkan domba, kambing, kelinci, gerbil, hamster, dan marmut lebih tahan terhadap toksisitas PA (Allen et al., 1965; Cheeke dan Pierson-Goeger, 1983; Fu et al., 2004; Hendricks dkk., 1981; Mattocks, 1986; Miller dkk., 1978; Prakash dkk., 1999; Stegelmeier dkk., 1999; Putih et al., 1973).[3]
Cedera hati[sunting | sunting sumber]
PA terutama dikenal karena hepatotoksisitasnya, sering ditandai dengan HVOD (juga disebut sindrom obstruksi sinusoidal), hepatomegali, dan megalocytosis (Bull et al., 1968; Mattocks, 1986; McLean, 1970; Schoental dan Head, 1955). Keracunan akut dapat menyebabkan hepatotoksisitas yang nyata dengan nekrosis hemoragik dan tergantung pada dosisnya dapat menyebabkan akut dosis PA hepatotoksik akan menyebabkan nekrosis hepatoseluler panlobular dengan perdarahan yang luas dan peradangan sederhana, sedangkan dosis yang lebih moderat menghasilkan nekrosis hepatoseluler zonal, dengan tingkat perdarahan sedang dan peradangan ringan.[3]
Cedera ekstrahepatik[sunting | sunting sumber]
Paparan kronis PA, terutama pada dosis kecil, dapat menyebabkan cedera ekstrahepatik, mempengaruhi paru-paru, jantung, saluran pencernaan, ginjal, dan otak (Mattocks, 1986). Karena bukti kurang bahwa sejumlah besar pirol reaktif dihasilkan dari PA bioaktivasi di jaringan di luar hati, seperti disebutkan di bagian “Distribusi dan Ekskresi,” eritrosit dapat berfungsi sebagai pembawa untuk metabolit reaktif ini ke jaringan lain untuk menginduksi cedera (Estep et al., 1991; Lamé et al., 1991; Pan et al., 1991).[3]
Genotoksisitas[sunting | sunting sumber]
Meskipun studi in vitro dan in vivo telah menunjukkan PA bersifat karsinogenik pada hewan, ada cukup bukti untuk menyimpulkan definitive bahwa paparan jangka panjang PA menyebabkan kanker pada manusia. Kerusakan DNA yang diinduksi PA yang tidak diperbaiki sebelum sintesis DNA berpotensi terjadi dalam kesalahan replikasi dan mutasi yang mengarah ke kanker. Baru-baru ini, berdasarkan pengujian karsinogenisitas yang ekstensif pada hewan, Program Toksikologi Nasional AS (NTP) mengklasifikasikan riddelliine, PA tipe retronecine, sebagai "cukup diantisipasi untuk menjadi karsinogen manusia" (Keamanan Pangan Eropa Otoritas (EFSA), 2011; Program Toksikologi Nasional Amerika Serikat (NTP), 2011; Xia et al., 2013).[3]
Pengobatan dan pencegahan[sunting | sunting sumber]
Diagnosis[sunting | sunting sumber]
Tanda dan gejala klinis keracunan PA mungkin tidak muncul sampai berbulan-bulan setelah terpapar, sering kali sulit untuk mengidentifikasi sumber paparan PA. Diagnosis toksisitas PA didasarkan pada riwayat, tanda klinis, patologi klinis, dan biopsi hati. Tanda dan gejala klinis toksisitas PA konsisten dengan gejala gagal hati. Pada hewan, tanda-tanda klinis yang paling umum adalah penurunan berat badan, penyakit kuning, depresi, kelainan perilaku, dan, dalam beberapa kasus, dermatitis fotosensitif (Radostits et al., 2000). Seperti dijelaskan sebelumnya (bagian "Cedera Hepatik"), tanda-tanda klinis toksisitas PA akut pada manusia termasuk perut mendadak nyeri, onset mual, muntah, diare, asites, dan hepatomegali (Coulombe, 2003; Sperl et al., 1995; Stillman et al., 1977). Tanda-tanda klinis toksisitas kronis termasuk asthenia, hepatomegali persisten, asites progresif, dan tanda-tanda lain dari hipertensi portal. (Stewart dan Steenkamp, 2001). Patologi klinis meliputi peningkatan konsentrasi asam empedu, hiperbilirubinemia, proteinemia, dan tes fungsi hati yang abnormal, serta peningkatan biomarker cedera hati seperti serum aminotransferases (Radostits et al., 2000).[3]
Deteksi PA yang cepat dan efisien juga penting untuk pemantauan makanan dan pakan untuk melindungi dari kontaminasi. Metodologi yang relevan untuk mendeteksi PA dalam bahan tanaman dan pirol terikat jaringan termasuk kolorimetri (Zuckerman et al.,2002), kromatografi lapis tipis (Chen et al., 1995), kromatografi gas/spektrometri massa (Mattocks and Jukes, 1990; Schoch dkk., 2000; Winter et al., 1988), dan kromatografi cair kinerja tinggi/spektrometri massa (Gaillard dan Pepin, 1999; Lindkk., 1998).[3]
Pengobatan dan pencegahan[sunting | sunting sumber]
Tidak ada pengobatan definitif untuk intoksikasi PA. Idealnya, paparan lebih lanjut terhadap PA harus dicegah. Pada hewan, pengobatan adalah hanya mendukung untuk memberikan waktu untuk regenerasi hati dan termasuk pemberian cairan intravena untuk dehidrasi dan untuk koreksi ketidakseimbangan elektrolit, glukosa untuk energi dasar, dan, jika perlu, antibiotik dan perawatan luka untuk fotodermatitis (Radostitis dkk., 2000; Schmitz, 1998; Talcott, 2003). Namun, ternak yang keracunan yang menunjukkan gejala klinis jarang sembuh (Stegelmeier, 2011). Pada manusia, pengobatan suportif nonspesifik untuk gagal hati, sebagai akibat dari HVOD, juga digunakan. Infus albumin digunakan untuk mengurangi asites. Pemulihan lengkap atau sebagian tergantung pada seberapa dini diagnosis keracunan PA dibuat (Steenkamp et al.,2000; Stewart dan Steenkamp, 2001). Secara keseluruhan, pencegahan tetap menjadi metode terbaik untuk mengurangi keracunan PA.[3]
Referensi[sunting | sunting sumber]
- ^ a b Schramm, Sebastian; Köhler, Nikolai; Rozhon, Wilfried (2019/1). "Pyrrolizidine Alkaloids: Biosynthesis, Biological Activities and Occurrence in Crop Plants". Molecules (dalam bahasa Inggris). 24 (3): 498. doi:10.3390/molecules24030498. PMC 6385001
 . PMID 30704105.
. PMID 30704105.
- ^ a b c d e Mulder, Patrick P.J.; López, Patricia; Castelari, Massimo; Bodi, Dorina; Ronczka, Stefan; Preiss-Weigert, Angelika; These, Anja (2018-01-02). "Occurrence of pyrrolizidine alkaloids in animal- and plant-derived food: results of a survey across Europe". Food Additives & Contaminants: Part A (dalam bahasa Inggris). 35 (1): 118–133. doi:10.1080/19440049.2017.1382726. ISSN 1944-0049.
- ^ a b c d e f g h i j k Yee, S.B.; Roth, R.A. (2018). Comprehensive Toxicology (dalam bahasa Inggris). Elsevier. hlm. 522–537. doi:10.1016/b978-0-12-801238-3.02114-0. ISBN 978-0-08-100601-6.
- ^ Neuman, Manuela G.; Cohen, Lawrence; Opris, Mihai; Nanau, Radu M.; Jeong, Hyunjin (2015-11-26). "Hepatotoxicity of Pyrrolizidine Alkaloids". Journal of Pharmacy & Pharmaceutical Sciences (dalam bahasa Inggris). 18 (4): 825–843. doi:10.18433/J3BG7J. ISSN 1482-1826.
- ^ "Risk assessment of pyrrolizidine alkaloids in food of plant and animal origin". Food and Chemical Toxicology (dalam bahasa Inggris). 115: 63–72. 2018-05-01. doi:10.1016/j.fct.2018.03.005. ISSN 0278-6915.
- ^ a b "Pyrrolizidine alkaloids: An update on their metabolism and hepatotoxicity mechanism". Liver Research (dalam bahasa Inggris). 3 (3-4): 176–184. 2019-12-01. doi:10.1016/j.livres.2019.11.004. ISSN 2542-5684.
- ^ "Pyrrolizidine Alkaloids". The Alkaloids: Chemistry and Biology (dalam bahasa Inggris). 80: 1–314. 2018-01-01. doi:10.1016/bs.alkal.2018.03.001. ISSN 1099-4831.
- ^ Edgar, John A.; Molyneux, Russell J.; Colegate, Steven M. (2015-01-20). "Pyrrolizidine Alkaloids: Potential Role in the Etiology of Cancers, Pulmonary Hypertension, Congenital Anomalies, and Liver Disease". Chemical Research in Toxicology. 28 (1): 4–20. doi:10.1021/tx500403t. ISSN 0893-228X.

