Nikel sulfida
| |
| Nama | |
|---|---|
| Nama IUPAC (preferensi)
sulfanylidenenickel [1] | |
| Nama lain
Nickel Monosulfide, Nickelous sulfide, alpha-Nickel Sulfide, beta Nickel sulfide
| |
| Penanda | |
| 3DMet | {{{3DMet}}} |
| ChemSpider | |
| Nomor EC | |
PubChem CID
|
|
| Nomor RTECS | {{{value}}} |
CompTox Dashboard (EPA)
|
|
| Sifat | |
| NiS | |
| Massa molar | 90.7584 g mol-1 |
| Penampilan | hitam padat |
| Bau | Odorless |
| Densitas | 5.8 g/cm3 |
| Titik lebur | 797 °C (1.467 °F; 1.070 K) |
| Titik didih | 1.388 °C (2.530 °F; 1.661 K) |
| tidak tercerna | |
| Kelarutan | tidak tercerna |
| Bahaya | |
| Bahaya utama | dapat menyebabkan kanker jika terhirup |
| Piktogram GHS | 
|
Kecuali dinyatakan lain, data di atas berlaku pada suhu dan tekanan standar (25 °C [77 °F], 100 kPa). | |
| Referensi | |
Nikel sulfida adalah senyawa anorganik dengan rumus NiS. Senyawa ini berbentuk solid berwarna hitam yang diproduksi dengan mereaksikan garam Nikel (II) dengan Hidrogen sulfida. Banyak nikel sulfida yang sudah diketahui, termasuk mineral Milerit. Nikel sulfida yang berkaitan dengan Milerit serta mineral lainnya, merupakan hasil dari reaksi desulfurisasi, dan kadang-kadang digunakan sebagai katalis.
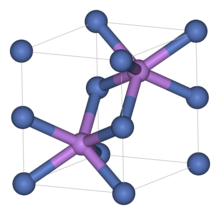
Structure[sunting | sunting sumber]
Seperti bahan terkait lainnya, nikel sulfida mengadopsi motif arsenide nikel. Dalam struktur ini, nikel berbentuk oktahedral dan sulfida berada di posisi prismatik trigonal.[2]
Nikel sulfida memiliki dua polimorf. Bentuk alfa memiliki unit sel heksagonal, sedangkan bentuk beta memiliki sel rhombohedral. Sejumlah kecil senyawa ini terjadi sebagai ketidaksempurnaan ketika struktur kaca dibentuk. Diyakini bahwa retakan yang terjadi pada panel kaca jendela yang keras terjadi karena perubahan volume terkait dengan tahap transisi alpha beta pada cacat nikel sulfida tersebut.[3][4]
Sintesis[sunting | sunting sumber]
Pengendapan nikel sulfida hitam solid yang menjadi andalan skema analisis anorganik kualitatif tradisional, yang dimulai dengan pemisahan logam berdasarkan kelarutan sulfida mereka. Reaksi tersebut ditulis
- Ni2+ + H2S → NiS + 2 H+
Banyak metode yang lebih terkontrol lainnya telah dikembangkan, termasuk reaksi metatesis solid state (dari NiCl2 dan Na2S) dan reaksi suhu tinggi dari masing-masing elemen.[5]
Referensi[sunting | sunting sumber]
- ^ "Nickel sulfide - Compound Summary". Diakses tanggal October 17, 2012.
- ^ Wells, A.F. (1984) Structural Inorganic Chemistry, Oxford: Clarendon Press. ISBN 0-19-855370-6.
- ^ Bishop, D.W.; Thomas, P.S.; Ray, A.S. (1998). "Raman spectra of nickel(II) sulfide". Materials Research Bulletin. 33 (9): 1303. doi:10.1016/S0025-5408(98)00121-4.
- ^ "NiS and Spontaneous Breakage". Glass on Web. Nov 2012. Diarsipkan dari versi asli tanggal 2013-06-12. Diakses tanggal 2013-10-17.
- ^ leading reference can be found in: Shabnam Virji, Richard B. Kaner, Bruce H. Weiller "Direct Electrical Measurement of the Conversion of Metal Acetates to Metal Sulfides by Hydrogen Sulfide" Inorg. Chem., 2006, 45 (26), pp 10467–10471.doi:10.1021/ic0607585
